ワインレブケトン合成
| ワインレブケトン合成 | |
|---|---|
| 名前の由来 | スティーブン・M・ウェインレブ |
| 反応タイプ | カップリング反応 |
| 識別子 | |
| 有機化学ポータル | ワインレブケトン合成 |
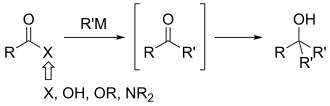
ワインレブケトン合成またはワインレブ・ナームケトン合成は、有機化学で炭素-炭素結合を作るのに使われる化学反応です。1981年にスティーブン・M・ワインレブとスティーブン・ナームがケトンを合成する方法として発見しました。[ 1 ]元々の反応は、酸塩化物をN , O-ジメチルヒドロキシルアミンで変換してワインレブ・ナームアミドを形成し、続いてこのアミドをグリニャール試薬や有機リチウム試薬などの有機金属試薬で処理するという、2つの置換反応から構成されていました。ナームとワインレブはまた、過剰量の水素化アルミニウムリチウムでアミドを還元してアルデヒドを合成することも報告しました(アミド還元を参照)。

より一般的なアシル化合物への有機金属試薬の付加反応と比較したこの方法の主な利点は、過剰付加という一般的な問題を回避できることです。後者の反応では、2当量の反応基が付加し、ケトンやアルデヒドではなくアルコールを形成します。これは、求核剤の当量を厳密に制御した場合でも発生します。
ワインレブ・ナームアミドは、それ以来、有機化学者によってケトン合成の信頼できる方法として広く用いられてきました。これらの官能基は多くの天然物に存在し、確実に反応して新たな炭素-炭素結合を形成したり、他の官能基に変換したりすることができます。この方法は、マクロスフェリドAおよびB、 [ 2 ]アンフィジノリドJ、[ 3 ]スピロファンギンAおよびB [ 4 ]など、多くの合成に用いられてきました。
機構
ワインレブとナームは、ワインレブ・ナームアミドの反応における選択性を説明するために、当初以下の反応機構を提唱した。彼らの提案は、有機金属試薬による求核付加反応の結果として形成される四面体中間体(下記A )が、図示のようにメトキシ基からのキレート化によって安定化されるというものである[ 1 ]。この中間体は低温でのみ安定であり、低温クエンチを必要とする。

このキレート化は、四面体中間体の崩壊によって2回目の付加反応が可能になるという過剰付加生成物の形成機構とは対照的である。ワインレブによるこの機構の推測は学界に即座に受け入れられたが、分光学的および速度論的解析によって確認されたのは2006年になってからであった。[ 5 ]
準備
上記に示したオリジナルの手順(敏感な基質との適合性に問題が生じる可能性がある)に加えて、ワインレブアミドは様々なアシル化合物から合成することができる。これらの手順の大部分は、市販のN,O-ジメチルヒドロキシルアミン塩酸塩[MeO(Me)NH•HCl]を用いており、これは通常、遊離アミンよりも取り扱いが容易である。[ 6 ]
エステルまたはラクトンをAlMe 3またはAlMe 2 Clで処理すると、対応するワインレブアミドが良好な収率で得られる。あるいは、イソプロピルマグネシウムクロリドなどの非求核性グリニャール試薬を用いて、エステルを添加する前にアミンを活性化することもできる。[ 7 ]

様々なペプチドカップリング試薬を用いて、カルボン酸からワインレブ・ナームアミドを合成することができる。この目的のために、カルボジイミド、ヒドロキシベンゾトリアゾール、トリフェニルホスフィンをベースとした様々なカップリング反応が報告されている。[ 6 ] [ 7 ]

最後に、スティーブン・ブッフワルドによって報告されたアミノカルボニル化反応は、アリールハライドを直接アリールワインレブ-ナームアミドに変換することを可能にする。[ 8 ]

範囲
ワインレブ・ナームケトン合成の標準条件では、分子中の他の部位にα-ハロゲン置換、N-保護アミノ酸、α-β不飽和、シルイルエーテル、様々なラクタムやラクトン、スルホン酸塩、スルフィネート、ホスホン酸エステルなど、多様な官能基を導入できることが知られている。[ 6 ] [ 7 ]アミドと組み合わせて使用できる求核剤は多岐にわたる。リチウム塩やグリニャール試薬が最も一般的に用いられ、脂肪族、ビニル、アリール、アルキニル炭素求核剤を用いた例が報告されている。しかし、塩基性が高い、あるいは立体障害のある求核剤を用いると、メトキシド部分が脱離してホルムアルデヒドが放出されるという重大な副反応が起こる可能性がある。[ 9 ]

それにもかかわらず、ワインレブ・ナームアミドは多くの合成において重要な役割を果たし、様々なフラグメントの重要なカップリングパートナーとして機能しています。以下は、免疫抑制剤であるマクロスフェリド類や抗生物質であるスピロファンギン類を含む、いくつかの天然物の合成におけるワインレブアミドの重要なステップです。[ 2 ] [ 3 ] [ 4 ]

バリエーション
ワインレブ・ナームアミドとウィッティヒ試薬との反応は、水素化物試薬や有機金属化合物の添加に必要となる、時に過酷な条件を回避するために行われてきた。この反応によりN-メチル-N-メトキシエナミンが得られ、これは加水分解により対応するケトンまたはアルデヒドに変換される。[ 10 ]

さらに、マグネシウム-ハロゲン交換とそれに続くアリール化をワンポットで行う方法が開発され、ワインレブ-ナームアミドの安定性が示され、アリールケトンの合成のための操作的に簡単な方法が提供されました。[ 11 ]

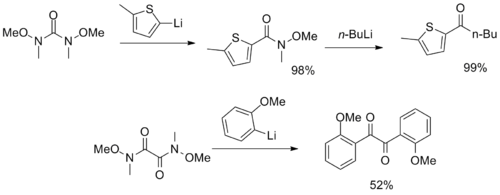
複数のワインレブ・ナームアミド官能基を持つより珍しい試薬も合成されており、CO2やα-ジケトンの合成子として利用されている。[ 12 ] [ 13 ]
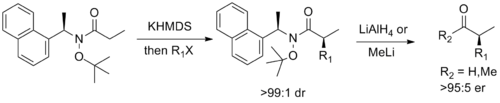
最後に、オックスフォード大学のスティーブン・G・デイヴィスは、ワインレブアミドの機能性とマイヤーズの擬似エフェドリン補助剤の機能性を組み合わせたキラル補助剤を設計し、ジアステレオ選択的なエノラートアルキル化とそれに続く対応するエナンチオ濃縮アルデヒドまたはケトンへの容易な切断を可能にした。[ 14 ]
参照
参考文献
- ^ a b Nahm, S.; Weinreb, SM (1981)、「N-メトキシ-n-メチルアミドの有効なアシル化剤としての有効性」、Tetrahedron Letters、22 (39): 3815– 3818、doi : 10.1016/s0040-4039(01)91316-4
- ^ a b Paek, S.-M.; Seo, S.-Y.; Kim, S.-H.; Jung, J.-W.; Lee, Y.-S.; Jung, J.-K.; Suh, Y.-G. (2005)、「(+)-マクロスフェリドAおよびBの簡潔な合成」、Organic Letters、7 (15): 3159– 3162、doi : 10.1021/ol0508429、PMID 16018610
- ^ a b Barbazanges, M.; Meyer, C.; Cossy, J. (2008)、「アンフィジノリドJの全合成」、Organic Letters、10 (20): 4489– 4492、doi : 10.1021/ol801708x、PMID 18811171
- ^ a b清水 剛志; 佐藤 剛志; 村越 健; 袖岡 正治 (2005)、「(−)-スピロファンギンAおよび(+)-スピロファンギンBの非対称全合成」、Organic Letters、7 (25): 5573– 5576、doi : 10.1021/ol052039k、PMID 16320994
- ^ Qu, B.; Collum, DB (2006)、「ワインレブアミドによるリチウムフェニルアセチリドのアシル化の機構」、The Journal of Organic Chemistry、71 (18): 7117– 7119、doi : 10.1021/jo061223w、PMID 16930080
- ^ a b c Singh, J.; Satyamurthi, N.; Aidhen, IS (2000)、「Weinrebのアミドの合成的有用性の増大」、Journal für praktische Chemie、342 :340、doi : 10.1002/(sici)1521-3897(200004)342:4<340::aid-prac340>3.0.co;2-1
- ^ a b cメンツェル、M.; Hoffmann、HMR (1997)、「現代有機合成における N-メトキシ-N-メチルアミド (ワインレブアミド)」、Journal für Praktische Chemie/Chemiker-Zeitung、339 : 517–524、doi : 10.1002/prac.19973390194
- ^ Martinelli, JR; Freckmann, DMM; Buchwald, SL (2006)、「大気圧下での臭化アリールのPd触媒アミノカルボニル化によるワインレブアミドの簡便な調製法」、Organic Letters、8 (21): 4843– 4846、doi : 10.1021/ol061902t、PMID 17020317
- ^ Graham, SL; Scholz, TH (1990)、「N-メトキシ-N-メチルアミドと強塩基性試薬との新たな反応性」、Tetrahedron Letters、31 (44): 6269– 6272、doi : 10.1016/s0040-4039(00)97039-4
- ^ Hisler, K.; Tripoli, R.; Murphy, JA (2006)、「ワインレブアミドの反応:ウィッティヒ反応によるアルデヒドの形成」、Tetrahedron Letters、47 (35): 6293– 6295、doi : 10.1016/j.tetlet.2006.06.118
- ^ Conrad, K.; Hsiao, Y.; Miller, R. (2005)、「α-アミノアリールケトン合成のための実用的なワンポットプロセス」、Tetrahedron Letters、46 (49): 8587– 8589、doi : 10.1016/j.tetlet.2005.09.183
- ^ Whipple, WL; Reich, HJ (1991), 「N,N'-ジメトキシ-N,N'-ジメチル尿素の有機金属付加反応におけるカルボニルジカチオン等価体としての利用。非対称ケトンの合成」The Journal of Organic Chemistry , 56 (8): 2911– 2912, doi : 10.1021/jo00008a057
- ^ Sibi, MP; Sharma, R.; Paulson, KL (1992)、「N,N′-ジメトキシ-N,N-ジメチルエタンジアミド:有用なα-オキソ-N-メトキシ-N-メチルアミドおよび1,2-ジケトン合成化合物」、Tetrahedron Letters、33 (15): 1941– 1944、doi : 10.1016/0040-4039(92)88108-h
- ^ Davies, SG; Goodwin, CJ; Hepworth, D.; Roberts, PM; Thomson, JE (2010)「N-1-(1'-ナフチル)エチル-O-tert-ブチルヒドロキサメート由来のエノラートのアルキル化におけるジアステレオ選択性の起源:キラルなワインレブアミド当量について」、The Journal of Organic Chemistry、75 (4): 1214– 1227、doi : 10.1021/jo902499s、PMID 20095549
