テガセロド
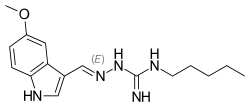 | |
 | |
| 臨床データ | |
|---|---|
| 商号 | ゼルノーム、ゼルマック |
| AHFS / Drugs.com | モノグラフ |
| 妊娠カテゴリー |
|
| 投与経路 | オーラル |
| ATCコード | |
| 法的地位 | |
| 法的地位 |
|
| 薬物動態データ | |
| バイオアベイラビリティ | 10% |
| タンパク質結合 | 98% |
| 代謝 | 胃と肝臓 |
| 消失半減期 | 11 ± 5時間 |
| 排泄 | 糞便と腎臓 |
| 識別子 | |
| |
| CAS番号 | |
| PubChem CID | |
| IUPHAR/BPS | |
| ドラッグバンク |
|
| ケムスパイダー |
|
| ユニイ | |
| ケッグ |
|
| チェムブル |
|
| CompToxダッシュボード(EPA) | |
| ECHA 情報カード | 100.158.793 |
| 化学および物理データ | |
| 式 | C 16 H 23 N 5 O |
| モル質量 | 301.394 g·mol −1 |
| 3Dモデル(JSmol) | |
| |
| |
 北 北 はい (これは何ですか?)(確認) はい (これは何ですか?)(確認) | |
テガセロドは、ノバルティス社が製造し、過敏性腸症候群および便秘の治療薬としてゼルノームおよびゼルマックの名称で販売されている5-HT4作動薬です。[ 1 ] 2002年にFDA(米国食品医薬品局)の承認を受けましたが、心血管系への有害作用の可能性をFDAが懸念したため、2007年に市場から撤退しました。それ以前は、過敏性腸症候群に伴う腹部不快感、膨満感、便秘の緩和に米国食品医薬品局(FDA)が承認した唯一の薬剤でした。また、慢性特発性便秘の治療薬としても承認されています。[ 2 ]
作用機序
この薬は運動刺激薬として作用し、消化管の腸管神経系の5-HT 4受容体を活性化することで所望の治療効果を発揮します。また、消化管運動と蠕動反射を刺激し、腹痛を軽減すると言われています。[ 3 ]さらに、テガセロドは5-HT 2B受容体拮抗薬でもあります。[ 4 ]
市場からの撤退
2007年3月30日、米国食品医薬品局はノバルティスにテガセロドを棚から撤去するよう要請した。[ 5 ] FDAは、この薬の処方と心臓発作や脳卒中のリスク増加との間に関係があると主張した。18,000人以上の患者から収集されたデータの分析により、テガセロドを投与された11,614人の患者のうち13人(発生率0.11%)に有害な心血管イベントが認められたのに対し、プラセボを投与された7,031人の患者では1人(発生率0.01%)であった。ノバルティスは、影響を受けた患者全員が既存の心血管疾患またはその危険因子を有しており、さらにテガセロドの使用と心血管イベントとの因果関係は実証されていないと主張した。[ 6 ] FDAの発表と同日、ノバルティス・ファーマシューティカルズ・カナダは、カナダ保健省の要請に応じて、カナダでのこの薬のマーケティングと販売を一時停止すると発表した。[ 7 ]米国の健康保険データベースに基づく大規模コホート研究では、テガセロド治療による心血管イベントのリスク増加は認められなかった。[ 8 ] 2019年に、テガセロドは65歳未満の女性の便秘型過敏性腸症候群(IBS-C)の治療薬として再導入された。 [ 9 ]
参考文献
- ^ 「Zelnormの新データ」 。 2007年12月9日時点のオリジナルよりアーカイブ。2007年3月30日閲覧。
- ^ 「FDA、過敏性腸症候群の女性患者向けの初の治療法を承認」。米国食品医薬品局。2007年2月5日時点のオリジナルよりアーカイブ。2007年3月30日閲覧。
- ^ Rossi, S. (2004).オーストラリア医薬品ハンドブック. アデレード: ヘルスコミュニケーションネットワーク. ISBN 0-9578521-4-2。
- ^ Beattie DT, Smith JA, Marquess D, et al. (2004年11月). 「5-HT4受容体作動薬テガセロドは、in vitroおよびin vivoにおいて強力な5-HT2B受容体拮抗薬である」 . Br. J. Pharmacol . 143 (5): 549–60 . doi : 10.1038/ sj.bjp.0705929 . PMC 1575425. PMID 15466450 .
- ^ 「FDA、安全上の理由から消化器系薬剤ゼルノームの販売中止を発表」 FDAプレスリリース。2007年3月30日。 2009年7月10日時点のオリジナルよりアーカイブ。
- ^ 「Zelnorm」(PDF) . Novartis . 2007年4月10日時点のオリジナル(PDF)からアーカイブ。 2007年3月30日閲覧。
- ^ 「ノバルティス、カナダ保健省の要請に応じ、ゼルノームのカナダにおけるマーケティングと販売を一時停止」 。 2007年3月30日閲覧。
- ^ Loughlin J, Quinn S, Rivero E, Wong J, Huang J, Kralstein J, Earnest DL, Seeger JD (2010). 「テガセロドと心血管虚血イベントのリスク:観察コホート研究」 . J Cardiovasc Pharmacol Ther . 15 (2): 151–7 . doi : 10.1177/1074248409360357 . PMID 20200325. S2CID 37964792 .
- ^ WorldMeds、米国「FDA、65歳未満の女性における便秘型過敏性腸症候群(IBS-C)治療薬Zelnorm™(テガセロド)の再導入を承認」www.prnewswire.com(プレスリリース)。2019年9月17日閲覧。