一酸化炭素
| |||
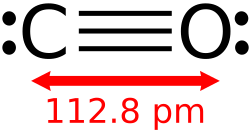 | |||
| 名前 | |||
|---|---|---|---|
| IUPAC名 一酸化炭素 | |||
その他の名前
| |||
| 識別子 | |||
| |||
3Dモデル(JSmol) | |||
| 3587264 | |||
| チェビ |
| ||
| チェムブル | |||
| ケムスパイダー |
| ||
| ECHA 情報カード | 100.010.118 | ||
| EC番号 |
| ||
| 421 | |||
| ケッグ |
| ||
| メッシュ | 一酸化炭素 | ||
PubChem CID | |||
| RTECS番号 |
| ||
| ユニイ |
| ||
| 国連番号 | 1016 | ||
CompToxダッシュボード(EPA) | |||
| |||
| |||
| プロパティ | |||
| CO | |||
| モル質量 | 28.010 g·mol −1 | ||
| 外観 | 無色 | ||
| 臭い | 無臭 | ||
| 密度 |
| ||
| 融点 | −205.02 °C (−337.04 °F; 68.13 K) | ||
| 沸点 | −191.5 °C (−312.7 °F; 81.6 K) | ||
| 27.6 mg/L (25℃) | |||
| 溶解度 | クロロホルム、酢酸、酢酸エチル、エタノール、水酸化アンモニウム、ベンゼンに溶ける | ||
ヘンリーの法則定数 (k H) | 1.04 atm·m 3 /モル | ||
磁化率(χ) | −9.8·10 −6 cm 3 /モル | ||
屈折率(nD ) | 1.0003364 | ||
| 0.122 D | |||
| 熱化学 | |||
熱容量(℃) | 29.1 J/(K·mol) | ||
| 197.7 J/(K·mol) | |||
標準生成エンタルピー(Δ f H ⦵ 298) | −110.5 kJ/モル | ||
標準燃焼エンタルピー(Δ c H ⦵ 298) | −283.0 kJ/モル | ||
| 薬理学 | |||
| V04CX08 ( WHO ) | |||
| 危険 | |||
| 労働安全衛生(OHS/OSH): | |||
主な危険 | 吸入すると有毒[ 1 ] | ||
| GHSラベル: | |||
   | |||
| 危険 | |||
| H220、H331、H360、H372、H420 | |||
| P201、P202、P210、P251、P260、P261、P264、P270、P281、P304+P340、P308+P313、P311、P314、P321、P377、P381、P403、P403+P233、P405、P501 | |||
| NFPA 704(ファイアダイヤモンド) | |||
| 引火点 | −191 °C (−311.8 °F; 82.1 K) | ||
| 609℃(1,128℉; 882K) | |||
| 爆発限界 | 12.5~74.2% | ||
| 致死量または濃度(LD、LC): | |||
LC 50(中央値濃度) |
| ||
LC Lo (公表最低額) |
| ||
| NIOSH(米国健康曝露限界): [ 1 ] | |||
PEL(許可) | TWA 50 ppm (55 mg/m 3 ) | ||
REL(推奨) |
| ||
IDLH(差し迫った危険) | 1200ppm | ||
| 安全データシート(SDS) | ICSC 0023 | ||
| 関連化合物 | |||
その他の陰イオン | 一硫化炭素 | ||
その他の陽イオン | 一酸化ケイ素一酸化ゲルマニウム 酸化スズ(II) 酸化鉛(II) | ||
関連する炭素酸化物 | 二酸化炭素 亜酸化炭素オキソカーボン | ||
| 補足データページ | |||
| 一酸化炭素(データページ) | |||
特に記載がない限り、データは標準状態(25 °C [77 °F]、100 kPa)における材料のものです。 | |||
一酸化炭素(化学式CO)は、無色、無臭、無味で、空気よりわずかに密度が低い、有毒で可燃性のガスです。一酸化炭素は、1つの炭素原子と1つの酸素原子が三重結合で結合した構造で、最も単純な炭素酸化物です。錯体において、一酸化炭素配位子はカルボニルと呼ばれます。工業化学の多くのプロセスにおいて重要な成分です。[ 5 ]
一酸化炭素の最も一般的な発生源は、炭素含有化合物の部分燃焼です。多くの環境および生物起源の発生源から一酸化炭素が発生します。産業界では、一酸化炭素は医薬品、香料、燃料など、多くの化合物の製造に重要な役割を果たしています。[ 6 ]
屋内では、COは室内空気質に影響を及ぼす最も急性毒性の高い汚染物質の一つです。COはタバコの煙から排出されるほか、燃料燃焼ストーブ(薪、灯油、天然ガス、プロパン)や燃料燃焼暖房システム(薪、石油、天然ガス)の故障、またこれらの機器に接続された煙突の詰まりからも発生します。[ 7 ]一酸化炭素中毒は多くの国で最も一般的な致死的な空気中毒です。[ 8 ] [ 7 ] [ 9 ]
一酸化炭素は、系統分類上の様々な界において重要な生物学的役割を担っています。ヒトを含む多くの生物によって産生されます。哺乳類の生理学において、一酸化炭素はホルミシスの典型的な例であり、低濃度では内因性神経伝達物質(ガス伝達物質)として機能し、高濃度では毒性を示し、一酸化炭素中毒を引き起こします。一酸化炭素は、シアン化物イオンCN −および分子状窒素N 2と等電子状態にあります。
物理的および化学的性質
一酸化炭素は最も単純なオキソカーボンであり、10個の価電子を有する他の三重結合二原子種(シアン化物アニオン、ニトロソニウムカチオン、フッ化ホウ素、窒素分子など)と等電子関係にある。モル質量は28.0で、理想気体の法則によれば、平均モル質量28.8の空気よりもわずかに密度が低い。
炭素と酸素は、正味2つのパイ結合と1つのシグマ結合からなる三重結合でつながっている。炭素原子と酸素原子の 結合長は112.8 pmである。[ 10 ] [ 11 ]この結合長は、同様の結合長(109.76 pm)とほぼ同じ分子量を持つ分子状窒素( N2 )の三重結合と一致している。炭素–酸素二重結合は大幅に長く、例えばホルムアルデヒドでは120.8 pmである。 [ 12 ]沸点(82 K)と融点(68 K)は、N2 (それぞれ77 Kと63 K)のそれらと非常に似ている。結合解離エネルギーは1072 kJ/molで、 N2 (942 kJ/mol)よりも強く、知られている中で最も強い化学結合を表している。[ 13 ]
一酸化炭素の基底電子状態は不対電子が 存在しないため 一重項状態である[ 14 ] 。
| 温度(℃) | 温度(K) | 密度(kg/m 3) | 比熱(J/g °C) | 動粘度(cg/m s) | 動粘度(cm 2 /s) | 熱伝導率(cW/m °C) | 熱拡散率(cm 2 /s) | プラントル数 |
|---|---|---|---|---|---|---|---|---|
| −73.15 | 200 | 1.6888 | 1.045 | 1.27 | 0.0752 | 1.7 | 0.0963 | 0.781 |
| −53.15 | 220 | 1.5341 | 1.044 | 1.37 | 0.0893 | 1.9 | 0.119 | 0.753 |
| −33.15 | 240 | 1.4055 | 1.043 | 1.47 | 0.105 | 2.06 | 0.141 | 0.744 |
| −13.15 | 260 | 1.2967 | 1.043 | 1.57 | 0.121 | 2.21 | 0.163 | 0.741 |
| 6.85 | 280 | 1.2038 | 1.042 | 1.66 | 0.138 | 2.36 | 0.188 | 0.733 |
| 26.85 | 300 | 1.1233 | 1.043 | 1.75 | 0.156 | 2.5 | 0.213 | 0.73 |
| 46.85 | 320 | 1.0529 | 1.043 | 1.84 | 0.175 | 2.63 | 0.239 | 0.73 |
| 66.85 | 340 | 0.9909 | 1.044 | 1.93 | 0.195 | 2.78 | 0.269 | 0.725 |
| 86.85 | 360 | 0.9357 | 1.045 | 2.02 | 0.216 | 2.91 | 0.298 | 0.725 |
| 106.85 | 380 | 0.8864 | 1.047 | 2.1 | 0.237 | 3.05 | 0.329 | 0.729 |
| 126.85 | 400 | 0.8421 | 1.049 | 2.18 | 0.259 | 3.18 | 0.36 | 0.719 |
| 176.85 | 450 | 0.7483 | 1.055 | 2.37 | 0.317 | 3.5 | 0.443 | 0.714 |
| 226.85 | 500 | 0.67352 | 1.065 | 2.54 | 0.377 | 3.81 | 0.531 | 0.71 |
| 276.85 | 550 | 0.61226 | 1.076 | 2.71 | 0.443 | 4.11 | 0.624 | 0.71 |
| 326.85 | 600 | 0.56126 | 1.088 | 2.86 | 0.51 | 4.4 | 0.721 | 0.707 |
| 376.85 | 650 | 0.51806 | 1.101 | 3.01 | 0.581 | 4.7 | 0.824 | 0.705 |
| 426.85 | 700 | 0.48102 | 1.114 | 3.15 | 0.655 | 5 | 0.933 | 0.702 |
| 476.85 | 750 | 0.44899 | 1.127 | 3.29 | 0.733 | 5.28 | 1.04 | 0.702 |
| 526.85 | 800 | 0.42095 | 1.14 | 3.43 | 0.815 | 5.55 | 1.16 | 0.705 |
結合と双極子モーメント
一酸化炭素中のC≡O結合の強さは、その振動数2143 cm −1で示される。[ 17 ]比較すると、ケトンやエステルなどの有機カルボニルは約1700 cm −1で吸収を示す。
炭素と酸素は、原子価殻に合計10個の電子を持つ。炭素と酸素の両方に適用されるオクテット則に従い、この2つの原子は、有機カルボニル化合物に見られる通常の二重結合ではなく、3つの結合分子軌道に6個の電子を共有する三重結合を形成する。共有電子のうち4個は酸素原子由来、2個のみが炭素由来であるため、1つの結合軌道は酸素原子由来の2個の電子によって占有され、配位結合または双極子結合を形成する。これにより、分子はC← O分極し、炭素には小さな負電荷、酸素には小さな正電荷が生じる。他の2つの結合軌道は、それぞれ炭素原子と酸素原子から1個ずつ電子によって占有され、酸素は炭素よりも電気陰性度が高いため、逆のC→O分極を伴う(極性)共有結合を形成する。遊離一酸化炭素分子では、正味の負電荷δ − が炭素端に残り、分子は0.122 Dという小さな双極子モーメントを持つ。[ 18 ]
そのため、分子は非対称です。酸素は炭素よりも電子密度が高く、また、炭素が負に帯電しているのに対し、酸素はわずかに正に帯電しています。
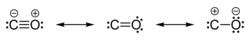
一酸化炭素の計算された分数結合次数は2.6であり、「3番目の」結合は重要であるものの、完全な結合よりはやや小さいことを示している。[ 19 ] したがって、原子価結合の観点から見ると、−C≡O +が最も重要な構造であり、:C=Oは非オクテットであるが、各原子の形式電荷は中性であり、共鳴に2番目に寄与する。この共鳴構造における孤立電子対と炭素の二価性のため、一酸化炭素は非常に安定したカルベンであるとしばしば考えられている。[ 20 ]イソシアニドは、OがNR(R = アルキルまたはアリール)基に置き換えられた化合物であり、同様の結合構造を持つ。
一酸化炭素が配位子として作用する場合、配位錯体の構造に依存して、双極子の極性が逆転し、酸素端に正味の負電荷が生じる可能性がある。[ 21 ]下記の「配位化学」の セクションも参照のこと。
結合極性と酸化状態
理論的および実験的研究によると、酸素の電気陰性度は高いにもかかわらず、双極子モーメントはより負の炭素端からより正の酸素端へと向いている。[ 22 ] [ 23 ] 3つの結合は実際には極性共有結合であり、強く分極している。酸素原子への分極率は、 σ結合で71% 、 π結合で77%と計算されている。[ 24 ]
これらの構造における一酸化炭素の炭素の酸化数は+2です。これは、すべての結合電子をより電気陰性度の高い酸素に属するものとして数えることで計算されます。炭素の非結合電子2つのみが炭素に割り当てられます。この数え方では、炭素は分子中に2つの価電子しか持たないのに対し、自由原子には4つの価電子しか持たないことになります。
発生
一酸化炭素は多くの環境で存在し、通常は微量です。例えば、植物の光化学的分解により、年間6,000万トンが発生すると推定されています。[ 26 ]典型的な濃度(ppm)は以下のとおりです。
| 濃度(ppmv [ a ]) | ソース |
|---|---|
| 0.1 | 自然大気水準(MOPITT)[ 28 ] |
| 0.5~5 | 家庭内の平均レベル[ 29 ] |
| 5~15歳 | 家庭内の適切に調整されたガスコンロの近くでは、現代の車の排気ガス[ 30 ] |
| 17 | 金星の大気 |
| 100~200 | 1975年のメキシコシティ中心部の自動車排気ガス[ 31 ] |
| 700 | 火星の大気 |
| 1,000未満 | 触媒コンバータを通過した後の自動車の排気ガス[ 32 ] |
| 5,000 | 家庭の薪ストーブからの排気[ 33 ] |
| 3万~10万 | 触媒コンバーターなしの希釈されていない暖かい自動車排気ガス[ 32 ] |
大気の存在

一酸化炭素(CO)は地球の大気中に微量(約80 ppb)存在しています。そのほとんどは、人間の活動によって放出される有機化合物との化学反応と、対流圏での光化学反応による自然発生で、年間約5 × 10 12キログラム生成されます。 [ 34 ] COのその他の自然発生源には、火山、森林火災、山火事、化石燃料などのその他の燃焼形態があります。[ 35 ]一酸化炭素は地球のマントル内の高圧下で溶融火山岩に溶解しているため、海洋や地質活動からも少量が放出されます。[ 36 ]一酸化炭素の自然発生源は年によって変化するため、このガスの自然放出を正確に測定することは困難です。
一酸化炭素は、メタンや対流圏オゾンなどの直接的な温室効果ガスの濃度を高めることで、放射強制力に間接的な影響を及ぼします。COは、メタンを破壊する他の大気成分(主にヒドロキシルラジカル、OH)と化学反応を起こします。 [ 37 ]大気中の自然現象によって、一酸化炭素は二酸化炭素とオゾンに酸化されます。一酸化炭素は大気中での寿命が短く(平均寿命は約1~2ヶ月)、濃度は空間的に変動します。[ 38 ]
一酸化炭素は中層対流圏で長い寿命を持つことから、汚染物質のトレーサーとしても利用されている。[ 39 ]
天文学
地球以外では、一酸化炭素は分子状水素に次いで星間物質中で2番目に多い二原子分子である。この極性分子は非対称性のため、水素分子よりもはるかに明るいスペクトル線を生成するため、COの検出がはるかに容易である。星間COは1970年に電波望遠鏡で初めて検出された。現在では、銀河の星間物質中では分子状水素は宇宙望遠鏡を必要とする紫外線でしか検出できないため、COは一般に分子ガスのトレーサーとして最も広く用いられている。一酸化炭素の観測は、ほとんどの星が形成される分子雲に関する多くの情報を提供する。[ 40 ] [ 41 ]
がか座で2番目に明るい星であるベータ・ピクトリスは、同型の通常の星に比べて赤外線放射が過剰であり、これは星の近くにある大量の塵とガス(一酸化炭素を含む) [ 42 ] [ 43 ]によって引き起こされます。
金星の大気中では、 169 nm未満の波長の電磁放射による二酸化炭素の光分解の結果として一酸化炭素が発生します。また、海王星の衛星トリトンの表面でも分光学的に一酸化炭素が確認されています。[ 44 ]
固体の一酸化炭素は彗星の成分である。[ 45 ]ハレー彗星の揮発性成分、つまり「氷」成分は約15%のCOである。[ 46 ]室温・大気圧下では、一酸化炭素は実際には準安定状態(ブドゥアール反応参照)であり、COとCO 2が固体となる低温でも同様であるが、それでも彗星中では数十億年も存在することができる。冥王星の大気にはCOがほとんど含まれておらず、これは彗星から形成されたと考えられる。これは冥王星内部に液体の水が存在する(または存在していた)ためであると考えられる。
一酸化炭素は水と反応して二酸化炭素と水素を生成します。
- CO + H 2 O → H 2 + CO 2
これは気相で起こる場合は水性ガス転化反応と呼ばれますが、水溶液中でも(非常にゆっくりと)起こります。水素分圧が十分に高い場合(例えば地下海)、ギ酸が生成されます。
- CO + H 2 O → HCOOH
これらの反応は冥王星のような温度でも数百万年で起こる可能性がある。[ 47 ]
汚染と健康への影響
都市の汚染
一酸化炭素は、一部の都市部では一時的な大気汚染物質であり、主に内燃機関(車両、ポータブルおよびバックアップ発電機、芝刈り機、高圧洗浄機などを含む)の排気ガスによって発生しますが、その他のさまざまな燃料(木材、石炭、木炭、石油、パラフィン、プロパン、天然ガス、ゴミなど)の不完全燃焼によっても発生します。
大規模なCO2汚染現象は宇宙から都市上空から観測できる。[ 48 ]
地上オゾン形成における役割
一酸化炭素は、アルデヒドとともに、光化学スモッグを形成する一連の化学反応サイクルの一部です。一酸化炭素はヒドロキシラジカル ( • OH) と反応してラジカル中間体• HOCO を生成し、これが急速にラジカル水素をO 2に転移してペルオキシラジカル ( HO 2 • ) と二酸化炭素 ( CO 2 )を形成します。[ 49 ]ペルオキシラジカルは次に窒素酸化物(NO)と反応して二酸化窒素( NO 2 ) とヒドロキシラジカルを形成します。NO 2 は光分解によりO( 3 P) を生成し、それによってO 2と反応してO 3が形成されます。ヒドロキシラジカルはNO 2の形成中に形成されるため、一酸化炭素から始まりオゾンの形成に至る一連の化学反応のバランスは次のようになります。
- CO + 2 O 2 + hν → CO 2 + O 3
(hνは、シーケンス内の NO 2分子によって吸収される光子を指します)
NO2の生成は低レベルのオゾン形成につながる重要なステップであるが、それはまた、オゾンと反応できるNOの量を減らすことによって、このオゾンを増加させるという、いくぶん相互に排他的な別の方法でもある。[ 50 ]
室内空気汚染
一酸化炭素は、最も急性毒性のある室内空気汚染物質の1つです。一酸化炭素は、タバコの煙から排出されるほか、燃料燃焼ストーブ(薪、灯油、天然ガス、プロパン)や燃料燃焼暖房システム(薪、石油、天然ガス)の故障、およびこれらの機器に接続された煙突の詰まりからも発生します。[ 7 ]先進国では、室内CO排出の主な発生源は、化石燃料を燃焼させる調理器具や暖房器具で、故障、不適切な設置、またはメンテナンスが不十分なものがあります。[ 51 ]機器の故障は、不適切な設置やメンテナンス不足、適切な使用が不十分なために発生することがあります。[ 7 ]低・中所得国では、家庭内でのCOの最も一般的な発生源は、バイオマス燃料の燃焼とタバコの煙です。[ 51 ]
鉱業
鉱夫たちは一酸化炭素を「白煙」または「サイレントキラー」と呼んでいます。これは、露天掘りと地下鉱山の両方において、換気の悪い密閉された場所で発生します。採掘作業における一酸化炭素の最も一般的な発生源は、内燃機関と爆発物ですが、炭鉱では石炭の低温酸化によっても一酸化炭素が発生することがあります。[ 52 ] 「炭鉱のカナリア」という慣用句は、一酸化炭素の存在を早期に警告するものでした。[ 53 ]
健康への影響
一酸化炭素中毒は、多くの国で最も一般的な致死性大気中毒です。急性曝露は、認知機能や行動の変化といった長期的な神経学的影響を引き起こす可能性があります。重度の一酸化炭素中毒は、意識喪失、昏睡、そして死に至る可能性があります。低濃度の一酸化炭素への慢性曝露は、無気力、頭痛、吐き気、インフルエンザ様症状、神経心理学的および心血管系の問題を引き起こす可能性があります。[ 8 ] [ 7 ] [ 9 ]
化学
一酸化炭素は化学のあらゆる分野において幅広い機能を持っています。反応性の主要な4つのカテゴリーは、金属カルボニル触媒、ラジカル化学、陽イオン化学、陰イオン化学です。[ 54 ]
錯体化学



ほとんどの金属は、共有結合した一酸化炭素を含む配位錯体を形成します。これらの誘導体は金属カルボニルと呼ばれ、金属の酸化状態が低いほど強固になります。例えば、鉄ペンタカルボニル(Fe(CO) 5)は空気中で安定で、蒸留可能な液体です。ニッケルカルボニルは、一酸化炭素と金属が直接結合することで形成される金属カルボニル錯体です。 [ 55 ]
- Ni + 4 CO → Ni(CO) 4 (1 bar、55 °C)
これらの揮発性錯体はしばしば非常に毒性が強い。一部の金属-CO錯体は、COからではなく、有機溶媒の脱カルボニル化によって合成される。例えば、三塩化イリジウムとトリフェニルホスフィンは、沸騰した2-メトキシエタノールまたはDMF中で反応し、 IrCl(CO)(PPh 3 ) 2を与える。
COは配位子として炭素を介して結合し、一種の三重結合を形成します。炭素原子上の孤立電子対は電子密度を供与し、M-COシグマ結合を形成します。CO上の2つのπ*軌道は、充填金属軌道と結合します。この効果は、デュワー・チャット・ダンカンソンモデルと関連しています。準三重MC結合の効果は、これらの錯体の赤外スペクトルに反映されています。遊離COは2143 cm −1で振動しますが、錯体は1950 cm −1付近で吸収を示す傾向があります。
有機化学と典型族化学
強酸の存在下では、 アルケンはカルボン酸と反応する。この種(アシルイオン)の加水分解によりカルボン酸が生成する。この反応はコッホ・ハーフ反応として知られる。[ 56 ]ガッターマン・コッホ反応では、 CO、 AlCl 3、HClの存在下でアレーンがベンズアルデヒド誘導体に変換される。[ 57 ]
水素ガスとCOの混合物はアルケンと反応してアルデヒドを生成する。このプロセスには金属触媒が必要である。[ 58 ]
COは典型族試薬と反応し、いくつかの注目すべき反応を起こす。COの塩素化は、重要な化合物であるホスゲンの工業的合成経路である。COはボランと反応し、アシル化陽イオン[H 3 CCO] +と等電子関係にある付加物H 3 BCOを形成する。COはナトリウムと反応し、アセチレンジオールナトリウム2Na + ·C 2 OなどのC−Cカップリング生成物を与える。2−2溶融カリウムと反応して、有機金属化合物、カリウムアセチレンジオラート2K + ·C 2 Oの混合物を生成する。2−2、ベンゼンヘキソレートカリウム6K + ·C 6 O6−6, [ 59 ]およびロジゾン酸カリウム2K + ·C 6 O2−6. [ 60 ]
シクロヘキサンヘキソンまたはトリキノイル(C 6 O 6)とシクロペンタンペントンまたはロイコン酸(C 5 O 5 )は、これまで微量しか得られておらず、一酸化炭素のポリマーとみなすことができます。5GPaを超える圧力では、一酸化炭素はポリカルボニルに変換されます。ポリカルボニルは、大気圧下では準安定ですが爆発性のある固体ポリマーです。[ 61 ] [ 62 ]
実験準備
一酸化炭素は、例えば濃硫酸を用いてギ酸やシュウ酸を脱水することによって実験室で簡単に生成できる。[ 56 ] [ 57 ] [ 63 ]別の方法として、粉末状の金属亜鉛と炭酸カルシウムの混合物を加熱する方法があり、これによりCOが放出され、酸化亜鉛と酸化カルシウムが残る。
- Zn + CaCO 3 → ZnO + CaO + CO
- CHI 3 + 3 AgNO 3 + H 2 O → 3 HNO 3 + CO + 3 AgI
最後に、金属シュウ酸塩は加熱すると CO を放出し、副産物として 炭酸塩を残します。
- Na 2 C 2 O 4 → Na 2 CO 3 + CO
生産
一酸化炭素の最も一般的な発生源は熱燃焼です。一酸化炭素は、炭素含有化合物の部分酸化によって生成されます。化学的に適正な濃度よりも濃い混合気で運転する内燃機関や、密閉空間で ストーブを運転する場合など、二酸化炭素(CO2 )を生成するのに十分な酸素がない場合に生成されます。
化学品製造における酸化プロセスでは、大量のCO副産物が生成されます。そのため、プロセスオフガスを精製する必要があります。
一酸化炭素の製造には多くの方法が開発されている。[ 64 ]
工業生産
COの主な産業発生源は、主に一酸化炭素と窒素を含む混合物である発生炉ガスです。これは、炭素が過剰に存在する高温の空気中で炭素が燃焼することによって生成されます。炉内では、空気がコークス層を通過します。最初に生成されたCO 2は、残りの高温の炭素と平衡してCOを生成します。[ 65 ] CO 2と炭素が反応してCOを生成する反応は、ブドゥアール反応と呼ばれます。[ 66 ] 800℃を超えると、COが主な生成物となります。
- CO 2 (g) + C (s) → 2 CO (g) (Δ H r = 170 kJ/mol)
もう一つの発生源は「水性ガス」です。これは、水蒸気と炭素の吸熱反応によって生成される水素と一酸化炭素の混合物です。
- H 2 O (g) + C (s) → H 2 (g) + CO (g) (Δ H r = 131 kJ/mol)
他の同様の「合成ガス」は、天然ガスやその他の燃料 から得ることができます。
一酸化炭素は、固体酸化物電解セルを用いた二酸化炭素の高温電気分解によっても生成できる。[ 67 ] DTU Energyで開発された方法の一つは、酸化セリウム触媒を使用しており、触媒の汚染の問題がない。[ 68 ] [ 69 ]
- 2 CO 2 → 2 CO + O 2
一酸化炭素も金属酸化物鉱石を炭素で還元したときに生成される副産物であり、簡略化すると次のようになります。
- MO + C → M + CO
一酸化炭素は、限られた酸素または空気の供給下で炭素が直接酸化されることでも生成されます。
- 2 C + O 2 → 2 CO
COは気体であるため、反応の正(有利)エントロピーを利用して加熱によって還元反応を促進できます。エリンガム図は、高温では COの生成がCO 2の生成よりも優先されることを示しています。
使用
化学産業
一酸化炭素は、バルク化学品の製造において多くの用途を持つ工業用ガスです。[ 70 ]アルケン、一酸化炭素、およびH 2のヒドロホルミル化反応によって大量のアルデヒドが生成されます。ヒドロホルミル化は、シェルの高級オレフィンプロセスと連携して洗剤の前駆体を生成します。
イソシアネート、ポリカーボネート、ポリウレタンの製造に有用なホスゲンは、精製された一酸化炭素と塩素ガスを多孔質活性炭層(触媒として作用)に通すことで製造されます。この化合物の世界生産量は、1989年には274万トンと推定されました。[ 71 ]
- CO + Cl 2 → COCl 2
メタノールは一酸化炭素の水素化によって生成されます。関連反応として、一酸化炭素の水素化はC-C結合の形成と結びついており、例えばフィッシャー・トロプシュ反応では一酸化炭素が水素化されて液体炭化水素燃料が生成されます。この技術により、石炭やバイオマスをディーゼル燃料に変換することができます。
カティバ法では、均一イリジウム触媒とヨウ化水素酸の存在下で一酸化炭素とメタノールを反応させ、酢酸を生成します。このプロセスは、酢酸の工業生産の大部分を担っています。
冶金
一酸化炭素は強力な還元剤であり、古代から乾式冶金において鉱石から金属を還元するために使用されてきました。一酸化炭素は金属酸化物から酸素を剥離し、高温で純粋な金属に還元し、その過程で二酸化炭素を生成します。一酸化炭素は通常、反応器内に気相でそのまま供給されるのではなく、酸素を運ぶ鉱石、またはコークスなどの石炭系物質と高温の存在下で高温で生成されます。高炉プロセスは、一酸化炭素を用いて鉱石から金属を還元するプロセスの典型的な例です。
同様に、高炉の上部で集められた高炉ガスには、依然として約 10% ~ 30% の一酸化炭素が含まれており、カウパーストーブや平炉製鋼のシーメンス・マーチン炉の燃料として使用されます。
ロケット燃料としての使用が提案されている
NASAの研究者ジェフリー・ランディスは、火星の燃料として一酸化炭素の使用を提案している。一酸化炭素/酸素エンジンは、初期の火星表面輸送用途として提案されている。これは、火星の二酸化炭素大気からジルコニア電気分解によって一酸化炭素と酸素の両方を直接生成できるためであり、メタンやその他の水素燃料の製造に必要な水素を得るために火星の水資源を使用する必要がない。 [ 72 ]
ランディスはまた、太陽光発電の無人航空機とロケット気球の上昇を組み合わせて、サンプルリターンミッションのために金星の同様の二酸化炭素大気から燃料を製造することを提案した。[ 73 ]
電気化学
一酸化炭素は、電気触媒として使用されるいくつかの金属との強い親和性を利用して、 COストリッピングと呼ばれる技術を通じて電気化学の分野で電極の構造を研究するために使用されます。[ 74 ]
生物学的および生理学的特性
生理
一酸化炭素は、ガス状のシグナル分子として機能する生理活性分子です。多くの酵素的および非酵素的経路によって自然に生成されますが、[ 75 ]最もよく知られているのは、ヘモグロビンなどのヘムタンパク質由来のヘムに対するヘムオキシゲナーゼの分解作用です。[ 76 ] 1993年に一酸化炭素が正常な神経伝達物質であるという最初の報告を受けて、[ 53 ]一酸化炭素は生物学的調節因子として臨床的に大きな注目を集めています。
一酸化炭素は体内で様々な役割を果たしているため、その代謝異常は神経変性、高血圧、心不全、病的炎症など、様々な疾患と関連付けられています。[ 77 ]多くの組織において、一酸化炭素は抗炎症作用、血管拡張作用、新生血管の成長促進作用を有しています。[ 78 ]動物モデル研究では、一酸化炭素は実験的に誘発された細菌性敗血症、膵炎、肝虚血再灌流障害、大腸炎、変形性関節症、肺損傷、肺移植拒絶反応、神経障害性疼痛の重症度を軽減し、皮膚創傷治癒を促進しました。そのため、一酸化炭素が医薬品や臨床標準治療となる治療の可能性に大きな関心が寄せられています。[ 79 ]
薬
一酸化炭素の抗炎症作用と細胞保護作用に関する研究は、世界中の多くの研究室で行われてきました。[ 80 ]これらの特性は、虚血再灌流障害、移植片拒絶反応、アテローム性動脈硬化症、重症敗血症、重症マラリア、自己免疫など、一連の病態の発症を予防するために使用できる可能性があります。[ 79 ]多くの医薬品薬物送達イニシアチブにより、一酸化炭素を安全に投与する方法が開発され、その後の管理された臨床試験で一酸化炭素の治療効果が評価されました。[ 81 ]
微生物学
微生物叢は一酸化炭素をガス伝達物質として利用することもある。[ 82 ]一酸化炭素の感知はCooAなどのタンパク質によって促進されるシグナル伝達経路である。[ 83 ] [ 84 ] [ 85 ]一酸化炭素感知の生物学的役割の範囲はまだ不明である。
ヒトのマイクロバイオームは一酸化炭素を生成し、消費し、それに反応します。[ 75 ]例えば、特定の細菌では、一酸化炭素は、下流の細胞活動に動力を与えるのに好ましい生体エネルギーを持つ一酸化炭素脱水素酵素によって二酸化炭素が還元されることによって生成されます。[ 86 ] [ 75 ]別の例として、一酸化炭素はメタン生成古細菌の栄養素であり、水素を使ってメタンに還元されます。[ 87 ]
一酸化炭素には特定の抗菌作用があり、感染症の治療に研究されてきました。[ 75 ]
食品科学
一酸化炭素は、米国では主に牛肉、豚肉、魚などの生鮮食肉製品の鮮度を保つために、調整雰囲気包装システムで使用されています。その利点は2つあります。一酸化炭素は微生物による腐敗を防ぎ、肉の色を鮮やかにして消費者の好みに合うようにすることです。 [ 88 ]一酸化炭素はミオグロビンと結合して、鮮やかなチェリーレッド色の色素であるカルボキシミオグロビンを形成します。カルボキシミオグロビンは、ミオグロビンの酸化型であるオキシミオグロビンよりも安定しています。オキシミオグロビンは酸化されて茶色の色素であるメトミオグロビンになります。この安定した赤色は、通常の包装された肉よりもはるかに長く持続します。このプロセスを使用する施設で使用される一酸化炭素の典型的なレベルは、0.4%から0.5%です。[ 88 ]
この技術は、2002年に米国食品医薬品局(FDA)から二次包装システムとして「一般的に安全と認められている」(GRAS)認定を受け、ラベル表示は不要です。2004年には、FDAはCOを一次包装方法として承認し、COは腐敗臭を隠さないと宣言しました。 [ 89 ]このプロセスは現在、日本、シンガポール、欧州連合を含む多くの国で認可されていません。[ 90 ] [ 91 ] [ 92 ]
兵器化
古代史では、ハンニバルが第二次ポエニ戦争中にローマの捕虜を石炭の煙で処刑した。[ 53 ]
一酸化炭素はホロコースト中にいくつかの絶滅収容所で大量虐殺に使用されており、最も有名なのはヘウムノのガストラックとアクションT4の「安楽死」プログラムである。[ 93 ]
歴史
先史時代
人類は紀元前80万年頃に初めて火の制御を学んで以来、一酸化炭素と複雑な関係を維持してきました。初期の人類は、住居に火を持ち込んだ際に一酸化炭素中毒の毒性を知ったと考えられます。紀元前6000年頃から青銅器時代にかけて出現した冶金・製錬技術の初期の発達もまた、人類を一酸化炭素への曝露に悩ませました。一酸化炭素の毒性に加え、先住民であるネイティブアメリカンは、シャーマニズム的な炉辺の儀式を通して、一酸化炭素の神経活性作用を経験した可能性があります。[ 53 ]
古代史
古代文明は、火の起源を説明する神話的物語を発展させました。例えば、ギリシャ神話のプロメテウスは人間と火を共有しました。アリストテレス(紀元前384~322年)は、燃える石炭が有毒な煙を発生させることを初めて記録しました。ギリシャの医師ガレノス(紀元後129~199年)は、空気の組成が変化し、それが吸入すると有害であると推測し、同時代の多くの人々は、石炭煙の毒性という文脈で一酸化炭素に関する知識の基礎を築きました。クレオパトラは一酸化炭素中毒で亡くなったと考えられています。[ 53 ]
産業革命以前
ゲオルク・エルンスト・シュタールは1697年、一酸化炭素と考えられる有毒な蒸気について「carbonarii halitus」という用語で言及しました。フリードリヒ・ホフマンは1716年に石炭による一酸化炭素中毒に関する最初の近代科学的調査を行いました。ヘルマン・ブールハーヴェは1730年代に、一酸化炭素(石炭煙)が動物に及ぼす影響に関する最初の科学的実験を行いました。[ 53 ]
ジョセフ・プリーストリーは1772年に初めて一酸化炭素を合成したと考えられている。カール・ヴィルヘルム・シェーレは1773年に同様に木炭から一酸化炭素を単離し、これが煙を有毒にする炭素質の実体である可能性があると考えた。トルバーン・ベルクマンは1775年にシュウ酸から一酸化炭素を単離した。その後1776年に、フランスの化学者ラソーンは酸化亜鉛をコークスで加熱してCOを生成したが、青い炎で燃えたため、気体生成物は水素であると誤って結論付けた。大気中の酸素を含む酸素の存在下では、一酸化炭素は青い炎で燃え、二酸化炭素を生成する。アントワーヌ・ラボアジエは1777年にラソーンと同様の結論の出ない実験を行った。このガスは1800年にウィリアム・クルックシャンクによって炭素と酸素を含む化合物であると特定された。[ 53 ] [ 94 ]
トーマス・ベドーズとジェームズ・ワットは1793年、一酸化炭素(炭化水素)が静脈血を白くすることを認識した。ワットは石炭の煙が血液中の酸素に対する解毒剤として作用する可能性があると示唆し、ベドーズとワットは1796年に同様に炭化水素は酸素よりも動物繊維との親和性が高いと示唆した。1854年、アドリアン・シュノーも同様に、一酸化炭素が血液から酸素を除去し、その後体内で二酸化炭素に酸化されると示唆した。[ 53 ]一酸化炭素中毒のメカニズムは、1846年に始まり1857年に出版されたクロード・ベルナールの回顧録に「動脈血が静脈血になるのを防ぐ」と記されていることで広く知られる。フェリックス・ホッペ=ザイラーも翌年、同様の結論を独自に発表した。[ 53 ]
工業化学の到来
一酸化炭素は、1900年代に必須の試薬として認識されました。[ 5 ] 産業界での進化を示す工業プロセスが3つあります。フィッシャー・トロプシュ法では、石炭や関連する炭素を豊富に含む原料が、COを介して液体燃料に変換されます。もともとこの技術は、国内の石油不足を補うためにドイツが戦争対策の一環として開発し、今日まで続いています。またドイツでは、COと水素の混合物がオレフィンと結合してアルデヒドを生成することが発見されました。ヒドロホルミル化と呼ばれるこのプロセスは、界面活性剤などの多くの大規模化学物質や、人気の香料や医薬品である特殊化合物の製造に使用されています。たとえば、COはビタミンAの製造に使用されます。[ 95 ]モンサント社の研究者による3番目の主要プロセスでは、COはメタノールと結合して酢酸を生成します。酢酸のほとんどはカティバ法で製造されています。ヒドロホルミル化と酢酸合成は、無数のカルボニル化プロセスのうちの 2 つです。
参照
- 呼気中の一酸化炭素濃度 – 呼気中の一酸化炭素濃度
- 一酸化炭素(データページ) – 化学データページ
- 一酸化炭素検知器 – 一酸化炭素(CO)を測定する装置
- 基準大気汚染物質 – 米国EPAによる特定の大気汚染物質の制限リダイレクト先の簡単な説明を表示するページ
- 毒性の高いガスのリスト
参考文献
- ^ a b NIOSH化学物質ハザードポケットガイド。「#0105」。米国国立労働安全衛生研究所(NIOSH)。
- ^ a b「一酸化炭素」。生命または健康に直ちに危険を及ぼす濃度。米国労働安全衛生研究所。
- ^リチャード・ポハニッシュ (2012).シッティグの毒性・有害化学物質・発がん性物質ハンドブック(第2版). エルゼビア. 572ページ. ISBN 978-1-4377-7869-4. 2015年9月5日閲覧。
- ^ 「一酸化炭素 - CAMEOケミカルズ」cameochemicals.noaa.gov .米国NOAA対応・復旧局。
- ^ a bビアハルス、ユルゲン (2001)。 「一酸化炭素」。ウルマンの工業化学百科事典。ワインハイム: ワイリー-VCH。土井: 10.1002/14356007.a05_203。ISBN 3527306730。
- ^ Bierhals, Jürgen (2001). 「一酸化炭素」. Ullmann's Encyclopedia of Industrial Chemistry . doi : 10.1002/14356007.a05_203 . ISBN 3527306730。
- ^ a b c d e Myers, Isabella (2022年2月).規制と立法の効率的な運用:一酸化炭素の死亡率への影響を理解するための包括的アプローチ(PDF) . CO Research Trust.
- ^ a b「一酸化炭素:毒性学的概要」英国保健安全保障庁2022年5月24日. 2024年4月17日閲覧。
- ^ a b Dent, Matthew R.; Rose, Jason J.; Tejero, Jesús; Gladwin, Mark T. (2024-01-29). 「一酸化炭素中毒:微生物から治療薬へ」 . Annual Review of Medicine . 75 (1): 337– 351. doi : 10.1146 / annurev-med-052422-020045 . ISSN 0066-4219 . PMC 11160397. PMID 37582490 .
- ^ Gilliam, OR; Johnson, CM; Gordy, W. (1950). 「2~3ミリメートル領域におけるマイクロ波分光法」. Physical Review . 78 (2): 140– 144. Bibcode : 1950PhRv...78..140G . doi : 10.1103/PhysRev.78.140 .
- ^ Haynes, William M. (2010). Handbook of Chemistry and Physics (91 ed.). Boca Raton, Florida, USA: CRC Press . p. 9–33. ISBN 978-1-43982077-3。
- ^ Haynes, William M. (2010). Handbook of Chemistry and Physics (91 ed.). Boca Raton, Florida, USA: CRC Press . p. 9–39. ISBN 978-1-43982077-3。
- ^共通結合エネルギー(D)と結合長(r) . wiredchemist.com
- ^ Vidal, CR (1997年6月28日). 「一酸化炭素の高励起三重項状態」 . 2006年8月28日時点のオリジナルよりアーカイブ。2012年8月16日閲覧。
- ^ホルマン、ジャック・P. (2002).熱伝達(第9版). ニューヨーク:マグロウヒル・カンパニーズ. pp. 600– 606. ISBN 9780072406559. OCLC 46959719 .
- ^ Incropera 1 Dewitt 2 Bergman 3 Lavigne 4, Frank P. 1 David P. 2 Theodore L. 3 Adrienne S. 4 (2007). 『熱と質量移動の基礎(第6版)』 ホーボーケン、ニュージャージー州: John Wiley and Sons, Inc. pp. 941– 950. ISBN 9780471457282. OCLC 62532755 .
{{cite book}}: CS1 maint: 数値名: 著者リスト (リンク) - ^ Little, LH; Amberg, CH (1962). 「クロミア・アルミナおよびアルミナに吸着した一酸化炭素および二酸化炭素の赤外スペクトル」. Canadian Journal of Chemistry . 40 (10): 1997– 2006. Bibcode : 1962CaJCh..40.1997L . doi : 10.1139/v62-306 .
- ^スクセリア、グスタボ E.;ミラー、マイケル D.ジェンセン、フランク。 Geertsen、Jan (1991)。 「一酸化炭素の双極子モーメント」。J.Chem.物理学。94 (10): 6660。ビブコード: 1991JChPh..94.6660S。土井: 10.1063/1.460293。
- ^ Martinie, Ryan J.; Bultema, Jarred J.; Vander Wal, Mark N.; Burkhart, Brandon J.; Vander Griend, Douglas A.; DeKock, Roger L. (2011-08-01). 「BF, CO, N2の結合次数と化学的性質」. Journal of Chemical Education . 88 (8): 1094– 1097. Bibcode : 2011JChEd..88.1094M . doi : 10.1021/ed100758t . ISSN 0021-9584 . S2CID 11905354 .
- ^ウルリッヒ、アンリ (2009).クリック反応におけるキュムレン. Wiley InterScience (オンラインサービス). 英国チチェスター: Wiley. p. 45. ISBN 9780470747957. OCLC 476311784 .
- ^ Lupinetti, Anthony J.; Fau, Stefan; Frenking, Gernot; Strauss, Steven H. (1997). 「COと正電荷原子の結合に関する理論的解析」. J. Phys. Chem. A. 101 ( 49): 9551– 9559. Bibcode : 1997JPCA..101.9551L . doi : 10.1021/jp972657l .
- ^ Blanco, Fernando; Alkorta, Ibon; Solimannejad, Mohammad; Elguero, Jose (2009). 「一酸化炭素と次亜ハロゲン酸の1:1錯体の理論的研究」. J. Phys. Chem. A . 113 (13): 3237– 3244. Bibcode : 2009JPCA..113.3237B . doi : 10.1021/jp810462h . hdl : 10261/66300 . PMID 19275137 .
- ^ Meerts, W; De Leeuw, FH; Dymanus, A. (1977年6月1日). 「分子線電気共鳴分光法による一酸化炭素の電気的・磁気的特性」.化学物理学. 22 (2): 319– 324. Bibcode : 1977CP.....22..319M . doi : 10.1016/0301-0104(77)87016-X .
- ^ Stefan, Thorsten; Janoschek, Rudolf (2000). 「酸性分子H 2 SO 3、H 2 SO 4、H 3 PO 3の記述において、S=OおよびP=O二重結合はどの程度重要であるか?」Journal of Molecular Modeling . 6 (2): 282– 288. doi : 10.1007/PL00010730 . S2CID 96291857 .
- ^世界地図。一酸化炭素。earthobservatory.nasa.gov
- ^ Khalil, MAK; Pinto, JP; Shearer, MJ (1999). 「大気中の一酸化炭素」. Chemosphere - Global Change Science . 1 ( 1– 3): ix– xi. Bibcode : 1999ChGCS...1D...9K . doi : 10.1016/S1465-9972(99)00053-7 .
- ^図の出典:二酸化炭素、 NOAA地球システム研究所(2010年6月更新)。メタン、 IPCC TAR表6.1 、 Wayback Machineに2007年6月15日にアーカイブ(1998年版に更新)。NASAの合計は100%を17 ppmv超えており、CO 2はここで15 ppmv増加している。正常化するには、 N 2 を約25 ppmv、 O 2を約7 ppmv削減する必要がある。
- ^環境汚染物質の医学的および生物学的影響に関する委員会(1977年)一酸化炭素。ワシントンD.C.:米国科学アカデミー。p.29。ISBN 978-0-309-02631-4。
- ^ Green W. 「室内空気質入門:一酸化炭素(CO)」。米国環境保護庁。2012年8月2日時点のオリジナルよりアーカイブ。2008年12月16日閲覧。
- ^ Gosink, Tom (1983年1月28日). 「一酸化炭素濃度は何を意味するのか?」アラスカ科学フォーラム. アラスカ大学フェアバンクス校地球物理学研究所. 2008年12月25日時点のオリジナルよりアーカイブ。 2007年12月1日閲覧。
- ^シンガー、ジークフリート・フレッド(1975年)『変化する地球環境』シュプリンガー、p.90、ISBN 978-9027704023。
- ^ a b「一酸化炭素中毒:車両(AEN-208)」 abe.iastate.edu . 2018年2月11日閲覧。
- ^ Gosink T (1983年1月28日). 「一酸化炭素濃度は何を意味するのか?」アラスカ科学フォーラム. アラスカ大学フェアバンクス校地球物理学研究所. 2008年12月25日時点のオリジナルよりアーカイブ。 2008年12月16日閲覧。
- ^ Weinstock, B.; Niki, H. (1972). 「自然界における一酸化炭素のバランス」. Science . 176 ( 4032): 290–2 . Bibcode : 1972Sci...176..290W . doi : 10.1126/science.176.4032.290 . PMID 5019781. S2CID 25223868 .
- ^サインフェルド、ジョン、パンディス、スパイロス (2006). 『大気化学と物理学:大気汚染から気候変動まで』 ジョン・ワイリー・アンド・サンズ. ISBN 978-0-471-72018-8。
- ^ Sigel, Astrid; Sigel, Roland KO (2009).酵素と補因子における金属-炭素結合. 英国王立化学協会. p. 243. ISBN 978-1-84755-915-9。
- ^ホワイト、ジェームズ・キャリック他 (1989).地球規模の気候変動の関連性:酸性雨、大気質、成層圏オゾン. シュプリンガー. p. 106. ISBN 978-0-444-01515-0。
- ^ドラモンド、ジェームズ(2018年2月2日)「MOPITT、大気汚染、そして私:個人的な物語」カナダ気象海洋学会。 2018年8月1日閲覧。
- ^ Pommier, M.; Law, KS; Clerbaux, C.; Turquety, S.; Hurtmans, D.; Hadji-Lazaro, J.; Coheur, P.-F.; Schlager, H.; Ancellet, G.; Paris, J.-D.; Nédélec, P.; Diskin, GS; Podolske, JR; Holloway, JS; Bernath, P. (2010). 「POLARCAT春季および夏季キャンペーンにおける北極圏上空のIASI一酸化炭素検証」 .大気化学物理学. 10 (21): 10655– 10678. Bibcode : 2010ACP....1010655P . doi : 10.5194/acp-10-10655-2010 .
- ^ Combes, Françoise (1991). 「天の川銀河におけるCOの分布」. Annual Review of Astronomy & Astrophysics . 29 : 195–237 . Bibcode : 1991ARA&A..29..195C . doi : 10.1146/annurev.aa.29.090191.001211 .
- ^ Hamed, M. (2021). 「z~2における大質量の塵に覆われた銀河とその青色伴銀河の多波長解析」.天文学と天体物理学. 646 : A127. arXiv : 2101.07724 . Bibcode : 2021A&A...646A.127H . doi : 10.1051/0004-6361/202039577 . S2CID 231639096 .
- ^カーン、アミナ. 「近くの恒星の周りの2つの惑星が衝突したのか? 有毒ガスがヒントを握っている」ロサンゼルス・タイムズ. 2014年3月9日閲覧。
- ^ Dent, WR, Wyatt, MC, Roberge, A, Augereau, JC, Casassus, S, Corder, S, Greaves, JS, de Gregorio-Monsalvo, I, Hales, A, Jackson, AP, Hughes, AM, Meredith A, Lagrange, AM, Matthews, B, Wilner, D (2014年3月6日). 「β Pictoris Debris Disk における氷天体の破壊による分子ガス塊」 . Science . 343 (6178): 1490– 1492. arXiv : 1404.1380 . Bibcode : 2014Sci...343.1490D . doi : 10.1126/science.1248726 . PMID 24603151 . S2CID 206553853 . 2014年3月9日閲覧。
- ^ Lellouch, E.; de Bergh, C.; Sicardy, B.; Ferron, S.; Käufl, H.-U. (2010). 「トリトンの大気におけるCOの検出と地表-大気相互作用の性質」.天文学と天体物理学. 512 : L8. arXiv : 1003.2866 . Bibcode : 2010A&A...512L...8L . doi : 10.1051/0004-6361/201014339 . ISSN 0004-6361 . S2CID 58889896 .
- ^ Greenberg, J. Mayo (1998). 「彗星核の形成」.天文学と天体物理学. 330 :375. Bibcode : 1998A&A...330..375G .
- ^ Yeomans, Donald K. (2005). 「彗星(ワールドブックオンラインリファレンスセンター 125580)」 NASA. 2005年4月29日時点のオリジナルよりアーカイブ。 2022年8月18日閲覧。
氷の約80%は水氷で、残りの15%は凍結した一酸化炭素である。
- ^ Christopher Glein、Hunter Waite (2018年5月11日). 「原始窒素は冥王星スプートニク平原の存在を宇宙化学的に説明する」Icarus . 313 : 79–92 . arXiv : 1805.09285 . Bibcode : 2018Icar..313...79G . doi : 10.1016/j.icarus.2018.05.007 . S2CID 102343522 .
- ^ Pommier, M.; McLinden, CA; Deeter, M. (2013). 「宇宙からの観測に基づく巨大都市におけるCO排出量の相対的変化」 .地球物理学研究論文集. 40 (14): 3766. Bibcode : 2013GeoRL..40.3766P . doi : 10.1002/grl.50704 .
- ^ Reeves, Claire E.; Penkett, Stuart A.; Bauguitte, Stephane; Law, Kathy S.; Evans, Mathew J.; Bandy, Brian J.; Monks, Paul S.; Edwards, Gavin D.; Phillips, Gavin; Barjat, Hannah; Kent, Joss; Dewey, Ken; Schmitgen, Sandra; Kley, Dieter (2002). 「ACSOE期間中の航空機観測から得られた北大西洋上空における対流圏光化学オゾン形成の可能性」 . Journal of Geophysical Research . 107 (D23): 4707. Bibcode : 2002JGRD..107.4707R . doi : 10.1029/2002JD002415 .
- ^オゾンとその他の光化学オキシダント. 米国科学アカデミー. 1977年. p. 23. ISBN 978-0-309-02531-7。
- ^ a bペニー、デイビッド; ベニグナス、ヴァーノン; ケファロプロス、スティリアノス; コツィアス、ディミトリオス; クラインマン、マイケル; ヴェリエ、アグネス (2010)、「一酸化炭素」、WHO室内空気質ガイドライン:特定汚染物質、世界保健機関、ISBN 978-92-890-0213-4, OCLC 696099951 , 2021年3月8日時点のオリジナルよりアーカイブ, 2024年3月18日閲覧
{{citation}}: CS1 maint: ISBNによる作業パラメータ(リンク) - ^ 「MSHA - 職業性疾病・傷害予防プログラム - 健康トピック - 一酸化炭素」 arlweb.msha.gov 。 2017年12月31日時点のオリジナルよりアーカイブ。 2017年12月31日閲覧。
- ^ a b c d e f g h i Hopper, Christopher P.; Zambrana, Paige N.; Goebel, Ulrich; Wollborn, Jakob (2021-06-01). 「一酸化炭素とその治療的起源の簡潔な歴史」 . Nitric Oxide . 111– 112: 45– 63. doi : 10.1016/j.niox.2021.04.001 . ISSN 1089-8603 . PMID 33838343. S2CID 233205099 .
- ^ Peng, Jin-Bao; Geng, Hui-Qing; Wu, Xiao-Feng (2019-03-14). 「COの化学:カルボニル化」 . Chem . 5 (3): 526– 552. Bibcode : 2019Chem....5..526P . doi : 10.1016/j.chempr.2018.11.006 . ISSN 2451-9294 .
- ^ C. Elschenbroich (2006).有機金属化学. VCH. ISBN 978-3-527-29390-2。
- ^ a b Koch, H.; Haaf, W. (1964). 「1-アダマンタンカルボン酸」.有機合成. 44 : 1. doi : 10.15227/orgsyn.044.0001 .
- ^ a bコールマン, GH; クレイグ, デイヴィッド (1932). 「p-トルアルデヒド」.有機合成. 12 : 80. doi : 10.15227/orgsyn.012.0080。
- ^ Chatani, N.; Murai, S. 「一酸化炭素」Encyclopedia of Reagents for Organic Synthesis (Ed: L. Paquette) 2004, J. Wiley & Sons, New York. doi : 10.1002/047084289X
- ^ブヒナー、W.;ワイス、E. (1964)。 「Zur Kenntnis der sogenannten "アルカリカルボニル" IV[1] Über die Reaktion von geschmolzenem Kalium mit Kohlenmonoxy」。ヘルベチカ・チミカ・アクタ。47 (6): 1415–1423。土井: 10.1002/hlca.19640470604。
- ^ファウンズ、ジョージ (1869). 『初等化学マニュアル』 HC Lea. p. 678 .
- ^ Katz, Allen I.; Schiferl, David; Mills, Robert L. (1984). 「加圧下における固体一酸化炭素の新しい相と化学反応」. The Journal of Physical Chemistry . 88 (15): 3176– 3179. doi : 10.1021/j150659a007 .
- ^ Evans, WJ; Lipp, MJ; Yoo, C.-S.; Cynn, H.; Herberg, JL; Maxwell, RS; Nicol, MF (2006). 「一酸化炭素の圧力誘起重合:不均化反応と高エネルギーラクトン性ポリマーの合成」 .材料化学. 18 (10): 2520– 2531. doi : 10.1021/cm0524446 . OSTI 884767 .
- ^ Brauer, Georg (1963). Handbook of Preparative Inorganic Chemistry Vol. 1, 2nd Ed . New York: Academic Press. p. 646. ISBN 978-0121266011。
{{cite book}}:ISBN / 日付の非互換性(ヘルプ) - ^ Holleman , AF; Wiberg, E.「無機化学」Academic Press: サンディエゴ、200。ISBN 0-12-352651-5。
- ^ 「一酸化炭素」 。 2021年5月21日閲覧。
- ^ヒグマン、C;ファン・デル・ブルクト、M (2003)。ガス化。湾岸プロフェッショナル出版。 p. 12.ISBN 978-0-7506-7707-3。
- ^ Zheng, Yun; Wang, Jianchen; Yu, Bo; Zhang, Wenqiang; Chen, Jing; Qiao, Jinli; Zhang, Jiujun (2017). 「固体酸化物電解セル(SOEC)を用いた持続可能な燃料製造のためのH2OとCOの高温共電解に関するレビュー:先進材料と技術」. Chem. Soc. Rev. 46 ( 5): 1427– 1463. doi : 10.1039/C6CS00403B . PMID 28165079 .
- ^ 「スタンフォード大学とDTUのチームが二酸化炭素からカーボンニュートラル燃料を製造する新たな方法を発見 - DTU」dtu.dk。
- ^スカフテ、タイス L.;グアン、ジシュアン。マチャラ、マイケル L. Gopal、Chirranjeevi B.;モンティ、マッテオ。レフ・マルティネス。スタメイト、オイゲン。サンナ、シモーネ。ガリド・トーレス、ホセ・A.クラムリン、イーサン J.ガルシア=メルチョール、マックス。バジディヒ、ミハル。チューエ、ウィリアム C.クリストファー・グレイブス(2019年10月8日)。「酸化炭素中間体によって可能になる選択的高温 CO 2 電気分解」。自然エネルギー。4 (10): 846–855。Bibcode : 2019NatEn...4..846S。土井: 10.1038/s41560-019-0457-4。hdl : 2262/93685 . S2CID 202640892 – www.nature.comより。
- ^エルシェンブロイヒ、C.;サルザー、A. (2006)。有機金属: 簡潔な紹介(第 2 版)。ワインハイム: ワイリー-VCH。ISBN 978-3-527-28165-7。
- ^ヴォルフガング・シュナイダー;ヴェルナー・ディラー。 "ホスゲン"。ウルマンの工業化学百科事典。ワインハイム: ワイリー-VCH。土井: 10.1002/14356007.a19_411。ISBN 978-3-527-30673-2。
- ^ Landis (2001). 「火星探査ロケットにおける現場推進剤の使用」. Journal of Spacecraft and Rockets . 38 (5): 730– 735. Bibcode : 2001JSpRo..38..730L . doi : 10.2514/2.3739 .
- ^ 「金星表面からのサンプルリターン」 NASA 2024年1月4日2024年5月29日閲覧。
- ^竹下智宏; 神高雄二; 篠崎一真; 児玉健作; 森本悠 (2020-08-15). 「COストリッピングボルタンメトリーによる高分子電解質膜燃料電池用Pt触媒におけるイオノマー被覆率の評価と酸素還元反応活性への影響」 . Journal of Electroanalytical Chemistry . 871 114250. doi : 10.1016/j.jelechem.2020.114250 . ISSN 1572-6657 .
- ^ a b c d Hopper, Christopher P.; De La Cruz, Ladie Kimberly; Lyles, Kristin V.; Wareham, Lauren K.; Gilbert, Jack A.; Eichenbaum, Zehava; Magierowski, Marcin; Poole, Robert K.; Wollborn, Jakob; Wang, Binghe (2020-12-23). 「宿主–腸内マイクロバイオームコミュニケーションにおける一酸化炭素の役割」 . Chemical Reviews . 120 (24): 13273– 13311. doi : 10.1021/acs.chemrev.0c00586 . ISSN 0009-2665 . PMID 33089988. S2CID 224824871 .
- ^ Ryter, Stefan W.; Alam, Jawed; Choi, Augustine MK (2006-04-01). 「ヘムオキシゲナーゼ-1/一酸化炭素:基礎科学から治療応用まで」 .生理学レビュー. 86 (2): 583– 650. doi : 10.1152/physrev.00011.2005 . ISSN 0031-9333 . PMID 16601269 .
- ^ Wu, L; Wang, R (2005年12月) . 「一酸化炭素:内因性産生、生理機能、および薬理学的応用」. Pharmacol Rev. 57 ( 4): 585– 630. doi : 10.1124/pr.57.4.3 . PMID 16382109. S2CID 17538129 .
- ^ Campbell, Nicole K.; Fitzgerald, Hannah K.; Dunne, Aisling (2021-01-29). 「抗酸化ヘムオキシゲナーゼ1による炎症制御」 . Nature Reviews Immunology . 21 (7): 411– 425. doi : 10.1038/s41577-020-00491- x . ISSN 1474-1741 . PMID 33514947. S2CID 231762031 .
- ^ a b Motterlini, Roberto; Otterbein, Leo E. (2010). 「一酸化炭素の治療的可能性」 . Nature Reviews Drug Discovery . 9 (9 ) : 728– 743. doi : 10.1038/nrd3228 . ISSN 1474-1784 . PMID 20811383. S2CID 205477130 .
- ^ Motterlini, Roberto; Foresti, Roberta (2017-01-11). 「一酸化炭素および一酸化炭素放出分子による生物学的シグナル伝達」 . American Journal of Physiology. Cell Physiology . 312 (3): C302– C313. doi : 10.1152/ajpcell.00360.2016 . ISSN 0363-6143 . PMID 28077358 .
- ^ Hopper, Christopher P.; Meinel, Lorenz; Steiger, Christoph; Otterbein, Leo E. (2018-10-11). 「ヘムオキシゲナーゼ-1/一酸化炭素治療薬の臨床的ブレークスルーはどこにあるのか?」 Current Pharmaceutical Design . 24 (20): 2264– 2282. doi : 10.2174/1381612824666180723161811 . PMID 30039755 . S2CID 51712930 .
- ^ Wareham, Lauren K.; Southam, Hannah M.; Poole, Robert K. (2018-09-06). 「一酸化窒素、一酸化炭素、硫化水素は本当に細菌の『ガス伝達物質』として適格なのか?」生化学会誌46 ( 5 ): 1107– 1118. doi : 10.1042/BST20170311 . ISSN 0300-5127 . PMC 6195638. PMID 30190328 .
- ^ Roberts, GP; Youn, H.; Kerby, RL (2004). 「COセンシングメカニズム」 . Microbiology and Molecular Biology Reviews . 68 (3): 453– 473. doi : 10.1128 / MMBR.68.3.453-473.2004 . PMC 515253. PMID 15353565 .
- ^清水亨;アルツベタ州レンガロバ。マルティネック、ヴァーツラフ。マルティンコバ、マルケタ(2019-12-09)。「ヘム:シグナル伝達、機能調節、および触媒中心としてのヘムの新たな役割」。化学会のレビュー。48 (24): 5624–5657 .土井: 10.1039/C9CS00268E。ISSN 1460-4744。PMID 31748766。S2CID 208217502。
- ^清水亨;黄、東陽。ヤン、ファン;ストラナヴァ、マーティン。バルトソワ、マルティナ。フォイティコヴァ、ヴェロニカ。マルティンコバ、マルケタ (2015-07-08)。「シグナル伝達におけるガス状 O2、NO、CO: ヘムベースのガスセンサーとヘム酸化還元センサーの構造と機能の関係」。化学レビュー。115 (13): 6491–6533。土井: 10.1021/acs.chemrev.5b00018。ISSN 0009-2665。PMID 26021768。
- ^ Jaouen、G.編。 (2006)。生体有機金属: 生体分子、標識、医学。ワインハイム: ワイリー-VCH。ISBN 978-3-527-30990-0。
- ^ Thauer, RK (1998). 「メタン生成の生化学:マージョリー・スティーブンソンへのトリビュート.1998年マージョリー・スティーブンソン賞講演」(無料) . Microbiology . 144 (9): 2377– 2406. doi : 10.1099/00221287-144-9-2377 . PMID 9782487 .
- ^ a b Van Rooyen, Lauren Anne; Allen, Paul; O'Connor, David I. (2017年10月). 「EU域内における肉の包装における一酸化炭素の使用は再評価される必要がある:概要」 . Meat Science . 132 : 179–188 . doi : 10.1016/j.meatsci.2017.03.016 . PMID 28465017 .
- ^ Eilert EJ (2005). 「21世紀の新しい包装技術」. Journal of Meat Science . 71 (1): 122– 127. doi : 10.1016/j.meatsci.2005.04.003 . PMID 22064057 .
- ^ 「Proof in the Pink? Meat Treated to Give It Fresh Look」 ABCニュース、2007年11月14日。 2009年5月5日閲覧。
- ^ 「肉の包装における一酸化炭素:神話と事実」アメリカ肉協会、2008年。2011年7月14日時点のオリジナルよりアーカイブ。2009年5月5日閲覧。
- ^ 「包装肉中のCO」。一酸化炭素中毒キャンペーン。2010年9月26日時点のオリジナルよりアーカイブ。2009年5月5日閲覧。
- ^キッチン、マーティン(2006年)『近代ドイツの歴史 1800-2000』ワイリー・ブラックウェル、323頁。ISBN 978-1-4051-0041-0。
- ^フリードリヒ・ストロマイヤー (1808)。Grundriß der theoretischen Chemie: zum Behuf seiner Vorlesungen entworfen (ドイツ語)。ローワー。1 ~ 18ページ 。
- ^ Kelkar, AA (2016). 「ファインケミカルのためのカルボニル化とヒドロホルミル化」.ファインケミカルおよびスペシャルティケミカルのための工業用触媒プロセス. pp. 663– 692. doi : 10.1016/B978-0-12-801457-8.00014-8 . ISBN 9780128014578。
外部リンク
- 一酸化炭素分布の世界地図
- 構造の説明
- 国際化学物質安全性カード 0023
- CDC NIOSH 化学物質の危険性に関するポケットガイド:一酸化炭素—米国国立労働安全衛生研究所(NIOSH)、米国疾病予防管理センター(CDC)
- 外部MSDSデータシート
- 一酸化炭素検知器の設置
- 一酸化炭素を用いたマイクロスケールのガス化学実験
- 「瞬間的な洞察:伝達者を責めるな」。Chemical Biology (11: Research News). 2007年10月18日。2007年10月28日時点のオリジナルよりアーカイブ。 2019年10月27日閲覧。英国
王立化学協会
による一酸化炭素の生理学の概要。






