リボソーム
この記事のリード部分は書き直す必要があるかもしれません。(2025年11月) |
| リボソーム | |
|---|---|
 リボソームの大きなサブユニット(赤)と小さなサブユニット(青) | |
| 詳細 | |
| の一部 | 細胞(生物学) |
| 識別子 | |
| メッシュ | D012270 |
| FMA | 66867 |
| 微細解剖学の解剖学用語 | |
| 細胞生物学 | |
|---|---|
| 動物細胞図 | |
 |
リボソーム(/ ˈ r aɪ b ə z oʊ m , - s oʊ m /)は、原核細胞と真核細胞の両方に存在するリボ核タンパク質粒子であり、タンパク質の合成を担っています。リボソームは、メッセンジャーRNA (mRNA)鎖の翻訳とタンパク質の生成における分子機械として機能します。リボソームは、mRNA分子のコドンで指定された順序でアミノ酸を結合し、ポリペプチド鎖を形成します。リボソームは、大サブユニットと小サブユニットで構成され、各サブユニットは1つ以上のリボソームRNA分子と多くのリボソームタンパク質で構成されています。リボソームと関連分子は、翻訳装置としても知られています。
リボソーム生合成は、リボソームを作るプロセスです。これはエネルギーを消費する動的なプロセスであり、リボソームRNAの処理とリボソームタンパク質との組み立てによってリボソームサブユニットを形成する際に、約200種類のタンパク質の合成を必要とします。
概要
タンパク質中のアミノ酸配列をコードするDNA配列は、メッセンジャー RNA (mRNA) 鎖に転写されます。リボソームはメッセンジャー RNA 分子に結合し、RNA のヌクレオチド配列を使用して、タンパク質の生成に必要なアミノ酸配列を決定します。アミノ酸は、トランスファー RNA (tRNA) 分子によって選択され、リボソームに運ばれます。トランスファー RNA はリボソームに入り、アンチコドンステム ループを介してメッセンジャー RNA 鎖に結合します。メッセンジャー RNA の各コード トリプレット (コドン) には、正確に一致するアンチコドンを持ち、成長中のポリペプチド鎖に組み込むための正しいアミノ酸を運ぶ、固有のトランスファー RNA があります。タンパク質が生成されると、折り畳まれて機能的な三次元構造を形成します。[ 1 ] [ 2 ]
翻訳中、タンパク質はその構成要素から合成され、開始、伸長、終結、リボソームのリサイクルという4つの段階で進行します。[ 3 ]すべてのmRNA分子の開始コドンはAUGという配列を持ちます。終止コドンはUAA、UAG、UGAのいずれかです。これらのコドンを認識するtRNA分子が存在しないため、リボソームは翻訳が完了したことを認識します。[ 4 ]リボソームがmRNA分子の読み取りを終えると、2つのサブユニットは分離し、通常は分解されますが、再利用することができます。リボソームは酵素の一種で、アミノ酸を連結する触媒ペプチジルトランスフェラーゼ活性がリボソームRNAによって行われることからリボザイムと呼ばれます。 [ 5 ]
細菌、古細菌、そして真核生物(3ドメインシステム)のリボソームは驚くほど類似しており、共通の起源を持つことを示しています。それらは、大きさ、配列、構造、そしてタンパク質とRNAの比率が異なります。構造の違いにより、一部の抗生物質は細菌のリボソームを阻害することで細菌を死滅させ、ヒトのリボソームには影響を与えません。すべてのドメインにおいて、 2つ以上のリボソームからなるポリソームが、単一のmRNA鎖に沿って同時に移動することができ、それぞれが特定の配列を読み取り、対応するタンパク質分子を生成します。
真核細胞のミトコンドリアリボソーム(ミトリボソーム)は他のリボソームとは異なります。ミトコンドリアが細胞内共生細菌として進化的に起源を持つことを反映し、ミトコンドリアの機能には細菌のリボソームと類似しています。[ 6 ] [ 7 ]
発見
リボソームは、1950年代半ばにルーマニア系アメリカ人の細胞生物学者ジョージ・エミール・パラデによって電子顕微鏡を用いて高密度粒子または顆粒として初めて観察されました。[ 8 ] 当初は 、その顆粒構造からパラデ顆粒と呼ばれていました。「リボソーム」という用語は、1958年にハワード・M・ディンツィスによって提唱されました。[ 9 ]
シンポジウムの過程で、意味上の難しさが明らかになりました。参加者の中には、「ミクロソーム」とは、ミクロソーム分画中のリボ核タンパク質粒子に他のタンパク質や脂質が混入したものを指すと考える人もいれば、ミクロソームはタンパク質と脂質に粒子が混入したもので構成されていると考える人もいました。「ミクロソーム粒子」という表現は適切ではなく、「ミクロソーム分画中のリボ核タンパク質粒子」という表現はあまりにも不自然です。会議中に「リボソーム」という用語が提案されました。これは非常に適切な名称であり、響きも心地よいものです。35~100 Sのサイズのリボ核タンパク質粒子を「リボソーム」と呼べば、現在の混乱は解消されるでしょう。
— アルベール・クロード、ミクロソーム粒子とタンパク質合成[ 10 ]
アルベール・クロード、クリスチャン・ド・デューブ、ジョルジュ・エミール・パラードは、1974年にリボソームの発見によりノーベル生理学・医学賞を共同受賞しました。 [ 11 ] 2009年のノーベル化学賞は、リボソームの詳細な構造とメカニズムの解明により、ヴェンカトラマン・ラマクリシュナン、トーマス・A・スタイツ、アダ・E・ヨナットに授与されました。[ 12 ]
構造

リボソームは、リボソームRNAとタンパク質の複合体から構成されるリボ核タンパク質粒子であり、大小2つのリボソームサブユニットに分かれています。リボソームは、原核生物と真核生物の両方の細胞に存在する複雑な分子機械です。原核生物と真核生物のリボソームサブユニットは非常によく似ています。[ 13 ]
リボソームは、主に特殊な非コードリボソームRNA(rRNA)と数十種類の異なるリボソームタンパク質(種によってその数はわずかに異なる)で構成されています。リボソームタンパク質とrRNAは、大小2つの異なるリボソームサブユニットに分かれて配置されています。これらのサブユニットはmRNA鎖を囲むように互いに固定され、タンパク質合成においてmRNAをポリペプチド鎖へと翻訳する際に一体となって機能します。[ 14 ]
原核生物
細菌
細菌のリボソームは 直径約20nm(200Å )で、65%のrRNAと35%のリボソームタンパク質で構成されています。[ 15 ]真核生物のリボソームは直径25~30nm ( 250~300Å)で、rRNAとタンパク質の比はほぼ1です。[ 16 ]結晶構造解析[ 17 ]により、ポリペプチド合成の反応部位の近くにはリボソームタンパク質が存在しないことが示されています。これは、リボソームのタンパク質成分がペプチド結合形成触媒に直接関与するのではなく、むしろこれらのタンパク質がrRNAのタンパク質合成能力を高めるための足場として作用することを示唆しています。[ 18 ]

リボソームサブユニットとrRNAフラグメントを表すために使用される測定単位はスヴェドベリ単位です。これは、サイズではなく遠心分離における沈降速度の尺度です。これが、フラグメント名が一致しない理由です。例えば、細菌の70Sリボソームは、50Sサブユニットと30Sサブユニットで構成されています。
原核生物は70個のSリボソームを有し、それぞれは小サブユニット(30S)と大サブユニット(50S)から構成されています。例えば、大腸菌は16S RNAサブユニット(1540ヌクレオチド)を有し、21個のタンパク質が結合しています。大サブユニットは、 5S RNAサブユニット(120ヌクレオチド)、23S RNAサブユニット(2900ヌクレオチド)、そして31個のタンパク質から構成されています。[ 13 ]
大腸菌(細菌)のリボソーム[ 20 ] : 962 リボソーム サブユニット rRNA rタンパク質 70年代 50代 23S (2904 nt ) 31 5S(120個) 30代 16S(1542塩基) 21
大腸菌リボソームのtRNA結合部位に対する親和性標識により、ペプチジルトランスフェラーゼ活性に最も関連する可能性のあるA部位およびP部位タンパク質の同定が可能になった。[ 5 ]標識されたタンパク質はL27、L14、L15、L16、L2であり、少なくともL27はE. CollatzとAP Czernilofskyによって示されたようにドナー部位に位置する。[ 21 ] [ 22 ]追加の研究により、S1およびS21タンパク質は16SリボソームRNAの3'末端に関連して、翻訳の開始に関与することが実証されている。[ 23 ]
古細菌
古細菌のリボソームは、一般的に細菌のリボソームと同程度の大きさで、50S大サブユニットと30S小サブユニットからなる70Sリボソームであるとされている。[ 24 ] rRNA鎖も同様に16S、23S、5Sと呼ばれることが多いが、近年の研究ではその沈降係数を正確に測定したものはほとんどない(そもそも存在しない) 。[ 25 ]しかし、配列レベルと構造レベルでは、細菌よりも真核生物のリボソームに近い。古細菌が細菌と比較して持つ余分なリボソームタンパク質には、真核生物の対応するタンパク質が存在するが、古細菌と細菌の間にはそのような関係は当てはまらない。[ 26 ] [ 27 ] [ 28 ]
ピロコッカス・フリオサス(古細菌)のリボソーム[ 29 ] [ 30 ] リボソーム サブユニット rRNA rタンパク質 70年代 50代 23S(3049ヌクレオチド) 42 5S(120個) 30代 16S(1495塩基) 26
真核生物
真核細胞は細胞質に80Sリボソームを有し、それぞれが小サブユニット(40S)と大サブユニット(60S)から構成されています。40Sサブユニットは18S RNA(1900ヌクレオチド)と33種類のタンパク質で構成されています。[ 31 ] [ 32 ]大サブユニットは5S RNA(120ヌクレオチド)、28S RNA(4700ヌクレオチド)、5.8S RNA(160ヌクレオチド)のサブユニットと49種類のタンパク質で構成されています。[ 13 ] [ 31 ] [ 33 ]
真核生物細胞質リボソーム ( R. Norvegicus ) [ 20 ] : 65 リボソーム サブユニット rRNA rタンパク質 80年代 60年代 28S(4718ヌクレオチド) 49 5.8S(160 nt) 5S(120個) 40代 18S(1874 nt) 33
1977年、チェルニロフスキーは、親和性標識を用いてラット肝臓リボソーム上のtRNA結合部位を同定した研究を発表しました。L32/33、L36、L21、L23、L28/29、L13を含むいくつかのタンパク質が、ペプチジルトランスフェラーゼ中心またはその近傍に存在することが示唆されました。[ 34 ]
プラストリボソームとミトリボソーム
真核生物では、リボソームはミトコンドリア(ミトリボソームと呼ばれることもある)と葉緑体などのプラスチド(プラストリボソームとも呼ばれる)に存在します。リボソームも、タンパク質が1つの70S粒子に結合した大小のサブユニットで構成されています。 [ 13 ]これらのリボソームは細菌のリボソームに似ており、これらの細胞小器官は共生細菌として起源を発したと考えられています。[ 13 ] 2つのうち、葉緑体のリボソームはミトコンドリアのリボソームよりも細菌のリボソームに近いです。ミトコンドリア内のリボソームRNAの多くは短縮されており、 5S rRNAの場合は動物や真菌では他の構造に置き換えられています。[ 35 ]特に、リーシュマニア・タレントラエは、最小限のミトコンドリアrRNAセットを持っています。[ 36 ]対照的に、植物のミトリボソームは細菌と比較して拡張されたrRNAと追加のタンパク質、特に多くのペンタトリコペプチド繰り返しタンパク質を持っています。[ 37 ]
クリプトモナドとクロララクニオフィテス藻類には、痕跡的な真核生物の核に似た核形態が含まれている可能性がある。 [ 38 ]真核生物の80Sリボソームは、核形態を含む区画に存在する可能性がある。[ 39 ]
違いを活かす
細菌と真核生物のリボソームの違いは、製薬化学者によって、感染者の細胞に害を与えることなく細菌感染を破壊できる抗生物質を作り出すために利用されている。構造の違いにより、細菌の70Sリボソームはこれらの抗生物質に対して脆弱であるが、真核生物の80Sリボソームは脆弱ではない。 [ 40 ]ミトコンドリアは細菌のものと似たリボソームを持っているが、ミトコンドリアはこれらの抗生物質の影響を受けない。なぜなら、ミトコンドリアはこれらの抗生物質が細胞小器官に容易に侵入できない二重膜に囲まれているからである。[ 41 ]注目すべき反例は、細菌の50Sリボソームと真核生物のミトコンドリアの50Sリボソームを阻害する抗腫瘍抗生物質クロラムフェニコールである。 [ 42 ]しかし、葉緑体のリボソームは異なります。葉緑体リボソームタンパク質の抗生物質耐性は、遺伝子工学によってマーカーとして導入する必要がある形質です。[ 43 ]
共通プロパティ
様々なリボソームは、サイズに大きな違いがあるにもかかわらず、非常によく似たコア構造を共有しています。RNAの大部分は、様々な三次構造モチーフ、例えば同軸スタッキングを示す擬似ノットに高度に組織化されています。大型リボソーム中の余分なRNAは、複数の長い連続挿入構造をとっており[ 44 ]、コア構造を破壊したり変化させたりすることなく、コア構造からループを形成しています。[ 13 ]リボソームの触媒活性はすべてRNAによって行われ、タンパク質は表面に存在し、構造を安定化させているようです。[ 13 ]
高解像度構造

リボソームの一般的な分子構造は1970年代初頭から知られていました。2000年代初頭には、数オングストロームのオーダーという高解像度での構造が解明されました。[ 46 ]
リボソームの構造を原子分解能で示した最初の論文は、2000年後半にほぼ同時に発表されました。50S(大型原核生物)サブユニットは、古細菌Haloarcula marismortui [ 45 ]と細菌Deinococcus radioduransから決定され、30Sサブユニットの構造は細菌Thermus thermophilusから決定されました。[ 19 ] [ 47 ]これらの構造研究は2009年にノーベル化学賞を受賞しました。2001年5月、これらの座標は、5.5Åの分解能でT. thermophilus 70S粒子 全体を再構築するために使用されました。[ 48 ]
2005年11月、大腸菌70Sリボソームの構造に関する2つの論文が発表されました。X 線結晶構造解析を用いて、空のリボソームの構造を3.5Åの分解能で決定しました。[ 49 ]そして2週間後、クライオ電子顕微鏡法に基づく構造が発表されました。[ 50 ]この構造では、新たに合成されたタンパク質鎖をタンパク質伝導チャネルに通過させるリボソームの様子が11~15Åの分解能で示されてい ます。
tRNAおよびmRNA分子と複合体を形成したリボソームの最初の原子構造は、2つのグループにより独立してX線結晶構造解析を用いて、2.8Å [ 51 ]および3.7Å [ 52 ]で解読された。これらの構造により、Thermus thermophilusリボソームとmRNAおよび古典的なリボソーム部位に結合したtRNAとの相互作用の詳細を見ることができる。その後まもなく、 リボソームとシャイン・ダルガルノ配列を含む長いmRNAとの相互作用が4.5~5.5Åの解像度で可視化された。[ 53 ] 2023年には、クライオ電子顕微鏡研究により、翻訳状態にある大腸菌70Sリボソームの1.55Åの構造が報告され、rRNA修飾、tRNA-mRNA相互作用、イオン配位の原子レベルの詳細が得られた。この高解像度マップにより、リボソーム多型部位の同定と、tRNA転座に関連する一過性のキメラハイブリッド状態を約2Åの解像度で可視化することが可能になった。これらの発見は、リボソームの機能領域の構造的理解を深め、抗生物質設計に貴重な知見を提供した。[ 54 ]
2011年、酵母サッカロミセス・セレビシエ由来の真核生物80Sリボソームの完全な原子構造が 結晶構造解析によって初めて明らかになった。[ 31 ]このモデルは、真核生物特有の要素の構造と、それらが普遍的に保存されたコアと相互作用する仕組みを明らかにしている。同時に、テトラヒメナ・サーモフィラの真核生物40Sリボソーム構造の完全なモデルが発表され、 40Sサブユニットの構造だけでなく、翻訳開始時の40SサブユニットとeIF1の相互作用についても多くのことが解明された。[ 32 ]同様に、テトラヒメナ・サーモフィラとeIF6の複合体から、真核生物60Sサブユニットの構造も決定された。[ 33 ]さらに、2つの回転状態で捉えられた好熱性真核生物の80Sリボソームの高解像度クライオ電子顕微鏡構造は、約2.9Åと約3.0Åの解像度で、真核生物の転座機構とGTP加水分解中のeEF2の立体構造ダイナミクスの原子レベルでの詳細を明らかにした。[ 55 ]
関数
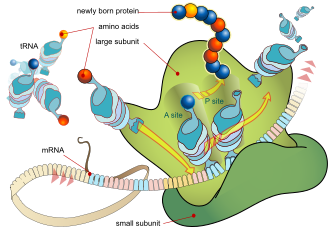
リボソームは、RNAと関連するタンパク質からなる微小な粒子で、タンパク質を合成する働きをします。タンパク質は、損傷の修復や化学反応の制御など、多くの細胞機能に必要です。リボソームは、細胞質内で遊離して浮遊しているか、粗面小胞体に結合しています。主な機能は、遺伝暗号をアミノ酸配列に変換し、アミノ酸モノマーからタンパク質ポリマーを構築することです。
リボソームは、ペプチジル転移とペプチジル加水分解と呼ばれる2つの非常に重要な生物学的プロセスにおいて触媒として作用します。[ 5 ] [ 56 ]「PTセンターは、タンパク質伸長中にタンパク質結合を生成する役割を担っています。」[ 56 ]
要約すると、リボソームには主に2つの機能があります。メッセージの解読とペプチド結合の形成です。これらの2つの機能はリボソームサブユニットに存在します。各サブユニットは、1つ以上のrRNAと多数のrタンパク質で構成されています。小サブユニット(細菌および古細菌では30S、真核生物では40S)は解読機能を担い、大サブユニット(細菌および古細菌では50S、真核生物では60S)はペプチジルトランスフェラーゼ活性と呼ばれるペプチド結合の形成を触媒します。細菌(および古細菌)の小サブユニットには16S rRNAと21個のrタンパク質(大腸菌)が含まれ、真核生物の小サブユニットには18S rRNAと32個のrタンパク質(サッカロミセス・セレビシエ、ただし種によって数は異なります)が含まれます。細菌の大サブユニットには5Sおよび23S rRNAと34個のrタンパク質が含まれており(大腸菌)、真核生物の大サブユニットには5S、5.8S、25S/28S rRNAと46個のrタンパク質が含まれています(S. cerevisiae。ここでも正確な数は種によって異なります)。[ 57 ]
翻訳

リボソームはタンパク質生合成、つまりmRNA をタンパク質に翻訳するプロセスが行われる場所です。 mRNA は、リボソームによって解読されタンパク質が作られる 一連のコドンで構成されています。 mRNA を鋳型として、リボソームは mRNA の各コドン (3ヌクレオチド) をトラバースし、アミノアシル tRNAによって提供される適切なアミノ酸と対にします。 アミノアシル tRNA は、一方の端に相補的なアンチコドン、もう一方の端に適切なアミノ酸を持っています。 適切な tRNA を素早く正確に認識するために、リボソームは大きな構造変化 (構造校正) を利用します。[ 58 ]通常、最初のアミノ酸であるメチオニンを含むアミノアシル tRNA に結合している小さなリボソームサブユニットは、mRNA 上の AUG コドンに結合し、大きなリボソームサブユニットをリクルートします。リボソームには、A、P、Eと呼ばれる3つのRNA結合部位があります。A部位はアミノアシルtRNAまたは終結解除因子に結合します。[ 59 ] [ 60 ] P部位はペプチジルtRNA(ポリペプチド鎖に結合したtRNA)に結合し、E部位(出口)は遊離tRNAに結合します。タンパク質合成は、 mRNAの5'末端付近にある開始コドンAUGから始まります。mRNAはまずリボソームのP部位に結合します。リボソームは、原核生物ではmRNAのシャイン・ダルガルノ配列、真核生物ではコザックボックスを用いて開始コドンを認識します。
ペプチド結合の触媒作用は、RNAのP部位アデノシンのC2位ヒドロキシル基を介したプロトンシャトル機構によって行われますが、タンパク質合成における他の段階(例えば転座)は、タンパク質の立体構造の変化によって引き起こされます。リボソームは、その触媒核がRNAで構成されているため、「リボザイム」に分類され[ 61 ] 、 RNAワールドの残骸であると考えられています[ 62 ]。

図5では、リボソームサブユニット(小サブユニットと大サブユニット)の両方が開始コドン(mRNAの5'末端側)に集合しています。リボソームは、mRNA上の現在のコドン(トリプレット)と一致するtRNAを用いて、ポリペプチド鎖にアミノ酸を付加します。これは、mRNA上のトリプレットごとに行われ、リボソームはmRNAの3'末端に向かって移動します。通常、細菌細胞では、複数のリボソームが1つのmRNAに対して並行して働き、ポリリボソームまたはポリソームと呼ばれるものを形成します。
共翻訳フォールディング
リボソームはタンパク質の折り畳みに積極的に関与することが知られている。[ 63 ] [ 64 ]このようにして得られる構造は、通常、タンパク質の化学的リフォールディングで得られる構造と同一であるが、最終生成物に至る経路は異なる場合がある。[ 65 ] [ 66 ]場合によっては、リボソームは機能的なタンパク質形態を得る上で非常に重要な役割を果たす。例えば、深く結び目のあるタンパク質の折り畳みの考えられるメカニズムの一つは、リボソームが鎖を付加されたループに押し込むことに依存している。[ 67 ]
翻訳非依存アミノ酸の付加
リボソーム品質管理タンパク質Rqc2の存在は、mRNA非依存性タンパク質伸長と関連している。[ 68 ] [ 69 ]この伸長は、 CATテールのリボソーム付加(Rqc2によって運ばれたtRNA経由)の結果である。リボソームは、停止したタンパク質のC末端を、ランダムで翻訳非依存性のaラニンとtスレオニンの配列で伸長させる。[ 70 ] [ 71 ]
リボソームの位置

リボソームは「遊離型」と「膜結合型」に分類されます。[ 72 ] 遊離型リボソームと膜結合型リボソームは空間分布が異なるだけで、構造は同一です。リボソームが遊離型か膜結合型かは、合成されるタンパク質上のER標的化シグナル配列の存在に依存します。そのため、個々のリボソームは、あるタンパク質を合成する際には膜結合型である一方、別のタンパク質を合成する際には細胞質内で遊離型となる可能性があります。
リボソームは時に細胞小器官と呼ばれるが、この用語の使用は、リン脂質膜を含む細胞内構成要素を指す場合に限られることが多い。一方、リボソームは完全に粒子状であるため、リン脂質膜は含まない。そのため、リボソームは「非膜性細胞小器官」と呼ばれることもある。
自由リボソーム
遊離リボソームは細胞質内のどこにでも移動できますが、細胞核やその他の細胞小器官からは排除されています。遊離リボソームから生成されたタンパク質は細胞質に放出され、細胞内で利用されます。細胞質は高濃度のグルタチオンを含み、還元環境であるため、酸化されたシステイン残基から形成されるジスルフィド結合を含むタンパク質は、細胞質内では生成されません。
膜結合リボソーム
リボソームが特定の細胞小器官に必要なタンパク質の合成を開始すると、そのタンパク質を合成するリボソームは「膜結合型」になることがあります。真核細胞では、これは小胞体(ER)の「粗面小胞体(ラフER)」と呼ばれる領域で起こります。新しく生成されたポリペプチド鎖は、リボソームによってベクトル合成され、ERに直接挿入され、その後、分泌経路を通って目的の場所に輸送されます。結合型リボソームは通常、細胞膜内で使用されるか、エキソサイトーシスによって細胞外に排出されるタンパク質を生成します。[ 73 ]
生合成
細菌細胞では、リボソームは細胞質内で複数のリボソーム遺伝子オペロンの転写によって合成されます。真核生物では、このプロセスは細胞質と核小体(細胞核内の領域)の両方で行われます。この組み立てプロセスには、4つのrRNAの合成と処理、そしてそれらのrRNAとリボソームタンパク質との組み立てにおいて、200を超えるタンパク質の協調的な機能が関与しています。[ 74 ]
起源
リボソームは最初プロトリボソームとして発生し、[ 75 ] RNAワールドでペプチジルトランスフェラーゼセンター (PTC) を含む可能性があり、自己複製複合体として出現し、アミノ酸が出現し始めたときにのみタンパク質を合成する能力を進化させました。[ 76 ]研究は、 rRNAのみで構成された古代のリボソームがペプチド結合を合成する能力を発達させた可能性があることを示唆しています。[ 77 ] [ 78 ] [ 79 ] [ 80 ] [ 81 ]さらに、証拠は古代のリボソームが自己複製複合体であったことを強く示しており、リボソーム内のrRNAは、リボソームの自己複製に必要なtRNAとタンパク質をコード化していた可能性があるため、情報、構造、および触媒の目的を持っていました。[ 82 ]自己複製RNAを持ち、DNAを持たない仮想的な細胞生物は、リボサイト(またはリボセル)と呼ばれます。 [ 83 ] [ 84 ]
アミノ酸が前生命的条件下でRNAワールドに徐々に出現するにつれて、[ 85 ] [ 86 ]それらの触媒RNAとの相互作用により、触媒RNA分子の機能の範囲と効率の両方が増加しました。[ 76 ]このように、リボソームが古代の自己複製機械から現在の翻訳機械へと進化した原動力は、タンパク質をリボソームの自己複製機構に組み込み、自己複製能力を高めるという選択圧であった可能性があります。[ 82 ] [ 87 ] [ 88 ]
異種リボソーム
1958年、フランシス・クリックは「1遺伝子1リボソーム1タンパク質仮説」を提唱しました。これは、各リボソームが1つのタンパク質をコードするのに必要な遺伝情報を担っているというものです。当時は信憑性が薄れていましたが、1999年に最初のリボソーム病であるダイアモンド・ブラックファン貧血が発見されて以来、リボソームは受動的な分子機械から動的な高分子機械へと進化を遂げてきました[ 89 ] [ 90 ]。リボソームは種間だけでなく、同一細胞内においても構成が異なっており、これは同じ真核細胞内に細胞質リボソームとミトコンドリアリボソームが存在することからも明らかです。哺乳類におけるリボソームタンパク質構成の異質性が遺伝子制御に重要であるという、いわゆる「特殊化リボソーム仮説」を提唱する研究者もいます[ 91 ] [ 92 ] 。しかし、この仮説は議論の的となっており、現在も研究が進められています[ 93 ] [ 94 ] 。
リボソーム構成の不均一性がタンパク質合成の翻訳制御に関与していることは、ヴィンス・マウロとジェラルド・エデルマンによって初めて提唱された。[ 95 ]彼らはリボソームの制御機能を説明するためにリボソームフィルター仮説を提唱した。様々な細胞集団に特異的な特殊リボソームが遺伝子の翻訳に影響を与える可能性を示唆する証拠がある。[ 96 ]一部のリボソームタンパク質は、組み立てられた複合体から細胞質のコピーと交換される。 [ 97 ]これは、生体内のリボソームの構造は、全く新しいリボソームを合成することなく改変できることを示唆している。
リボソームタンパク質の中には、細胞の生命にとって絶対的に不可欠なものもあれば、そうでないものもあります。出芽酵母では、78種類中14種類のリボソームタンパク質が成長に必須ではありませんが、ヒトでは研究対象の細胞によって異なります。[ 98 ]その他の異質性の形態としては、リボソームタンパク質に対する翻訳後修飾(アセチル化、メチル化、リン酸化など)があります。[ 99 ]アラビドプシス、[ 100 ] [ 101 ] [ 102 ] [ 103 ]ウイルスの内部リボソーム進入部位(IRES)は、構成の異なるリボソームによる翻訳を媒介する可能性があります。例えば、酵母細胞および哺乳類細胞におけるeS25のない40Sリボソーム単位は、CrPV IGR IRESをリクルートできません。[ 104 ]
リボソームRNA修飾の不均一性は構造維持や機能に重要な役割を果たしており、ほとんどのmRNA修飾は高度に保存された領域に見られる。[ 105 ] [ 106 ]最も一般的なrRNA修飾は、擬似ウリジン化とリボースの2'-O-メチル化である。[ 107 ]
参照
参考文献
- ^バシャン、アナト;アグモン、イラナ。ザリヴァチ、ラズ。シュルエンゼン、フランク。ハームズ、ヨルグ。ベリシオ、リタ。バーテルス、平家。フランチェスキ、フランソワ。アウアーバッハ、タマル。ハンセン、ハーリー AS。コッソイ、エリザベタ。ケスラー、マギー。エイダ、ヨナス (2003 年 1 月)。 「ペプチド結合形成、転座、および新生鎖の進行のためのリボソーム機構の構造基盤」。分子細胞。11 (1): 91–102。土井: 10.1016/s1097-2765(03)00009-1。ISSN 1097-2765。PMID 12535524。
- ^ブライアン・グレゴリー、ヌスラット・ラーマン、アナント・ボンマカンティ、Md・シャムズザマン、ママタ・タパ、アラナ・レスキュール、ジャニス・M・ゼンゲル、ラッセ・リンダール(2019年4月)。 「リボソームの小サブユニットと大サブユニットは、安定性と蓄積において互いに依存している」。ライフサイエンス・アライアンス。2 ( 2 ) e201800150。doi : 10.26508 / lsa.201800150。ISSN 2575-1077。PMC 6402506。PMID 30837296。
- ^ Schuller AP, Green R (2018年8月). 「真核生物翻訳における障害と解決策」. Nat Rev Mol Cell Biol . 19 (8): 526– 541. doi : 10.1038/s41580-018-0011-4 . PMC 6054806. PMID 29760421 .
- ^ 「自然翻訳/RNA翻訳により引用可能」。
- ^ a b c Tirumalai MR, Rivas M, Tran Q, Fox GE (2021年11月). 「ペプチジルトランスフェラーゼセンター:過去への窓」 . Microbiol Mol Biol Rev. 85 ( 4) e00104-21: e0010421. Bibcode : 2021MMBR...85...21T . doi : 10.1128/MMBR.00104-21 . PMC 8579967. PMID 34756086 .
- ^ Benne R, Sloof P (1987). 「ミトコンドリアタンパク質合成機構の進化」. Bio Systems . 21 (1): 51– 68. Bibcode : 1987BiSys..21...51B . doi : 10.1016/0303-2647(87)90006-2 . PMID 2446672 .
- ^ 「リボソーム」 . 2009年3月20日時点のオリジナルよりアーカイブ。2011年4月28日閲覧。
- ^ Palade GE (1955年1月). 「細胞質の小さな粒子状成分」 . The Journal of Biophysical and Biochemical Cytology . 1 (1): 59– 68. doi : 10.1083/jcb.1.1.59 . PMC 2223592. PMID 14381428 .
- ^ Rheinberger, Hans-Jörg (2022年9月). 「タンパク質生合成とリボソーム研究の簡潔な歴史」 .リンダウ・ノーベル賞受賞者会議. 2023年8月16日閲覧。
- ^ Roberts RB編 (1958). 「序論」.ミクロソーム粒子とタンパク質合成. ニューヨーク: Pergamon Press, Inc.
- ^ 「1974年のノーベル生理学・医学賞」Nobelprize.org .ノーベル財団. 2013年1月26日時点のオリジナルよりアーカイブ。 2012年12月10日閲覧。
- ^ 「2009年ノーベル化学賞」ノーベル財団。2012年4月28日時点のオリジナルよりアーカイブ。 2012年12月10日閲覧。
- ^ a b c d e f g Alberts B, Johnson A, Lewis J, Raff M, Roberts K, Walter P (2002). 「膜結合リボソームが粗面小胞体を定義する」 . Molecular Biology of the Cell (第4版). ニューヨーク: Garland Science. p. 342. ISBN 978-0-8153-4072-0。
- ^ 「リボソーム」www.genome.gov . 2026年1月6日閲覧。
- ^ Kurland CG (1960). 「大腸菌リボソーム由来のリボ核酸の分子特性解析」.分子生物学ジャーナル. 2 (2): 83– 91. doi : 10.1016/s0022-2836(60)80029-0 .
- ^ Wilson DN, Doudna Cate JH (2012年5月). 「真核生物リボソームの構造と機能」 . Cold Spring Harbor Perspectives in Biology . 4 (5) a011536. doi : 10.1101/cshperspect.a011536 . PMC 3331703. PMID 22550233 .
- ^ Nissen P, Hansen J, Ban N, Moore PB, Steitz TA (2000年8月). 「ペプチド結合合成におけるリボソーム活性の構造的基礎」(PDF) . Science . 289 (5481): 920–30 . Bibcode : 2000Sci...289..920N . doi : 10.1126/science.289.5481.920 . PMID 10937990. S2CID 8370119. 2020年11月30日時点のオリジナル(PDF)からのアーカイブ。
- ^ Polacek, N. (2005). 「リボソームペプチジルトランスフェラーゼセンター:構造、機能、進化、阻害」(PDF) . Critical Reviews in Biochemistry and Molecular Biology . 40 (5): 285– 311. doi : 10.1080/10409230500394081(2025年11月9日現在非アクティブ). PMID 16257828 .
{{cite journal}}: CS1 maint: DOIは2025年11月時点で非アクティブです(リンク) - ^ a b Wimberly BT, Brodersen DE, Clemons WM, Morgan-Warren RJ, Carter AP, Vonrhein C, Hartsch T, Ramakrishnan V (2000年9月). 「30Sリボソームサブユニットの構造」. Nature . 407 ( 6802): 327–39 . Bibcode : 2000Natur.407..327W . doi : 10.1038/35030006 . PMID 11014182. S2CID 4419944 .
- ^ a b Garrett R, Grisham CM (2009).生化学(第4版). Cengage Learning Services. ISBN 978-0-495-11464-2。
- ^ Collatz E, Küchler E, Stöffler G, Czernilofsky AP (1976年4月). 「リボソームタンパク質L27とtRNA Met fの親和性標識誘導体との反応部位」 FEBS Letters 63 ( 2): 283–6 . Bibcode : 1976FEBSL..63..283C . doi : 10.1016/0014-5793(76)80112-3 . PMID 770196 .
- ^ Czernilofsky AP, Collatz EE, Stöffler G, Kuechler E (1974年1月). 「大腸菌リボソームのtRNA結合部位におけるタンパク質」 .米国科学アカデミー紀要. 71 (1): 230–4 . Bibcode : 1974PNAS...71..230C . doi : 10.1073 / pnas.71.1.230 . PMC 387971. PMID 4589893 .
- ^ Czernilofsky AP, Kurland CG, Stöffler G (1975年10月). 「16S RNAの3'末端に会合する30Sリボソームタンパク質」 . FEBS Letters . 58 (1): 281–4 . Bibcode : 1975FEBSL..58..281C . doi : 10.1016/0014-5793(75)80279-1 . PMID 1225593 .
- ^ハッサン、ああ;ピンカス、M;八重島C;石野、S;内海 哲也伊藤和也デモ、G (2025 年 1 月 11 日)。 「独自の30S-30S二量体化を促進する新規古細菌リボソーム二量体化因子」。核酸の研究。53 (2)。土井:10.1093/nar/gkae1324。PMID 39797736。
- ^ RA、ギャレット;ダルガード、J;ラーセン、N;ジェイムズ、J;アスファルト州マンキン(1991 年 1 月)。 「古細菌のrRNAオペロン」。生化学科学の動向。16 (1): 22–6 .土井: 10.1016/0968-0004(91)90011-j。PMID 1905072。
- ^ Cullen KE (2009). 「古細菌リボソーム」.生命科学百科事典. ニューヨーク: Facts On File. pp. 1– 5. doi : 10.1002/9780470015902.a0000293.pub3 . ISBN 978-0-470-01590-2. S2CID 243730576 .
- ^ Tirumalai MR, Anane-Bediakoh D, Rajesh R, Fox GE (2021年11月). 「好塩菌のS10およびspcクラスターのリボソームタンパク質の正味電荷は耐塩性の程度と逆相関している」 . Microbiol . Spectr . 9 (3) e01782-21: e0178221. Bibcode : 2021MicSp...9.1782T . doi : 10.1128/spectrum.01782-21 . PMC 8672879. PMID 34908470 .
- ^ Wang J, Dasgupta I, Fox GE (2009年4月28日). 「多くの非普遍的な古細菌リボソームタンパク質は保存された遺伝子クラスター内に発見される」 . Archaea . 2 ( 4): 241–51 . doi : 10.1155/2009/971494 . PMC 2686390. PMID 19478915 .
- ^ Armache, JP; Anger, AM; Márquez, V; Franckenberg, S; Fröhlich, T; Villa, E; Berninghausen, O; Thomm, M; Arnold, GJ; Beckmann, R; Wilson, DN (2013年1月). 「古細菌リボソームタンパク質の乱雑な行動:真核生物リボソームの進化への影響」. Nucleic acid research . 41 (2): 1284–93 . doi : 10.1093/nar/gks1259 . PMID 23222135.ゲノム解析に基づき、P .
furiosus 70Sリボソームは64個のrタンパク質(30Sサブユニットに25個、50Sサブユニットに39個)を含むと予測されている。 [...] 驚いたことに、すべての rRNA と r タンパク質をフィッティングした後、4 つの追加密度領域が未だに不明のままでした。1 つは 30S サブユニットにあり、残りの 3 つは 50S サブユニットにありました。
- ^ 「ゲノム注釈検索:Pyrococcus furiosus DSM 3638ゲノムアセンブリASM730v1、タイプ:rRNA」。NCBI 。
- ^ a b cベン=シェム A、ガロー・ド・ルーブレス N、メルニコフ S、ジェンナー L、ユスポワ G、ユスポフ M (2011 年 12 月)。「解像度 3.0 Å での真核生物のリボソームの構造」。科学。334 (6062): 1524– 9. Bibcode : 2011Sci...334.1524B。土井: 10.1126/science.1212642。PMID 22096102。S2CID 9099683。
- ^ a b Rabl J, Leibundgut M, Ataide SF, Haag A, Ban N (2011年2月). 「開始因子1と複合体を形成した真核生物40Sリボソームサブユニットの結晶構造」(PDF) . Science . 331 (6018): 730–6 . Bibcode : 2011Sci...331..730R . doi : 10.1126/science.11 98308. hdl : 20.500.11850 / 153130 . PMID 21205638. S2CID 24771575 .
- ^ a b Klinge S, Voigts-Hoffmann F, Leibundgut M, Arpagaus S, Ban N (2011年11月). 「開始因子6と複合体を形成した真核生物60Sリボソームサブユニットの結晶構造」. Science . 334 ( 6058): 941–8 . Bibcode : 2011Sci...334..941K . doi : 10.1126/science.1211204 . PMID 22052974. S2CID 206536444 .
- ^ Fabijanski S, Pellegrini M (1977). 「ラット肝リボソームのペプチジルtRNA結合部位におけるタンパク質の同定」. Molecular & General Genetics . 184 (3): 551–6 . doi : 10.1007/BF00431588 . PMID 6950200. S2CID 9751945 .
- ^ Agrawal RK, Sharma MR (2012年12月). 「ミトコンドリア翻訳装置の構造的側面」 . Current Opinion in Structural Biology . 22 (6): 797– 803. doi : 10.1016/j.sbi.2012.08.003 . PMC 3513651. PMID 22959417 .
- ^ Sharma MR, Booth TM, Simpson L, Maslov DA, Agrawal RK (2009年6月). 「最小限のRNAを含むミトコンドリアリボソームの構造」 . Proceedings of the National Academy of Sciences of the United States of America . 106 (24): 9637–42 . Bibcode : 2009PNAS..106.9637S . doi : 10.1073/pnas.0901631106 . PMC 2700991. PMID 19497863 .
- ^ Waltz F, Nguyen TT, Arrivé M, Bochler A, Chicher J, Hammann P, Kuhn L, Quadrado M, Mireau H, Hashem Y, Giegé P (2019年1月). 「シロイヌナズナミトコンドリアリボソームにおけるSmall is big」. Nature Plants . 5 (1): 106– 117. Bibcode : 2019NatPl...5..106W . doi : 10.1038/s41477-018-0339- y . PMID 30626926. S2CID 58004990 .
- ^ Archibald JM, Lane CE (2009). 「消えゆく、消えゆく、まだ完全に消え去っていない:核ゲノム縮小における核形態の事例研究」 . The Journal of Heredity . 100 (5): 582–90 . doi : 10.1093/jhered/esp055 . PMID 19617523 .
- ^ 「原核生物の特殊な内部構造 | Boundless Microbiology」courses.lumenlearning.com . 2021年9月24日閲覧。
- ^ Recht MI, Douthwaite S, Puglisi JD (1999年6月). 「アミノグリコシド系抗生物質の原核生物に対する作用特異性の基礎」 . The EMBO Journal . 18 (11): 3133–8 . doi : 10.1093/emboj/ 18.11.3133 . PMC 1171394. PMID 10357824 .
- ^ O'Brien TW (1971年5月). 「哺乳類肝ミトコンドリアにおける55Sリボソームの一般的な存在」 . The Journal of Biological Chemistry . 246 (10): 3409–17 . doi : 10.1016/S0021-9258(18)62239-2 . PMID 4930061 .
- ^ 「クロラムフェニコール誘発性骨髄抑制」 . JAMA . 213 (7): 1183– 1184. 1970-08-17. doi : 10.1001/jama.1970.03170330063011 . ISSN 0098-7484 . PMID 5468266 .
- ^ Newman SM, Boynton JE, Gillham NW, Randolph-Anderson BL, Johnson AM, Harris EH (1990年12月). 「クラミドモナスにおける葉緑体リボソームRNA遺伝子の形質転換:統合イベントの分子遺伝学的特徴づけ」 . Genetics . 126 (4): 875–88 . doi : 10.1093/genetics/126.4.875 . PMC 1204285. PMID 1981764 .
- ^ Penev PI, Fakhretaha-Aval S, Patel VJ, Cannone JJ, Gutell RR, Petrov AS, Williams LD, Glass JB (2020年8月). 「アスガルド古細菌における超大型リボソームRNA伸展セグメント」 . Genome Biology and Evolution . 12 (10): 1694– 1710. doi : 10.1093/gbe/ evaa170 . PMC 7594248. PMID 32785681 .
- ^ a b Ban N, Nissen P, Hansen J, Moore PB, Steitz TA (2000年8月). 「2.4Å分解能におけるリボソーム大サブユニットの完全な原子構造」. Science . 289 (5481): 905–20 . Bibcode : 2000Sci...289..905B . CiteSeerX 10.1.1.58.2271 . doi : 10.1126/science.289.5481.905 . PMID 10937989 .
- ^ Ramakrishnan, V. (2014年11月). 「リボソームはブラックボックスから出現する」. Cell . 159 (5): 979–984 . doi : 10.1016/j.cell.2014.10.052 .
- ^ Schluenzen F, Tocilj A, Zarivach R, Harms J, Gluehmann M, Janell D, Bashan A, Bartels H, Agmon I, Franceschi F, Yonath A (2000年9月). 「3.3オングストローム分解能における機能的に活性化された小リボソームサブユニットの構造」 . Cell . 102 (5): 615–23 . doi : 10.1016 / S0092-8674(00)00084-2 . PMID 11007480. S2CID 1024446 .
- ^ Yusupov MM, Yusupova GZ, Baucom A, Lieberman K, Earnest TN, Cate JH, Noller HF (2001年5月). 「5.5Å分解能でのリボソームの結晶構造」 . Science . 292 (5518): 883–96 . Bibcode : 2001Sci...292..883Y . doi : 10.1126/science.1060089 . PMID 11283358. S2CID 39505192 .
- ^ Schuwirth BS, Borovinskaya MA, Hau CW, Zhang W, Vila-Sanjurjo A, Holton JM, Cate JH (2005年11月). 「3.5Å分解能における細菌リボソームの構造」 . Science . 310 ( 5749 ): 827–34 . Bibcode : 2005Sci...310..827S . doi : 10.1126/science.11 17230. PMC 7550191. PMID 16272117. S2CID 37382005 .
- ^ Mitra K, Schaffitzel C, Shaikh T, Tama F, Jenni S, Brooks CL, Ban N, Frank J (2005年11月). 「翻訳リボソームに結合した大腸菌タンパク質伝導チャネルの構造」 . Nature . 438 ( 7066): 318–24 . Bibcode : 2005Natur.438..318M . doi : 10.1038/nature04133 . PMC 1351281. PMID 16292303 .
- ^ Selmer M, Dunham CM, Murphy FV, Weixlbaumer A, Petry S, Kelley AC, Weir JR, Ramakrishnan V (2006年9月). 「mRNAおよびtRNAと複合体を形成した70Sリボソームの構造」. Science . 313 ( 5795): 1935–42 . Bibcode : 2006Sci...313.1935S . doi : 10.1126/science.11 31127. PMID 16959973. S2CID 9737925 .
- ^ Korostelev A, Trakhanov S, Laurberg M, Noller HF (2006年9月). 「70Sリボソーム-tRNA複合体の結晶構造は機能的相互作用と再配置を明らかにする」 . Cell . 126 ( 6): 1065–77 . doi : 10.1016/j.cell.2006.08.032 . PMID 16962654. S2CID 13452915 .
- ^ Yusupova G, Jenner L, Rees B, Moras D, Yusupov M (2006年11月). 「リボソーム上でのメッセンジャーRNAの移動の構造的基礎」. Nature . 444 ( 7117): 391–4 . Bibcode : 2006Natur.444..391Y . doi : 10.1038/nature05281 . PMID 17051149. S2CID 4419198 .
- ^ Fromm, Simon A.; O'Connor, Kate M.; Purdy, Michael; Bhatt, Pramod R.; Loughran, Gary; Atkins, John F.; Jomaa, Ahmad; Mattei, Simone (2023-02-25). 「クライオ電子顕微鏡画像サービスによって生成された1.55Å解像度の細菌リボソームの翻訳」 . Nature Communications . 14 (1): 1095. Bibcode : 2023NatCo..14.1095F . doi : 10.1038/ s41467-023-36742-3 . ISSN 2041-1723 . PMC 9968351. PMID 36841832 .
- ^ Kišonaitė, Miglė; Wild, Klemens; Lapouge, Karine; Ruppert, Thomas; Sinning, Irmgard (2022-01-25). 「好熱性真核生物の80Sリボソームの高解像度構造は、転座の原子レベルでの詳細を明らかにする」 . Nature Communications . 13 (1): 476. Bibcode : 2022NatCo..13..476K . doi : 10.1038/ s41467-022-27967-9 . ISSN 2041-1723 . PMC 8789840. PMID 35079002 .
- ^ a b「原核生物の特殊な内部構造」courses.lumenlearning.com . Boundless Microbiology . 2018年9月27日閲覧。
- ^ Lafontaine, D.; Tollervey, D. ( 2001 ). 「リボソームの機能と合成」Nat Rev Mol Cell Biol . 2 (7): 514– 520. doi : 10.1038/35080045 . hdl : 1842/729 . PMID 11433365. S2CID 2637106 .
- ^ Savir Y, Tlusty T (2013年4月). 「最適なデコーダーとしてのリボソーム:分子認識の教訓」 . Cell . 153 (2): 471– 479. Bibcode : 2013APS..MARY46006T . doi : 10.1016/j.cell.2013.03.032 . PMID 23582332 .
- ^ Korkmaz G, Sanyal S (2017年9月). 「大腸菌」 . The Journal of Biological Chemistry . 292 (36): 15134– 15142. doi : 10.1074/jbc.M117.785238 . PMC 5592688. PMID 28743745 .
- ^ Konevega AL, Soboleva NG, Makhno VI, Semenkov YP, Wintermeyer W, Rodnina MV, Katunin VI (2004年1月). 「tRNAの37番目のプリン塩基は、スタッキングとMg 2+依存性相互作用によってリボソームA部位のコドン-アンチコドン相互作用を安定化する」 . RNA . 10 (1): 90– 101. doi : 10.1261 / rna.5142404 . PMC 1370521. PMID 14681588 .
- ^ Rodnina MV, Beringer M, Wintermeyer W (2007年1月). 「リボソームはペプチド結合をどのように形成するのか」. Trends in Biochemical Sciences 32 (1): 20– 26. doi : 10.1016/j.tibs.2006.11.007 . PMID 17157507 .
- ^ Cech, TR (2000年8月). 「構造生物学. リボソームはリボザイムである」. Science . 289 ( 5481): 878– 879. doi : 10.1126/science.289.5481.878 . PMID 10960319. S2CID 24172338 .
- ^ Banerjee D, Sanyal S (2014年10月). 「リボソームのタンパク質フォールディング活性(PFAR) - 抗プリオン化合物の標的」 .ウイルス. 6 (10): 3907– 3924. doi : 10.3390/v6103907 . PMC 4213570. PMID 25341659 .
- ^ Fedorov AN, Baldwin TO (1997年12月). 「共翻訳タンパク質フォールディング」 . The Journal of Biological Chemistry . 272 (52): 32715– 32718. doi : 10.1074/jbc.272.52.32715 . PMID 9407040 .
- ^ Baldwin RL (1975年6月). 「タンパク質フォールディング反応における中間体とタンパク質フォールディングのメカニズム」. Annual Review of Biochemistry . 44 (1): 453– 475. doi : 10.1146/annurev.bi.44.070175.002321 . PMID 1094916 .
- ^ Das D, Das A, Samanta D, Ghosh J, Dasgupta S, Bhattacharya A, Basu A, Sanyal S, Das Gupta C (2008年8月). 「タンパク質フォールディングにおけるリボソームの役割」(PDF) . Biotechnology Journal . 3 (8): 999– 1009. doi : 10.1002/biot.200800098 . PMID 18702035 .
- ^ Dabrowski-Tumanski P, Piejko M, Niewieczerzal S, Stasiak A, Sulkowska JI (2018年12月). 「リボソーム出口チャネルから排出される新生ポリペプチド鎖の能動的な糸引きによるタンパク質の結び目形成」. The Journal of Physical Chemistry B. 122 ( 49): 11616– 11625. Bibcode : 2018JPCB..12211616D . doi : 10.1021/acs.jpcb.8b07634 . PMID 30198720. S2CID 52176392 .
- ^ Brandman O, Stewart-Ornstein J, Wong D, Larson A, Williams CC, Li GW, Zhou S, King D, Shen PS, Weibezahn J, Dunn JG, Rouskin S, Inada T, Frost A, Weissman JS (2012年11月). 「リボソーム結合型品質管理複合体は新生ペプチドの分解を誘導し、翻訳ストレスを示唆する」 . Cell . 151 ( 5): 1042– 1054. doi : 10.1016/j.cell.2012.10.044 . PMC 3534965. PMID 23178123 .
- ^ Defenouillère Q, Yao Y, Mouaikel J, Namane A, Galopier A, Decourty L, Doyen A, Malabat C, Saveanu C, Jacquier A, Fromont-Racine M (2013年3月). 「60S粒子に結合したCdc48関連複合体は、異常な翻訳産物の除去に必要である」 . Proceedings of the National Academy of Sciences of the United States of America . 110 (13): 5046– 5051. Bibcode : 2013PNAS..110.5046D . doi : 10.1073 / pnas.1221724110 . PMC 3612664. PMID 23479637 .
- ^ Shen PS, Park J, Qin Y, Li X, Parsawar K, Larson MH, Cox J, Cheng Y, Lambowitz AM, Weissman JS, Brandman O, Frost A (2015年1月). 「タンパク質合成.Rqc2pと60SリボソームサブユニットはmRNA非依存性の新生鎖伸長を媒介する」. Science . 347 ( 6217): 75– 78. Bibcode : 2015Sci...347...75S . doi : 10.1126/science.1259724 . PMC 4451101. PMID 25554787 .
- ^ Keeley, J.; Gutnikoff, R. (2015年1月2日). 「リボソーム研究でタンパク質合成の新たなメカニズムが明らかに」(プレスリリース)ハワード・ヒューズ医学研究所. 2015年1月12日時点のオリジナルよりアーカイブ。 2015年1月16日閲覧。
- ^ Cooper HL, Berger SL, Braverman R (1976年8月). 「生理的に分裂しない細胞における遊離リボソーム。ヒト末梢リンパ球」. J Biol Chem . 251 (16): 4891–900 . PMID 956167 .
- ^ Alberts B, Johnson A, Lewis J, Raff M, Roberts K, Walter P (2002). 「膜結合リボソームが粗面小胞体を定義する」 . Molecular Biology of the Cell (第4版). ニューヨーク: Garland Science. ISBN 978-0-8153-4072-0。
- ^ Kressler, Dieter; Hurt, Ed; Babler, Jochen (2009). 「リボソームアセンブリの駆動」(PDF) . Biochimica et Biophysica Acta (BBA) - Molecular Cell Research . 1803 (6): 673– 683. doi : 10.1016/j.bbamcr.2009.10.009 . PMID 19879902 .
- ^ダンス、アンバー(2023年2月28日) 「生命はどのように始まったのか? 鍵となる要素の一つが見えてきた ― ノーベル賞受賞科学者のチームが、タンパク質を合成できる初期地球のRNAの再構築に向けて大きな一歩を踏み出した」 Nature 615 ( 7950): 22– 25. doi : 10.1038/d41586-023-00574-4 . PMID 36854922 .
- ^ a b Noller HF (2012年4月). 「RNAワールドからのタンパク質合成の進化」 . Cold Spring Harbor Perspectives in Biology . 4 (4) a003681. Bibcode : 2012CSHPB...4.3681N . doi : 10.1101 / cshperspect.a003681 . PMC 3312679. PMID 20610545 .
- ^ Dabbs ER (1986).原核生物リボソームの変異体研究. ニューヨーク: Springer-Verlag.
- ^ Noller HF, Hoffarth V, Zimniak L (1992年6月). 「ペプチジルトランスフェラーゼのタンパク質抽出手順に対する異常な耐性」. Science . 256 (5062): 1416–9 . Bibcode : 1992Sci...256.1416N . doi : 10.1126/science.1604315 . PMID 1604315 .
- ^野村 正之、水島 聡、尾崎 正之、トラウブ P、ローリー CV (1969). 「リボソームとその分子成分の構造と機能」.コールド・スプリング・ハーバー定量生物学シンポジウム. 34 : 49–61 . doi : 10.1101/sqb.1969.034.01.009 . PMID 4909519 .
- ^ Krupkin M, Matzov D, Tang H, Metz M, Kalaora R, Belousoff MJ, Zimmerman E, Bashan A, Yonath A (2011年10月). 「現代のリボソーム内にプレバイオティック結合機構の痕跡が機能している」 . Phil. Trans. R. Soc. B. 366 ( 1580): 2972 –8. doi : 10.1098/rstb.2011.0146 . PMC 3158926. PMID 21930590 .
- ^ Bose T, Fridkin G, Davidovich C, Krupkin M, Dinger N, Falkovich AH, Peleg Y, Agmon I, Bashan A, Yonat A (2022年2月). 「生命の起源:プロトリボソームはペプチド結合を形成し、RNAとタンパク質が支配する世界を結びつける」 . Nucleic Acids Res . 50 (4): 1815– 1828. doi : 10.1093/nar/gkac052 . PMC 8886871. PMID 35137169 .
- ^ a b Root-Bernstein M, Root-Bernstein R (2015年2月). 「生命進化におけるミッシングリンクとしてのリボソーム」 . Journal of Theoretical Biology . 367 : 130–158 . doi : 10.1016/j.jtbi.2014.11.025 . PMID 25500179 .
- ^ Yarus M (2002). 「始原遺伝学:リボサイトの表現型」. Annual Review of Genetics . 36 : 125–51 . doi : 10.1146/annurev.genet.36.031902.105056 . PMID 12429689 .
- ^ Forterre P, Krupovic M (2012). 「ビリオンとウイルス細胞の起源:逃避仮説の再考」.ウイルス:生命の必須因子. pp. 43– 60. doi : 10.1007/978-94-007-4899-6_3 . ISBN 978-94-007-4898-9。
- ^ Caetano-Anollés G, Seufferheld MJ (2013). 「生化学と細胞組織の共進化のルーツがRNAワールドパラダイムに挑戦する」. Journal of Molecular Microbiology and Biotechnology . 23 ( 1–2 ): 152–77 . doi : 10.1159/000346551 . PMID 23615203. S2CID 41725226 .
- ^ Saladino R, Botta G, Pino S, Costanzo G, Di Mauro E (2012年8月). 「遺伝学が先か、代謝が先か? ホルムアミドの手がかり」. Chemical Society Reviews . 41 (16): 5526–65 . doi : 10.1039/c2cs35066a . hdl : 11573/494138 . PMID 22684046 .
- ^ Fox GE (2010年9月). 「リボソームの起源と進化」 . Cold Spring Harb Perspect Biol . 2 (9) a003483. doi : 10.1101/cshperspect.a003483 . PMC 2926754. PMID 20534711 .
- ^ Fox GE (2016). 「リボソームの起源と初期進化」 Hernández G, Jagus R (編).タンパク質合成機構とその制御の進化. スイス: Springer, Cham. pp. 31– 60. doi : 10.1007/978-3-319-39468-8 . ISBN 978-3-319-39468-8. S2CID 27493054 .
- ^ Crick, FH (1958). 「タンパク質合成について」.実験生物学会シンポジウム. 12 : 138–163 . ISSN 0081-1386 . PMID 13580867 .
- ^ドラプチンスカヤ、ナタリア;グスタフソン、ピーター。アンダーソン、ビョルン。モニカ・ペッターソン。ティエボー・ノエル・ウィリグ;ディアンザーニ、イルマ。ボール、サラ。チェルニア、ギル。クラー、ヨアキム。マットソン、ハンス。ディミトリ・テントラー。モハンダス、ナーラ。カールソン、ビルギット。ダール、ニクラス(1999 年 2 月)。「ダイヤモンド・ブラックファン貧血ではリボソームタンパク質S19をコードする遺伝子が変異している」。自然遺伝学。21 (2): 169–175 .土井: 10.1038/5951。ISSN 1546-1718。
- ^ Shi Z, Fujii K, Kovary KM, Genuth NR, Röst HL, Teruel MN, Barna M (2017年7月). 「異種リボソームはゲノムワイドで異なるmRNAサブプールを優先的に翻訳する」 . Molecular Cell . 67 (1). Elsevier BV: 71–83.e7. doi : 10.1016/j.molcel.2017.05.021 . PMC 5548184. PMID 28625553 .
- ^ Xue S, Barna M (2012年5月). 「特殊リボソーム:遺伝子制御と生物生物学の新たなフロンティア」 . Nature Reviews. 分子細胞生物学. 13 ( 6). Springer Science and Business Media LLC: 355– 369. doi : 10.1038/nrm3359 . PMC 4039366. PMID 22617470 .
- ^ Ferretti MB, Karbstein K (2019年5月). 「リボソームの機能的特殊化は本当に存在するのか?」 . RNA . 25 ( 5). Cold Spring Harbor Laboratory: 521– 538. doi : 10.1261/rna.069823.118 . PMC 6467006. PMID 30733326 .
- ^ Farley-Barnes KI, Ogawa LM, Baserga SJ (2019年10月). 「リボソモパシー:古い概念、新たな論争」 . Trends in Genetics . 35 (10). Elsevier BV: 754– 767. doi : 10.1016/j.tig.2019.07.004 . PMC 6852887. PMID 31376929 .
- ^ Mauro VP, Edelman GM (2002年9月). 「リボソームフィルター仮説」 . Proceedings of the National Academy of Sciences of the United States of America . 99 (19): 12031–6 . Bibcode : 2002PNAS...9912031M . doi : 10.1073/ pnas.192442499 . PMC 129393. PMID 12221294 .
- ^ Xue S, Barna M (2012年5月). 「特殊リボソーム:遺伝子制御と生物生物学の新たなフロンティア」 . Nature Reviews. Molecular Cell Biology . 13 (6): 355– 69. doi : 10.1038/nrm3359 . PMC 4039366. PMID 22617470 .
- ^ Mathis AD, Naylor BC, Carson RH, Evans E, Harwell J, Knecht J, Hexem E, Peelor FF, Miller BF, Hamilton KL, Transtrum MK, Bikman BT, Price JC (2017年2月). 「栄養シグナルに対する生体内リボソーム維持機構の変化のメカニズム」 . Molecular & Cellular Proteomics . 16 (2): 243– 254. doi : 10.1074/mcp.M116.063255 . PMC 5294211. PMID 27932527 .
- ^ Steffen KK, McCormick MA, Pham KM, MacKay VL, Delaney JR, Murakami CJ, et al. (2012年5月). 「リボソーム欠損はサッカロミセス・セレビシエにおけるERストレスから保護する」 . Genetics . 191 ( 1). Genetics Society of America: 107– 118. doi : 10.1534/genetics.111.136549 . PMC 3338253. PMID 22377630 .
- ^ Lee SW, Berger SJ, Martinović S, Pasa-Tolić L, Anderson GA, Shen Y, 他 (2002年4月). 「キャピラリーLC/FTICR法を用いた酵母大リボソームサブユニットの完全タンパク質の直接質量分析」 . Proceedings of the National Academy of Sciences of the United States of America . 99 (9): 5942– 5947. Bibcode : 2002PNAS...99.5942L . doi : 10.1073 / pnas.082119899 . PMC 122881. PMID 11983894 .
- ^ Carroll AJ, Heazlewood JL, Ito J, Millar AH (2008年2月). 「シロイヌナズナ細胞質リボソームプロテオームの解析により、その構成タンパク質とその翻訳後修飾に関する詳細な知見が得られる」 . Molecular & Cellular Proteomics . 7 (2): 347– 369. doi : 10.1074/mcp.m700052-mcp200 . PMID 17934214 .
- ^ Odintsova TI, Müller EC, Ivanov AV, Egorov TA, Bienert R, Vladimirov SN, et al. (2003年4月). 「質量分析法およびエドマン法によるヒト大細胞質リボソームサブユニットタンパク質の翻訳後修飾の特性評価と解析」. Journal of Protein Chemistry . 22 (3): 249– 258. doi : 10.1023/a : 1025068419698 . PMID 12962325. S2CID 10710245 .
- ^ Yu Y, Ji H, Doudna JA, Leary JA (2005年6月). 「ヒト40Sリボソームサブユニットの質量分析:天然およびHCV IRES結合複合体」 . Protein Science . 14 (6): 1438– 1446. doi : 10.1110/ps.041293005 . PMC 2253395. PMID 15883184 .
- ^ Zeidan Q, Wang Z, De Maio A, Hart GW (2010年6月). 「O-GlcNAcサイクリング酵素は翻訳機構と会合し、コアリボソームタンパク質を修飾する」 . Molecular Biology of the Cell . 21 (12): 1922– 1936. doi : 10.1091/mbc.e09-11-0941 . PMC 2883937. PMID 20410138 .
- ^ Landry DM, Hertz MI, Thompson SR (2009年12月). 「RPS25はジシストロウイルス科およびC型肝炎ウイルスのIRESによる翻訳開始に必須である」. Genes & Development . 23 (23): 2753– 2764. doi : 10.1101/gad.1832209 . PMC 2788332. PMID 19952110 .
- ^ Decatur WA, Fournier MJ ( 2002年7月). 「rRNA修飾とリボソーム機能」. Trends in Biochemical Sciences 27 (7): 344–51 . doi : 10.1016/s0968-0004(02)02109-6 . PMID 12114023 .
- ^ Natchiar SK, Myasnikov AG, Kratzat H, Hazemann I, Klaholz BP (2017年11月). 「ヒト80Sリボソーム構造における化学修飾の可視化」. Nature . 551 ( 7681): 472– 477. Bibcode : 2017Natur.551..472N . doi : 10.1038/nature24482 . PMID 29143818. S2CID 4465175 .
- ^ Guo H (2018年8月). 「特殊リボソームと翻訳制御」.生化学会誌. 46 (4): 855– 869. doi : 10.1042/BST20160426 . PMID 29986937. S2CID 51609077 .
外部リンク
- 実験室のコンピューターがリボソームの動きをシミュレート
- リボソームの役割、グウェン・V・チャイルズ、ここに転載
- プロテオペディアのリボソーム— タンパク質やその他の分子に関する無料の共同3D百科事典
- ExPASyにおけるリボソームタンパク質ファミリーArchived 2011-04-30 at the Wayback Machine
- 今月の分子 2009年10月27日アーカイブWayback Machine © RCSB Protein Data Bank :
- リボソームアーカイブ2010-11-14 at the Wayback Machine
- 伸長因子アーカイブ2011-03-16 at the Wayback Machine
- パレード
- EMデータバンク(EMDB)におけるリボソームの3D電子顕微鏡構造
 この記事には、Science Primer . NCBI .のパブリックドメイン資料が含まれています。2009年12月8日にオリジナルからアーカイブされました。
この記事には、Science Primer . NCBI .のパブリックドメイン資料が含まれています。2009年12月8日にオリジナルからアーカイブされました。

