シャーガス病
| シャーガス病 | |
|---|---|
| 別名 | アメリカトリパノソーマ症 |
 | |
| ギムザ染色されたヒト血液中のクルーズトリパノソーマ・トリポマスティゴートの顕微鏡写真 | |
| 発音 |
|
| 専門 | 感染症 |
| 症状 | 発熱、リンパ節腫脹、頭痛[ 1 ] |
| 合併症 | 心不全、食道肥大、結腸肥大[ 1 ] |
| 原因 | クルーズトリパノソーマはサシガメによって広がります[ 1 ] |
| 診断方法 | 血液中の寄生虫、そのDNA、または抗体の検出[ 2 ] |
| 予防 | サシガメの駆除と刺されの予防[ 1 ] |
| 医薬品 | ベンズニダゾール、ニフルチモックス[ 1 ] |
| 頻度 | 650万人(2019年)[ 3 ] |
| 死亡者 | 9,490 (2019) [ 3 ] |
シャーガス病(アメリカトリパノソーマ症とも呼ばれる)は、クルーズトリパノソーマ(Trypanosoma cruzi)によって引き起こされる熱帯寄生虫病です。主にサシガメ亜科の昆虫(「サシガメ」とも呼ばれる)によって伝播します。症状は感染期間を通して変化します。初期段階では、症状が全く現れないか軽度で、発熱、リンパ節の腫れ、頭痛、咬傷部位の腫れなどがみられることがあります。[ 1 ] 4~8週間後、治療を受けない場合、慢性期に移行しますが、ほとんどの場合、それ以上の症状は現れません。[ 2 ] [ 4 ]慢性感染症患者の最大45%は、発症から10~30年後に心疾患を発症し、心不全につながる可能性があります。食道肥大や結腸肥大などの消化器系合併症も最大21%の患者に発生し、最大10%の患者は神経障害を経験する可能性があります。[ 2 ]
T.cruziは、サシガメの咬傷や感染した糞便を介してヒトや他の哺乳類に広く感染します。 [ 5 ]この病気は、輸血、臓器移植、寄生虫に汚染された飲食物の摂取、垂直感染(母親から子供へ)によっても感染する可能性があります。 [ 1 ]初期診断は、顕微鏡を使用して血液中の寄生虫を見つけるか、ポリメラーゼ連鎖反応によってそのDNAを検出することで行われます。 [ 4 ]慢性疾患は、血液中にT.cruziに対する抗体を見つけることで診断されます。 [ 6 ]
予防はサシガメの駆除と刺されを避けることに重点が置かれる。[ 1 ]これには殺虫剤や蚊帳の使用が含まれる場合がある。[ 7 ]その他の予防努力には輸血用血液のスクリーニングが含まれる。初期の感染はベンズニダゾールやニフルチモックスという薬で治療でき、感染後すぐに投与すれば通常病気は治るが、シャーガス病の罹患期間が長くなるほど効果は少なくなる。慢性疾患に使用すると、薬によって末期症状の発現を遅らせたり予防したりできる場合がある。ベンズニダゾールとニフルチモックスは皮膚障害、消化器系の炎症、神経症状などの副作用を引き起こすことが多く、その結果治療が中止されることがある。[ 2 ] [ 8 ]シャーガス病の新薬が開発中であり[ 9 ]実験的なワクチンが動物モデルで研究されているが[ 10 ] [ 11 ]ヒト用ワクチンはまだ開発されていない。
2019年現在、メキシコ、中央アメリカ、南アメリカを中心に650万人がシャーガス病に罹患していると推定されており[ 1 ] [ 3 ]、年間約9,490人が死亡しています。[ 3 ]この病気に罹患している人のほとんどは貧困層であり[ 12 ]、ほとんどの人は自分が感染していることに気づいていません。[ 13 ]大規模な人口移動により、シャーガス病は米国や多くのヨーロッパ諸国を含む新しい地域に持ち込まれました。[ 1 ]この病気は150種類以上の動物に影響を与えます。[ 14 ] 2000年から2018年にかけて、米国の8州で29件のシャーガス病の現地感染例が確認され、シャーガス病を米国の風土病として再分類するよう求める声が上がっています。[ 15 ]
この病気は1909年にブラジルの医師カルロス・シャガスによって初めて報告され、彼の名にちなんで命名されました。[ 1 ]シャガス病は顧みられない熱帯病に分類されています。[ 16 ]
徴候と症状

シャーガス病は2段階で発症する。急性期は虫刺され後1~2週間で発症し、慢性期は何年もかけて発症する。[ 2 ] [ 4 ] [ 17 ]急性期には症状が現れないことが多い。[ 2 ]症状が現れても、通常は軽度で、特定の病気に特異的ではない。[ 4 ]兆候と症状には、発熱、倦怠感、頭痛、肝臓、脾臓、リンパ節の腫大などがある。[ 1 ] [ 2 ] [ 4 ]感染部位に腫れた結節が現れることもあり、まぶたの場合は「ロマーニャ徴候」、皮膚の他の部位の場合は「チャゴマ」と呼ばれる。[ 4 ] [ 18 ]稀に(1~5%未満)、感染者は重篤な急性疾患を発症します。心筋の炎症、心臓周囲の体液貯留、脳および周辺組織の炎症などがあり、生命を脅かす可能性があります。急性期は通常4~8週間続き、治療なしで治癒します。[ 2 ]
抗寄生虫薬による治療を受けない限り、急性期から回復した後もT. cruziに感染したままになります。慢性感染のほとんどは無症状で、非定型慢性シャーガス病と呼ばれます。しかし、数十年にわたる罹患期間を経て、約30~40%の患者が臓器機能障害(定型慢性シャーガス病)を発症し、その多くは心臓または消化器系に影響を及ぼします。[ 2 ] [ 4 ]
最も一般的な長期症状は心臓病で、慢性シャーガス病患者の14~45%に発症します。[ 2 ]シャーガス心病の患者は、不整脈により動悸や失神を経験することがよくあります。心電図では、シャーガス心病の患者は不整脈が最も多く見られます。病気が進行するにつれて、心室が拡大し(拡張型心筋症)、血液を送り出す能力が低下します。多くの場合、シャーガス心病の最初の兆候は、心不全、血栓塞栓症、または微小血管の異常に関連する胸痛です。[ 19 ]
慢性シャガス病では消化器系の障害もよく見られ、10~21%の人が罹患しています。[ 2 ]食道または結腸の肥大は、最も一般的な消化器系の問題です。[ 17 ]食道肥大の人は、しばしば痛み(嚥下痛)または嚥下困難(嚥下障害)、胃酸逆流、咳、および体重減少を経験します。結腸肥大の人は便秘を経験することが多く、腸またはその血液供給の重度の閉塞を発症する可能性があります。慢性感染者の最大10%に神経障害が起こり、しびれ、反射または動作の変化を引き起こす可能性があります。[ 2 ]慢性疾患は通常数十年かけて進行しますが、シャガス病患者の一部(10%未満)は急性疾患直後に心臓障害を進行します。[ 19 ]
あまり一般的ではない経路でT.cruziに感染した人の場合は、兆候や症状が異なります。寄生虫の摂取によって感染した人は、摂取後3週間以内に発熱、嘔吐、息切れ、咳、胸部、腹部、筋肉の痛みなどの症状を伴い、重症化する傾向があります。[ 2 ]先天性感染者は通常、症状がほとんどないかまったくありませんが、軽度の非特異的症状、または黄疸、呼吸困難、心臓障害などの重篤な症状が現れることがあります。[ 2 ]臓器移植や輸血によって感染した人は、媒介生物媒介性疾患に似た症状を示す傾向がありますが、症状は1週間から5か月間現れないこともあります。[ 2 ] HIV感染によって免疫抑制状態になった慢性感染者は、特に重篤で独特な病気を呈することがあり、最も一般的には脳や周囲の組織の炎症または脳膿瘍が特徴です。[ 4 ]症状は脳膿瘍の大きさや場所によって大きく異なりますが、典型的には発熱、頭痛、発作、感覚喪失、または特定の神経系の損傷部位を示唆するその他の神経学的問題が含まれます。[ 20 ]時折、これらの患者は急性心臓炎、皮膚病変、胃、腸、または腹膜の疾患を経験することもあります。[ 4 ]
原因
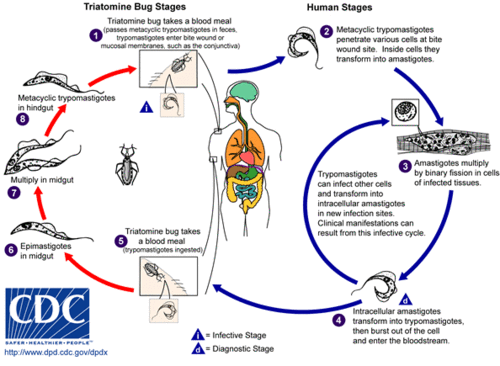
シャーガス病は、原虫寄生虫T. cruziの感染によって引き起こされます。T. cruziは、通常、「キスリングバグ」とも呼ばれるサシガメに刺されることでヒトに感染します。[ 4 ]サシガメが刺咬部位で排泄すると、運動性のT. cruziの形態であるトリポマスティゴートが血流に入り、様々な宿主細胞に侵入します。[ 5 ]宿主細胞内で、寄生虫はアマスティゴートと呼ばれる複製型に変化し、複数回の複製を経ます。[ 5 ]複製されたアマスティゴートは再びトリポマスティゴートに変化し、宿主細胞を破裂させて血流に放出されます。[ 2 ]その後、トリポマスティゴートは全身の様々な組織に拡散し、そこで細胞に侵入して複製します。[ 2 ]長年にわたる寄生虫の複製と免疫反応のサイクルは、これらの組織、特に心臓と消化管に深刻な損傷を与える可能性があります。[ 2 ]
伝播

T. cruzi は、 Triatoma 属、Panstrongylus 属、Rhodnius属の様々なサシガメによって媒介される。[ 2 ]ヒトへの感染の主な媒介生物は、 Triatoma infestans、Rhodnius prolixus、Triatoma dimidiataおよびPanstrongylus megistusといった、ヒトの住居に生息するサシガメ類である。[ 21 ]これらの昆虫は、アルゼンチン、ボリビア、チリ、パラグアイではvinchuca 、ブラジルではbarbeiro (床屋)、コロンビアではpito、中央アメリカではchinche 、ベネズエラではchipoなど、いくつかの現地名で知られている。[ 22 ]これらの虫は夜間に摂食する傾向があり、目や口の近くの湿った表面を好む。[ 17 ] [ 21 ]サシガメは感染した宿主から摂食するとT. cruziに感染する可能性がある。 [ 17 ] T. cruzi は昆虫の腸管で増殖し、その糞便中に排出される。[ 17 ]感染したサシガメが吸血する際、皮膚に穴を開けて血液を摂取し、同時に排便して新たな血液のためのスペースを確保する。[ 17 ]咬傷は通常無痛であるが、痒みを伴う。[ 17 ]咬傷を掻くと、T. cruziを含んだ糞便が咬傷口に入り込み、感染が始まる。[ 17 ]
シャーガス病は、古典的な媒介生物による拡散に加え、サシガメ類やその排泄物に汚染された飲食物を介して感染することもある。[ 23 ]加熱や乾燥により寄生虫が死滅するため、飲み物、特にフルーツジュースが最も一般的な感染源である。[ 23 ]この経口感染経路は、いくつかの発生例に関与していることが示唆されており、サシガメ類に噛まれた場合よりも高い寄生虫量による感染が原因で、異常に重篤な症状を引き起こしたと考えられる。[ 6 ] [ 23 ] T.cruziを保有する飲食物に含まれる砕いたサシガメ 1 匹には、約 600,000 匹のメタサイクリック・トリポマスティゴートが含まれる可能性があるが、サシガメ類の排泄物には 1 μL あたり 3,000~4,000 匹が含まれる。[ 24 ]
クルーズトリパノソーマは、サシガメとは独立して、輸血中、臓器移植後、または妊娠中の胎盤を介して伝染することがある。 [ 2 ]感染したドナーの血液を輸血すると、レシピエントが10~25%の確率で感染する。[ 2 ]これを防ぐために、米国だけでなくシャーガス病が風土病となっている多くの国では、献血に対してクルーズトリパノソーマのスクリーニングが実施されている。 [ 6 ]同様に、感染したドナーからの固形臓器の移植によっても、レシピエントにクルーズトリパノソーマが伝染することがある。 [ 2 ]これは特に心臓移植の場合に当てはまり、 75~100%の確率でクルーズトリパノソーマが伝染するが、肝臓移植(0~29%) や腎臓移植(0~19%) の場合はその確率は低くなる。[ 2 ]感染した母親は胎盤を介してクルーズトリパノソーマを子供に伝染させることがある。これは感染した母親による出産の最大15%で起こる。[ 25 ] 2019年時点で、新規感染の22.5%は先天性感染によるものでした。[ 26 ]
病態生理学

病気の急性期では、徴候と症状はT. cruziの複製とそれに対する免疫系の反応によって直接引き起こされます。[ 2 ]この段階では、T. cruziは体中の様々な組織に存在し、血液中に循環しています。[ 2 ]感染後数週間は、抗体の産生と宿主の炎症反応、特にTNF-αやIFN-γなどの炎症シグナル分子によって駆動されるNK細胞やマクロファージなどの細胞内病原体を標的とする細胞の活性化によって、寄生虫の複製は制御されます。[ 2 ]
慢性シャーガス病では、寄生虫の継続的な複製と免疫系からのダメージにより、長年にわたり長期的な臓器障害が進行します。病気の初期段階では、T. cruziは心臓の横紋筋線維に頻繁に見られます。 [ 27 ]病気が進行するにつれて、心臓は全体的に肥大し、心筋線維の大部分が瘢痕組織と脂肪に置き換わります。[ 27 ]活動性炎症領域は心臓全体に散在し、それぞれに炎症性免疫細胞、典型的にはマクロファージとT細胞が存在します。[ 27 ]病気の後期には、寄生虫が心臓で検出されることはまれであり、非常に低レベルにしか存在しないこともあります。[ 27 ]
心臓、結腸、食道では、慢性疾患により神経終末が大量に失われる。[ 19 ]心臓では、これが不整脈やその他の心機能障害の一因となる可能性がある。[ 19 ]結腸と食道では、神経系の制御の喪失が臓器機能障害の主な原因である。[ 19 ]神経の喪失は消化管を通る食物の移動を妨げ、食道や結腸の閉塞や血液供給の制限につながる可能性がある。[ 19 ]
この寄生虫はキネトプラストDNAを宿主細胞に挿入することができ、これは水平遺伝子伝播の一例です。挿入されたkDNAの垂直遺伝はウサギと鳥類で実証されています。ニワトリでは、挿入されたkDNAを持つ子孫は、生きたトリパノソーマを保有していないにもかかわらず、疾患の症状を示します。[ 28 ] 2010年には、5つのヒト家族において、挿入されたkDNAが垂直伝播したことが判明しました。[ 29 ]
診断

血液中にT.cruziが存在することで、シャーガス病と診断できる。感染の急性期には、運動性寄生虫を抗凝固処理した新鮮な血液またはそのバフィーコートの顕微鏡検査、またはギムザ染色した薄い血液塗抹標本と濃い血液塗抹標本を作製して寄生虫を直接観察することによって検出できる。[ 4 ] [ 6 ]血液塗抹標本の検査では、34~85%の症例で寄生虫が検出される。マイクロヘマトクリット遠心分離などの技術を使用して血液を濃縮すると、感度が向上する。 [ 2 ]染色した血液塗抹標本の顕微鏡検査では、T.cruziのトリポマスティゴートは、波状の膜によって体につながれた鞭毛を持つS字型またはU字型の生物として現れる。寄生虫の体内には核と、キネトプラストと呼ばれるより小さな構造が見える。T.cruziのキネトプラストは比較的大きく、これがヒトに感染する他のトリパノソーマ種との区別に役立つ。[ 30 ]
あるいは、T. cruziのDNAはポリメラーゼ連鎖反応(PCR)によって検出することができます。急性および先天性シャーガス病において、PCRは顕微鏡検査よりも感度が高く[ 26 ] 、また、母親から胎児へのT. cruziに対する抗体の移行(受動免疫)の影響を受けないため、先天性疾患の診断においては抗体検査よりも信頼性が高いとされています[ 31 ] 。PCRは臓器移植患者や免疫抑制状態にある人のT. cruziレベルのモニタリングにも用いられており、感染または再活性化を早期に検出することが可能です[ 2 ] 。 [ 4 ] [ 26 ]
慢性シャーガス病では、血液中の寄生虫濃度が低すぎて顕微鏡検査やPCRで確実に検出できないため[ 2 ] 、通常は血液中のT.cruziに対する免疫グロブリンG抗体を検出する血清学的検査によって診断が行われます。 [ 6 ]診断を確定するには、異なる検査法を用いた2回の血清学的検査で陽性反応を示すことが必要です。[ 4 ]検査結果が決定的でない場合は、ウエスタンブロット法などの追加の検査法を使用することができます。[ 2 ]
シャーガス病の迅速診断検査は数多く存在します。これらの検査は持ち運びが容易で、特別な訓練を受けていない人でも実施できます。[ 32 ]多数の人や医療施設を利用できない人の検査には有用ですが、感度は比較的低く、 [ 2 ]陽性結果を確認するには別の方法を用いることが推奨されています。[ 32 ] [ 33 ]
トリコモナス・クルーズの寄生虫は、血液培養、異種診断、あるいはヒトの血液を動物に接種することで、血液サンプルから培養することができます。血液培養法では、ヒトの赤血球を血漿から分離し、専用の培養培地に加えて寄生虫の増殖を促進します。結果が出るまでには最大6ヶ月かかる場合があります。異種診断法では、血液をサシガメに与え、30~60日後に糞便中に寄生虫が含まれているかどうかを調べます。[ 32 ]これらの方法は、時間がかかり感度が低いため、日常的に使用されていません。[ 34 ] [ 32 ]
予防

シャーガス病の予防努力は、主にサシガメへの曝露を制限するための媒介生物の駆除に重点を置いてきた。殺虫剤散布プログラムは媒介生物駆除の主流であり、残留性殺虫剤を家屋やその周辺地域に散布するものである。 [ 35 ]これはもともと有機塩素系、有機リン系、カーバメート系の殺虫剤を用いて行われ、1980年代にピレスロイド系に取って代わられた。[ 35 ]これらのプログラムにより、ブラジルとチリでの伝染が劇的に減少し、[ 17 ]特定の地域から主要な媒介生物を排除した。ブラジル、チリ、ウルグアイ、ペルーとパラグアイの一部からサシガメ(Triatoma infestans)が、中央アメリカからRhodnius prolixusが排除された。[ 19 ]一部の地域では、サシガメの殺虫剤耐性の発達により媒介生物の駆除が妨げられている。 [ 35 ]これに対応して、媒介生物管理プログラムでは、代替殺虫剤(アルゼンチンとボリビアではフェニトロチオンとベンジオカルブなど)、家畜(サシガメの餌となる)への殺虫剤投与、殺虫剤を含浸させた塗料の使用、その他の実験的アプローチが実施されてきた。[ 35 ]サシガメがいる地域では、蚊帳の下で寝ることや、サシガメが家に定着するのを防ぐ住宅の改善によって、 T. cruziの伝染を防ぐことができる。[ 17 ]
かつては、輸血がシャーガス病の2番目に多い感染方法であった。[ 36 ] T.cruzi は冷蔵保存された血液中で生存でき、凍結融解にも耐えることができるため、全血、赤血球、顆粒球、クリオプレシピテート、血小板中で存続できる。[ 36 ]血液銀行のスクリーニング検査の開発と実施により、輸血中の感染リスクは劇的に減少した。[ 36 ]ラテンアメリカ諸国では、ほぼすべての献血でシャーガス病スクリーニングが行われている。[ 36 ]シャーガス病非流行国でも、流行地域からの移民人口が多い国では、英国(1999年実施)、スペイン(2005年)、米国(2007年)、フランスとスウェーデン(2009年)、スイス(2012年)、ベルギー(2013年)など、広範囲にわたるスクリーニングが一般的である。[ 37 ]血清学的検査、典型的にはELISAは、ドナー血液中のT.cruziタンパク質に対する抗体を検出するために使用されます。[ 36 ]
シャーガス病予防プログラムは、他の感染経路にも焦点を当てています。妊娠中にT. cruziに感染した母親を治療することで、先天性感染のリスクを低減できます。[ 25 ]この目的のため、ラテンアメリカの多くの国では、妊婦と乳児のT. cruzi感染の定期スクリーニングを実施しており、世界保健機関は、先天性感染が慢性疾患に発展するのを防ぐため、感染した母親から生まれたすべての子どものスクリーニングを推奨しています。[ 1 ] [ 38 ]輸血と同様に、シャーガス病が風土病となっている多くの国では、移植用の臓器を血清学的検査でスクリーニングしています。[ 2 ]
シャーガス病に対するワクチンは存在しない。[ 8 ]いくつかの実験的ワクチンがT.cruziに感染した動物で試験され、血液と心臓中の寄生虫の数を減らすことができたが、[ 39 ] 2016年時点ではヒトを対象とした臨床試験を実施したワクチン候補はない。[ 40 ]
管理
.jpg/440px-NECT_treatment_(cropped).jpg)
シャーガス病は、体内からT.cruziを排除するための抗寄生虫薬と、感染の影響に対処するための対症療法を用いて管理される。 [ 6 ] 2018年現在、シャーガス病の治療にはベンズニダゾールとニフルチモックスが抗寄生虫薬として選択されるが[ 2 ] 、ラテンアメリカのほとんどの地域ではベンズニダゾールのみが入手可能である。[ 41 ]どちらの薬剤も、治療は通常、60日から90日間、1日2~3回の経口投与で構成される。[ 2 ]抗寄生虫治療は感染初期に最も効果的であり、急性期には50~80%の人からT.cruziを排除する(WHO:「ほぼ100%」)が、[ 42 ]慢性期では20~60%しか排除されない。[ 6 ]慢性疾患の治療は成人よりも小児の方が効果的であり、先天性疾患の治癒率は生後1年以内に治療すればほぼ100%となる。[ 2 ]抗寄生虫治療は病気の進行を遅らせ、先天性感染の可能性を減らすこともできる。[ 1 ] T.cruziを除去しても慢性シャーガス病による心臓や胃腸の損傷は治癒しないため、これらの疾患は別々に治療する必要がある。[ 6 ]すでに拡張型心筋症を発症している人には抗寄生虫治療は推奨されない。[ 19 ]
ベンズニダゾールはニフルチモックスよりも副作用が軽く、有効性もよく理解されているため、通常は第一選択薬と考えられています。 [ 2 ] [ 26 ]ベンズニダゾールとニフルチモックスにはどちらも、治療中止につながる一般的な副作用があります。ベンズニダゾールの最も一般的な副作用は、皮膚の発疹、消化器系の問題、食欲減退、脱力感、頭痛、睡眠障害です。これらの副作用は、抗ヒスタミン薬やコルチコステロイドで治療できることがあり、治療を中止すると一般的に回復します。[ 2 ]しかし、ベンズニダゾールは最大29%の症例で中止されます。[ 2 ]ニフルチモックスは副作用の頻度が高く、この薬を服用している人の最大97.5%に影響を及ぼします。[ 2 ]最も一般的な副作用は、食欲不振、体重減少、吐き気、嘔吐、気分変化、不眠症、知覚異常、末梢神経障害などの様々な神経障害である。[ 2 ]最大75%の症例で治療が中止される。[ 2 ] [ 26 ]両薬剤とも、妊婦および肝不全または腎不全の患者には禁忌である。[ 1 ] 2019年現在、これらの薬剤に対する耐性が報告されている。[ 41 ]
合併症
慢性期の治療では、病気の臨床症状の管理が中心となる。シャーガス病心筋症の治療は、他の心臓病の治療と同様である。[ 2 ]ベータ遮断薬やACE阻害薬が処方されることはあるが、シャーガス病患者の中には、低血圧または低心拍数のため、これらの薬を標準用量で服用できない人もいる。[ 2 ] [ 19 ]不整脈の管理には、アミオダロンなどの抗不整脈薬を処方したり、ペースメーカーを埋め込んだりすることがある。[ 4 ]血液凝固阻止剤は、血栓塞栓症や脳卒中の予防に使用されることがある。[ 19 ]未治療のT.cruzi感染による慢性心疾患は、心臓移植手術 の一般的な理由である。[ 17 ]移植レシピエントは臓器拒絶反応を防ぐために免疫抑制薬を服用するため、病気の再活性化を検出するためにPCRを用いたモニタリングが行われる。心臓移植を受けたシャーガス病患者の生存率は、平均的な心臓移植患者よりも高い。[ 19 ]
軽度の胃腸疾患は、便秘に対して下剤を使用したり、食前にメトクロプラミドなどの消化管運動促進薬を服用して食道症状を緩和するなど、対症療法で治療できる場合がある。 [ 4 ] [ 43 ]食道疾患のより重篤な症例では、下部食道括約筋を切断する手術(心筋切開術)が行われる場合があり、 [ 43 ]進行した巨大結腸症や巨大食道症では、患部の外科的切除が必要になる場合がある。[ 4 ] [ 34 ]
疫学


2019年には、世界中で推定650万人がシャーガス病に罹患し、毎年約17万3000人が新たに感染し、9490人が死亡しました。[ 3 ]この病気による世界の年間経済的負担は2013年に72億米ドルと推定され、そのうち86%は流行国が負担しています。[ 37 ] [ 46 ]シャーガス病は、毎年80万人以上の障害調整生命年を失わせます。 [ 2 ]
シャーガス病の流行地域は米国南部からチリ北部、アルゼンチンまで広がっており、ボリビア(6.1%)、アルゼンチン(3.6%)、パラグアイ(2.1%)でこの病気の有病率が最も高い。[ 2 ]ラテンアメリカ大陸内では、シャーガス病はアルゼンチン、ベリーズ、ボリビア、ブラジル、チリ、コロンビア、コスタリカ、エクアドル、エルサルバドル、フランス領ギアナ、グアテマラ、ガイアナ、ホンジュラス、メキシコ、ニカラグア、パナマ、パラグアイ、ペルー、スリナム、ウルグアイ、ベネズエラの21か国で流行している。[ 1 ] [ 2 ]流行地域では、主に媒介動物管理の取り組みと献血のスクリーニングにより、1980年代のピーク時から2010年までに年間感染者数と死亡者数がそれぞれ67%と73%以上減少しました。[ 2 ] [ 47 ]昆虫媒介および輸血による伝播は、ウルグアイ(1997年)、チリ(1999年)、ブラジル(2006年)で完全に遮断されており、[ 47 ]アルゼンチンでは、2001年時点で19の流行州のうち13州で媒介生物による伝播が遮断されていました。[ 48 ]ベネズエラの人道危機の間、以前は遮断されていた地域で媒介生物による伝播が発生し始め、シャーガス病の血清陽性率が上昇しました。[ 49 ]グランチャコ地域では殺虫剤耐性により、アマゾン川流域では経口感染により感染率が上昇している。 [ 2 ]
ラテンアメリカのほとんどの地域で媒介動物によるシャーガス病の発生率は減少しているが、経口感染によるシャーガス病の発生率は上昇している。これは、都市化と森林伐採の進行により、人々がサシガメとより密接に接触し、サシガメの種の分布が変化したことが原因と考えられる。[ 23 ] [ 50 ] [ 51 ]経口感染によるシャーガス病はベネズエラで特に懸念されており、2007年から2018年の間に16件の発生が記録されている。[ 49 ]
シャーガス病は、2 つの異なる生態学的なゾーンに存在します。南部コーン地域では、主なベクターが人家とその周辺に生息しています。中央アメリカとメキシコでは、主なベクター種は住居内と無人地域の両方に生息しています。どちらのゾーンでも、シャーガス病はほぼ例外なく農村部で発生し、そこではT. cruziも野生動物と家畜の間で循環しています。[ 52 ] T. cruzi は、ラテンアメリカ全域で 100 種を超える哺乳類によく感染し、その中にはオポッサム( Didelphis spp.) [ 53 ] 、アルマジロ、マーモセット、コウモリ、さまざまなげっ歯類[ 54 ] 、イヌ[ 53 ]などがあり、これらはすべてベクターによって感染するか、サシガメや他の感染した動物を食べることで経口感染する可能性があります。[ 54 ] [ 53 ]昆虫食動物にとって、これは一般的なモードです。[ 53 トカゲは、伝染にサシガメを必要とせず、自身の尿や糞便を通してライフサイクルを完了するという点で独特である。[ 53 ]獣医による伝染は、胎盤、輸血、臓器移植を介した垂直感染によっても起こる。[ 53 ]
他の感染症と同様に、気候変動はシャーガス病の分布と感染リスクに影響を及ぼすでしょう。具体的な影響は、地理的地域、病原体媒介生物種、気候変動のシナリオ、その他多くの要因によって異なります。[ 55 ]
非流行国
シャーガス病は伝統的にラテンアメリカの農村部の病気だと考えられているが、国際移住により、この病気にかかった人は主に北米とヨーロッパの多くの非風土病国に拡散している。[ 1 ] [ 37 ] 2020年現在、約30万人の感染者が米国に居住しており[ 56 ]、2018年には米国で3万人から4万人がシャーガス心筋症を患っていると推定された。[ 19 ]米国における症例の大部分はラテンアメリカからの移民に発生しているが[ 19 ] [ 26 ]、地域感染の可能性がある。11種のサシガメが米国原産であり、一部の南部の州では昆虫媒介動物と動物の保有者との間で病気の伝播の持続的なサイクルがあり[ 2 ] [ 26 ] 、これにはアメリカネズミ、ポッサム、アライグマ、アルマジロ、スカンクが含まれる。[ 57 ]しかし、国内で感染することは非常にまれであり、1955年から2015年までに28件の症例が記録されているに過ぎない。[ 2 ] [ 56 ]国内の病原体保有生物とヒトへの感染を考慮して、一部の科学者はシャーガス病を米国風土病、特に感染率の低さを反映して「低風土病」として再分類することを提案している。[ 15 ]
2013年時点で、米国における治療費は年間9億ドル(世界全体では70億ドル)と推定されており、これには入院費やペースメーカーなどの医療機器代も含まれている。[ 46 ]
2019年現在、ヨーロッパでは約6万8千人から12万3千人がシャーガス病に罹患している。 [ 58 ]ラテンアメリカからの移民率が高いスペインでは、この病気の有病率が最も高い。スペインでは5万人から7万人がシャーガス病に罹患していると推定されており、ヨーロッパの症例の大部分を占めている。[ 59 ]移民のパターンの違いにより、ヨーロッパ諸国内でも有病率には大きなばらつきがある。[ 58 ]イタリアの有病率が2番目に高く、オランダ、イギリス、ドイツがそれに続く。[ 59 ]
歴史

トリコモナス・クルーズは、人類が大陸に到着するはるか以前から南米の哺乳類に生息していた可能性が高い。[ 60 ]トリコモナス・クルーズは、アタカマ砂漠にある9000年前のチンチョーロのミイラから、ミナスジェライス州の様々な年代の遺体、はるか北はリオグランデ川近くのチワワ砂漠にある1100年前のミイラまで、南米各地の古代人の遺体から検出されている。[ 60 ]初期の文献にはシャーガス病と一致する症状が数多く記されており、この病気の初期の記述はミゲル・ディアス・ピメンタ(1707年)、ルイス・ゴメス・フェレイラ(1735年)、テオドロ・JH・ランガード(1842年)によるものとされている。[ 60 ]
シャーガス病は、 1909年にカルロス・シャーガスが、発熱、リンパ節の腫れ、脾臓と肝臓の腫大を呈した2歳の女児を診察した後に正式に記載された。[ 60 ]女児の血液を検査したところ、シャーガスは、その直前にサシガメの後腸から特定したトリパノソーマと同一のトリパノソーマを発見し、指導者であるブラジルの医師オスワルド・クルスにちなんで、トリパノソーマ・クルーズと命名した。[ 60 ]彼は感染したサシガメをリオデジャネイロのクルスに送り、クルスは感染したサシガメに噛まれるとT. cruziがマーモセットにも感染することを示した。[ 60 ]わずか2年間、1908年と1909年の間に、シャーガスはこの病気、原因生物、感染に必要な昆虫媒介生物に関する記述を出版した。[ 61 ] [ 62 ] [ 63 ]その直後、当時リオデジャネイロ医学部の教授であったミゲル・コウトの提案により、この病気は「シャーガス病」として広く知られるようになりました。[ 61 ]シャーガスの発見は国内外で名声を博しましたが、ブラジル政府のこの病気への対応の不十分さを浮き彫りにしたことで、シャーガス自身と彼の名前を冠したこの病気に対する批判を招き、彼の発見に関する研究は停滞し、1921年のノーベル賞候補にもつれ込むことになりました。 [ 61 ] [ 64 ]
1930年代にサルバドール・マッツァがシャーガス病研究を再燃させ、アルゼンチンのチャコ州で1000件を超える症例を報告した。[ 60 ]アルゼンチンでは、この病気は彼にちなんでマル・デ・シャーガス・マッツァと呼ばれている。 [ 65 ]シャーガス病の血清学的検査は1940年代に導入され、T.cruziによる感染がラテンアメリカ全土に広がっていることが明らかになった。[ 60 ]これは、殺虫剤の使用によるマラリア媒介生物の排除の成功と相まって、サシガメを根絶するために家屋に殺虫剤を処理することに焦点を当てた公衆衛生キャンペーンの創出を促した。[ 35 ] [ 60 ] 1950年代には、血液をクリスタルバイオレットで処理すると寄生虫を根絶できることが発見され、ラテンアメリカでの輸血スクリーニングプログラムにクリスタルバイオレットが広く使用されるようになった。[ 60 ]大規模な駆除プログラムは1960年代に形になり始め、最初はサンパウロで、次にアルゼンチンのさまざまな場所で、そしてラテンアメリカ全体で国家レベルのプログラムが展開されました。[ 66 ]これらのプログラムは、使用後に汚れや臭いを残さず、より長持ちし、より費用対効果の高いピレスロイド系殺虫剤の導入により、1980年代に大きく促進されました。[ 60 ] [ 66 ]シャーガス病の駆除に特化した地域組織は、汎米保健機構の支援により設立され、1991年にシャーガス病撲滅のための南部コーン・イニシアチブが開始され、その後、アンデス諸国イニシアチブ(1997年)、中米諸国イニシアチブ(1997年)、アマゾン諸国イニシアチブ(2004年)が続きました。[ 35 ]
研究
治療
アフリカ睡眠病の治療薬として承認されている抗寄生虫薬であるフェキシニダゾールは、動物モデルにおいてシャーガス病に対する活性を示しています。2019年現在、スペインで慢性シャーガス病を対象とした第II相臨床試験が行われています。 [ 41 ] [ 67 ]その他の候補薬としては、マウスのシャーガス病に有効で予備的な毒性試験が行われているプロテアソーム阻害剤GNF6702や、動物モデルで有望な結果が得られているAN4169などがあります。 [ 11 ] [ 68 ]
いくつかの実験的ワクチンが動物実験で実施されている。サブユニットワクチンに加えて、弱毒化したT. cruzi原虫、またはT. cruziと同じ抗原を発現するがヒトには疾患を引き起こさない生物(例えば、Trypanosoma rangeliやPhytomonas serpens )を用いたワクチン接種も行われている。DNAワクチンも研究されている。2019年現在、ワクチン研究は主に小動物モデルに限られている。[ 10 ]
診断検査
2018年現在、シャーガス病の標準的な診断検査は、駆虫薬治療の有効性を測定する能力が限られています。血清学的検査では、トリパノソーマが体内から排除された後も何年も陽性反応が続く可能性があり、PCR検査では血中の寄生虫濃度が低い場合に偽陰性の結果が出る可能性があるためです。治療反応の潜在的なバイオマーカーとして、特定のトリパノソーマ抗原に対する免疫測定、トリパノソーマの異なるライフステージに対する抗体を検出するためのフローサイトメトリー検査、凝固や脂質代謝の変化など、寄生虫によって引き起こされる生理学的変化のマーカーなどが研究されています。[ 19 ]
もう一つの研究分野は、慢性疾患の進行を予測するためのバイオマーカーの利用です。腫瘍壊死因子α、脳性および心房性ナトリウム利尿ペプチド、アンジオテンシン変換酵素2の血清値は、シャーガス心筋症の予後指標として研究されてきました。[ 69 ]
トリコモナス・クルーズトリコモナス急性期抗原(SAPA)は、ELISAまたはウェスタンブロット法を用いて血液中で検出することができ、[25]、早期急性および先天性感染症の指標として使用されている。[69] 先天性疾患を診断するために、尿中のトリコモナス・クルーズトリコモナス抗原の検査が開発されている。[ 25 ]
参照
参考文献
- ^ a b c d e f g h i j k l m n o p q「シャーガス病(アメリカトリパノソーマ症)」世界保健機関。2019年4月17日。2020年1月20日時点のオリジナルよりアーカイブ。 2020年3月9日閲覧。
- ^ a b c d e f g h i j k l m no p q r s t u v w x y z aa ab ac ad ae af ag ag ai ajak al am an ao ap aq ar as at au av axペレス=モリーナJA、モリーナ I (2018)。 「シャーガス病」。ランセット。391 (10115): 82–94。土井: 10.1016/S0140-6736(17)31612-4。ISSN 0140-6736。PMID 28673423。S2CID 4514617。
- ^ a b c d e「グローバルヘルスメトリクス:シャーガス病—レベル3の原因」(PDF) . The Lancet . 2020年。2022年3月18日時点のオリジナルよりアーカイブ(PDF) 。
- ^ a b c d e f g h i j k l m n o p Bern C (2015年7月). 「シャーガス病」. N. Engl. J. Med. (Review). 373 (5): 456– 66. doi : 10.1056/NEJMra1410150 . PMID 26222561 .
- ^ a b c「DPDx – トリパノソーマ症、アメリカ。ファクトシート」。米国疾病予防管理センター(CDC)。2019年4月30日。 2019年9月5日時点のオリジナルよりアーカイブ。 2020年3月10日閲覧。
- ^ a b c d e f g h Guarner J (2019年5月). 「再出現する寄生虫の例としてのシャーガス病」 .診断病理学セミナー. 36 (3): 164–9 . doi : 10.1053/j.semdp.2019.04.008 . PMID 31006555 .
- ^ 「シャーガス病の予防」世界保健機関。2018年2月11日時点のオリジナルよりアーカイブ。2018年2月24日閲覧。
- ^ a b Santi AM, Murta SM (2022). 「シャーガス病およびリーシュマニア症の化学療法における合理的標的としての抗酸化防御システム」 . Memórias do Instituto Oswaldo Cruz . 117 e210401. doi : 10.1590/0074-02760210401 . PMC 8896756. PMID 35239945 .
- ^ Porta EO, Kalesh K, Steel PG (2023). 「シャーガス病における薬剤再利用のナビゲート:進歩、課題、そして機会」 . Front Pharmacol . 14 1233253. doi : 10.3389/fphar.2023.1233253 . PMC 10416112. PMID 37576826 .
- ^ a bリオス LE、バスケス=チャゴヤン JC、パチェコ AO、ザーゴ MP、ガーグ NJ (2019)。「クルーズトリパノソーマに対する免疫およびワクチン開発の取り組み」。アクタ・トロピカ。200 105168.土井: 10.1016/j.actatropica.2019.105168。ISSN 0001-706X。PMC 7409534。PMID 31513763。
- ^ a b Vermelho AB, Rodrigues GC, Supuran CT (2019). 「なぜシャーガス病の新薬発見はそれほど進歩していないのか?」. Expert Opinion on Drug Discovery . 15 (2): 145– 158. doi : 10.1080 / 17460441.2020.1681394 . ISSN 1746-0441 . PMID 31670987. S2CID 207815975 .
- ^ラッシ Jr A、ラッシ A、マルコンデス デ レゼンデ J (2012 年 6 月)。 「アメリカ人トリパノソーマ症(シャーガス病)」。北米の感染症クリニック。26 (2): 275–91。土井: 10.1016/j.idc.2012.03.002。PMID 22632639。S2CID 34941921。
- ^カピネラ JL 編(2008年)。昆虫学百科事典(第 2 版)。ドルドレヒト: スプリンガー。 p. 824。ISBN 978-1-4020-6242-1。
- ^ Rassi A, Rassi A, Marin-Neto JA (2010年4月). 「シャーガス病」. Lancet . 375 (9723): 1388–402 . doi : 10.1016 / S0140-6736 (10)60061-X . PMID 20399979. S2CID 5068417
- ^ a b Beatty, Norman L.; Hamer, Gabriel L.; Moreno-Peniche, Bernardo; Mayes, Bonny; Hamer, Sarah A. (2025年9月). 「シャーガス病:米国における風土病」 . Emerging Infectious Diseases . 31 (9). doi : 10.3201/eid3109.241700 . PMC 12407112 .
- ^ 「顧みられない熱帯病」cdc.gov、2011年6月6日。2014年12月4日時点のオリジナルよりアーカイブ。 2014年11月28日閲覧。
- ^ a b c d e f g h i j k l Despommier DD, Griffin DO, Gwadz RW, Hotez PJ, Knirsch CA (2019). 「アメリカトリパノソーマ症」.寄生虫病(第7版). ニューヨーク: Parasites Without Borders. pp. 71– 84. 2020年3月26日閲覧。
- ^ 「シャーガス病 – 詳細なファクトシート」 www.cdc.gov . CDC(疾病予防管理センター). 2019年8月16日時点のオリジナルよりアーカイブ。 2020年4月15日閲覧。
- ^ a b c d e f g h i j k l m n Nunes MC, Beaton A, Acquatella H, et al. (2018年9月). 「シャーガス心筋症:最新の臨床知識と管理の最新情報:米国心臓協会からの科学的声明」 Circulation ( Review). 138 (12): e169– e209. doi : 10.1161/CIR.0000000000000599 . PMID 30354432 .
- ^ Echeverria LE, Morillo CA (2019年2月). 「アメリカトリパノソーマ症(シャーガス病)」.北米感染症クリニック. 33 (1): 119– 134. doi : 10.1016/j.idc.2018.10.015 . PMID 30712757. S2CID 73446292 .
- ^ a b c Alba Soto CD, González Cappa SM (2019年9月9日). 「トリパノソーマ・クルーズジ 昆虫ベクターから宿主細胞への旅」 Marcelo Altcheh J, Freilij H (編).シャーガス病. Birkhäuser Advances in Infectious Diseases. スイス: Springer Nature. pp. 25– 59. doi : 10.1007/978-3-030-00054-7_2 . ISBN 978-3-030-00054-7. ISSN 2504-3811 . S2CID 203357705
- ^ Maudlin I, Holmes PH, Miles MA編 (2004). The Trypanosomiases . Wallingford: CAB International. p. 184 . ISBN 978-0-85199-034-7。
- ^ a b c d Robertson LJ、Deveesschauwer B、de Noya BA、Gozalez ON、Togerson PR(2016年6月)。 「クルーズトリパノソーマ:食品媒介性寄生虫として国際的に認識される時が来た」。PLOS Neglected Tropical Diseases。10 ( 6 ) e0004656。doi : 10.1371/ journal.pntd.0004656。PMC 4890754。PMID 27253136
- ^ 「シャーガス病の経口感染は深刻な影響を及ぼす(『経口感染シャーガス病について知っておくべき7つのこと』のセクション付き)」 Medscape 、 2024年3月1日。
- ^ a b c d Messenger LA, Bern C (2018). 「先天性シャーガス病:現在の診断、限界、そして将来の展望」(PDF) . Current Opinion in Infectious Diseases . 31 (5): 415–21 . doi : 10.1097/QCO.0000000000000478 . PMID 30095485. S2CID 51955023. 2020年3月5日時点のオリジナルよりアーカイブ(PDF) .
- ^ a b c d e f g Bern C, Messenger LA, Whitman JD, Maguire JH (2019). 「米国におけるシャーガス病:公衆衛生学的アプローチ」. Clinical Microbiology Reviews (Review). 33 (1) e00023-19. doi : 10.1128/CMR.00023-19 . ISSN 0893-8512 . PMC 6927308. PMID 31776135 .
- ^ a b c d Bonney KM, Luthringer DJ, Kim SA, Garg NJ, Engman DM (2019年1月). 「シャーガス心疾患の病理と病態発生」 . Annu Rev Pathol (Review). 14 : 421– 47. doi : 10.1146/annurev-pathol-020117-043711 . PMC 7373119. PMID 30355152 .
- ^テイシェイラ AR、ニッツ N、ギマロ MC、ゴメス C、サントス=ブッフ CA (2006 年 12 月)。「シャーガス病」。大学院生 Med J. 82 (974): 788–98 .土井: 10.1136/pgmj.2006.047357。PMC 2653922。PMID 17148699。
- ^ Hecht MM, Nitz N, Araujo PF, et al. (2010年2月). 「アメリカトリパノソーマからヒト宿主へ伝達されたDNAの継承」 . PLOS ONE . 5 (2) e9181. Bibcode : 2010PLoSO...5.9181H . doi : 10.1371/journal.pone.0009181 . PMC 2820539. PMID 20169193 .
- ^ Bain BJ (2015年1月20日). Blood Cells: A Practical Guide . John Wiley & Sons. pp. 165–7 . ISBN 978-1-118-81733-9。
- ^ Schijman AG (2018 年 8 月)。 「クルーズトリパノソーマの分子診断」。アクタ・トロピカ。184 : 59–66。土井: 10.1016/j.actatropica.2018.02.019。hdl : 11336/79861。PMID 29476727。S2CID 3513900。
- ^ a b c dルケッティ AO、シジマン AG (2019 年 9 月 9 日)。 「シャーガス病の診断」。 Marcelo Altcheh J、Freilij H (編)。シャーガス病。ビルクホイザーによる感染症の進歩。スイス:シュプリンガー・ネイチャー。 pp. 141–58 . doi : 10.1007/978-3-030-00054-7_7。ISBN 978-3-030-00054-7. ISSN 2504-3811 . S2CID 203376369
- ^ Angheben A, Buonfrate D, Cruciani M, et al. (2019年5月). 「リスクのある集団における慢性シャーガス病の診断のための迅速免疫クロマトグラフィー検査:系統的レビューとメタアナリシス」 . PLOS Neglected Tropical Diseases . 13 (5) e0007271. doi : 10.1371/journal.pntd.0007271 . PMC 6561601. PMID 31150377 .
- ^ a b Kirchhoff OV (2019年4月26日). 「シャーガス病(アメリカトリパノソーマ症)」 . eMedicine . 2020年3月12日時点のオリジナルよりアーカイブ。2020年4月8日閲覧。
- ^ a b c d e f Mougabure-Cueto G, Picollo MI (2015年9月). 「媒介性シャーガス病における殺虫剤耐性:進化、メカニズム、そして管理」. Acta Tropica . 149 : 70–85 . doi : 10.1016/j.actatropica.2015.05.014 . hdl : 11336/61521 . PMID 26003952 .
- ^ a b c d e Angheben A, Boix L, Buonfrate D, et al. (2015年10月). 「シャーガス病と輸血医療:非流行国からの視点」. Blood Transfusion . 13 (4): 540–50 . doi : 10.2450/2015.0040-15 . PMC 4624528. PMID 26513769 .
- ^ a b c Lidani KCF, Andrade FA, Bavia L, et al. (2019年7月). 「シャーガス病:発見から世界的な健康問題へ」 . Frontiers in Public Health . 7 166. Bibcode : 2019FrPH....7..166L . doi : 10.3389/fpubh.2019.00166 . PMC 6614205. PMID 31312626 .
- ^ Bonney KM (2014年3月). 「21世紀のシャーガス病:公衆衛生上の成功か、それとも新たな脅威か」 . Parasite . 21 ( 11): 11. doi : 10.1051/parasite/2014012 . PMC 3952655. PMID 24626257 .
- ^ Dumonteil E, Herrera C, Buekens P (2019年1月). 「シャーガス病に対する妊娠前治療ワクチン:先天性感染を減らし、ワクチン開発を加速させる新たな適応症」 . PLOS Neglected Tropical Diseases . 13 (1) e0006985. doi : 10.1371/journal.pntd.0006985 . PMC 6354953. PMID 30703092 .
- ^ Beaumier CM, Gillespie PM, Strych U, et al. (2016年6月). 「シャーガス病ワクチンの研究開発の現状」 . Vaccine . 34 (26): 2996– 3000. doi : 10.1016/j.vaccine.2016.03.074 . PMID 27026146 .
- ^ a b c Ribeiro V, Dias N, Paiva T, et al. (2019年12月). 「シャーガス病の薬理学的管理における現在の動向」 . Int J Parasitol Drugs Drug Resist (Review). 12 : 7– 17. doi : 10.1016/j.ijpddr.2019.11.004 . PMC 6928327. PMID 31862616 .
- ^ WHO. (2022年4月13日).「シャーガス病(アメリカトリパノソーマ症とも呼ばれる)」 .ファクトシート.
- ^ a bデ オリベイラ EC、ダ シルベイラ ABM、ルケッティ AO (2019 年 9 月 9 日)。 「消化管シャーガス病」。 Marcelo Altcheh J、Freilij H (編)。シャーガス病。ビルクホイザーによる感染症の進歩。スイス:シュプリンガー・ネイチャー。 pp. 243–62。土井: 10.1007/978-3-030-00054-7_12。ISBN 978-3-030-00054-7. ISSN 2504-3811 . S2CID 203457516
- ^ Liu Q, Zhou XN (2015年12月). 「アメリカトリパノソーマ症の伝播と非流行国への拡散防止」 .貧困と感染症. 4 60. doi : 10.1186/s40249-015-0092-7 . PMC 4693433. PMID 26715535 .
- ^世界保健機関. 「疾病負担と死亡率の推定」 . 2020年2月10日時点のオリジナルよりアーカイブ。2020年4月27日閲覧。
- ^ a b Lee BY, Bacon KM, Bottazzi ME, Hotez PJ (2013年4月). 「シャーガス病の世界的経済的負担:計算シミュレーションモデル」 . The Lancet Infectious Diseases . 13 (4): 342–8 . doi : 10.1016/S1473-3099(13)70002-1 . PMC 3763184. PMID 23395248 .
- ^ a b Moncayo A, Silveria AC (2017). 「ラテンアメリカにおけるシャーガス病の現在の疫学的傾向と将来の課題:疫学、監視、そして保健政策」アメリカトリパノソーマ症-シャーガス病(第2版)エルゼビア. pp. 59– 88. doi : 10.1016/B978-0-12-801029-7.00004-6 .
- ^ 「サザンコーン・イニシアティブ:最新情報」熱帯病研究訓練特別プログラム(TDR)(プレスリリース)WHO. 2004年。2009年9月22日時点のオリジナルよりアーカイブ。 2008年8月29日閲覧。
- ^ a b Grillet ME, Hernández-Villena JV, Llewellyn MS, et al. (2019年5月). 「ベネズエラの人道危機、ベクター媒介性疾患の再興、そして地域におけるスピルオーバーへの影響」(PDF) . Lancet Infect Dis (Review). 19 (5): e149– e161. doi : 10.1016/S1473-3099(18) 30757-6 . PMID 30799251. S2CID 73475841 .
- ^ Alarcón de Noya B, Noya Gonzáles O (2019年9月9日). 「経口感染性シャーガス病:食中毒の生物学、疫学、臨床的側面」 Marcelo Altcheh J, Freilij H (編).シャーガス病. Birkhäuser Advances in Infectious Diseases. スイス: Springer Nature. pp. 225–241 . doi : 10.1007/978-3-030-00054-7_11 . ISBN 978-3-030-00054-7. ISSN 2504-3811 . S2CID 239445211
- ^ Hotez PJ, Basáñez MG, Acosta-Serrano A, Grillet ME (2017). 「ベネズエラと増加しているベクター媒介性顧みられない病気」. PLOS Neglected Tropical Diseases . 11 (6) e0005423. doi : 10.1371/journal.pntd.0005423 . ISSN 1935-2735 . PMC 5490936. PMID 28662038 .
- ^ Morel CM, Lazdins J (2003年10月). 「シャーガス病」 . Nat Rev Microbiol . 1 (1): 14– 5. doi : 10.1038/nrmicro735 . PMID 15040175. S2CID 29869370 .
- ^ a b c d e f Wilkowsky SE (2022年3月9日). 「動物のトリパノソーマ症 - 循環器系」 . Merck Veterinary Manual . 2022年3月28日時点のオリジナルよりアーカイブ。 2022年3月28日閲覧。
- ^ a b Jansen AM, Roque ALR (2010). 「11. 家畜および野生哺乳類のリザーバー」. Telleria J, Tibayrenc M (編).アメリカトリパノソーマ症. Elsevier. pp. 249– 276. doi : 10.1016/B978-0-12-384876-5.00011-3 . ISBN 978-0-123-84876-5。
- ^ Tidman, Rachel; Abela-Ridder, Bernadette; de Castañeda, Rafael Ruiz (2021年1月28日). 「気候変動が顧みられない熱帯病に与える影響:系統的レビュー」 .王立熱帯医学衛生学会誌. 115 (2): 147–168 . doi : 10.1093/trstmh/traa192 . ISSN 0035-9203 . PMC 7842100. PMID 33508094 .
- ^ a b Turabelidze G, Vasudevan A, Rojas-Moreno C, et al. (2020). 「土着性シャーガス病 — ミズーリ州、2018年」MMWR .疾病・死亡率週報. 69 (7): 193– 195. doi : 10.15585/mmwr.mm6907a4 . ISSN 0149-2195 . PMC 7043387. PMID 32078594 .
- ^ Montgomery SP, Starr MC, Cantey PT, Edwards MS, Meymandi SK (2014). 「米国における無視されている寄生虫感染症:シャーガス病」 . Am J Trop Med Hyg . 90 (5): 814– 818. doi : 10.4269/ ajtmh.13-0726 . PMC 4015570. PMID 24808250 .
- ^ a bアロンソ=パディージャ J、ピナソ MJ、ガスコン J (2019 年 9 月 9 日)。 「ヨーロッパにおけるシャーガス病」。 Marcelo Altcheh J、Freilij H (編)。シャーガス病。ビルクホイザーによる感染症の進歩。スイス:シュプリンガー・ネイチャー。 pp. 111–123 . doi : 10.1007/978-3-030-00054-7_5。ISBN 978-3-030-00054-7. ISSN 2504-3811 . S2CID 203406723
- ^ a b Velasco M, Gimeno-Feliú LA, Molina I, et al. (2020年2月). 「移民と難民におけるクルーズトリパノソーマ感染症のスクリーニング:スペイン感染症・臨床微生物学会による系統的レビューと推奨事項」. Euro Surveill. (Review). 25 (8). doi : 10.2807/1560-7917.ES.2020.25.8.1900393 . PMC 7055039. PMID 32127121 .
- ^ a b c d e f g h i j k Steverding D (2014年7月). 「シャーガス病の歴史」 .寄生虫とベクター. 7 : 317. doi : 10.1186/ 1756-3305-7-317 . PMC 4105117. PMID 25011546 .
- ^ a b c Kropf SP, Sá MR (2009年7月). 「トリパノソーマ・クルーズジの発見とシャーガス病(1908~1909年):ブラジルの熱帯医学」 . Hist Cienc Saude Manguinhos . 16 (Suppl 1): 13– 34. doi : 10.1590/s0104-59702009000500002 . PMID 20027916. S2CID 36106351 .
- ^シャーガス C (1909)。 「ノイエ・トリパノソーメン」。ヴォルロイフィーゲ・ミッテルング・アーチ・シフ・トロペンヒグ。13:120-2.
- ^シャーガス C (1909)。「新生トリパノソーマ症ヒト:Estudos sobre a morfolojia eo ciclo evolutivo do Schizotrypanum cruzi n. gen., n. sp., ajente etiolojico de nova entidade morbida do homem [新生ヒトトリパノソーマ症。トリパノソーマ症の病原体であるシゾトリパノソーマ症の形態と生活環に関する研究。人間の新たな病的な実体]」。オズワルド・クルーズのメモ。1 (2): 159–218。土井: 10.1590/S0074-02761909000200008。ISSN 0074-0276。 (ポルトガル語、ドイツ語全訳は「Ueber eine neue Trypanosomiasis des Menschen」)
- ^ Bestetti RB, Martins CA, Cardinalli-Neto A (2009年5月). 「正義は正義にこそある:アメリカトリパノソーマ症(シャーガス病)の発見者、カルロス・シャーガス(1879-1934)の死後ノーベル賞」International Journal of Cardiology . 134 (1): 9– 16. doi : 10.1016/j.ijcard.2008.12.197 . PMID 19185367 .
- ^ 「Enfermedad de Chagas – Mazza」(スペイン語)。ルチャ・コントラ・エル・マル・デ・シャーガス協会。2011 年 9 月 16 日のオリジナルからアーカイブ。2011 年9 月 15 日に取得。
- ^ a b Dias JCP (2015年9月). 「シャーガス病スクリーニングプログラムと管理プログラムの進化」 . Global Heart . 10 (3): 193– 202. doi : 10.1016/j.gheart.2015.06.003 . PMID 26407516 .
- ^ Deeks ED (2019). 「フェキシニダゾール:初の国際承認」. Drugs (Review). 79 (2): 215– 220. doi : 10.1007/ s40265-019-1051-6 . ISSN 0012-6667 . PMID 30635838. S2CID 57772417 .
- ^ Kratz JM (2019). 「シャーガス病に対する創薬:ある視点」 . Acta Tropica (Review). 198 105107. doi : 10.1016/j.actatropica.2019.105107 . ISSN 0001-706X . PMID 31351074 .
- ^ a b Balouz V, Agüero F, Buscaglia CA (2017). 「シャーガス病の診断への応用:現在の知見と今後の展望」 . Adv . Parasitol. (Review). 97 : 1– 45. doi : 10.1016/bs.apar.2016.10.001 . PMC 5363286. PMID 28325368 .
外部リンク
- 米国疾病予防管理センターのシャーガス病情報
- 顧みられない病気のための医薬品イニシアチブからのシャガス情報
- 国際旅行者医療支援協会による旅行者向けシャーガス病情報

