極低温電子顕微鏡
 |

極低温電子顕微鏡法(クライオEM)は、極低温に冷却された試料に適用される透過型電子顕微鏡法である。生物試料の場合、試料の構造はガラス質氷の環境に包埋することで保存される。試料水溶液をグリッドメッシュに塗布し、液体エタンまたは液体エタンとプロパンの混合液にプランジ凍結する。[ 1 ]この技術の開発は1970年代に始まったが、近年の検出器技術とソフトウェアアルゴリズムの進歩により、生体分子の構造を原子レベルに近い分解能で決定できるようになった。[ 2 ]これにより、構造生物学分野において、X線結晶構造解析やNMR分光法の代替として、この手法が広く注目を集めている。 [ 3 ]
2017年のノーベル化学賞は、ジャック・デュボシェ、ヨアヒム・フランク、リチャード・ヘンダーソンの3人に授与されました。受賞理由は「溶液中の生体分子の高解像度構造決定のためのクライオ電子顕微鏡法の開発」でした。[ 4 ] また、ネイチャー・メソッド誌は2015年にクライオ電子顕微鏡を「今年の手法」に選出しました。[ 5 ]
歴史
初期の開発
1960年代には、高エネルギー電子線による放射線損傷のため、透過型電子顕微鏡を用いた生物試料の構造決定は限定的でした。科学者たちは、試料を低温で検査することで、電子線誘起の放射線損傷を軽減できると仮説を立てました。 [ 6 ]液体ヘリウム(-269 ℃または 4Kまたは-452.2 ℉)と液体窒素(-195.79℃または77Kまたは-320℉)はどちらも極低温物質として考えられていましたが、 [ 7 ]高い安定性は達成されませんでした。1980年、エルウィン・クナペックとジャック・デュボシェは、極低温における電子線損傷に関するコメントを発表し、次のような観察結果を共有しました。
炭素膜上に載せられた薄い結晶は、室温よりも4Kで30~300倍の耐ビーム性があることがわかりました。私たちの結果のほとんどは、4K領域での凍結保護が温度に強く依存していると仮定することで説明できます。[ 8 ]
しかし、これらの結果は再現性がなく、わずか2年後に修正版[ 9 ]が発表され、Nature誌の解説[ 10 ]では、ビーム耐性は当初予想されていたほど大きくないことが示唆されました。4Kで得られた保護効果は、L-バリンの標準試料の場合、以前の発表よりも「10倍」に近かったとされています。[ 10 ]クライオ電子顕微鏡(クライオEM)試料は通常、液体窒素温度で採取されますが、[ 11 ]試料の挙動を理解し、液体ヘリウム温度で採取するための研究が継続されています。[ 12 ] [ 13 ] [ 11 ]
1981年、欧州分子生物学研究所の科学者アラスデア・マクドウォールとジャック・デュボシェが、クライオ電子顕微鏡(cryo-EM)の初めての導入に成功したと報告した。[ 14 ]マクドウォールとデュボシェは、親水性カーボンフィルムに純水を噴霧し、急速に極低温(77 K に冷却した液体プロパンまたは液体エタン)に浸すことで、薄膜状に純水をガラス化した。非晶質氷の薄い層の厚さは1 μm未満で、電子回折パターンにより非晶質/ガラス質氷の存在が確認された。1984年、デュボシェのグループは、ガラス化したアデノウイルス2型、T4バクテリオファージ、セムリキ森林ウイルス、バクテリオファージCbK、水疱性口内炎ウイルスの分析により、構造生物学におけるクライオ電子顕微鏡の威力を実証した。[ 15 ]この論文はクライオ電子顕微鏡の起源を示すものと一般的に考えられており、この技術は世界中の多くの研究室で日常的に使用されるまでに発展しました。
イメージングに使用される電子のエネルギー(80~300 kV)は、有機試料および生物試料中の共有結合の切断につながる可能性があります。 [ 16 ]このような試料をイメージングする場合、画像取得に使用する電子照射量を制限する必要があります。この低い照射量では、専用のソフトウェアを用いて、数千、あるいは数百万もの同一の凍結分子の画像を選択し、整列させ、平均化することで高解像度のマップを作成する必要があります。2012年には、直接電子検出器とより優れた計算アルゴリズムの導入により、構造特徴の大幅な改善が達成されました。[ 17 ]
最近の進歩
電子検出器技術、特に直接電子検出器の進歩と、より強力なソフトウェア画像化アルゴリズムにより、原子分解能に近い解像度で高分子の構造を決定できるようになりました。 [ 18 ]画像化された高分子には、ウイルス、リボソーム、ミトコンドリア、イオンチャネル、酵素複合体などがあります。2018年からは、クライオ電子顕微鏡 (cryo-EM) はヘモグロビン(64 kDa ) [ 19 ]のような小さな構造にも適用でき、解像度は最大1.8 Åに達します。[ 20 ] 2019年には、タンパク質データバンクに登録された構造の2.5%がクライオ電子顕微鏡 (cryo-EM) 構造で占められており、[ 21 ]この数は増え続けています。[ 22 ]クライオ電子顕微鏡の応用例として、傾斜した2D画像からサンプルの3D再構成を行う クライオ電子トモグラフィー(cryo-ET) があります。
2010年代は電子カメラの飛躍的な進歩が顕著でした。特に、直接電子検出器の改良は「解像度革命」[ 23 ]をもたらし、アミノ酸の位置と配向を解明するために不可欠な約2~3Åの限界を下回る解像度を実現しました。[ 24 ]
ヘンダーソン(MRC分子生物学研究所、英国ケンブリッジ)は、ラザフォード・アップルトン研究所の技術者およびマックス・プランク協会の科学者らとコンソーシアムを結成し、最初のプロトタイプの資金調達と開発を行った。その後、コンソーシアムは電子顕微鏡メーカーのFEIと提携し、新設計の製品化と販売を開始した。ほぼ同時期に、カリフォルニア州プレザントンのガタン社は、ピーター・デネス(ローレンス・バークレー国立研究所)とデビッド・アガード(カリフォルニア大学サンフランシスコ校)が設計した同様の検出器を発表した。3つ目のタイプのカメラは、ダイレクト・エレクトロン社(カリフォルニア州サンディエゴ)のグエン・フー・シュオンによって開発された。[ 23 ]
最近では、タンパク質ベースのイメージングスキャフォールドの使用における進歩が、サンプルの方向バイアスとサイズ制限の問題を解決するのに役立っています。 Cryo-EM の最小サイズはまだ決定されていませんが、約 50 kDa未満のタンパク質は一般に信号対雑音比(SNR)が低すぎるため、画像内でタンパク質粒子を分解することができず、3D 再構成が困難または不可能になります。[ 25 ] [ 26 ]小さなタンパク質の構造を決定する際に SNR を改善する複数の手法が報告されています。[ 27 ] [ 28 ]高親和性のDARPins、ナノボディ、抗体フラグメントに基づいて、[ 29 ]これらの方法は標的タンパク質を強固に結合し、それによって有効粒子サイズを増やして対称性を導入し、 Cryo-EM マップ再構成の SNR を改善します。
2017年ノーベル化学賞
クライオ電子顕微鏡が生化学に与えた影響が認められ、ジャック・デュボシェ、ヨアヒム・フランク、リチャード・ヘンダーソンの3人の科学者が「溶液中の生体分子の高解像度構造決定のためのクライオ電子顕微鏡の開発」によりノーベル化学賞を受賞した。 [ 4 ]
X線結晶構造解析との比較
伝統的に、X線結晶構造解析は生体分子の3次元構造を決定するための最も一般的な手法であった。[ 30 ]しかし、前述のクライオ電子顕微鏡(クライオEM)の進歩により、生体分子の詳細を調べるツールとしての人気が高まっている。2010年以降、クライオ電子顕微鏡による構造の年間登録数はX線結晶構造解析を上回っている。[ 31 ] X線結晶構造解析は数十年にわたる歴史を持つため、登録数が大幅に多いものの、2035年頃には両手法の総登録数が上回ると予測されている。[ 31 ]
X線結晶構造解析の解像度は結晶の均質性によって制限され、[ 32 ]、理想的な結晶化条件が不明な生物学的分子を結晶状態に誘導することは非常に時間がかかり、極端な場合には数か月から数年かかることもあります。[ 33 ]対照的に、クライオ電子顕微鏡(cryo-EM)でのサンプル調製では、タンパク質凝集や優先配向などの問題を克服するために、複数回のスクリーニングと最適化が必要になる場合があります。[ 34 ] [ 35 ]しかし、サンプルが結晶を形成する必要はなく、クライオ電子顕微鏡用のサンプルは急速冷凍され、ほぼ天然の状態で検査されます。[ 36 ]
Proteopediaによると、タンパク質データバンクにおけるX線結晶構造解析による平均解像度(2019年5月19日現在)は2.05Åであり、 [ 32 ] 、記録上達成された最高解像度(2022年9月30日現在)は0.48Åである。[ 37 ] 2020年現在、クライオ電子顕微鏡(cryo-EM)によって決定されたタンパク質構造の大部分は、3~4Åの低い解像度である。[ 38 ] しかし、2020年現在、最高のクライオ電子顕微鏡(cryo-EM)解像度は1.22Åで記録されており、[ 35 ]場合によっては解像度の面で競合することになる。
生物標本
薄膜
生物試料は電子顕微鏡グリッド上に広げられ、通常は液体窒素温度に近い液体エタン中で急速凍結により凍結水和状態で保存されます。試料を液体窒素温度またはそれ以下の温度に保つことで、電子顕微鏡カラムの高真空中に導入することができます。ほとんどの生物試料は放射線感受性が非常に高いため、低線量技術を用いて画像化する必要があります(透過型電子顕微鏡の低温は、放射線損傷に対するさらなる保護因子となります)。
その結果、画像には非常にノイズが多くなります。一部の生物系では、画像を平均化することで信号対雑音比を高め、単粒子解析と呼ばれる手法を用いて標本に関する高解像度の情報を取得することが可能です。このアプローチでは、平均化の対象となるものが一般的に同一である必要がありますが、限定的な構造的異質性(リボソームなど)を研究できるようになりました。タンパク質複合体やウイルスのCryoTEM画像からの3次元再構成は、サブナノメートルまたは原子レベルに近い解像度で解読されており、これらの大規模集合体の構造と生物学的特性に関する新たな知見をもたらしています。
膜貫通タンパク質の2次元結晶やタンパク質のらせん状配列など、タンパク質の整列した配列を解析することで、ある種の平均化が可能になり、試料に関する高解像度の情報が得られます。この技術は電子結晶構造解析と呼ばれます。
硝子体切片
薄膜法は、厚い試料では電子が多重散乱を起こさずに透過できないため、薄い試料(通常 500 nm 未満)に限られます。厚い試料は、エタン中でプランジ凍結(凍結固定)するか、より一般的には高圧凍結(厚さ数百 μm)してガラス化できます。その後、クライオウルトラミクロトームでダイヤモンドナイフを使用して、-135 °C(失透温度)未満の温度で薄切片(厚さ 40~200 nm)に切断できます。この切片は電子顕微鏡グリッド上に集められ、薄膜でガラス化された試料と同じ方法で画像化されます。この技術は、ガラス体切片の透過型電子クライオ顕微鏡法(CEMOVIS)または凍結水和切片の透過型電子クライオ顕微鏡法と呼ばれます。
材料標本
クライオTEMは、ガラス化された生物試料の観察を可能にするだけでなく、真空中では揮発性が高すぎて標準的な室温電子顕微鏡では観察できない物質試料の観察にも使用できます。例えば、液体と固体の界面のガラス化された切片をクライオTEMで抽出して分析することができます[ 39 ]。また、電子顕微鏡の真空中で昇華しやすい硫黄は、クライオTEMで安定化させ、観察することができます[ 40 ] 。
クライオTEMにおける画像処理
電子顕微鏡法のほとんどのアプローチでは、物質の最高解像度の画像を取得しようとしますが、クライオTEMでは必ずしもそうではありません。高解像度画像の利点はありますが、信号対雑音比が各粒子の配向を決定する上で依然として大きな障害となっています。例えば、高分子複合体では、画像化中に3Dから2Dに投影される複数の異なる構造があり、それらを区別しないと画像処理の結果はぼやけてしまいます。そのため、この種の研究では確率的アプローチがより強力になります。[ 41 ]現在、クライオ電子顕微鏡の画像処理で広く使用されている2つの一般的なアプローチがあります。1998年に発見された最大尤度アプローチ[ 42 ]と、比較的最近採用されたベイズアプローチです。[ 43 ]
最尤推定法は統計学からこの分野に持ち込まれました。この方法では、粒子のあらゆる可能な方向を合計して、結果として得られる確率分布を得ます。これは、画像ごとに粒子の正確な方向が与えられる典型的な最小二乗推定法に似ています。[ 44 ]この方法では、サンプル内の粒子は計算後に「あいまいな」方向を取得し、対応する確率によって重み付けされます。このプロセス全体は反復的であり、反復するたびにモデルは改善されます。実際の構造をよりよく表すモデルを作成するための良好な条件は、データに過度のノイズがなく、粒子に特定の方向がないことです。最尤推定法の主な欠点は、結果が初期推定値に依存し、モデルの最適化が局所的最小値で行き詰まってしまう場合があることです。[ 45 ]
現在クライオTEMで使用されているベイズ法は、本質的に経験的な手法です。つまり、粒子の分布は元のデータセットに基づいています。同様に、通常のベイズ法では、データの観測後に変更される固定の事前確率があります。最大尤度推定との主な違いは、再構成時のノイズを低減しながら、得られたマップを滑らかにする特別な再構成項にあります。[ 44 ]マップの平滑化は、事前確率をガウス分布と仮定し、フーリエ空間でデータを解析することによって行われます。事前知識とデータセットとの関連性が確立されているため、人的要因によるエラーの可能性が低くなり、画像再構成の客観性が向上する可能性があります。[ 43 ]
クライオTEMイメージングおよび画像再構成の新しい手法の出現に伴い、プロセスの自動化を支援する新しいソフトウェアソリューションが登場しています。経験的ベイズ法がオープンソースのコンピュータプログラムRELION(REgularized LIkelihood OptimizatioN)に3D再構成用に実装されて以来、[ 46 ] [ 47 ]このプログラムはクライオTEM分野で広く普及しました。RELIONは、再構成画像の解像度を向上させる様々な補正機能を提供し、Python言語を用いた汎用的なスクリプトの実装を可能にし、2D/3Dモデル分類やde novoモデル作成といった一般的なタスクを実行します。[ 48 ] [ 49 ]
テクニック
CryoTEMでは様々な技術が使用可能である。[ 50 ]一般的な技術としては以下のようなものがある。
- 単粒子分析(SPA)
- 電子クライオトモグラフィー(クライオET)
- 電子結晶学
相関光クライオTEMとクライオET
2019年には、相関光クライオTEMとクライオETを用いて神経細胞内のトンネルナノチューブ(TNT)を観察した。[ 58 ]
走査型電子顕微鏡
走査型電子顕微鏡法(cryoSEM) は、極低温チャンバー内に走査型電子顕微鏡の冷却ステージを備えた 走査型電子顕微鏡法技術です。
極低温透過型電子顕微鏡
極低温透過型電子顕微鏡(クライオTEM)は、構造生物学および材料科学において用いられる透過型電子顕微鏡法の一種です。口語的には、「クライオ電子顕微鏡法」またはその短縮形である「クライオEM」という用語は、基本的に極低温透過型電子顕微鏡法を指します。これは、クライオEMの大部分が走査型電子顕微鏡ではなく透過型電子顕微鏡で行われるためです。

高度な方法
- クライオ電子トモグラフィー(クライオET)は、様々な傾斜角度で個々のサンプルの画像を多数撮影し、単一のサンプルの3D再構成を実現する特殊なアプリケーションです。[ 59 ]
- 電子結晶学、透過型電子顕微鏡(TEM)を用いて固体中の原子の配列を決定する方法
- マイクロED、[ 60 ] 3次元結晶からの電子回折を用いてタンパク質、ペプチド、有機分子、無機化合物の構造を決定する方法[ 61 ] [ 62 ] [ 63 ]
- 単粒子解析クライオ電子顕微鏡法は、単分散サンプルからタンパク質の構造を決定するための平均化法である。[ 64 ]
- アイアンマウンテンバイオフィルム由来の無傷のARMAN細胞のクライオ電子顕微鏡画像。画像幅は576 nm。
参照
参考文献
- ^ Tivol WF, Briegel A, Jensen GJ (2008年10月). 「プランジ凍結のための改良型極低温物質」 . Microscopy and Microanalysis . 14 (5): 375– 379. Bibcode : 2008MiMic..14..375T . doi : 10.1017/S1431927608080781 . PMC 3058946. PMID 18793481 .
- ^ Cheng Y, Grigorieff N, Penczek PA, Walz T (2015年4月). 「単粒子クライオ電子顕微鏡法の入門」 . Cell . 161 ( 3): 438– 449. doi : 10.1016/j.cell.2015.03.050 . PMC 4409659. PMID 25910204 .
- ^ Stoddart C (2022年3月1日). 「構造生物学:タンパク質はどのようにクローズアップされたか」 . Knowable Magazine . doi : 10.1146/knowable-022822-1 . S2CID 247206999. 2022年3月25日閲覧。
- ^ a b「2017年ノーベル化学賞」NobelPrize.org . 2022年9月30日閲覧。
- ^ Doerr A (2017年1月). 「クライオ電子トモグラフィー」. Nature Methods . 14 (1): 34. doi : 10.1038/nmeth.4115 . ISSN 1548-7091 . S2CID 27162203 .
- ^ Dubochet J, Knapek E (2018年4月). 「初期の電子クライオ顕微鏡法の浮き沈み」 . PLOS Biology . 16 (4) e2005550. doi : 10.1371/journal.pbio.2005550 . PMC 5929567. PMID 29672565 .
- ^ Venables JA (1963). 「電子顕微鏡用液体ヘリウム冷却傾斜ステージ」. Review of Scientific Instruments . 34 (5): 582– 583.
- ^ Knapek E, Dubochet J (1980年8月). 「クライオ電子顕微鏡法における有機材料へのビーム損傷の大幅な低減」. Journal of Molecular Biology . 141 (2): 147– 161. doi : 10.1016/0022-2836(80)90382-4 . PMID 7441748 .
- ^ Lepault, J.; Dubochet, J.; Dietrich, I.; Knapek, E.; Zeitler, E. (1983年1月). 「液体ヘリウム温度における有機試料への電子線損傷に関する修正」. Journal of Molecular Biology . 163 (3): 511. doi : 10.1016/0022-2836(83)90073-6 .
- ^ a b Newmark P (1982年9月30日). 「クライオ透過型顕微鏡:薄れゆく希望」 . Nature . 299 (5882): 386– 387. Bibcode : 1982Natur.299..386N . doi : 10.1038/299386c0 .
- ^ a b Dickerson, JL; Naydenova, K; Peet, MJ; Wilson, H; Nandy, B; McMullan, G; Morrison, R; Russo, CJ (2025年4月29日). 「液体ヘリウム温度を用いたクライオ電子顕微鏡における放射線損傷の影響の低減」 . Proceedings of the National Academy of Sciences of the United States of America . 122 (17) e2421538122. doi : 10.1073/pnas.2421538122 . PMC 12054821. PMID 40261934 .
- ^ Pfeil-Gardiner, Olivia; Mills, Deryck J.; Vonck, Janet; Kuehlbrandt, Werner (2019年11月1日). 「液体窒素および液体ヘリウム冷却を用いた単粒子クライオ電子顕微鏡の比較研究」 . IUCrJ . 6 (6): 1099–1105 . doi : 10.1107/S2052252519011503 . PMC 6830223 .
- ^ Dickerson, Joshua L; Russo, Christopher J (2025年7月25日). 「液体ヘリウム温度におけるクライオ電子顕微鏡の物理理論」. Microscopy and Microanalysis . 31 (Supplement_1). doi : 10.1093/mam/ozaf048.514 .
- ^ Dubochet J, McDowall AW (1981年12月). 「電子顕微鏡観察のための純水のガラス化」 . Journal of Microscopy . 124 (3): 3– 4. doi : 10.1111/j.1365-2818.1981.tb02483.x .
- ^ Adrian M, Dubochet J, Lepault J, McDowall AW (1984年3月). 「ウイルスのクライオ電子顕微鏡法」 . Nature . 308 ( 5954): 32– 36. Bibcode : 1984Natur.308...32A . doi : 10.1038/308032a0 . PMID 6322001. S2CID 4319199 .
- ^ Garman, Elspeth F.; Owen, Robin Leslie (2006-01-01). 「高分子結晶学におけるクライオクーリングと放射線損傷」 . Acta Crystallographica Section D 生物結晶学. 62 (1): 32– 47. doi : 10.1107/S0907444905034207 . ISSN 0907-4449 .
- ^ Callaway E (2015年9月). 「革命は結晶化しない:新しい手法が構造生物学を席巻」 . Nature . 525 (7568): 172–4 . Bibcode : 2015Natur.525..172C . doi : 10.1038/525172a . PMID 26354465 .
- ^ Murata K, Wolf M (2018年2月). 「クライオ電子顕微鏡法による動的生体高分子の構造解析」 . Biochimica et Biophysica Acta (BBA) - General Subjects . 1862 (2): 324– 334. doi : 10.1016/j.bbagen.2017.07.020 . PMID 28756276 .
- ^ Khoshouei M, Radjainia M, Baumeister W, Danev R (2017年6月). 「ボルタ位相板を用いて決定した3.2Åにおけるヘモグロビンのクライオ電子顕微鏡構造」. Nature Communications . 8 16099. Bibcode : 2017NatCo...816099K . doi : 10.1038/ncomms16099 . PMC 5497076. PMID 28665412 .
- ^メルク A、バルテサギ A、バナジー S、ファルコニエリ V、ラオ P、デイビス MI、プラガニ R、ボクサー MB、アール LA、ミルン JL、サブラマニアム S (2016 年 6 月)。「創薬を促進するためのクライオ EM 解像度の障壁を打ち破る」。セル。165 (7): 1698–1707。土井: 10.1016/j.cell.2016.05.040。PMC 4931924。PMID 27238019。
- ^ 「実験手法と分子型によるPDBデータ分布」 www.rcsb.org . 2019年12月3日閲覧。
- ^ 「PDB統計:年間に公開される3DEM実験構造の増加」 www.rcsb.org . 2018年12月22日閲覧。
- ^ a b Kühlbrandt, Werner (2014-03-28). 「解像度革命」 . Science . 343 (6178): 1443– 1444. Bibcode : 2014Sci...343.1443K . doi : 10.1126 /science.1251652 . ISSN 0036-8075 . PMID 24675944. S2CID 35524447 .
- ^ Kuster, Daniel J.; Liu, Chengyu; Fang, Zheng; Ponder, Jay W.; Marshall, Garland R. (2015-04-20). 「三中心水素結合と多重極静電気を考慮したタンパク質ヘリックスの高解像度結晶構造」 . PLOS ONE . 10 (4) e0123146. Bibcode : 2015PLoSO..1023146K . doi : 10.1371/journal.pone.0123146 . ISSN 1932-6203 . PMC 4403875. PMID 25894612 .
- ^ヘンダーソン、リチャード(1995年5月)「非染色生体分子の原子分解能顕微鏡観察における中性子、電子、X線の可能性と限界」『Quarterly Reviews of Biophysics』28 (2): 171–193 . doi : 10.1017/s003358350000305x .
- ^ Herzik, Mark A.; Wu, Mengyu; Lander, Gabriel C. (2019-03-04). 「従来のクライオ電子顕微鏡を用いた100 kDa未満の複合体の高解像度構造決定」 . Nature Communications . 10 (1): 1032. Bibcode : 2019NatCo..10.1032H . doi : 10.1038/ s41467-019-08991-8 . ISSN 2041-1723 . PMC 6399227. PMID 30833564 .
- ^ Wentinck, Koen; Gogou, Christos; Meijer, Dimphna H. (2022). 「分子量の付与:100kDa未満のタンパク質のクライオ電子顕微鏡による構造決定を可能にする」 . Current Research in Structural Biology . 4 : 332– 337. doi : 10.1016/j.crstbi.2022.09.005 . PMC 9562432 .
- ^ Gilman, Morgan SA; Skiba, Meredith A. (2025年8月15日). 「隠れた宝石がタンパク質を可視化する」Nature Chemical Biology . doi : 10.1038/s41589-025-01959-4 .
- ^
- Wu, Shenping; Avila-Sakar, Agustin; Kim, JungMin; Booth, David S.; Greenberg, Charles H.; Rossi, Andrea; Liao, Maofu; Li, Xueming; Alian, Akram; Griner, Sarah L.; Juge, Narinobu; Yu, Yadong; Mergel, Claudia M.; Chaparro-Riggers, Javier; Strop, Pavel; Tampé, Robert; Edwards, Robert H.; Stroud, Robert M.; Craik, Charles S.; Cheng, Yifan (2012年4月). 「Fabsによる低分子タンパク質の単粒子クライオ電子顕微鏡研究」 . Structure . 20 (4): 582– 592. doi : 10.1016/j.str.2012.02.017 . PMC 3322386 .Mukherjee, Somnath; Erramilli, Satchal K.; Ammirati, Mark; Alvarez, Frances JD; Fennell, Kimberly F.; Purdy, Michael D.; Skrobek, Blazej M.; Radziwon, Katarzyna; Coukos, John; Kang, Yanyong; Dutka, Przemysław; Gao, Xiang; Qiu, Xiayang; Yeager, Mark; Eric Xu, H.; Han, Seungil; Kossiakoff, Anthony A. (2020年3月27日). 「膜タンパク質の単粒子クライオ電子顕微鏡構造決定における普遍的な基準マークとしてのBRILに対する合成抗体」 . Nature Communications . 11 (1). doi : 10.1038/s41467-020-15363-0 . PMC 7101349 .Xie, Pujun; Li, Yan; Lamon, Gaëlle; Kuang, Huihui; Wang, Da-Neng; Traaseth, Nathaniel J. (2025年1月2日). 「クライオ電子顕微鏡(クライオEM)を用いた、複数の立体構造を持つ小型MFSトランスポーター構造の解像に適したフィデューシャル支援戦略」 . Nature Communications . 16 (1). doi : 10.1038/s41467-024-54986-5 . PMC 11695964 .Castells-Graells R, Meador K, Arbing MA, Sawaya MR, Gee M, Cascio D, et al. (2023年9月). 「剛性イメージングスキャフォールドを用いた3Å分解能での小型治療用タンパク質標的のクライオ電子顕微鏡構造決定」 . Proceedings of the National Academy of Sciences of the United States of America . 120 (37) e2305494120. Bibcode : 2023PNAS..12005494C . doi : 10.1073 / pnas.2305494120 . PMC 10500258. PMID 37669364 .Ackle, Fabian; Thavarasah, Sujani; Earp, Jennifer C.; Seeger, Markus A. (2025年3月19日). 「抗体断片を用いたシボディの剛体拡大法による小型膜タンパク質のクライオ電子顕微鏡解析」 . Scientific Reports . 15 (1). doi : 10.1038/s41598-025-92950-5 . PMC 11923154 .Wu, Xudong; Rapoport, Tom A. (2021年10月12日). 「ナノボディ結合スキャフォールド(レゴボディ)による低分子タンパク質のクライオ電子顕微鏡構造決定」 . Proceedings of the National Academy of Sciences . 118 (41). doi : 10.1073/pnas.2115001118 . PMC 8521671 .Yi, Gangshun; Mamalis, Dimitrios; Ye, Mingda; Carrique, Loic; Fairhead, Michael; Li, Huanyu; Duerr, Katharina L.; Zhang, Peijun; Sauer, David B.; von Delft, Frank; Davis, Benjamin G.; Gilbert, Robert JC (2025年8月15日). 「共有結合的に束縛された『Di-Gembodies』がクライオ電子顕微鏡による並列構造解析を可能にする」 Nature Chemical Biology . doi : 10.1038/s41589-025-01972-7 .Kung, Jennifer E.; Johnson, Matthew C.; Tegunov, Dimitry; Jao, Christine C.; Wu, Ping; Oh, Angela; Lin, May; Daria, Jose M.; Koth, Christopher M.; Arthur, Christopher P.; Rohou, Alexis; Sudhamsu, Jawahar (2025年9月30日). 「ジスルフィド結合型Fabが高解像度単粒子クライオ電子顕微鏡における標的サイズ制限を克服」 . Nature Communications . 16 (1). doi : 10.1038/s41467-025-63766-8 . PMC 12484979 .
- ^ Smyth MS, Martin JH (2000年2月). 「X線結晶構造解析」 .分子病理学. 53 (1): 8– 14. doi : 10.1136/mp.53.1.8 . PMC 1186895. PMID 10884915 .
- ^ a b Chiu, Wah; Schmid, Michael F.; Pintilie, Grigore D.; Lawson, Catherine L. (2021年1月). 「コミュニティ、PDB、EMDBによるクライオ電子顕微鏡構造とデータの標準化と普及の進化」 . Journal of Biological Chemistry . 296 100560. doi : 10.1016/j.jbc.2021.100560 . ISSN 0021-9258 . PMC 8050867. PMID 33744287 .
- ^ a b「Resolution - Proteopedia、3Dでの生活」proteopedia.org . 2020年10月27日閲覧。
- ^ Callaway E (2020年2月). 「革命的なクライオ電子顕微鏡法が構造生物学を席巻している」 . Nature . 578 (7794): 201. Bibcode : 2020Natur.578..201C . doi : 10.1038/d41586-020-00341-9 . PMID 32047310 .
- ^ Lyumkis, Dmitry (2019-03-29). 「クライオ電子顕微鏡を用いた単粒子解析における課題と機会」 . Journal of Biological Chemistry . 294 (13): 5181– 5197. doi : 10.1074/jbc.rev118.005602 . ISSN 0021-9258 . PMC 6442032. PMID 30804214 .
- ^ a b Nakane T, Kotecha A, Sente A, McMullan G, Masiulis S, Brown PM, et al. (2020年11月). 「原子分解能での単粒子クライオ電子顕微鏡観察」 . Nature . 587 ( 7832): 152– 156. Bibcode : 2020Natur.587..152N . doi : 10.1038/s41586-020-2829-0 . PMC 7611073. PMID 33087931 .
- ^ Wang HW, Wang JW (2017年1月). 「クライオ電子顕微鏡法とX線結晶構造解析はどのように相互補完するのか」 . Protein Science . 26 (1): 32– 39. doi : 10.1002/ pro.3022 . PMC 5192981. PMID 27543495 .
- ^ Schmidt A, Teeter M, Weckert E, Lamzin VS (2011年4月). 「0.48Å分解能における低分子タンパク質クランビンの結晶構造」 . Acta Crystallographica. セクションF, Structural Biology and Crystallization Communications . 67 (Pt 4): 424– 428. doi : 10.1107 /S1744309110052607 . PMC 3080141. PMID 21505232 .
- ^ Yip KM, Fischer N, Paknia E, Chari A, Stark H (2020年11月). 「クライオ電子顕微鏡による原子分解能タンパク質構造決定」. Nature . 587 (7832): 157– 161. Bibcode : 2020Natur.587..157Y . doi : 10.1038/ s41586-020-2833-4 . PMID 33087927. S2CID 224823207 .
- ^ Zachman MJ, Asenath-Smith E, Estroff LA, Kourkoutis LF (2016年12月). 「ラベルフリーのin situ局在化とクライオフォーカスイオンビームリフトアウトによる無傷固液界面の部位特異的調製」 . Microscopy and Microanalysis . 22 (6): 1338– 1349. Bibcode : 2016MiMic..22.1338Z . doi : 10.1017/S1431927616011892 . PMID 27869059 .
- ^ Levin BD, Zachman MJ, Werner JG, Sahore R, Nguyen KX, Han Y, Xie B, Ma L, Archer LA, Giannelis EP, Wiesner U, Kourkoutis LF, Muller DA (2017年2月). 「昇華アーティファクトのない電子顕微鏡法による硫黄およびナノ構造硫黄電池正極の特性評価」 . Microscopy and Microanalysis . 23 (1): 155– 162. Bibcode : 2017MiMic..23..155L . doi : 10.1017/S1431927617000058 . PMID 28228169. S2CID 6801783 .
- ^ Cheng, Yifan (2018-08-31). 「単粒子クライオ電子顕微鏡 ― これまでどのように到達し、今後どこへ向かうのか」 . Science . 361 ( 6405): 876– 880. Bibcode : 2018Sci...361..876C . doi : 10.1126/science.aat4346 . ISSN 0036-8075 . PMC 6460916. PMID 30166484 .
- ^ Sigworth, FJ (1998). 「単一粒子画像の精密化への最大尤度アプローチ」 . Journal of Structural Biology . 122 (3): 328– 339. doi : 10.1006/jsbi.1998.4014 . PMID 9774537 .
- ^ a b Scheres, Sjors HW (2012年1月). 「クライオ電子顕微鏡による構造決定におけるベイズ的視点」. Journal of Molecular Biology . 415 ( 2 ): 406– 418. doi : 10.1016/j.jmb.2011.11.010 . PMC 3314964. PMID 22100448 .
- ^ a b Nogales, Eva; Scheres, Sjors HW (2015年5月). 「クライオ電子顕微鏡:高分子の複雑性を可視化する独自のツール」 . Molecular Cell . 58 (4): 677– 689. doi : 10.1016 / j.molcel.2015.02.019 . ISSN 1097-2765 . PMC 4441764. PMID 26000851 .
- ^ Sigworth, Fred J. (2016-02-01). 「クライオ電子顕微鏡における単粒子画像処理の原理」 .顕微鏡学. 65 (1): 57– 67. doi : 10.1093/jmicro/dfv370 . ISSN 2050-5698 . PMC 4749045. PMID 26705325 .
- ^ Scheres, Sjors HW (2012-12-01). 「RELION: クライオ電子顕微鏡構造決定へのベイズアプローチの実装」 . Journal of Structural Biology . 180 (3): 519– 530. doi : 10.1016 / j.jsb.2012.09.006 . ISSN 1047-8477 . PMC 3690530. PMID 23000701 .
- ^ 「RELION:クライオ電子顕微鏡法用画像処理ソフトウェア」 . GitHub . 3dem. 2023年10月27日. 2023年10月27日閲覧。
- ^ Bai, Xiao-chen; McMullan, Greg; Scheres, Sjors HW (2015年1月). 「クライオ電子顕微鏡法は構造生物学にどのような革命をもたらすのか」. Trends in Biochemical Sciences . 40 (1): 49– 57. doi : 10.1016/j.tibs.2014.10.005 . ISSN 0968-0004 . PMID 25544475. S2CID 19727349 .
- ^ Zivanov, Jasenko; Nakane, Takanori; Forsberg, Björn O; Kimanius, Dari; Hagen, Wim JH; Lindahl, Erik; Scheres, Sjors HW (2018-11-09). Egelman, Edward H; Kuriyan, John (編). 「RELION-3における高解像度クライオ電子顕微鏡構造自動決定のための新ツール」. eLife . 7 e42166 . doi : 10.7554/eLife.42166 . ISSN 2050-084X . PMC 6250425. PMID 30412051 .
- ^クライオ電子顕微鏡法に関するプレゼンテーション | PharmaXChange.info
- ^ Fu Z, Kaledhonkar S, Borg A, Sun M, Chen B, Grassucci RA, Ehrenberg M, Frank J (2016年12月). 「時間分解クライオ電子顕微鏡法によるリボソームリサイクルの主要中間体の可視化」 . Structure . 24 (12): 2092– 2101. doi : 10.1016/j.str.2016.09.014 . PMC 5143168. PMID 27818103 .
- ^ Feng X, Fu Z, Kaledhonkar S, Jia Y, Shah B, Jin A, Liu Z, Sun M, Chen B, Grassucci RA, Ren Y, Jiang H, Frank J, Lin Q (2017年4月). 「高解像度単粒子クライオ電子顕微鏡のための高速かつ効果的なマイクロ流体スプレー・プランジング法」 . Structure . 25 ( 4): 663–670.e3. doi : 10.1016/j.str.2017.02.005 . PMC 5382802. PMID 28286002 .
- ^ Chen B, Kaledhonkar S, Sun M, Shen B, Lu Z, Barnard D, Lu TM, Gonzalez RL, Frank J (2015年6月). 「ミキシング・スプレー法による時間分解クライオ電子顕微鏡法によるリボソームサブユニット会合の構造ダイナミクスの解析」 . Structure . 23 (6): 1097–105 . doi : 10.1016/j.str.2015.04.007 . PMC 4456197. PMID 26004440 .
- ^ Shi D, Nannenga BL, Iadanza MG, Gonen T (2013年11月). 「タンパク質微結晶の3次元電子結晶構造解析」 . eLife . 2 e01345. doi : 10.7554/eLife.01345 . PMC 3831942. PMID 24252878 .
- ^ Nannenga BL, Shi D, Leslie AG, Gonen T (2014年9月). 「MicroEDにおける連続回転データ収集による高解像度構造決定」 . Nature Methods . 11 (9): 927– 930. doi : 10.1038/nmeth.3043 . PMC 4149488. PMID 25086503 .
- ^ Shi D、Nanenga BL、de la Cruz MJ、Liu J、Sawtelle S、Calero G、Reyes FE、Hattne J、Gonen T (2016 年 5 月)。「高分子結晶解析のためのMicroEDデータ集」。ネイチャープロトコル。11 (5): 895–904 .土井: 10.1038/nprot.2016.046。PMC 5357465。PMID 27077331。
- ^ de la Cruz MJ, Hattne J, Shi D, Seidler P, Rodriguez J, Reyes FE, Sawaya MR, Cascio D, Weiss SC, Kim SK, Hinck CS, Hinck AP, Calero G, Eisenberg D, Gonen T (2017年2月). 「クライオ電子顕微鏡法MicroEDによる断片化タンパク質結晶からの原子分解能構造」 . Nature Methods . 14 (4): 399– 402. doi : 10.1038/nmeth.4178 . PMC 5376236. PMID 28192420 .
- ^ Sartori-Rupp A, Cordero Cervantes D, Pepe A, Gousset K, Delage E, Corroyer-Dulmont S, et al. (2019年1月). 「相関クライオ電子顕微鏡法による神経細胞内のTNTの構造の解明」 . Nature Communications . 10 (1): 342. Bibcode : 2019NatCo..10..342S . doi : 10.1038/s41467-018-08178-7 . PMC 6341166. PMID 30664666 .
- ^ Bäuerlein, Felix JB; Baumeister, Wolfgang (2021-10-01). 「高解像度での視覚的プロテオミクスに向けて」 . Journal of Molecular Biology . タンパク質配列から構造へワープスピードで:アルファフォールドが生物学に与える影響. 433 (20) 167187. doi : 10.1016/j.jmb.2021.167187 . ISSN 0022-2836 . PMID 34384780 .
- ^ Nannenga BL, Shi D, Leslie AG, Gonen T (2014年9月). 「MicroEDにおける連続回転データ収集による高解像度構造決定」 . Nature Methods . 11 (9): 927– 930. doi : 10.1038/nmeth.3043 . PMC 4149488. PMID 25086503 .
- ^ Jones CG, Martynowycz MW, Hattne J, Fulton TJ, Stoltz BM, Rodriguez JA, et al. (2018年11月). 「CryoEM法MicroEDは小分子構造決定のための強力なツールである」 . ACS Central Science . 4 (11): 1587– 1592. doi : 10.1021/acscentsci.8b00760 . PMC 6276044. PMID 30555912 .
- ^ de la Cruz MJ, Hattne J, Shi D, Seidler P, Rodriguez J, Reyes FE, et al. (2017年2月). 「クライオ電子顕微鏡法MicroEDによる断片化タンパク質結晶からの原子分解能構造」. Nature Methods . 14 (4): 399– 402. doi : 10.1038/nmeth.4178 . PMC 5376236. PMID 28192420 .
- ^ Gruene T, Wennmacher JT, Zaubitzer C, Holstein JJ, Heidler J, Fecteau-Lefebvre A, et al. (2018年12月). 「電子回折法を用いた微結晶分子化合物の迅速構造決定」 . Angewandte Chemie . 57 (50): 16313– 16317. doi : 10.1002/anie.201811318 . PMC 6468266. PMID 30325568 .
- ^ Cheng Y (2018年8月). 「単粒子クライオ電子顕微鏡:どのようにしてここにたどり着き、そしてどこへ向かうのか」. Science . 361 ( 6405): 876– 880. Bibcode : 2018Sci...361..876C . doi : 10.1126/science.aat4346 . PMC 6460916. PMID 30166484 .
- ^ Xiao, C., Fischer, MG, Bolotaulo, DM, Ulloa-Rondeau, N., Avila, GA, and Suttle, CA (2017)「カフェテリア・ロンベルゲンシスウイルスカプシドのクライオ電子顕微鏡による再構成は、巨大ウイルスの新たな集合経路を示唆している」 Scientific Reports , 7 : 5484. doi : 10.1038/s41598-017-05824-w .

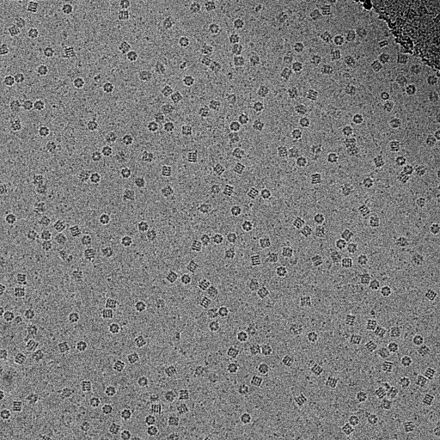

![CroV巨大海洋ウイルスのクライオ電子顕微鏡画像(スケールバーは200nmを表す)[65]](http://upload.wikimedia.org/wikipedia/commons/thumb/6/6e/CroV_TEM_(cropped).jpg/440px-CroV_TEM_(cropped).jpg)
