インフルエンザワクチン
 米海軍の乗組員にインフルエンザの予防接種が行われている | |
| ワクチンの説明 | |
|---|---|
| ターゲット | インフルエンザウイルス(季節性インフルエンザ:A/H1N1、A/H3N2、B/ビクトリア) |
| ワクチンの種類 | 不活化、弱毒化、組み換え |
| 臨床データ | |
| 商号 | アフルリア、フルアリックス、フルゾン、その他 |
| AHFS / Drugs.com | 不活性化:モノグラフ 鼻腔内:モノグラフ 組換え体:モノグラフ |
| 妊娠カテゴリー | |
| 投与経路 | 筋肉内、鼻腔内、皮内 |
| ATCコード | |
| 法的地位 | |
| 法的地位 | |
| 識別子 | |
| CAS番号 | |
| ケムスパイダー |
|
| ケッグ | |
インフルエンザワクチンは、通称インフルエンザ予防接種[ 28 ]またはインフルエンザジャブ[ 29 ]と呼ばれ、インフルエンザウイルスによる感染を予防するワクチンです。[ 30 ] [ 31 ]インフルエンザウイルスは急速に変化するため、ワクチンの新しいバージョンは年に2回開発されます。[ 30 ]ワクチンの有効性は年によって異なりますが、ほとんどのワクチンはインフルエンザに対して中程度から高い予防効果を提供します。[ 30 ] [ 32 ]インフルエンザのワクチン接種は1930年代に始まり、1945年から米国で大規模に利用可能になりました。[ 33 ] [ 34 ]
世界保健機関(WHO)と米国疾病予防管理センター(CDC)はともに、生後6か月以上のほぼすべての人、特に高リスクの人々に毎年のワクチン接種を推奨しており、[ 30 ] [ 35 ] [ 36 ] [ 37 ]インフルエンザワクチンは世界保健機関の必須医薬品リストに掲載されています。[ 38 ]欧州疾病予防管理センター(ECDC)も、高リスクグループ、特に妊婦、高齢者、生後6か月から5歳までの乳幼児、および特定の健康問題を抱えている人々に毎年のワクチン接種を推奨しています。[ 30 ] [ 37 ]
ワクチンは一般的に安全で、重度の卵アレルギーのある人にも安全です。[ 40 ]一般的な副作用は注射部位近くの痛みです。ワクチン接種を受けた子供の5〜10%に発熱が見られ、一時的な筋肉痛や倦怠感が起こることもあります。特定の年には、ワクチン接種により高齢者のギランバレー症候群が増加し、接種回数100万回につき約1人の割合でした。 [ 30 ]インフルエンザワクチンは、以前のバージョンのワクチン自体に重度のアレルギーがあった人には推奨されません。 [ 30 ] [ 40 ]ワクチンには不活性ウイルスと弱毒化ウイルスの形態があります。生の弱毒化ワクチンは一般的に妊婦、2歳未満の子供、50歳以上の成人、免疫力が低下している人には推奨されません。[ 30 ]ワクチンの種類によって、筋肉に注射(筋肉内)、鼻に噴霧(鼻腔内)、または皮膚の中間層に注射(皮内)することができます。[ 30 ]皮内ワクチンは、2018~2019年と2019~2020年のインフルエンザシーズンには入手できませんでした。[ 41 ] [ 42 ] [ 43 ]
歴史
ワクチンはヒトとヒト以外の動物の両方に使用されます。特に獣医用、家禽用、または家畜用と明記されていない限り、ヒト用ワクチンを指します。
起源と発展
1918年に世界的に発生したスペイン風邪の大流行の際、「薬剤師たちは、患者に瀉血を行う古来の治療法から酸素投与、新しいワクチンや血清(主にインフルエンザ菌と呼ばれる菌 (元々は病原菌と考えられていたことからこの名前がついた)と数種類の肺炎球菌に対するもの)の開発まで、知っている限りのこと、聞いたことのあることすべてを試した。唯一効果があった治療法は、回復した患者の血液を新たな感染者に輸血することだった。」[ 44 ]
1931年、ヴァンダービルト大学のアーネスト・ウィリアム・グッドパスチャーと同僚らは、発育鶏卵でのウイルス増殖を報告した。この研究は、トーマス・フランシス、ジョナス・ソーク、ウィルソン・スミス、マクファーレン・バーネットなど数名の研究者らによってインフルエンザウイルスの増殖にまで拡張され、初の実験的インフルエンザワクチンの開発につながった。[ 45 ] 1940年代、米軍は初めて認可されたインフルエンザ不活化ワクチンを開発し、第二次世界大戦中に使用された。[ 46 ]鶏卵はインフルエンザワクチンに使用されるウイルスの製造に引き続き使用されたが、製造業者は卵タンパク質を除去しワクチンの全身反応性を低減する改良プロセスを開発することにより、ウイルスの純度を向上させた。[ 47 ] 2012年に米国食品医薬品局(FDA)は細胞培養でウイルスを増殖させて作られたインフルエンザワクチンを承認し、[ 48 ] [ 49 ] [ 50 ]組み換えタンパク質から作られたインフルエンザワクチンは2013年に承認されました。[ 51 ]
受け入れ
インフルエンザワクチンを製造するための卵ベースの技術は、1950年代に開発された。[ 52 ] 1976年の米国での豚インフルエンザの恐怖では、ジェラルド・フォード大統領は豚インフルエンザのパンデミックが発生する可能性に直面した。ワクチン接種プログラムは急いで実施されたが、遅延や広報上の問題に悩まされた。一方、軍による最大限の封じ込め努力により、予想外にも、新型インフルエンザを発生源である唯一の陸軍基地に閉じ込めることに成功した。その基地では、兵士数名が重症化したが、死亡したのは1名のみだった。このプログラムは、人口の約24%がワクチン接種を受けた後に中止された。ワクチン接種プログラム自体が原因で、通常の年間レベルよりも25名多く死亡し、ギランバレー症候群により400名多く入院したと推定され、ワクチン自体にリスクがないわけではないことが示された。[ 53 ] 2010年の研究では、1976年に豚インフルエンザのワクチン接種を受けた研究参加者で、2009年のパンデミックH1N1に対する免疫反応が著しく強化されたことがわかりました。 [ 54 ] 2009年のH1N1豚インフルエンザの発生により、パンデミックインフルエンザワクチンが急速に承認されました。[ 55 ]パンデムリックスはその流行している株を標的とするようにすぐに改良され、2010年後半までに7000万人が接種を受けました。[ 56 ] 8年後、英国医学雑誌(BMJ)は、パンデミック中にグラクソ・スミスクライン社がまとめた初期のワクチン薬物安全性報告書を入手し、BMJは、パンデムリックスでは他のパンデミックワクチンと比較して死亡する可能性が5.39倍高いことを報告しました。[ 55 ] [ 56 ]しかし、その後のより徹底的かつ堅牢な分析では、ナルコレプシーというまれな例外を除いて、死亡率の増加やその他の深刻な悪影響はほとんど確認されませんでした。[ 57 ]
四価ワクチン

2012年3月にFDAによって鼻腔噴霧投与される4価インフルエンザワクチンが承認された。[ 58 ] [ 59 ] Fluarix Quadrivalentは2012年12月にFDAによって承認された。[ 60 ]
2014年にカナダ国立予防接種諮問委員会(NACI)は4価インフルエンザワクチンのレビューを発表しました。[ 61 ]
2018~2019年のインフルエンザシーズンから、米国では通常用量の卵ベースのインフルエンザワクチンのほとんどと、すべての組み換えおよび細胞培養インフルエンザワクチンが4価です。[ 62 ] 2019~2020年のインフルエンザシーズンでは、米国では通常用量のインフルエンザワクチンとすべての組み換えインフルエンザワクチンが4価です。[ 63 ]
2019年11月、FDAは、2020~2021年のインフルエンザシーズンから米国での使用をFluzone High-Dose Quadrivalent(高用量四価)に承認しました。[ 64 ] [ 65 ]
2020年2月、FDAは米国でFluad Quadrivalentの使用を承認しました。[ 66 ] [ 67 ] 2020年7月、FDAは2020~2021年のインフルエンザシーズンに向けて、FluadとFluad Quadrivalentの両方を米国での使用を承認しました。[ 66 ] [ 68 ]
四価ワクチンの対象となる4つの系統の1つであるインフルエンザBのB/山形系統は、COVID-19パンデミック対策により2020/2021年に絶滅した可能性があり、[ 69 ] 2020年3月以降、自然発生的な症例は確認されていない。[ 70 ] [ 71 ] 2023年、世界保健機関は、季節性インフルエンザワクチンでは山形系統に対する防御は不要であると結論付けたため、将来のワクチンは四価ではなく三価にすることが推奨されている。[ 70 ] [ 71 ] 2024~2025年の北半球インフルエンザシーズンに向けて、FDAはすべてのインフルエンザワクチンからB/山形を除去することを推奨している。[ 72 ]
医療用途
インフルエンザワクチンは、ワクチンに含まれるインフルエンザウイルスA型およびB型サブタイプによって引き起こされるインフルエンザ疾患の予防のための能動免疫に適応されます。 [ 17 ] [ 14 ] 米国疾病予防管理センター(CDC)は、インフルエンザから人々を守り、その蔓延を防ぐ最善の方法としてインフルエンザワクチンを推奨しています。[ 73 ]インフルエンザワクチンは、ワクチンに含まれていない株に感染した場合のインフルエンザの重症度を軽減することもできます。[ 73 ]ワクチン接種後、防御抗体が形成されるまでには約2週間かかります。[ 73 ] [ 74 ]
2012年のメタアナリシスでは、インフルエンザワクチン接種は67 %の確率で効果があったことが判明しました。最も効果があったのは、18歳から55歳までのHIV陽性成人(76 %)、18歳から46歳までの健康な成人(約70 %)、生後6ヶ月から24ヶ月までの健康な小児(66 %)でした。[ 75 ]インフルエンザワクチンは心筋梗塞の予防にも効果があり、その効果は15~45%とされています。[ 76 ]
効果
| 2004 | 10% |
|---|---|
| 2005 | 21% |
| 2006 | 52% |
| 2007 | 37% |
| 2008 | 41% |
| 2009 | 56% |
| 2010 | 60% |
| 2011 | 47% |
| 2012 | 49% |
| 2013 | 52% |
| 2014 | 19% |
| 2015 | 48% |
| 2016 | 40% |
| 2017 | 38% |
| 2018 | 29% |
| 2019 | 39% |
| 2020 | 未知 |
| 2021 | 36% |
| 2022 | 30% |
| 2023 | 44% |
| 2024 | 56% |
ワクチンは、その有効性(管理された条件下での疾患のリスクをどの程度低減するか)と有効性(ワクチン使用後に観察されるリスクの低減)によって評価される。[ 80 ]インフルエンザの場合、有効性はインフルエンザ様疾患の発生率を使用して測定されるため(インフルエンザ様疾患は必ずしもインフルエンザによって引き起こされるわけではない)、有効性は有効性よりも低くなると予想される。[ 81 ]現実の世界では、インフルエンザワクチンの有効性の研究は困難である。ワクチンが完全に適合しない場合があり、ウイルスの蔓延は年によって大きく異なり、インフルエンザは他のインフルエンザ様疾患と混同されることが多い。[ 82 ]しかし、ほとんどの年(2007年以前の19年間のうち16年間)では、インフルエンザワクチンの株は流行している株とよく適合しており、[ 83 ]不適合のワクチンでも交差防御を提供できる場合が多い。[ 73 ]ウイルスは抗原ドリフトにより急速に変化し、ウイルスにわずかな突然変異が起こり、新しい株が出現する。[ 84 ]
季節性インフルエンザワクチンの有効性は大きく異なり、症状のある疾患に対する平均有効性は40~60%と推定されていますが[ 85 ]、ワクチン株、年齢、以前の免疫、免疫機能によって異なります。そのため、ワクチン接種を受けた人でもインフルエンザに罹患する可能性があります。[ 86 ] [ 77 ]インフルエンザワクチンの有効性は、特に高齢者では最適ではないと考えられていますが[ 87 ]、ワクチン接種はインフルエンザによる死亡率と入院率、入院期間を短縮するのに依然として有益です。[ 86 ] [ 88 ]学齢期の子供へのワクチン接種は、他の年齢層にも間接的な保護を提供することが示されています。LAIVは、特に6歳未満の子供に対する優れた有効性と、不活化ワクチンと比較して非ワクチン株に対する免疫力が高いことに基づいて、子供に推奨されています。[ 89 ] [ 90 ]
ニュージーランドでは2012年から2015年にかけて、集中治療室への入院に対するワクチンの有効性は82%でした。[ 91 ] 2019~2020年の米国のインフルエンザシーズンにおけるインフルエンザによる入院に対する有効性は、全体で41%、65歳以上の人では54%でした。[ 92 ]あるレビューでは、成人の死亡に対する有効性は31%であることがわかりました。[ 93 ] [ 94 ]
毎年のインフルエンザワクチン接種を繰り返すと、一般的に毎年一貫したインフルエンザ予防効果が得られます。[ 94 ]しかし、特定のインフルエンザ亜型に対するワクチンの有効性は、繰り返し接種によって低下する可能性があることを示唆する証拠があり、これは免疫インプリンティング(免疫系が以前のインフルエンザへの曝露からの反応を優先的に思い出す現象)に関連している可能性があります。[ 95 ] [ 96 ] [ 97 ] [ 98 ] 2019年現在、CDCは、ほとんどの研究で毎年のインフルエンザワクチン接種の全体的な有効性が実証されているため、毎年のワクチン接種を推奨しています。[ 94 ]
インフルエンザワクチンの種類によって有効性に有意な差があることを証明するには十分な証拠はないが[ 99 ]、高齢者においてより強い免疫反応を誘発する高用量ワクチンやアジュバント添加ワクチンが存在する[ 100 ] 。
ニューサウスウェールズ大学の教員による2016年の研究によると、インフルエンザの予防接種は、心臓発作の予防に禁煙と同等かそれ以上の効果があるという。[ 101 ]
2024年のCDCの研究では、2024年のインフルエンザワクチンにより、南半球におけるインフルエンザによる入院リスクが35%減少したことが判明しました。[ 102 ]アルゼンチン、ブラジル、チリ、パラグアイ、ウルグアイの5カ国で実施されたこの研究では、ワクチンの効果は前シーズンに使用されたものよりも低いことが示されました。[ 103 ]
子供たち
2002年4月、米国予防接種実施諮問委員会(ACIP)は、生後6ヶ月から23ヶ月までのすべての子供に毎年インフルエンザの予防接種を受けることを推奨しました。[ 104 ] 2010年に、ACIPは再び生後6ヶ月以上の子供に毎年のインフルエンザ予防接種を受けることを推奨しました。[ 104 ] CDCも、生後6ヶ月未満の乳児を除くすべての人に季節性インフルエンザワクチンの接種を推奨しています。[ 35 ]
ワクチン接種キャンペーンでは通常、妊婦、5歳未満の子供、高齢者、慢性疾患や免疫力の低下を患っている人など、インフルエンザに罹患すると重篤な合併症を起こすリスクが高い人々や、医療従事者など、これらの人々に接触する可能性のある人々に特別な注意が向けられます。[ 35 ] [ 105 ]
6ヶ月未満の乳児は、年齢の高い小児に比べてインフルエンザ合併症の相対的リスクが高いため、CDCとWHOは、乳児へのインフルエンザ感染リスクを減らすために、乳児の家庭内接触者や保護者にワクチン接種を受けることを推奨しています。[ 105 ] [ 106 ]
健康な子供においても、ワクチン接種はインフルエンザやインフルエンザ様疾患のリスクを低下させる可能性がある。[ 107 ] 2017~2018年のインフルエンザシーズン中、CDCは死亡した子供の85%が「ワクチン接種を受けていなかった可能性が高い」と指摘した。[ 108 ] 2歳未満の子供については、2018年時点でのデータは限られていた。[ 107 ]
米国では、2019年1月時点で、CDCは6ヶ月から35ヶ月の小児にはFluzone Quadrivalentの1回投与あたり0.25ミリリットルまたは0.5 ミリリットルのいずれかを投与することを推奨しています。[ 63 ] [ 109 ]この年齢層では、Fluzone Quadrivalentの投与量のどちらか一方に優先順位はありません。[ 63 ] 3歳以上のすべての人は、Fluzone Quadrivalentの1回投与あたり0.5ミリリットルを投与する必要があります。[ 63 ] 2018年10月時点で、Afluria Quadrivalentは米国で6ヶ月以上の小児に対して承認されています。[ 63 ] [ 110 ] 6ヶ月から35ヶ月の小児には、Afluria Quadrivalentの1回投与あたり0.25ミリリットルを投与する必要があります。[ 63 ] 36ヶ月以上のすべての人は、 1回あたり0.5ミリリットルのアフルリアクアドリバレントを接種する必要があります。[ 63 ]以前にインフルエンザワクチン接種を受けていない、またはインフルエンザワクチン接種歴が不明な場合は、4週間間隔で2回接種することが推奨されます。[ 63 ]
2018年2月現在、カナダではアフルリア・テトラは成人および5歳以上の子供にのみ認可されている。[ 111 ]
2014年、カナダ国立予防接種諮問委員会(NACI)は、5~18歳の健康な小児におけるインフルエンザワクチン接種のレビューを発表しました[ 112 ]。また、2015年には、6~72ヶ月齢の小児における小児用フルアドの使用に関するレビューを発表しました[ 113 ] 。三次医療機関で実施されたある研究では、小児におけるインフルエンザワクチン接種率はわずか31%でした。免疫抑制状態の小児(46%)と炎症性腸疾患の小児(50%)では、より高い接種率が見られました[ 114 ] 。
大人
.jpg/440px-Navy_flu_shot_(50494239776).jpg)
ワクチン接種を受けていない成人では16%がインフルエンザに似た症状を示すのに対し、ワクチン接種を受けた成人では約10%にしか現れません。[ 81 ]ワクチン接種により、インフルエンザの確定症例は約2.4%から1.1%に減少しました。[ 81 ]入院への影響は認められませんでした。[ 81 ]
1997年から2023年までのインフルエンザ研究を統合的に解析したところ、約3分の2の人がワクチン接種後1ヶ月で50%の防御に必要な抗体反応を達成しており、そのうち半数はワクチン接種前から既にこの強力な抗体反応を示していたが、残りの半数はワクチン接種後に初めてこの反応に達したことが示された。[ 115 ]つまり、この集団の3分の1はワクチン接種前に防御され、3分の1はワクチン接種によって防御され、残りの3分の1はワクチン接種後も弱い抗体反応を示していた。このようなばらつきにもかかわらず、複数のインフルエンザ変異株に対するワクチン接種前の抗体反応は、ワクチン接種後の反応を予測することができた。[ 115 ]
コクラン共同体による調査では、働く成人において、ワクチン接種によりインフルエンザの症状と労働日数の減少がわずかに改善したが、感染やインフルエンザ関連の合併症には影響がなかったことが明らかになった。[ 81 ]健康な働く成人では、インフルエンザワクチンはウイルス学的に確認されたインフルエンザに対して中程度の予防効果をもたらすが、季節によってはその効果が大幅に低下したり、全く効果がなかったりする。[ 116 ]
医療従事者では、2006年のレビューで純利益が認められた。[ 117 ]このレビューの18の研究のうち、スタッフのインフルエンザワクチン接種率と患者死亡率の関係も評価したのは2つだけで、どちらの研究でも、医療従事者のワクチン接種率が高いほど患者の死亡率が減少することが分かった。[ 117 ] 2014年のレビューでは、医療従事者が予防接種を受けると患者に利益があることが判明した。これは、医療従事者が予防接種を受けた患者の全死亡率が、ワクチン接種を受けなかった患者と比較して減少したことなどに基づく中程度の証拠[118]によって裏付けられている。[ 119 ]
お年寄り
65歳以上の成人における効果の証拠は不明である。[ 120 ]ランダム化比較研究と症例対照研究の両方を検証した系統的レビューでは、高品質の証拠が不足していることが判明した。[ 116 ] [ 121 ]症例対照研究のレビューでは、地域在住の高齢者において、検査で確認されたインフルエンザ、肺炎、および死亡に対する効果が認められた。 [ 122 ] [ 123 ]
パンデミック以外のインフルエンザに最も脆弱なグループである高齢者は、ワクチンの恩恵が最も少ない。ワクチンの有効性が急激に低下する理由は複数あるが、最も一般的なのは、免疫機能の低下と加齢に伴う虚弱性である。[ 124 ]パンデミックが発生していない年には、米国では50~64歳の人がインフルエンザ関連で死亡する可能性は若年層に比べて約10倍高く、65歳以上の人がインフルエンザ関連で死亡する可能性は50~64歳の年齢層に比べて10倍以上高い。[ 125 ]
より強い免疫反応をもたらすように特別に配合された高用量インフルエンザワクチンがあります。[ 126 ]入手可能な証拠によると、高齢者に高用量ワクチンを接種すると、通常用量ワクチンよりもインフルエンザに対する免疫反応が強くなることが示されています。[ 127 ] [ 128 ] [ 129 ]
アジュバントを含むインフルエンザワクチンは、 2015年11月に米国食品医薬品局(FDA)により、65歳以上の成人を対象に承認されました。このワクチンは米国ではFluadという商品名で販売されており、2016~2017年のインフルエンザシーズンに初めて利用可能になりました。このワクチンには、スクアレン油の水中油型エマルジョンであるMF59C.1アジュバント[ 130 ]が含まれています。これは、米国で販売された最初のアジュバント添加季節性インフルエンザワクチンです。[ 131 ] [ 132 ] [ 133 ] MF59C.1アジュバントを含むインフルエンザワクチンを高齢者が使用することで有意な利益があるかどうかは明らかではありません。[ 134 ] [ 135 ] [ 136 ]予防接種実施諮問委員会のガイドラインによれば、Fluadは65歳以上の人に承認されている他のインフルエンザワクチンの代替として使用することができます。[ 132 ]
多くの国では、高齢者と関わる医療従事者へのワクチン接種が推奨されており、この脆弱な集団におけるインフルエンザの流行を減らすことを目指している。[ 137 ] [ 138 ] [ 139 ]ランダム化臨床試験では、医療従事者へのワクチン接種が高齢者をインフルエンザから守るのに役立つという決定的な証拠はないが、有益性を示す暫定的な証拠はある。[ 140 ]
Fluad Quadは2019年9月にオーストラリアで使用が承認され、[ 141 ] Fluad Quadrivalentは2020年2月に米国で使用が承認され、[ 66 ] Fluad Tetraは2020年5月に欧州連合で使用が承認されました。[ 142 ] [ 143 ]
妊娠
妊婦の予防接種は、インフルエンザ感染の影響から母子を守るだけでなく、妊娠を満期まで継続できる可能性を高める傾向があります。[ 144 ]
三価不活化インフルエンザワクチンは、 HIVに感染した妊婦に対して予防効果があります。[ 145 ]
安全性
副作用
ワクチン接種の一般的な副作用には、注射部位の局所反応と風邪のような症状があります。発熱、倦怠感、筋肉痛はそれほど一般的ではありません。インフルエンザワクチンは、インフルエンザワクチンまたはワクチンの成分に反応して重度のアレルギー反応を経験した人には禁忌です。LAIVは、ライ症候群を発症するリスクがあるため、重度の免疫不全の子供や若者、またはサリチル酸塩治療を受けている人には投与されません。[ 89 ] LAIVは2歳未満の子供、 [ 90 ]妊婦、および免疫抑制状態の成人にも推奨されません。不活化インフルエンザワクチンはインフルエンザを引き起こすことはなく、妊娠中でも安全であると考えられています。[ 89 ]
インフルエンザワクチンの副作用が起こる可能性はありますが、通常は軽微で、注射部位の痛み、発赤、腫れ、頭痛、発熱、吐き気、倦怠感などが含まれます。[ 146 ]鼻腔スプレーワクチンの副作用には、鼻水、喘鳴、喉の痛み、咳、嘔吐などがあります。[ 147 ]
インフルエンザワクチン接種は、アレルギー反応などの重篤な副作用を引き起こす場合もありますが、これはまれです。さらに、一般的な副作用やリスクは、毎年のインフルエンザ流行のリスクや深刻な健康影響と比較すると、軽度で一時的なものです。[ 73 ]
よくある誤解とは異なり、インフルエンザの予防接種を受けてもインフルエンザに罹ることはありません。[ 148 ] [ 149 ]
ギラン・バレー症候群
ギランバレー症候群はワクチン接種の合併症として懸念されてきたが、CDCは、現代のインフルエンザワクチンに関する研究のほとんどでギランバレー症候群との関連は見られなかったと述べている。[ 150 ] [ 151 ]インフルエンザウイルス自体の感染は、死亡リスク(最大1万人に1人)とギランバレー症候群を発症するリスクを、ワクチンの関与が疑われる最高レベル(2009年の推定では約10倍)よりもはるかに高く増加させる。[ 152 ] [ 153 ]
ある調査ではギランバレー症候群の発生率はワクチン接種100万回につき約1例とされているが[ 154 ]、2009年のH1N1型「豚」インフルエンザに対するワクチン接種を1億回近く行った中国での大規模研究では、ギランバレー症候群の症例はわずか11例(100万回あたり0.1例)で、ワクチン接種を受けた人全体の発生率は中国における通常の発生率よりも低く、その他の注目すべき副作用は認められなかった[ 153 ] [ 155 ] 。
卵アレルギー
.jpg/440px-Ampliação_e_Modernização_da_Fábrica_de_Vacina_(40225018103).jpg)
ほとんどのインフルエンザワクチンは卵を原料とする技術で製造されているが、卵アレルギーを持つ人にとっても、たとえ重度であってもインフルエンザワクチンは安全であると推奨されている。 [ 40 ]卵アレルギーを持つ人にとって、卵を原料とするワクチンに対するアレルギー反応のリスク増加は示されていない。[ 156 ]重度の卵アレルギーを持つ人に対するインフルエンザワクチンの安全性を調べた研究では、アナフィラキシーは非常にまれであり、100万回接種あたり1.3件発生することが判明した。 [ 40 ]
症状が重篤な患者には、ワクチン接種による症状のモニタリングが推奨されます。[ 157 ]卵アレルギーのある約800人の子供(過去にアナフィラキシー反応を経験したことのある250人以上を含む)を対象とした研究では、生弱毒化インフルエンザワクチンを投与されたときに全身性アレルギー反応はゼロでした。[ 158 ] [ 159 ]
他の技術を用いて製造されたワクチン、特に組換えワクチンや卵タンパク質ではなく細胞培養に基づくワクチンは、2012年に米国で利用可能になり始め、[ 160 ]、その後ヨーロッパ[ 161 ]とオーストラリアでも利用可能になりました。[ 156 ]
他の
いくつかの研究では、パンデミックH1N1インフルエンザAS03アジュバントワクチンの接種者でナルコレプシーの発症率が上昇していることが明らかになっている。[ 162 ]このメカニズムを特定する取り組みでは、ナルコレプシーは自己免疫性であり、AS03アジュバントH1N1ワクチンがヒポクレチンを模倣して引き金となる可能性があることが示唆されている。[ 163 ]
米国の成人向けの注射用インフルエンザワクチンの中には、水銀ベースの防腐剤であるチオマーサール(チメロサールとも呼ばれる)が含まれているものがあります。[ 164 ] [ 165 ]メディアで多少の論争があったにもかかわらず、 [ 166 ]世界保健機関のワクチン安全性に関する世界諮問委員会は、ワクチン中のチオマーサールの毒性の証拠はなく、安全性の観点から、より高価な単回投与に変更する理由はないと結論付けています。[ 167 ]
インフルエンザワクチン接種前に運動することは有害ではないと考えられていますが、有益な効果があるという証拠もありません。[ 168 ]
種類
季節性インフルエンザワクチンは次のいずれかの方法で入手できます。
- 不活化ウイルスを含む注射剤。通常は筋肉内注射ですが、皮下注射や皮内注射でも予防効果が得られます。[ 169 ]
- 生きた弱毒化インフルエンザウイルスを含む、弱毒化生インフルエンザワクチンの鼻腔スプレー。
季節性インフルエンザワクチンは、A/H1N1、A/H3N2、B/ビクトリア系統のそれぞれから少なくとも1つのウイルスを標的とします。使用される特定の株は、翌シーズンのインフルエンザの流行期に優勢となる株の年間予測に基づいています(下記「年間の処方変更」の項を参照)。3価ワクチンはこれらの3系統のみを標的とし、4価ワクチンはB/ヤマガタ系統も標的とします。B/ヤマガタ系統は、COVID-19パンデミック対策により2020/2021年に絶滅した可能性があり[ 69 ]、2023年以降はWHOの推奨には含まれていません[ 70 ]。
注射ワクチンは不活化ウイルス上に存在する抗原に対する免疫反応に基づいて防御を誘発しますが、鼻スプレーは鼻腔内での短期的な感染を確立することによって機能します。[ 170 ]
H5N1およびH5N8を含む非季節性インフルエンザのワクチンはヒト用に承認されています。下記の「パンデミックインフルエンザへの迅速な対応」の項をご覧ください。
毎年の処方変更
世界保健機関(WHO)の世界インフルエンザ監視・対応システム( GIS)は、毎年、翌年の季節性インフルエンザワクチン接種に3種類のインフルエンザ株を選定しています。 [ 171 ]三価ワクチンの推奨は、インフルエンザA型2株(A/H1N1とA/H3N2がそれぞれ1株)とインフルエンザB型1株(B/ビクトリア)で構成され、これらは合わせて、翌シーズンに深刻な人的被害を引き起こす可能性が最も高いと考えられる株です。WHOは2012年から、4価ワクチンにインフルエンザB型2株(B/山形)の使用も推奨していましたが、これは2024年に廃止されました。[ 172 ]
- WHO世界インフルエンザサーベイランスネットワークは1952年に設立されました(2011年に「世界インフルエンザサーベイランス・アンド・レスポンスシステム」に改称)。[ 173 ]このネットワークは、4つのWHO協力センター(WHO CC)と、WHOによってWHO国立インフルエンザセンター(NIC)として認定されている83カ国112の機関で構成されています。これらのNICは、自国で検体を採取し、一次ウイルス分離と予備的な抗原性評価を実施します。新たに分離された株は、高度な抗原性および遺伝子分析のためにWHO CCに送られ、その結果は毎年、南北半球向けのインフルエンザワクチンの組成に関するWHOの勧告の基礎となります。[ 174 ]
WHOの正式な勧告は1973年に初めて発行されました。1999年以降は、北半球と南半球のそれぞれについて、毎年2つの勧告が発行されています。[ 175 ]
COVID-19パンデミックの初期に非医薬品介入(ロックダウン)が広く実施されたため、B/山形インフルエンザ系統は2020年3月以降分離されておらず、根絶された可能性があります。WHOおよびその他の規制当局は、2024年の南半球インフルエンザシーズンから、B/山形をインフルエンザワクチンの推奨対象から除外しました。[ 172 ] [ 72 ] [ 176 ]
推奨事項
世界保健機関(WHO)を含むさまざまな公衆衛生機関は、特にインフルエンザの合併症のリスクがある人や、次のような高リスクの人と同居している人、またはその人を介護している人に対して、毎年のインフルエンザ予防接種を定期的に受けることを推奨しています。
- 50歳以上の人々[ 37 ]
- 喘息を含む慢性肺疾患の患者[ 37 ]
- 慢性心疾患のある人[ 37 ]
- 慢性肝疾患患者[ 37 ]
- 慢性腎臓病患者[ 37 ]
- 脾臓を摘出した人、または脾臓が正常に機能していない人
- 免疫不全の人[ 37 ]
- 老人ホームやその他の長期ケア施設の入居者[ 37 ]
- 医療従事者(病気の予防と患者への感染拡大の予防の両方)[ 177 ] [ 178 ]
- インフルエンザ流行期に妊娠している、または妊娠する予定の女性[ 37 ]
- アスピリンまたはサリチル酸塩を含む薬剤を服用しており、インフルエンザウイルス感染後にライ症候群を発症するリスクがある可能性のある小児および青年(6ヶ月から18歳)[ 37 ]
- アメリカインディアン/アラスカ先住民[ 37 ]
- 極度の肥満の人(成人の場合、BMIが40以上)[ 37 ]
インフルエンザワクチンは、生後6ヶ月未満の乳幼児や、インフルエンザワクチンもしくはワクチンの成分に対して重篤な生命に関わるアレルギーのある人には禁忌です。[ 35 ] [ 179 ] [ 40 ]
世界保健機関
2016年現在、世界保健機関(WHO)は、以下の人々に季節性インフルエンザワクチン接種を推奨しています。[ 180 ] [ 181 ] [ 182 ] [ 183 ] [ 184 ]
最優先事項:
- 妊婦
2番目の優先順位(順不同):
- 6~59ヶ月のお子様
- お年寄り
- 特定の慢性疾患を持つ個人
- 医療従事者
カナダ
カナダ公衆衛生局に助言する団体である国家予防接種諮問委員会(NACI)は、生後6ヶ月以上のすべての人に毎年インフルエンザワクチン接種を受けることを奨励し、生後6ヶ月から24ヶ月の乳幼児とその家庭内の接触者はインフルエンザワクチン接種の優先順位を高くすべきであると推奨している。[ 185 ] 特に:
- インフルエンザ関連の合併症や入院のリスクが高い人、病的肥満の人、健康な妊婦、6~59ヶ月の子供、高齢者、先住民、慢性疾患の項目別リストのいずれかに該当する人
- 家庭内接触者や医療従事者など、高リスク者にインフルエンザを感染させる可能性のある人々
- 不可欠なコミュニティサービスを提供する人々
- 特定の養鶏労働者
カナダでは2019~2020年シーズンに生弱毒化インフルエンザワクチン(LAIV)は入手できませんでした。[ 185 ]
欧州連合
欧州疾病予防管理センター(ECDC)は、高齢者へのワクチン接種を優先し、次に慢性疾患のある人や医療従事者へのワクチン接種を推奨している。[ 186 ]
インフルエンザワクチン接種戦略は、一般的に、インフルエンザの流行を抑制したり、ヒトのインフルエンザ罹患を根絶したりすることよりも、脆弱な人々を保護することに重点が置かれています。これは、ポリオや麻疹といった他の感染症における高い集団免疫戦略とは対照的です。[ 187 ]これは、毎年の接種に伴う財政的および物流上の負担も一因となっています。[ 188 ]
イギリス
英国の国民保健サービスでは、以下の人々にインフルエンザ予防接種を提供してい ます。
- 65歳以上の人々
- 特定の長期的な健康状態を抱えている人々
- 妊娠している人
- 介護施設に住む人々
- 高齢者や障害者の主な介護者、または介護手当を受給している人
- 免疫力が弱っている人と暮らしている人。[ 189 ]
これらのグループに該当する人は、無料でワクチン接種を受けることができます。18歳から65歳までのこれらのグループ以外の人も、薬局や一部の私立診療所で少額の料金で民間のインフルエンザワクチン接種を受けることができます。[ 190 ]
アメリカ合衆国

アメリカ合衆国では、生後6か月以上のすべての人に定期的なインフルエンザ予防接種が推奨されています。[ 191 ] [ 37 ] [ 192 ]十分な抗体が体内で生成されるまでには、予防接種後最大2週間かかります。[ 192 ] CDCは10月末までに予防接種を推奨していますが、 [ 37 ] 12月以降にワクチン接種を受けても有益であると考えています。[ 37 ] [ 73 ] [ 192 ]米軍も現役および予備役軍人に毎年インフルエンザの予防接種を義務付けています。[ 193 ]
CDCによると、生弱毒化ウイルス(LAIV4)(米国では鼻腔スプレーの形で入手可能)は一部のグループでは避けるべきである。[ 37 ] [ 194 ]
1981年に医療従事者に対してインフルエンザワクチンの推奨を開始した米国CDCは、一般のワクチン接種に関する包括的な推奨の中で、特定の脆弱なグループのメンバーとその介護者に対するワクチン接種の特別な緊急性を臨床医に強調しています。
- ワクチン接種は、重篤なインフルエンザ合併症のリスクが高い人や、重篤な合併症のリスクが高い人と同居している人、またはその人を介護している人にとっては特に重要です。[ 195 ] 2009年には、標準的なインフルエンザワクチンの新しい高用量製剤が承認されました。[ 196 ] Fluzone High Doseは特に65歳以上の人々を対象としており、標準的なFluzoneの4倍の抗原量が含まれているという違いがあります。[ 197 ] [ 198 ] [ 199 ] [ 200 ]
米国政府は病院に対し、従業員のワクチン接種率の報告を義務付けています。一部の州と数百の病院では、インフルエンザ流行期に医療従事者にワクチン接種を受けるかマスクを着用することを義務付けています。これらの義務付けは、時折、狭い団体交渉の根拠に基づいて労働組合による訴訟を引き起こすことがありますが、支持派は、疾病の流行時に一般住民に影響を与える強制ワクチン接種法は、裁判所が概ね承認してきたと指摘しています。[ 201 ]
インフルエンザの予防接種は、インフルエンザの合併症を起こす可能性が高い高リスクグループのメンバー、例えば妊婦[ 37 ] [ 202 ]や、アスピリンやサリチル酸を含む薬を服用していて、インフルエンザウイルス感染後にライ症候群を発症するリスクがある6ヶ月から18歳までの子供や10代の若者にとって特に重要であると考えられています。[ 37 ]
- 年齢の上限を18歳に引き上げる目的は、小児科医の診察や学校を休むことで失われる子供と親の時間、および合併症に対する抗生物質の必要性を減らすことです[ 203 ]
- 小児のワクチン接種によって期待されるさらなる利益は、親や他の家族の間でのインフルエンザ症例数の減少と、一般社会へのインフルエンザの蔓延の可能性の減少である。[ 203 ]
CDCは、鼻腔スプレーワクチンとも呼ばれる生弱毒インフルエンザワクチン(LAIV)は、米国の2016~2017年のインフルエンザシーズンには推奨されないと示唆した。[ 204 ]
さらに、CDCは、重度の免疫不全患者をケアする医療従事者には、LAIVではなく注射(TIVまたはQIV)を受けることを推奨しています。[ 205 ]
オーストラリア
オーストラリア政府は、生後6ヶ月以上のすべての人に季節性インフルエンザの予防接種を推奨しています。オーストラリアでは不活化ワクチンを使用しています。[ 206 ] 2021年までは卵由来のワクチンが唯一のワクチン(そして現在も唯一の無料ワクチン)でしたが、2021年3月からは希望者向けに新しい細胞由来のワクチンが有料で提供され、2026年までにこれが標準ワクチンになると予想されています。[ 156 ] 標準インフルエンザワクチンは、以下の人々には無料で提供されます。[ 207 ]
- 6か月から5歳までの子供
- 65歳以上の人々
- 生後6か月以上のアボリジニおよびトレス海峡諸島民。
- 妊婦
- 重度の喘息、肺疾患、心臓病、免疫力の低下、糖尿病など、インフルエンザの合併症を引き起こす可能性のある病状を持つ生後 6 か月以上の人。
吸収
| 国 | 地域 | 65歳以上の割合 |
|---|---|---|
| 大韓民国 | アジア | 83 |
| オーストラリア | オセアニア | 75 |
| イギリス | ヨーロッパ | 73 |
| アメリカ合衆国 | アメリカ大陸 | 68 |
| ニュージーランド | オセアニア | 65 |
| チリ | アメリカ大陸 | 65 |
| オランダ | ヨーロッパ | 64 |
| カナダ | アメリカ大陸 | 61 |
| ポルトガル | ヨーロッパ | 61 |
| イスラエル | アジア | 58 |
| アイルランド | ヨーロッパ | 58 |
| スペイン | ヨーロッパ | 54 |
| イタリア | ヨーロッパ | 53 |
| デンマーク | ヨーロッパ | 52 |
| 日本 | アジア | 50 |
| フランス | ヨーロッパ | 50 |
| スウェーデン | ヨーロッパ | 49 |
| フィンランド | ヨーロッパ | 48 |
| アイスランド | ヨーロッパ | 45 |
| ルクセンブルク | ヨーロッパ | 38 |
| ドイツ | ヨーロッパ | 35 |
| ノルウェー | ヨーロッパ | 34 |
| ハンガリー | ヨーロッパ | 27 |
| チェコ共和国 | ヨーロッパ | 20 |
| リトアニア | ヨーロッパ | 13 |
| スロバキア共和国 | ヨーロッパ | 13 |
| スロベニア | ヨーロッパ | 12 |
| ラトビア | ヨーロッパ | 8 |
| 七面鳥 | アジア | 7 |
| エストニア | ヨーロッパ | 5 |
リスクグループ
インフルエンザワクチン接種の接種率は、季節性およびパンデミック時の両方で低いことが多い。[ 209 ]パンデミックインフルエンザワクチン接種率の系統的レビューでは、性別(男性の方が接種率が高い)、民族(少数民族の人々の方が接種率が高い)、慢性疾患の有無など、接種率に影響を与える可能性のあるいくつかの個人的要因が特定されている。[ 210 ] [ 211 ]ワクチンの安全性と有効性に対する信念も重要である。[ 209 ]
60歳以上のワクチン接種率を高めるためには、チラシや手紙を使った患者へのリマインダー、はがきによるリマインダー、クライアントへのアウトリーチプログラム、ワクチンの家庭訪問、集団ワクチン接種、無料ワクチン接種、医師への支払い、医師へのリマインダー、医師間の競争の奨励など、いくつかの対策が有効です。[ 212 ]
医療従事者
最前線の医療従事者には、季節性インフルエンザワクチンとパンデミックインフルエンザワクチンの接種が推奨されることが多い。例えば、英国では、患者のケアに携わるすべての医療従事者に季節性インフルエンザワクチンの接種が推奨されており、2009年のパンデミック時には、 H1N1/09 (後にA(H1N1)pdm09に改名[注 1 ] [ 213 ])豚インフルエンザウイルスのワクチン接種も推奨された。しかし、接種率は低い場合が多い[ 178 ] 。2009年のパンデミック時には、英国[ 178 ]、イタリア[ 214 ] 、ギリシャ[ 215 ] 、香港[ 216 ]などの国で、医療従事者の接種率が低かった。
2010年に米国の医療従事者を対象に実施された調査では、2010~2011年シーズンにインフルエンザワクチンを接種したと回答した人は63.5%で、前シーズンの61.9%から増加しました。患者と直接接触する米国の医療従事者、例えば医師や歯科医師(84.2%)、看護師(82.6%)は、ワクチン接種率がより高くなっています。[ 217 ] [ 218 ] [ 219 ]
医療従事者にワクチン接種を行う主な理由は、スタッフが患者にインフルエンザを広めるのを防ぎ、サービス需要が高いときにスタッフの欠勤を減らすことですが、医療従事者がワクチン接種を受け入れるか拒否するかを決定する理由は、多くの場合、個人的な利益の認識に関係している可能性があります。[ 178 ]
オーストラリア、ビクトリア州の公立病院では、2005年の医療従事者のワクチン接種率は、非臨床スタッフで34%、検査スタッフで42%でした。ワクチン接種を拒否する理由の一つは、副作用への懸念でした。ある研究では、ある教育病院の研修医の31%が、オーストラリアのワクチンがインフルエンザを引き起こす可能性があると誤って考えていました。[ 220 ]
製造業

特定の株に合わせる必要がなく、幅広い種類のインフルエンザウイルスに効果を発揮する「ユニバーサル」インフルエンザワクチンのアイデアに関する研究が続けられています。 [ 221 ] 2007年11月までにワクチン候補は発表されていませんでしたが、[ 222 ] 2021年現在、前臨床開発段階および臨床試験段階にあるユニバーサルワクチン候補がいくつか存在します。[ 223 ] [ 224 ] [ 225 ] [ 226 ]
2007年の報告書では、季節性インフルエンザワクチン(不活化ワクチンと生ワクチン)の世界生産能力は約8億2600万回分で、生産量4億1300万回分の2倍だった。 2013年までにパンデミックインフルエンザワクチンを生産するという積極的なシナリオでも、6か月間でわずか28億回分しか生産できない。パンデミック時にすべての高所得国と上位中所得国が全人口にワクチンを接種しようとすると、約20億回分が必要になる。中国もこの目標を追求した場合、これらの人口に接種するには30億回分以上が必要になる。[ 227 ]世界中の人々が購入可能な価格で、はるかに大量のワクチンを生産できる新しいワクチン手法を見つけるためのワクチン研究開発が進行中である。
卵ベース
ほとんどのインフルエンザワクチンは、ワクチン製造業者によって受精鶏卵で培養されます。[ 228 ] [ 222 ]北半球では、WHOが冬季インフルエンザシーズン向けの推奨株を発表した(通常2月)後に製造プロセスが開始されます。[ 228 ] [ 229 ] 3種類のインフルエンザ株(H1N1、H3N2、B株)が選ばれ、それぞれ鶏卵に接種されます。これらの単価ワクチンを混合して三価ワクチンが製造されます。[ 230 ]
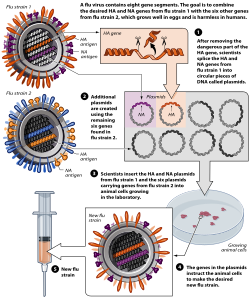
2007年11月現在、従来の注射剤と点鼻スプレーはどちらも鶏卵を用いて製造されています。欧州連合(EU)は、ノバルティス社が動物細胞を用いて製造したワクチン「オプタフル」も承認しました。この技術は、より大規模に製造可能であり、アレルギー反応や鶏などの鳥類に影響を与える株との不適合性といった卵に起因する問題を回避できると期待されています。[ 222 ]
インフルエンザワクチンは、病原体を含まない11日齢または12日齢の卵で製造されます。[ 231 ]卵の上部をアルコールで拭いて消毒し、卵をろうそくで照らして尿膜腔内の静脈のない部分を特定します。そこに圧力を逃がすための小さな穴が開けられます。[ 232 ]卵の上部に2つ目の穴を開け、そこからインフルエンザウイルスを尿膜腔に注入します。2つの穴は溶かしたパラフィンで密閉され、接種された卵は37℃で48時間培養されます。[ 231 ]培養期間中、ウイルスは複製され、新たに複製されたウイルスが尿膜腔液中に放出されます。[ 233 ]
48時間の孵化期間後、卵の上部を割り、尿膜腔液を10ml採取します。そこから約15マイクログラムのインフルエンザワクチンが採取されます。この時点でウイルスは弱毒化または死滅しており、ウイルス抗原は精製され、バイアル、注射器、または鼻腔スプレーに充填されます。[ 233 ] 3価ワクチン1回分の製造には最大3個の卵が必要であり、インフルエンザワクチン製造のために毎年推定6億個の卵が製造されています。[ 234 ]
その他の製造方法
卵を必要としないワクチン生成方法の一つに、インフルエンザウイルス様粒子(VLP)の構築がある。VLPはウイルスに類似しているが、ウイルスのコード要素を含まず、単にビリオンと同様の方法で抗原を提示するだけなので、不活化の必要はない。VLPの生産方法には、Spodoptera frugiperda Sf9昆虫細胞の培養や、植物由来のワクチン生産(例えば、Nicotiana benthamianaでの生産)などがある。一部のVLPは、赤血球凝集抑制試験(HIA)において、他のワクチンと比較して、より広範な抗原的に異なるウイルス分離株を認識する抗体を誘導するという証拠がある。 [ 235 ]
不活化H5N1ワクチンで追加接種した後に免疫系を準備するために使用される遺伝子ベースのDNAワクチンは、2011年に臨床試験を受けました。[ 236 ] [ 237 ] [ 238 ]
2012年11月、ノバルティスは初の細胞培養ワクチンについてFDAの承認を受けた。[ 160 ] [ 49 ] [ 239 ] [ 240 ] 2013年には、組み換えインフルエンザワクチンであるFlublokが米国での使用が承認された。[ 51 ] [ 241 ] [ 242 ] [ 243 ]
2020年9月17日、欧州医薬品庁(EMA)のヒト用医薬品委員会(CHMP)は、四価インフルエンザワクチン(組換え、細胞培養で製造)であるSupemtekの販売承認を付与することを推奨する肯定的な意見を採択しました。[ 244 ]この医薬品の申請者はサノフィパスツールです。[ 244 ] Supemtekは2020年11月に欧州連合で医療用として承認されました。[ 161 ] [ 245 ]
オーストラリアは2021年3月、犬の腎臓の「永久細胞株」をベースとした初の細胞ワクチンを承認しました。このワクチンの製造方法により、インフルエンザ株により適合したワクチンを生産することができます。[ 156 ]
ワクチン製造国
WHOによると、2019年現在、インフルエンザワクチンが生産されている国は以下のとおりです。[ 246 ]
- オーストラリア
- ブラジル
- カナダ
- 中国
- フランス
- ドイツ
- ハンガリー
- インド
- イラン
- 日本
- メキシコ
- オランダ
- ニカラグア
- ロシア連邦
- 韓国
- イギリス
- アメリカ合衆国
- ベトナム
さらに、カザフスタン、セルビア、タイにも生産体制構築の最終段階にある施設があった。[ 246 ]
費用対効果
季節性インフルエンザワクチンの費用対効果は、さまざまなグループやさまざまな状況で広く評価されてきました。[ 247 ]高齢者(65歳以上)については、公開されている研究の大部分でワクチン接種によって費用が節約され、インフルエンザワクチン接種に関連する費用削減(たとえば、医療機関への受診の回避)がワクチン接種の費用を上回っていることがわかっています。[ 248 ]高齢者(50〜64歳)については、いくつかの公開されている研究でインフルエンザワクチン接種は費用対効果が高いことがわかりましたが、これらの研究結果は、経済評価で使用される主要な仮定に依存していることが判明していることがよくあります。[ 249 ]インフルエンザの費用対効果モデルの不確実性は、疾病負荷の推定に伴う複雑さ[ 250 ]や、循環する株の季節変動、ワクチンの適合によって部分的に説明できます。[ 251 ] [ 252 ]健康な働く成人(18~49歳)の場合、2012年のレビューでは、ワクチン接種は一般的に費用節約にはならず、資金提供の適合性は関連する健康上の利益を得るために支払う意思に依存することがわかりました。[ 253 ]小児では、ほとんどの研究でインフルエンザワクチン接種は費用対効果が高いことがわかりましたが、多くの研究には(間接的な)生産性向上が含まれており、すべての環境で同じ重みが与えられるとは限りません。[ 254 ]いくつかの研究では、将来のパンデミックから身を守るための介入(パンデミック前のワクチン接種を含む)の費用対効果を予測しようとしましたが、将来の潜在的なパンデミックの深刻さとそれに対する対策の有効性に関する不確実性により、費用対効果の推定は複雑になっています。[ 255 ]
研究
インフルエンザ研究には、分子ウイルス学、分子進化、病因論、宿主免疫応答、ゲノミクス、疫学が含まれます。これらは、ワクチン、治療法、診断ツールなどのインフルエンザ対策の開発に役立ちます。インフルエンザ対策の改善には、ウイルスがどのように細胞に侵入し、複製、変異し、新しい株に進化し、免疫応答を誘発するかについての基礎研究が必要です。インフルエンザゲノム配列解析プロジェクトでは、インフルエンザの配列ライブラリ[ 256 ]を作成しています。これは、ある株が他の株よりも致死性が高い理由、免疫原性に最も影響を与える遺伝的決定因子、そしてウイルスがどのように進化するかを 研究者が理解するのに役立ちます。
別のアプローチとして、インターネットコンテンツを用いてインフルエンザ予防接種キャンペーンの効果を推定する方法があります。具体的には、研究者らはTwitterとMicrosoftのBing検索エンジンのデータを活用し、一連の処理を経て、これらの情報を予防接種が行われた地域におけるインフルエンザ様疾患の減少率の推定値にマッピングする統計的枠組みを提案しました。この手法は、イングランドで実施された2つのインフルエンザ予防接種プログラム(2013/14年と2014/15年)の効果を定量化するために使用されました。これらのプログラムでは、学齢期の児童に生弱毒化インフルエンザワクチン(LAIV)が投与されました。注目すべきは、この効果の推定値が、従来の症候群サーベイランスエンドポイントに基づくイングランド公衆衛生局の推定値と一致していたことです。 [ 257 ] [ 258 ]
パンデミックインフルエンザへの迅速な対応
パンデミックインフルエンザワクチンの迅速な開発、生産、そして流通は、インフルエンザパンデミックの際に数百万人の命を救う可能性を秘めています。パンデミック株の特定からワクチン接種が必要になるまでの期間が短いため、研究者たちは、より迅速な「リアルタイム」アクセスとより低コストでの生産を可能にするワクチン製造のための新たな技術を研究しています。これにより、インフルエンザパンデミックの発生源となる可能性のある低所得国および中所得国に住む人々のワクチンへのアクセスが向上します。例えば、弱毒生ワクチン(卵子または細胞由来)や組換え技術(タンパク質およびウイルス様粒子)などが挙げられます。[ 259 ] 2009年7月現在、パンデミックインフルエンザワクチンに関する臨床試験は70件以上が完了または進行中です。[ 260 ] 2009年9月、FDAは2009年H1N1インフルエンザウイルス(2009年パンデミック株)に対する4種類のワクチンを承認し、最初のワクチンロットは翌月中に入手可能になると予想しました。[ 261 ]
2020年1月、米国食品医薬品局(FDA)は、オーデンツをH5N1インフルエンザウイルスのワクチンとして承認しました。[ 262 ]オーデンツは、ワクチンに含まれるA型インフルエンザウイルスH5N1亜型によって引き起こされる疾患の予防のための能動免疫を適応とするワクチンです。オーデンツは、ワクチンに含まれるA型インフルエンザウイルスH5N1亜型への曝露リスクが高い生後6ヶ月以上の人への使用が承認されています。[ 263 ]
人獣共通インフルエンザワクチンSeqirusは欧州連合での使用が承認されています。[ 264 ]これはH5N8ワクチンであり、 H5亜型インフルエンザAウイルスに対する獲得免疫を提供することを目的とします。[ 264 ]
ユニバーサルインフルエンザワクチン
各半球のインフルエンザシーズンごとに設計・製造する必要のない万能インフルエンザワクチンがあれば、ワクチンの供給が安定し、シーズンの変異株の予測ミスを防ぎ、変異による株の流出を防ぐことができる。[ 221 ]このようなワクチンは数十年にわたって研究されてきた。[ 265 ]
一つのアプローチは、21世紀初頭に毎年使用されてきた季節性ワクチンとは異なり、体に免疫反応を誘発するのではなく、免疫反応そのものの構成要素となる広域中和抗体を用いることである。最初の中和抗体は1993年に実験によって特定された。[ 266 ]インフルエンザ中和抗体はヘマグルチニンタンパク質の茎に結合することが発見された。これらのタンパク質の頭部に結合できる抗体が特定された。高度に保存されたM2プロトンチャネルは、広域中和抗体の潜在的な標的として提案された。[ 265 ] [ 267 ]
研究者にとっての課題は、どの季節でも使用できるようにウイルスの多くのサブタイプを中和できる単一の抗体を特定し、抗原ドリフトに耐性のある保存されたドメインを標的とすることです。[ 265 ]
もう一つのアプローチは、これらのプロジェクトから特定された保存されたドメインを取り出し、これらの抗原のグループを送達して免疫反応を誘発することです。異なる抗原を異なる方法(融合タンパク質として、ウイルス様粒子上に搭載、非病原性ウイルス上に、DNAとしてなど)で提示する様々なアプローチが開発中です。[ 267 ] [ 268 ] [ 269 ]
T細胞応答を特異的に活性化するユニバーサルワクチンの開発も進められている。これは、インフルエンザ感染時に強力な早期T細胞応答を示す人は転帰が良好であること、そしてT細胞が保存されたエピトープに反応することを示す臨床データに基づいている。開発者にとっての課題は、これらのエピトープが免疫原性が弱い内部タンパク質ドメイン上にあることである。[ 267 ]
他のワクチン分野の研究者と同様に、ユニバーサルワクチンの研究者たちは、ワクチンが十分に強力で持続的な免疫反応を生み出す能力を向上させるためにワクチンアジュバントの実験を行ってきました。 [ 267 ] [ 270 ]
経口インフルエンザワクチン
2019年現在、経口インフルエンザワクチンが臨床研究中である。[ 271 ]経口ワクチン候補は、複製に必要な遺伝子を除去するように改変されたアデノウイルス5型ベクターに基づいており、アジュバント として小さな二本鎖RNAヘアピン分子を発現する遺伝子が追加されている。[ 272 ] 2020年には、錠剤型のワクチンの第II相ヒト試験で、忍容性が良好で、承認された注射ワクチンと同様の免疫が得られることが示された。[ 273 ]
多面的効果の可能性
最近の観察研究と臨床試験では、インフルエンザワクチン接種による多面的効果として知られる非特異的な効果が、インフルエンザ感染の予防にとどまらず、より広範な影響を及ぼすことが示唆されています。9001人のランダム化試験参加者を対象としたメタアナリシスでは、インフルエンザワクチン接種はプラセボと比較して、主要な心血管イベントの有害事象リスクが34%低下することがわかりました。[ 274 ]このリスク低下の程度は、スタチンを含む他のガイドライン推奨の心血管薬で見られる心保護効果に匹敵します。[ 275 ]カナダの成人400万人を対象とした大規模な集団ベースの後ろ向きコホート研究でも、あらゆる病因による脳卒中の予防効果が示唆されています。[ 276 ]また、1型糖尿病の発症や癌関連死亡に対する予防効果がある可能性もあり、現在活発に研究が進められています。[ 277 ]
COVID-19(新型コロナウイルス感染症
インフルエンザワクチンとCOVID-19ワクチンは、安全に同時に接種することができます。[ 74 ] [ 278 ]予備的な研究では、インフルエンザワクチン接種はCOVID-19を予防することはできませんが、COVID-19感染の発生率と重症度を軽減する可能性があることが示されています。[ 279 ]
批判
2006年、コクラン共同体によるインフルエンザワクチンのレビューを主導したトム・ジェファーソンは、インフルエンザワクチンに関する臨床的証拠を「ナンセンス」と呼び、効果がないと述べました。彼はプラセボ対照ランダム化臨床試験の実施を求めましたが、この分野のほとんどの専門家はこれを非倫理的だと考えています。インフルエンザワクチンの有効性に関する彼の見解は、CDCや国立衛生研究所などの医療機関、そしてアンソニー・ファウチのようなこの分野の重要人物によって否定されています。[ 280 ] [ 281 ]
感染症研究政策センターによる2012年のインフルエンザワクチンに関するレビューを主導したマイケル・オスターホルム氏は、ワクチン接種を推奨する一方で、その宣伝については批判し、「このワクチンは過剰に宣伝し、誇大宣伝しすぎている 。宣伝されているほどの予防効果はない。すべてはセールスマンの仕事、広報活動だ」と述べた。[ 282 ]
獣医学的用途
獣医インフルエンザワクチン接種は、以下の4つの目的を達成することを目指しています。[ 283 ]
- 臨床疾患からの保護
- 毒性ウイルスによる感染からの保護
- ウイルス排泄からの保護
- 感染動物とワクチン接種動物の血清学的区別(いわゆる DIVA 原理)。
馬
馬インフルエンザに感染した馬は、発熱、空咳、鼻水、そして数日間は食欲不振や食欲不振に陥りますが、通常は2~3週間で回復します。「ワクチン接種スケジュールは通常、3~6週間間隔で2回の初回接種を行い、その後6~12ヶ月間隔で追加接種を行います。多くの場合、このようなスケジュールでは抗体の防御レベルを維持できないことが一般的に認識されており、リスクの高い状況ではより頻繁な接種が推奨されます。」[ 284 ]
イギリスのショーでは、馬に馬インフルエンザの予防接種を受けさせ、予防接種カードを提示することが一般的に義務付けられています。国際馬術連盟(FEI)は6ヶ月ごとに予防接種を受けることを義務付けています。[ 285 ] [ 286 ]
家禽
特定の株の高病原性鳥インフルエンザに対するワクチン接種は家禽に可能です。ワクチン接種は、感染モニタリング、早期発見、バイオセキュリティといった他の管理対策と組み合わせる必要があります。[ 287 ] [ 288 ]
豚
豚インフルエンザワクチンは、ヨーロッパと北米の養豚場で広く使用されています。ほとんどの豚インフルエンザワクチンには、 H1N1株とH3N2株が含まれています。
豚インフルエンザは1976年の発生以来、大きな問題として認識されてきました。ウイルスの進化により、従来のワクチンに対する反応は一貫していません。標準的な市販の豚インフルエンザワクチンは、ウイルス株が交差防御能を持つほど十分に一致している場合、問題の制御に効果的です。より困難な症例では、分離された特定のウイルスから作られたカスタム(自家)ワクチンが製造・使用されています。[ 289 ]ワクチン製造業者のノバルティスは、H3N2株(1998年に初めて特定)が養豚農家に大きな損失をもたらしたと主張しています。流産の兆候としてよく見られるのは、母豚が数日間餌を食べなくなり、高熱を出すことです。死亡率は15%にも達することがあります。[ 290 ]
犬
2004年、インフルエンザAウイルスの亜型H3N8が犬インフルエンザを引き起こすことが発見されました。犬はこのウイルスに過去に曝露したことがないため、このウイルスに対する自然免疫を持っていません。しかし、2004年にワクチンが発見されました。[ 291 ]
注記
- ^ (H1N1)pdm09 は、2009 年のパンデミック H1N1 ウイルスの新しい命名法であり、別の株ではありません。
参考文献
- ^ a b「AusPAR:インフルエンザヘマグルチニン組換え体」米国医薬品局(TGA) 2021年8月23日。2021年9月11日時点のオリジナルよりアーカイブ。 2021年9月10日閲覧。
- ^ a b「AusPAR:不活化四価インフルエンザワクチン(スプリットビリオン)インフルエンザウイルスヘマグルチニン」米国医薬品局(TGA) 2020年12月2日。2021年9月11日時点のオリジナルよりアーカイブ。 2021年9月10日閲覧。
- ^ 「妊娠中の処方薬データベースの更新」医薬品行政局(TGA) 2022年12月21日オリジナルより2022年4月3日時点のアーカイブ。 2023年1月2日閲覧。
- ^ 「処方薬:オーストラリアにおける新規化学物質の登録、2017年」オーストラリア医薬品行政局(TGA) 2022年6月21日オリジナルより2023年4月10日時点のアーカイブ。 2023年4月9日閲覧。
- ^ 「処方薬:オーストラリアにおける新規化学物質の登録、2016年」オーストラリア医薬品行政局(TGA) 2022年6月21日オリジナルより2023年4月10日時点のアーカイブ。 2023年4月10日閲覧。
- ^ 「AusPAR: Flucelvax Quad」 . Therapeutic Goods Administration . 2024年3月31日閲覧。
- ^ 「Summary Basis of Decision (SBD) for Supemtek」カナダ保健省、2014年10月23日。2022年5月30日時点のオリジナルよりアーカイブ。2022年5月29日閲覧。
- ^ 「規制決定概要 - Flucelvax Quad」カナダ保健省2014年10月23日. 2022年6月7日時点のオリジナルよりアーカイブ。 2022年6月7日閲覧。
- ^ 「規制決定概要 - Flucelvax Quad」カナダ保健省2014年10月23日. 2022年6月7日時点のオリジナルよりアーカイブ。 2022年6月7日閲覧。
- ^ 「規制決定概要 - Influvac Tetra」カナダ保健省。2014年10月23日。2022年6月7日時点のオリジナルよりアーカイブ。 2022年6月7日閲覧。
- ^ 「パネンザ(ヘマグルチニンA株(H1N1))に関する規制決定概要」 .医薬品・健康製品ポータル. 2023年10月27日. 2024年4月2日閲覧.
- ^ 「Afluria(インフルエンザAウイルス a/victoria/4897/2022 ivr-238(h1n1)抗原(プロピオラクトン不活化)、インフルエンザAウイルス a/thailand/8/2022 ivr-237(h3n2)抗原(プロピオラクトン不活化)、インフルエンザBウイルス b/austria/1359417/2021 bvr-26抗原-プロピオラクトン不活化注射液、懸濁液)」 DailyMed . 2024年7月1日. 2024年12月17日閲覧。
- ^ 「Audenz-インフルエンザAウイルスH5N1全注射」 DailyMed 、 2024年8月6日。 2024年12月17日閲覧。
- ^ a b「Fluad(インフルエンザAウイルス a/victoria/4897/2022 ivr-238(h1n1)抗原(ホルムアルデヒド不活化)、インフルエンザAウイルス a/thailand/8/2022 ivr-237(h3n2)抗原(ホルムアルデヒド不活化)、インフルエンザBウイルス b/austria/1359417/2021 bvr-26抗原 - ホルムアルデヒド不活化注射液、懸濁液)」 DailyMed . 2025年7月1日。
- ^ 「Fluarix 2024/2025 - インフルエンザウイルスワクチンの中断」 DailyMed 、 2024年7月1日。 2024年12月17日閲覧。
- ^ 「Flublok Trivalent Northern Hemisphere (インフルエンザAウイルス a/west virginia/30/2022 (h1n1) 組換えヘマグルチニン抗原、インフルエンザAウイルス a/massachusetts/18/2022- h3n2 組換えヘマグルチニン抗原、およびインフルエンザBウイルス b/austria/1359417/2021 組換えヘマグルチニン抗原注射液」 DailyMed . 2024年10月18日. 2024年12月17日閲覧。
- ^ a b「Flucelvax(インフルエンザAウイルス a/georgia/12/2022 cvr-167 (h1n1)抗原(MDCK細胞由来、プロピオラクトン不活化)、インフルエンザAウイルス a/sydney/1304/2022 (h3n2)抗原(MDCK細胞由来、プロピオラクトン不活化)、インフルエンザBウイルス b/singapore/wuh4618/2021抗原-MDCK細胞由来、プロピオラクトン不活化注射液、懸濁液;Flucelvax(インフルエンザAウイルス a/georgia/12/2022 crv-167 (h1n1)抗原(MDCK細胞由来、プロピオラクトン不活化)、インフルエンザAウイルス a/sydney/1304/2022 (h3n2)抗原(MDCK細胞由来、プロピオラクトン不活化)、 「インフルエンザBウイルス b/singapore/wuh4618/2021抗原 - MDCK細胞由来、プロピオラクトン不活化注射液、懸濁液」 DailyMed 、 2024年7月1日。 2024年12月17日閲覧。
- ^ 「Flulaval 2024/2025 - インフルエンザウイルスワクチンの接種中止」 DailyMed 、 2024年7月1日。 2024年12月17日閲覧。
- ^ 「Flumist- インフルエンザワクチン生鼻腔内スプレー」 DailyMed 、 2024年8月6日。 2024年12月17日閲覧。
- ^ 「Fluzone High-Dose Quadrivalent Northern Hemisphere(インフルエンザAウイルス a/victoria/4897/2022 ivr-238(h1n1)抗原(ホルムアルデヒド不活化)、インフルエンザAウイルス a/california/122/2022 san-022(h3n2)抗原(ホルムアルデヒド不活化)、インフルエンザBウイルス b/phuket/3073/2013抗原(ホルムアルデヒド不活化)、およびインフルエンザBウイルス b/michigan/01/2021抗原-ホルムアルデヒド不活化注射液、懸濁液」 DailyMed . 2024年7月30日. 2024年12月17日閲覧。
- ^ 「Fluzone Quadrivalent Northern Hemisphere(インフルエンザAウイルス a/victoria/2570/2019 ivr-215(h1n1)抗原(ホルムアルデヒド不活化)、インフルエンザAウイルス a/darwin/9/2021 san-010(h3n2)抗原(ホルムアルデヒド不活化)、インフルエンザBウイルス b/phuket/3073/2013抗原(ホルムアルデヒド不活化)、およびインフルエンザBウイルス b/michigan/01/2021抗原-ホルムアルデヒド不活化注射液、懸濁液)」 DailyMed . 2024年6月14日. 2024年12月17日閲覧。
- ^ 「Fluzone Quadrivalent Northern Hemisphere(インフルエンザAウイルス a/victoria/4897/2022 ivr-238(h1n1)抗原(ホルムアルデヒド不活化)、インフルエンザAウイルス a/darwin/9/2021 san-010(h3n2)抗原(ホルムアルデヒド不活化)、インフルエンザBウイルス b/phuket/3073/2013抗原(ホルムアルデヒド不活化)、およびインフルエンザBウイルス b/michigan/01/2021抗原-ホルムアルデヒド不活化注射液、懸濁液;Flucelvax(インフルエンザAウイルス a/victoria/4897/2022 ivr-238(h1n1)抗原(ホルムアルデヒド不活化)、インフルエンザAウイルス a/california/122/2022 san-022(h3n2)抗原(ホルムアルデヒド不活化)、インフルエンザBウイルス b/phuket/3073/2013抗原(ホルムアルデヒド不活化)、およびインフルエンザBウイルス b/michigan/01/2021抗原 - ホルムアルデヒド不活化注射液」。DailyMed 。2024年7月24日。 2024年12月17日閲覧。
- ^ 「Fluzone Quadrivalent Southern Hemisphere(インフルエンザAウイルス a/victoria/4897/2022 ivr-238(h1n1)抗原(ホルムアルデヒド不活化)、インフルエンザAウイルス a/california/122/2022(a/thailand/8/2022様ウイルス(h3n2)抗原(ホルムアルデヒド不活化)、インフルエンザBウイルス b/michigan/01/2021抗原(ホルムアルデヒド不活化)、およびインフルエンザBウイルス b/phuket/3073/2013抗原-ホルムアルデヒド不活化注射液、懸濁液)」DailyMed . 2024年2月22日. 2024年12月17日閲覧。
- ^ 「Supemtek EPAR」 .欧州医薬品庁. 2020年11月25日. 2024年6月27日閲覧。
- ^ 「Fluad Tetra」欧州医薬品庁(EMA) 2020年5月20日. 2024年8月10日閲覧。
- ^ 「Fluad製品情報」。医薬品連合登録簿。2024年11月19日。 2024年12月17日閲覧。
- ^ 「Flucelvax製品情報」。医薬品連合登録簿。2024年11月26日。 2024年12月17日閲覧。
- ^ 「季節性インフルエンザワクチンに関する重要な事実」インフルエンザ(Flu) 2024年9月30日。
- ^ 「妊娠中のインフルエンザ予防接種」 nhs.uk 2020年12月3日。
- ^ a b c d e f g h i世界保健機関(2012年11月)「インフルエンザワクチンに関するWHOの立場表明」Weekly Epidemiological Record 87 ( 47): 461–76 . hdl : 10665/241993 . PMID 23210147 .
- ^世界保健機関(2022年5月). 「インフルエンザワクチン:WHOポジションペーパー – 2022年5月」.週刊疫学記録. 97 (19): 185–208 . hdl : 10665/354265 .
- ^ Manzoli L, Ioannidis JP , Flacco ME, De Vito C, Villari P (2012年7月). 「小児、成人、高齢者における季節性インフルエンザワクチンおよびパンデミックインフルエンザワクチンの有効性と有害性:15件のメタアナリシスの批判的レビューと再分析」 . Human Vaccines & Immunotherapeutics . 8 ( 7): 851–62 . doi : 10.4161/hv.19917 . PMC 3495721. PMID 22777099 .
- ^ RW 社 (2009)。パンデミックインフルエンザのワクチン。ドルドレヒト: スプリンガー。 p. 49.ISBN 978-3-540-92165-3. 2020年8月3日時点のオリジナルよりアーカイブ。2017年9月9日閲覧。
- ^ワクチン分析:戦略、原則、および管理. Springer. 2014. p. 61. ISBN 978-3-662-45024-6. 2020年8月3日時点のオリジナルよりアーカイブ。2017年9月9日閲覧。
- ^ a b c d「インフルエンザワクチンを接種すべき人と接種すべきでない人」米国疾病予防管理センター(CDC) 2019年10月11日。2019年12月2日時点のオリジナルよりアーカイブ。 2019年12月2日閲覧。
 この記事には、パブリック ドメインであるこのソースからのテキストが組み込まれています。
この記事には、パブリック ドメインであるこのソースからのテキストが組み込まれています。 - ^免疫学的基礎シリーズ:モジュール23:インフルエンザワクチン.世界保健機関(WHO). 2017年10月. hdl : 10665/259211 . ISBN 978-92-4-151305-0。
- ^ a b c d e f g h i j k l m n o p q r s Grohskopf LA, Alyanak E, Ferdinands JM, Broder KR, Blanton LH, Talbot HK, et al. (2021年8月). 「ワクチンによる季節性インフルエンザの予防と制御:米国予防接種実施諮問委員会の勧告、2021~22年インフルエンザシーズン」 ( PDF) . MMWR Recomm Rep . 70 (5): 1– 28. doi : 10.15585/mmwr.rr7005a1 . PMC 8407757. PMID 34448800. 2021年8月27日時点のオリジナルよりアーカイブ(PDF) . 2021年8月29日閲覧。
 この記事には、パブリック ドメインであるこのソースからのテキストが組み込まれています。
この記事には、パブリック ドメインであるこのソースからのテキストが組み込まれています。 - ^世界保健機関(2025).必須医薬品の選択と使用、2025年:WHO必須医薬品モデルリスト、第24版. ジュネーブ:世界保健機関. doi : 10.2471/B09474 . hdl : 10665/382243 . ライセンス: CC BY-NC-SA 3.0 IGO.
- ^ 「季節性インフルエンザワクチン接種に関する理事会勧告(2009/1019/EU)の実施」(PDF) .欧州疾病予防管理センター. 2014年1月. 2020年4月10日時点のオリジナルよりアーカイブ(PDF) . 2020年4月10日閲覧。
- 一般向け要約:「季節性インフルエンザワクチン接種に関する理事会勧告の実施」。欧州疾病予防管理センター。2014年1月9日。
- ^ a b c d e「インフルエンザワクチンと卵アレルギーを持つ人々」米国疾病予防管理センター(CDC)2019年11月25日。2019年12月2日時点のオリジナルよりアーカイブ。 2019年12月2日閲覧。
 この記事には、パブリック ドメインであるこのソースからのテキストが組み込まれています。
この記事には、パブリック ドメインであるこのソースからのテキストが組み込まれています。 - ^ 「皮内インフルエンザ(インフルエンザ)ワクチン接種」米国疾病予防管理センター(CDC) 2018年10月31日。2019年10月14日時点のオリジナルよりアーカイブ。 2019年10月14日閲覧。
 この記事には、パブリック ドメインであるこのソースからのテキストが組み込まれています。
この記事には、パブリック ドメインであるこのソースからのテキストが組み込まれています。 - ^ 「インフルエンザワクチン – 米国、2019~2020年インフルエンザシーズン」米国疾病予防管理センター(CDC) 2019年8月22日。2019年10月14日時点のオリジナルよりアーカイブ。 2019年10月14日閲覧。
 この記事には、パブリック ドメインであるこのソースからのテキストが組み込まれています。
この記事には、パブリック ドメインであるこのソースからのテキストが組み込まれています。 - ^ 「インフルエンザウイルスワクチンの不活化」アメリカ医療システム薬剤師会(AHS)2018年11月19日。2019年10月14日時点のオリジナルよりアーカイブ。 2019年10月13日閲覧。
- ^ Institute of Medicine (2005). Knobler SL, Mack A, Mahmoud A, Lemon SM (編).パンデミックインフルエンザの脅威:我々は準備ができているか?ワークショップ概要. 全米科学アカデミー出版. p. 62. doi : 10.17226/11150 . ISBN 978-0-309-09504-4. PMID 20669448 .
- ^ Plotkin, SLおよびPlotkin, SA「ワクチン接種の短い歴史」Stanley A. Plotkin、Walter A. Orenstein、Paul A. Offit編『ワクチン』 Elsevier Health Sciences、2008年、6~7頁。
- ^ Artenstein、AW「インフルエンザ」In:ワクチン: 伝記、アンドリュー W. アーテンスタイン編191–205ページ。
- ^ Hampson AW (2008年6月). 「パンデミックインフルエンザに対するワクチン。現行のワクチンの歴史、限界、そしてパンデミックの脅威に対処するための要件」 Annals of the Academy of Medicine, Singapore . 37 (6): 510–17 . doi : 10.47102/annals-acadmedsg.V37N6p510 . PMID 18618064. S2CID 17102174 .
- ^ Milián E, Kamen AA (2015). 「インフルエンザワクチンのための最新および新興の細胞培養製造技術」 . Biomed Res Int . 2015 504831. doi : 10.1155/2015/504831 . PMC 4359798. PMID 25815321 .
- ^ a b「FDA、細胞培養技術を用いて製造された初の季節性インフルエンザワクチンを承認」(プレスリリース)。米国食品医薬品局(FDA)。 2013年1月2日時点のオリジナルよりアーカイブ。
 この記事には、パブリック ドメインであるこのソースからのテキストが組み込まれています。
この記事には、パブリック ドメインであるこのソースからのテキストが組み込まれています。 - ^ 「細胞ベースのインフルエンザワクチン」米国疾病予防管理センター(CDC)2019年10月11日。2019年12月2日時点のオリジナルよりアーカイブ。 2019年12月2日閲覧。
 この記事には、パブリック ドメインであるこのソースからのテキストが組み込まれています。
この記事には、パブリック ドメインであるこのソースからのテキストが組み込まれています。 - ^ a b「FDA、新技術を用いた新たな季節性インフルエンザワクチンを承認」(プレスリリース)。米国食品医薬品局(FDA)。2013年1月16日。2013年5月18日時点のオリジナルよりアーカイブ。
 この記事には、パブリック ドメインであるこのソースからのテキストが組み込まれています。
この記事には、パブリック ドメインであるこのソースからのテキストが組み込まれています。 - ^ Osterholm MT (2005年5月). 「次のパンデミックへの備え」. The New England Journal of Medicine . 352 (18): 1839–42 . CiteSeerX 10.1.1.608.6200 . doi : 10.1056/NEJMp058068 . PMID 15872196. S2CID 45893174 .
- ^ 「豚インフルエンザの流行」 1999年10月9日。1999年10月9日時点のオリジナルよりアーカイブ。
- ^ McCullers JA, Van De Velde LA, Allison KJ, Branum KC, Webby RJ, Flynn PM (2010年6月). 「1976年「豚インフルエンザ」ワクチン接種者は、2009年新型H1N1インフルエンザウイルスに対する中和反応を強化する」 . Clinical Infectious Diseases . 50 (11): 1487–92 . doi : 10.1086/652441 . PMC 2946351. PMID 20415539 .
- ^ a b Doshi P (2018年9月20日). 「パンデムリックスワクチン:なぜ一般の人々は早期警告サインについて知らされていなかったのか?」BMJ . 362 k3948. doi : 10.1136/bmj.k3948 . ISSN 0959-8138 . S2CID 52308748 .
- ^ a b Doshi P (2018年9月20日). 「パンデムリックスワクチン:なぜ一般の人々は早期警告サインについて知らされていなかったのか?」BMJ . 362 : インフォグラフィック. doi : 10.1136/bmj.k3948 . S2CID 52308748 .
- ^ Cohet C, van der Most R, Bauchau V, Bekkat-Berkani R, Doherty TM, Schuind A, et al. (2019年5月). 「AS03アジュバント添加インフルエンザワクチンの安全性:エビデンスのレビュー」 . Vaccine . 37 (23): 3006– 3021. doi : 10.1016/j.vaccine.2019.04.048 . PMID 31031030 .
- ^ 「季節性インフルエンザに対する初の四価ワクチンがFDAの承認を得る」 2012年3月2日。2012年3月4日時点のオリジナルよりアーカイブ。
- ^ 「FDA、季節性インフルエンザ予防のための初の四価ワクチンを承認」(プレスリリース)。米国食品医薬品局(FDA)。 2012年12月21日時点のオリジナルよりアーカイブ。
 この記事には、パブリック ドメインであるこのソースからのテキストが組み込まれています。
この記事には、パブリック ドメインであるこのソースからのテキストが組み込まれています。 - ^ 「2012年12月14日 承認書 – Fluarix Quadrivalent」米国食品医薬品局(FDA)。2013年1月2日時点のオリジナルよりアーカイブ。
 この記事には、パブリック ドメインであるこのソースからのテキストが組み込まれています。
この記事には、パブリック ドメインであるこのソースからのテキストが組み込まれています。 - ^国立予防接種諮問委員会(NACI)(2014年7月)。四価インフルエンザワクチンに関する文献レビュー(PDF)。オタワ:カナダ公衆衛生局。ISBN 978-1-100-24682-6. Cat.: HP40-117/2014E-PDF Pub.: 140118. 2020年8月1日時点のオリジナルよりアーカイブ(PDF) . 2020年1月11日閲覧。
- ^ 「2018~2019年のインフルエンザシーズンに知っておくべきこと」米国疾病予防管理センター(CDC) 2019年1月10日。2020年8月6日時点のオリジナルよりアーカイブ。 2020年2月5日閲覧。
 この記事には、パブリック ドメインであるこのソースからのテキストが組み込まれています。
この記事には、パブリック ドメインであるこのソースからのテキストが組み込まれています。 - ^ a b c d e f g h「インフルエンザ(Flu)に関するよくある質問:2019~2020年シーズン」。米国疾病予防管理センター(CDC)。2019年11月5日。2019年12月1日時点のオリジナルよりアーカイブ。 2019年11月30日閲覧。
 この記事には、パブリック ドメインであるこのソースからのテキストが組み込まれています。
この記事には、パブリック ドメインであるこのソースからのテキストが組み込まれています。 - ^ 「Fluzone High-Dose Quadrivalent」 . 米国食品医薬品局(FDA). 2019年11月4日. STN: BL 103914. 2020年1月12日時点のオリジナルよりアーカイブ。 2020年2月5日閲覧。
 この記事には、パブリック ドメインであるこのソースからのテキストが組み込まれています。
この記事には、パブリック ドメインであるこのソースからのテキストが組み込まれています。 - ^ 「FDA、65歳以上の成人向けにFluzone高用量四価(インフルエンザワクチン)を承認」サノフィ(プレスリリース)。2019年11月4日。2020年8月1日時点のオリジナルよりアーカイブ。 2020年2月5日閲覧。
- ^ a b c「Fluad Quadrivalent」。米国食品医薬品局(FDA)。2020年7月2日。STN: 125510。2020年8月11日時点のオリジナルよりアーカイブ。 2020年8月25日閲覧。
 この記事には、パブリック ドメインであるこのソースからのテキストが組み込まれています。
この記事には、パブリック ドメインであるこのソースからのテキストが組み込まれています。 - ^ 「Seqirus社、65歳以上の成人向けに4価フルアド(Fluad Quadrivalent)のFDA承認を取得」 Seqirus (プレスリリース)2020年2月24日。2020年8月26日時点のオリジナルよりアーカイブ。 2020年8月25日閲覧。
- ^ 「Seqirus、2020/21インフルエンザワクチンの米国市場への出荷を開始」Seqirus(プレスリリース)。2020年7月30日。2020年8月26日時点のオリジナルよりアーカイブ。2020年8月25日閲覧。
- ^ a b Koutsakos M, Wheatley AK, Laurie K, Kent SJ, Rockman S (2021年12月). 「COVID-19パンデミックにおけるインフルエンザ系統の絶滅?」 . Nature Reviews. Microbiology . 19 (12): 741– 742. doi : 10.1038/s41579-021-00642-4 . PMC 8477979. PMID 34584246 .
- ^ a b c世界保健機関(2023年9月29日). 「質疑応答:南半球2024年インフルエンザシーズンに使用するインフルエンザウイルスワクチンの推奨組成とパンデミック対策のための候補ワクチンウイルスの開発」(PDF) . 2023年10月10日時点のオリジナルよりアーカイブ(PDF) . 2023年10月26日閲覧。
- ^ a b Schnirring L (2023年9月29日). 「WHOアドバイザー、三価インフルエンザワクチンへの切り替えを推奨」 . CIDRAP . 2023年12月18日時点のオリジナルよりアーカイブ。2023年10月26日閲覧。
- ^ a b「2024~2025年の米国インフルエンザシーズンにおける三価インフルエンザワクチンの使用」米国食品医薬品局(FDA) 2024年3月5日。2024年3月7日時点のオリジナルよりアーカイブ。 2024年3月7日閲覧。
 この記事には、パブリック ドメインであるこのソースからのテキストが組み込まれています。
この記事には、パブリック ドメインであるこのソースからのテキストが組み込まれています。 - ^ a b c d e f「季節性インフルエンザワクチンに関する重要な事実」。米国疾病予防管理センター(CDC)。2019年12月2日。2019年12月2日時点のオリジナルよりアーカイブ。 2019年12月2日閲覧。
 この記事には、パブリック ドメインであるこのソースからのテキストが組み込まれています。
この記事には、パブリック ドメインであるこのソースからのテキストが組み込まれています。 - ^ a b「インフルエンザワクチン」英国国民保健サービス(NHS)2022年5月13日。2021年10月26日時点のオリジナルよりアーカイブ。 2022年8月13日閲覧。
- ^ Osterholm MT, Kelley NS, Sommer A, Belongia EA (2012年1月). 「インフルエンザワクチンの有効性と効果:系統的レビューとメタアナリシス」. The Lancet. Infectious Diseases . 12 (1): 36– 44. doi : 10.1016/s1473-3099(11)70295-x . PMID 22032844 .
- ^ MacIntyre CR, Mahimbo A, Moa AM, Barnes M (2016年12月). 「心筋梗塞予防のための冠動脈介入としてのインフルエンザワクチン」 . Heart . 102 (24): 1953– 1956. doi : 10.1136 / heartjnl-2016-309983 . PMC 5256393. PMID 27686519 .
- ^ a b「CDC季節性インフルエンザワクチンの有効性研究」米国疾病予防管理センター(CDC) 2025年5月30日。2025年9月23日時点のオリジナルよりアーカイブ。 2025年12月6日閲覧。
 この記事には、パブリック ドメインであるこのソースからのテキストが組み込まれています。
この記事には、パブリック ドメインであるこのソースからのテキストが組み込まれています。 - ^ Doyle JD, Chung JR, Kim SS, Gaglani M, Raiyani C, Zimmerman RK, et al. (2019年2月). 「2018-19年季節性インフルエンザワクチンの有効性の暫定推定値 - 米国、2019年2月」(PDF) . Morbidity and Mortality Weekly Report . 68 (6): 135–39 . doi : 10.15585/mmwr.mm6806a2 . PMC 6375657. PMID 30763298 .
 この記事には、パブリック ドメインであるこのソースからのテキストが組み込まれています。
この記事には、パブリック ドメインであるこのソースからのテキストが組み込まれています。 - ^ Dawood FS, Chung JR, Kim SS, Zimmerman RK, Nowalk MP, Jackson ML, et al. (2020年2月). 「2019-20年季節性インフルエンザワクチンの有効性の暫定推定値 - 米国、2020年2月」(PDF) . Morbidity and Mortality Weekly Report . 69 (7): 177–82 . doi : 10.15585/mmwr.mm6907a1 . PMC 7043386. PMID 32078591 .
 この記事には、パブリック ドメインであるこのソースからのテキストが組み込まれています。
この記事には、パブリック ドメインであるこのソースからのテキストが組み込まれています。 - ^ Fedson DS (1998). 「保護の測定:有効性と実効性」.生物学的標準化の発展. 95 : 195–201 . PMID 9855432 .
- ^ a b c d e Demicheli V, Jefferson T, Ferroni E, Rivetti A, Di Pietrantonj C (2018年2月). 「健康な成人におけるインフルエンザ予防のためのワクチン」 . Cochrane Database of Systematic Reviews . 2020 (2) CD001269. doi : 10.1002 / 14651858.CD001269.pub6 . PMC 6491184. PMID 29388196 .
- ^ Jefferson T (2006年10月). 「インフルエンザワクチン接種:政策とエビデンス」 . BMJ . 333 (7574): 912–15 . doi : 10.1136/bmj.38995.531701.80 . PMC 1626345. PMID 17068038 .
- ^ 「2007~2008年インフルエンザシーズン」米国疾病予防管理センター(CDC)2008年6月26日。2008年3月6日時点のオリジナルよりアーカイブ。
 この記事には、パブリック ドメインであるこのソースからのテキストが組み込まれています。
この記事には、パブリック ドメインであるこのソースからのテキストが組み込まれています。 - ^ Carrat F, Flahault A (2007年9月). 「インフルエンザワクチン:抗原ドリフトの課題」. Vaccine . 25 ( 39–40 ): 6852–6862 . doi : 10.1016/j.vaccine.2007.07.027 . PMID 17719149 .
- ^ Sautto GA, Kirchenbaum GA, Ross TM (2018年1月19日). 「ユニバーサルインフルエンザワクチンに向けて:一つの目標に向けた様々なアプローチ」 . Virology Journal . 15 (1) 17. doi : 10.1186/s12985-017-0918-y . PMC 5785881. PMID 29370862 .
- ^ a b Chow EJ, Doyle JD, Uyeki TM (2019年6月12日). 「インフルエンザウイルス関連の重篤疾患:予防、診断、治療」 . Critical Care . 23 (1) 214. doi : 10.1186/ s13054-019-2491-9 . PMC 6563376. PMID 31189475 .
- ^ Krammer F, Smith GJ, Fouchier RA, Peiris M, Kedzierska K, Doherty PC, et al. (2018年6月28日). 「インフルエンザ」 . Nature Reviews Disease Primers . 4 (1) 3. doi : 10.1038 / s41572-018-0002-y . PMC 7097467. PMID 29955068 .
- ^ Dabestani NM, Leidner AJ, Seiber EE, Kim H, Graitcer SB, Foppa IM, 他 (2019年9月). 「成人インフルエンザワクチン接種およびその他の予防サービスの費用対効果のレビュー」 .予防医学. 126 105734. doi : 10.1016/j.ypmed.2019.05.022 . PMC 6778688. PMID 31152830 .
- ^ a b c Ghebrehewet S、MacPherson P、Ho A (2016 年 12 月 7 日)。「インフルエンザ」。BMJ。355i6258。土井:10.1136/bmj.i6258。PMC 5141587。PMID 27927672。
- ^ a b Principi N, Esposito S (2018年3月4日). 「インフルエンザに対する小児の予防:新たな問題」 . Human Vaccines & Immunotherapeutics . 14 (3): 750– 757. doi : 10.1080/21645515.2017.1279772 . PMC 5861800. PMID 28129049 .
- ^ Thompson MG, Pierse N, Huang QS, Prasad N, Duque J, Newbern EC, et al. (2018年9月18日). 「2012~2015年ニュージーランドにおけるインフルエンザワクチンの有効性:インフルエンザ関連集中治療室入院の予防と成人の重症化軽減(インフルエンザワクチンの効果) 」 . Vaccine . 36 ( 39): 5916– 5925. doi : 10.1016/j.vaccine.2018.07.028 . ISSN 0264-410X . PMID 30077480. S2CID 51922011. 2022年5月27日時点のオリジナルよりアーカイブ。2022年4月23日閲覧。
- ^ Tenforde MW, Talbot HK, Trabue CH, Gaglani M, McNeal TS, Monto AS, et al. (2020年12月30日). 「米国におけるインフルエンザワクチンの入院に対する有効性、2019~2020年」 . The Journal of Infectious Diseases . 224 (5): 813– 820. doi : 10.1093/infdis/jiaa800 . ISSN 0022-1899 . PMC 8408767. PMID 33378531. 2022年4月23日時点のオリジナルよりアーカイブ。2022年4月23日閲覧。
- ^ Ferdinands JM, Thompson MG, Blanton L, Spencer S, Grant L, Fry AM (2021年6月23日). 「インフルエンザワクチン接種はブレイクスルー感染症の重症度を軽減するか? ナラティブレビューと今後の研究への提言」 . Vaccine . 39 (28): 3678– 3695. doi : 10.1016/j.vaccine.2021.05.011 . ISSN 0264-410X . PMID 34090700. S2CID 235361401. 2022年4月23日時点のオリジナルよりアーカイブ。2022年4月23日閲覧。
- ^ a b c「ワクチンの有効性:インフルエンザワクチンはどの程度効果があるのか?」米国疾病予防管理センター(CDC) 2018年10月12日。2019年10月25日時点のオリジナルよりアーカイブ。 2019年10月24日閲覧。
 この記事には、パブリック ドメインであるこのソースからのテキストが組み込まれています。
この記事には、パブリック ドメインであるこのソースからのテキストが組み込まれています。 - ^ Ramsay LC, Buchan SA, Stirling RG, Cowling BJ, Feng S, Kwong JC, 他 (2019年1月). 「インフルエンザワクチンの有効性に対するワクチン接種の繰り返しの影響:系統的レビューとメタアナリシス」 . BMC Medicine . 17 (1) 9. doi : 10.1186/s12916-018-1239-8 . PMC 6327561. PMID 30626399 .
- ^ Belongia EA, Skowronski DM, McLean HQ, Chambers C, Sundaram ME, De Serres G (2017年7月). 「毎年のインフルエンザワクチン接種の繰り返しとワクチンの有効性:エビデンスのレビュー」 Expert Review of Vaccines . 16 (7): 1– 14. doi : 10.1080/14760584.2017.1334554 . PMID 28562111 .
- ^ Ashraf N (2025). 「卵子の適応と免疫刷り込みがインフルエンザワクチンの有効性に与える影響」. Vaccine . 43 (6): 1172–1180 . doi : 10.1016/j.vaccine.2024.12.015 .
- ^ Liu F, Tzeng WP, Horner L, Kamal RP, Tatum HR, Blanchard EG, 他 (2018年10月). 「成人におけるインフルエンザワクチン接種後の循環A(H1N1)pdm09ウイルスに対する抗体反応に対するワクチンの免疫プライミングと卵適応の影響」 . The Journal of Infectious Diseases . 218 (10): 1571– 1581. doi : 10.1093 / infdis/jiy376 . PMC 8974399. PMID 29931203 .
- ^ Gemmill I, Young K (2018年6月7日). 「高齢者におけるサブユニットウイルスとスプリットウイルス不活化インフルエンザワクチンの有効性の比較に関するNACI文献レビューの要約」 .カナダ感染症報告書. 44 (6): 129– 133. doi : 10.14745/ccdr.v44i06a02 . ISSN 1481-8531 . PMC 6449119. PMID 31015805. 2020年5月17日時点のオリジナルよりアーカイブ。2020年6月2日閲覧。
- ^ 「インフルエンザと65歳以上の人々」。米国疾病予防管理センター。2021年8月26日。2022年4月22日時点のオリジナルよりアーカイブ。2022年4月21日閲覧。
- ^ MacIntyre CR, Mahimbo A, Moa AM, Barnes M (2016年12月). 「心筋梗塞予防のための冠動脈介入としてのインフルエンザワクチン」 . Heart . 102 (24): 1953– 1956. doi : 10.1136 / heartjnl-2016-309983 . PMC 5256393. PMID 27686519 .
- ^ Zeno EE (2024). 「2024年南半球インフルエンザワクチンのインフルエンザ関連入院予防における有効性の暫定推定値 ― REVELAC-iネットワーク、南米5カ国、2024年3~7月」 MMWR .疾病・死亡率週報. 73 (39): 861– 868. doi : 10.15585/mmwr.mm7339a1 . ISSN 0149-2195 . PMC 11449270. PMID 39361525 .
- ^ Benadjaoud Y. 「インフルエンザワクチン、南半球での入院リスクを35%低下:CDC」ABCニュース。2024年10月4日閲覧。
- ^ a b “インフルエンザの歴史的タイムライン | パンデミックインフルエンザ(インフルエンザ) | CDC” . 2020年3月11日. 2022年1月30日時点のオリジナルよりアーカイブ。 2022年1月27日閲覧。
- ^ a b「インフルエンザ(季節性)」世界保健機関(WHO) 2018年11月6日。2019年10月25日時点のオリジナルよりアーカイブ。 2019年10月24日閲覧。
- ^ 「小児のインフルエンザ関連死亡に関する研究で、健康な小児もリスクにさらされていることが判明」米国疾病予防管理センター(CDC) 2018年2月12日。 2019年12月2日時点のオリジナルよりアーカイブ。 2019年12月2日閲覧。
 この記事には、パブリック ドメインであるこのソースからのテキストが組み込まれています。
この記事には、パブリック ドメインであるこのソースからのテキストが組み込まれています。 - ^ a b Jefferson T, Rivetti A, Di Pietrantonj C, Demicheli V (2018年2月). 「健康な小児におけるインフルエンザ予防のためのワクチン」 . Cochrane Database of Systematic Reviews . 2018 (2) CD004879. doi : 10.1002/14651858.CD004879.pub5 . PMC 6491174. PMID 29388195 .
- ^ Steenhuysen J (2018年1月22日). 「小児死亡者増加を受け、米国CDC長官がインフルエンザワクチン接種を推奨」ロイター. 2021年5月6日時点のオリジナルよりアーカイブ。 2018年1月26日閲覧。
- ^ 「Fluzone High-Dose Quadrivalent」 . 米国食品医薬品局(FDA). 2019年11月14日. 2019年12月1日時点のオリジナルよりアーカイブ。 2019年11月30日閲覧。
 この記事には、パブリック ドメインであるこのソースからのテキストが組み込まれています。
この記事には、パブリック ドメインであるこのソースからのテキストが組み込まれています。 - ^ 「Afluria Quadrivalent」 . 米国食品医薬品局(FDA). 2019年11月8日. 2019年12月1日時点のオリジナルよりアーカイブ。 2019年11月30日閲覧。
 この記事には、パブリック ドメインであるこのソースからのテキストが組み込まれています。
この記事には、パブリック ドメインであるこのソースからのテキストが組み込まれています。 - ^国立予防接種諮問委員会(NACI)(2018年11月)。「補足声明 – アフルリア・テトラ – 諮問委員会声明(ACS)」。カナダ公衆衛生庁。オタワ。カタログ番号:HP37-25E-PDF 発行番号:180566。2020年1月12日時点のオリジナルよりアーカイブ。 2020年1月11日閲覧。
- ^健康な5~18歳児におけるインフルエンザワクチン接種に関する文献レビュー(PDF)(報告書)。オタワ:カナダ公衆衛生局。2014年7月。ISBN 978-1-100-24681-9. Cat.: HP40-116/2014E-PDF Pub.: 140116. 2020年8月1日時点のオリジナルよりアーカイブ(PDF) . 2020年1月12日閲覧。
- ^生後6~72ヶ月の小児におけるインフルエンザワクチンの使用に関する文献レビュー(PDF)(報告書)。オタワ:カナダ公衆衛生局。2015年。2020年5月17日時点のオリジナルよりアーカイブ(PDF) 。 2020年1月11日閲覧。
- ^ Peleg N, Zevit N, Shamir R, Chodick G, Levy I (2015年1月). 「季節性インフルエンザワクチン接種率と胃腸障害児における非接種理由」. Vaccine . 33 (1): 182– 186. doi : 10.1016/j.vaccine.2014.10.086 . PMID 25444802 .
- ^ a b Stacey H, Carlock M, Allen J, Hanley H, Crotty S, Ross T, et al. (2025年6月). 「複数のインフルエンザH3N2変異株に対するワクチン接種前の抗体価を活用し、ワクチン接種後の反応を予測する」 . eBioMedicine . 116 (105744): 1– 22. doi : 10.1016/j.ebiom.2025.105744 . PMC 12155842. PMID 40424667 .
- ^ a b Osterholm MT, Kelley NS, Sommer A, Belongia EA (2012年1月). 「インフルエンザワクチンの有効性と効果:系統的レビューとメタアナリシス」. The Lancet. Infectious Diseases . 12 (1): 36– 44. doi : 10.1016/S1473-3099(11)70295-X . PMID 22032844 .
- ^ a b Burls A, Jordan R, Barton P, Olowokure B, Wake B, Albon E, 他 (2006年5月). 「脆弱な人々を守るための医療従事者へのインフルエンザワクチン接種 ― 医療資源の有効活用か? エビデンスの体系的レビューと経済評価」. Vaccine . 24 (19): 4212–21 . doi : 10.1016/j.vaccine.2005.12.043 . PMID 16546308 .
- ^ Ahmed F, Lindley MC, Allred N, Weinbaum CM, Grohskopf L (2014年1月). 「医療従事者に対するインフルエンザワクチン接種が患者の罹患率と死亡率に与える影響:系統的レビューとエビデンスの格付け」 . Clinical Infectious Diseases . 58 (1): 50– 57. doi : 10.1093/cid/cit580 . PMID 24046301 .
- ^ Griffin MR (2014年1月). 「医療従事者へのインフルエンザワクチン接種:行動基準の策定」 .臨床感染症. 58 (1): 58–60 . doi : 10.1093/cid/cit590 . PMID 24046312 .
- ^ Simonsen L, Viboud C, Taylor RJ, Miller MA, Jackson L (2009年10月). 「インフルエンザワクチン接種と死亡率の減少:新たな知見と新たな機会」. Vaccine . 27 (45): 6300–04 . doi : 10.1016/j.vaccine.2009.07.008 . PMID 19840664 .
- ^ Demicheli V, Jefferson T, Di Pietrantonj C, Ferroni E, Thorning S, Thomas RE, 他 (2018年2月). 「高齢者におけるインフルエンザ予防のためのワクチン」 . Cochrane Database of Systematic Reviews . 2 (11) CD004876. doi : 10.1002/14651858.CD004876.pub4 . PMC 6491101. PMID 29388197 .
- ^ Darvishian M, Bijlsma MJ, Hak E, van den Heuvel ER (2014年12月). 「地域在住高齢者における季節性インフルエンザワクチンの有効性:陰性試験デザインの症例対照研究のメタアナリシス」. The Lancet. Infectious Diseases . 14 (12): 1228–39 . doi : 10.1016/S1473-3099(14)70960-0 . PMID 25455990 .
- ^ Nichol KL, Nordin JD, Nelson DB, Mullooly JP, Hak E (2007年10月). 「地域在住高齢者におけるインフルエンザワクチンの有効性」 . The New England Journal of Medicine . 357 (14): 1373–81 . doi : 10.1056/NEJMoa070844 . PMID 17914038. S2CID 14850833 .
- ^ Simonsen L, Taylor RJ, Viboud C, Miller MA, Jackson LA (2007年10月). 「高齢者におけるインフルエンザワクチン接種による死亡率へのベネフィット:継続的な論争」. The Lancet. Infectious Diseases . 7 (10): 658–66 . doi : 10.1016/S1473-3099(07)70236-0 . PMID 17897608 .
- ^ Thompson WW, Shay DK, Weintraub E, Brammer L, Cox N, Anderson LJ, et al. (2003年1月). 「米国におけるインフルエンザおよびRSウイルスに関連する死亡率」 . JAMA . 289 (2): 179–86 . doi : 10.1001 / jama.289.2.179 . PMID 12517228. S2CID 5018362 .
- ^ 「高齢者向けの高用量インフルエンザワクチン « Science-Based Medicine」。Sciencebasedmedicine.org。2010年10月19日。2013年5月8日時点のオリジナルよりアーカイブ。2013年10月17日閲覧。
- ^ 「Fluzone高用量季節性インフルエンザワクチン」米国疾病予防管理センター(CDC)2019年9月6日。2019年12月2日時点のオリジナルよりアーカイブ。 2019年12月2日閲覧。
- ^ DiazGranados CA, Dunning AJ, Kimmel M, Kirby D, Treanor J, Collins A, et al. (2014年8月). 「高齢者における高用量インフルエンザワクチンと標準用量インフルエンザワクチンの有効性の比較」 . The New England Journal of Medicine . 371 ( 7): 635–45 . doi : 10.1056/NEJMoa1315727 . PMID 25119609. S2CID 205096393 .
- ^ Wells C, Grobelna A (2019年1月8日). 「成人向け高用量インフルエンザワクチン:臨床効果、費用対効果、ガイドラインのレビュー」(PDF) .迅速対応報告書. オタワ:カナダ医薬品技術庁 (CADTH). ISSN 1922-8147 . PMID 31141324. 2020年8月1日時点のオリジナルよりアーカイブ(PDF) . 2022年8月15日閲覧.
- ^マスカーニ P、ヴィチェンツィ E、カヤステ=ルドニツキー A、ペリチョッタ G、モンティ A、チェルヴィ C、他。 (2012年)。 「医療従事者のグループにおけるパンデミックA/H1N1/2009インフルエンザワクチンの有効性と安全性の評価」。ラ メディチーナ デル ラヴォロ。103 (3): 220–29 . PMID 22838300。
- ^ 「FDA、アジュバントを含む初の季節性インフルエンザワクチンを承認」(プレスリリース)。米国食品医薬品局(FDA)。2015年11月24日。2017年7月22日時点のオリジナルよりアーカイブ。 2017年8月20日閲覧。
 この記事には、パブリック ドメインであるこのソースからのテキストが組み込まれています。
この記事には、パブリック ドメインであるこのソースからのテキストが組み込まれています。 - ^ a b「アジュバント配合インフルエンザワクチン」米国疾病予防管理センター(CDC) 2019年9月4日。2019年12月2日時点のオリジナルよりアーカイブ。 2019年12月2日閲覧。
 この記事には、パブリック ドメインであるこのソースからのテキストが組み込まれています。
この記事には、パブリック ドメインであるこのソースからのテキストが組み込まれています。 - ^ 「Fluad」 . 米国食品医薬品局(FDA). 2019年11月8日. STN 125510. 2019年12月2日時点のオリジナルよりアーカイブ。2019年12月2日閲覧。
 この記事には、パブリック ドメインであるこのソースからのテキストが組み込まれています。
この記事には、パブリック ドメインであるこのソースからのテキストが組み込まれています。 - ^「スクアレンアジュバント配合インフルエンザワクチン:新製剤。既存製品と比べても遜色ない」Prescrire International . 13 (74): 206–08 . 2004年12月. PMID 15599987 .
- ^ Camilloni B, Basileo M, Valente S, Nunzi E, Iorio AM (2015). 「60歳以上の被験者における筋肉内接種MF59アジュバント添加および皮内接種インフルエンザワクチンの免疫原性:文献レビュー」 . Human Vaccines & Immunotherapeutics . 11 (3): 553– 63. doi : 10.1080/21645515.2015.1011562 . PMC 4514405. PMID 25714138 .
- 「65歳以上の成人における高用量(Fluzone High-Dose)およびMF59アジュバント添加(Fluad)三価不活化インフルエンザワクチンの有効性と効果に関する文献レビューの最新情報」の一般向け要約。カナダ公衆衛生庁。2018年5月1日。
- ^ Van Damme P, Arnou R, Kafeja F, Fiquet A, Richard P, Thomas S, 他 (2010年5月). 「2種類の血清学的手法を用いた皮内接種とアジュバント添加季節性インフルエンザワクチンの非劣性評価:無作為化比較試験」 . BMC Infectious Diseases . 10 134. doi : 10.1186/1471-2334-10-134 . PMC 2895601. PMID 20504306 .
- ^ Haverkate M, D'Ancona F, Giambi C, Johansen K, Lopalco PL, Cozza V, 他 (VENICEプロジェクト ゲートキーパー コンタクトポイント コレクティブ) (2012年5月). 「EU、アイスランド、ノルウェーにおける義務的および推奨されるワクチン接種:国家ワクチン接種プログラムの実施方法に関するVENICE 2010調査の結果」 . Euro Surveillance . 17 (22). doi : 10.2807/ese.17.22.20183-en . PMID 22687916 .
- ^ Field RI (2009年11月). 「医療従事者へのワクチン接種義務化:誰の権利が優先されるべきか?」 P & T . 34 (11): 615–18 . PMC 2810172. PMID 20140133 .
- ^ Kassianos G (2015). 「欧州の医療従事者の季節性インフルエンザワクチン接種への意欲:現状と改善に向けた提言」 . Drugs in Context . 4 212268. doi : 10.7573/dic.212268 . PMC 4316812. PMID 25657810 .
- ^ Thomas RE, Jefferson T, Lasserson TJ, Earnshaw S (2025年2月). 「長期ケア施設に入所している60歳以上の患者をケアする医療従事者に対するインフルエンザワクチン接種」 .コクラン・システマティック・レビュー・データベース. 2 (2) CD005187. doi : 10.1002/14651858.CD005187.pub6 . PMC 11866472. PMID 40013540 .
- ^ 「Fluad Quad Australian prescription medicine decision summary」 Therapeutic Goods Administration (TGA) 2019年12月13日。2020年3月8日時点のオリジナルよりアーカイブ。 2020年8月24日閲覧。
- ^ 「Fluad Tetra EPAR」欧州医薬品庁(EMA) 2020年3月24日. 2020年8月1日時点のオリジナルよりアーカイブ。2020年5月29日閲覧。
- ^ 「Fluad Tetra 製品情報」。Union Register of Medicinal Products。2023年3月5日時点のオリジナルよりアーカイブ。2023年3月3日閲覧。
- ^ Fell DB, Sprague AE, Liu N, Yasseen AS, Wen SW, Smith G, 他 (2012年6月). 「妊娠中のH1N1インフルエンザワクチン接種と胎児および新生児の転帰」 . American Journal of Public Health (投稿原稿). 102 (6 ) : e33–40. doi : 10.2105/AJPH.2011.300606 . PMC 3483960. PMID 22515877 .
- ^ Madhi SA, Cutland CL, Kuwanda L, Weinberg A, Hugo A, Jones S, 他 (2014年9月). 「妊婦のインフルエンザワクチン接種と乳児の保護」. The New England Journal of Medicine . 371 (10): 918–31 . doi : 10.1056/NEJMoa1401480 . hdl : 2263/42412 . PMID 25184864 .
- ^ “インフルエンザ予防接種” . CDC . 2020. 2019年12月2日時点のオリジナルよりアーカイブ。2020年9月24日閲覧。
- ^ 「インフルエンザワクチンに関する誤解」 CDC 、 2020年。2020年8月10日時点のオリジナルよりアーカイブ。 2020年9月24日閲覧。
- ^ McNeil Jr DG (2018年10月1日). 「昨年の冬、インフルエンザで8万人以上のアメリカ人が死亡、過去最高」 . The New York Times . 2018年10月1日時点のオリジナルよりアーカイブ。 2024年6月24日閲覧。
- ^ 「インフルエンザワクチンに関する5つの誤解」世界保健機関。2024年2月14日時点のオリジナルよりアーカイブ。 2024年6月24日閲覧。
- ^ Haber P, Sejvar J, Mikaeloff Y, DeStefano F (2009). 「ワクチンとギランバレー症候群」. Drug Safety . 32 (4): 309–23 . doi : 10.2165/00002018-200932040-00005 . PMID 19388722. S2CID 33670594 .
- ^「再構成テキスト」. JAMA耳鼻咽喉科・頭頸部外科. 141 (5): 428. 2015年5月. doi : 10.1001 /jamaoto.2015.0540 . PMID 25996397. S2CID 26612829 .
- ^ Stowe J, Andrews N, Wise L, Miller E (2009年2月). 「英国一般診療研究データベースを用いたギランバレー症候群とインフルエンザワクチンおよびインフルエンザ様疾患の時間的関連性の調査」 . American Journal of Epidemiology . 169 (3): 382–88 . doi : 10.1093/aje/kwn310 . PMID 19033158 .
- ^ a b Sivadon-Tardy V, Orlikowski D, Porcher R, Sharshar T, Durand MC, Enouf V, et al. (2009年1月). 「ギラン・バレー症候群とインフルエンザウイルス感染症」 .臨床感染症. 48 (1): 48– 56. doi : 10.1086/594124 . PMID 19025491 .
- ^ Vellozzi C, Burwen DR, Dobardzic A, Ball R, Walton K, Haber P (2009年3月). 「成人における三価不活化インフルエンザワクチンの安全性:パンデミックインフルエンザワクチンの安全性モニタリングの背景」 . Vaccine . 27 (15): 2114–20 . doi : 10.1016/j.vaccine.2009.01.125 . PMID 19356614. 2020年8月1日時点のオリジナルよりアーカイブ。2020年5月21日閲覧。
- ^ Reinberg S (2011年2月2日). 「昨年のH1N1インフルエンザワクチンは安全だったと研究で判明」 US News & World Report . 2013年4月25日時点のオリジナルよりアーカイブ。
- ^ a b c d Roberts L (2021年3月27日). 「オーストラリア初の細胞ベースのインフルエンザワクチン、今シーズンから導入へ」 ABCニュース. 2021年4月27日時点のオリジナルよりアーカイブ。 2021年4月28日閲覧。
- ^国立予防接種諮問委員会(NACI)(2012年8月)「2012~2013年季節性インフルエンザワクチンに関する声明」(PDF)カナダ感染症報告書38ページ。オタワ。 2013年1月17日時点のオリジナル(PDF)からアーカイブ。 2013年7月18日閲覧。
- ^ Turner PJ, Southern J, Andrews NJ, Miller E, Erlewyn-Lajeunesse M (2015年12月). 「卵アレルギーのある若年者における弱毒生インフルエンザワクチンの安全性:多施設前向きコホート研究」. BMJ . 351 h6291 . doi : 10.1136/bmj.h6291 . PMC 4673102. PMID 26645895 .
- ^ Greenhawt M (2015年12月). 「卵アレルギーのある小児に対する弱毒化生インフルエンザワクチン」. BMJ . 351 h6656. doi : 10.1136/bmj.h6656 . PMID 26657778. S2CID 37037904 .
- ^ a b「ノバルティス、季節性インフルエンザの予防に役立つ米国初の細胞培養ワクチン「Flucelvax」のFDA承認を取得」(プレスリリース)。ノバルティス。2012年11月20日。2012年11月28日時点のオリジナルよりアーカイブ。
- ^ a b「Supemtek EPAR」 .欧州医薬品庁(EMA) . 2020年9月15日. 2021年1月10日時点のオリジナルよりアーカイブ。 2020年11月27日閲覧。
- ^技術報告書:パンデミックインフルエンザワクチン接種とナルコレプシーの関連(PDF)ストックホルム、スウェーデン:欧州疾病予防管理センター(ECDC)。2012年。ISBN 978-92-9193-388-4. 2013年12月31日時点のオリジナル(PDF)からアーカイブ。2013年12月30日閲覧。
- ^ Yong E (2013). 「ナルコレプシーは自己免疫疾患であることが確認された」Nature . doi : 10.1038/nature.2013.14413 . S2CID 74850662 .
- ^ 「インフルエンザワクチン中のチメロサール」米国疾病予防管理センター(CDC)2015年10月16日。2019年12月2日時点のオリジナルよりアーカイブ。 2019年12月2日閲覧。
 この記事には、パブリック ドメインであるこのソースからのテキストが組み込まれています。
この記事には、パブリック ドメインであるこのソースからのテキストが組み込まれています。 - ^ 「ワクチンに含まれるチメロサール:チメロサール - 懸念事項 - ワクチンの安全性」米国疾病予防管理センター(CDC)2015年10月27日。2019年11月2日時点のオリジナルよりアーカイブ。 2019年12月2日閲覧。
 この記事には、パブリック ドメインであるこのソースからのテキストが組み込まれています。
この記事には、パブリック ドメインであるこのソースからのテキストが組み込まれています。 - ^ Offit PA (2007年9月). 「チメロサールとワクチン ― 警告の物語」 . The New England Journal of Medicine . 357 (13): 1278–79 . doi : 10.1056/NEJMp078187 . PMID 17898096. S2CID 36318722 .
- ^ワクチン安全性に関する世界諮問委員会(2006年7月14日)「チオマーサールとワクチン」世界保健機関(WHO)。 2009年11月6日時点のオリジナルよりアーカイブ。 2007年11月20日閲覧。
- ^ Grande AJ, Reid H, Thomas EE, Nunan D, Foster C (2016年8月). 「成人におけるインフルエンザワクチン接種前の運動はインフルエンザ発症率と関連合併症の抑制に役立つ」 .コクラン・システマティック・レビュー・データベース. 2016 (8) CD011857. doi : 10.1002/14651858.CD011857.pub2 . PMC 8504432. PMID 27545762 .
- ^プロトキン SA、オレンスタイン WA (1988)。ワクチン。フィラデルフィア: WB サンダース社。 p. 424.ISBN 978-0-7216-1946-0. 2020年9月7日閲覧。
- ^製品モノグラフ:フルミスト(PDF)、アストラゼネカ・カナダ社、2014年6月20日、2020年9月30日時点のオリジナルよりアーカイブ(PDF) 、 2020年9月5日取得
- ^ 「世界インフルエンザ監視・対応システム(GISRS)」世界保健機関。2011年10月3日時点のオリジナルよりアーカイブ。 2019年10月22日閲覧。
- ^ a b Schnirring L (2023年9月29日). 「WHOアドバイザー、三価インフルエンザワクチンへの切り替えを推奨」 .感染症研究政策センター. 2023年12月18日時点のオリジナルよりアーカイブ。 2024年1月23日閲覧。
- ^ 「スポットライト:インフルエンザ」世界保健機関。2019年10月18日時点のオリジナルよりアーカイブ。 2019年10月22日閲覧。
- ^ 「世界のインフルエンザ監視」WHO。 2003年4月30日時点のオリジナルよりアーカイブ。
- ^ WHOの流行しやすい感染症の世界的サーベイランスに関する報告書 - インフルエンザ.世界保健機関(WHO). 2000. hdl : 10665/66485 . WHO/CDS/CSR/ISR/2000/1.
- ^ 「2024/2025年季節性インフルエンザワクチンの成分に関するEUの勧告」欧州医薬品庁(EMA) 2024年3月26日。2024年3月28日時点のオリジナルよりアーカイブ。 2024年3月28日閲覧。
- ^ KW、Lai A、Lee KC、Koh D、Lee SS(2016年10月)「医療従事者におけるインフルエンザワクチン接種率の向上:課題と解決策のレビュー」The Journal of Hospital Infection . 94 (2): 133–42 . doi : 10.1016/j.jhin.2016.07.003 . PMID 27546456 .
- ^ a b c d Rubin GJ, Potts HW, Michie S (2011年3月). 「医療従事者における豚インフルエンザワクチンおよび季節性インフルエンザワクチンの接種率:英国電話調査データの横断的分析」. Vaccine . 29 (13): 2421–28 . doi : 10.1016/j.vaccine.2011.01.035 . PMID 21277402 .
- ^ 「季節性インフルエンザ予防接種」米国疾病予防管理センター(CDC) 2019年12月9日。2019年12月2日時点のオリジナルよりアーカイブ。 2020年1月12日閲覧。
 この記事には、パブリック ドメインであるこのソースからのテキストが組み込まれています。
この記事には、パブリック ドメインであるこのソースからのテキストが組み込まれています。 - ^ 「ワクチンの使用」世界保健機関(WHO)。2012年12月15日時点のオリジナルよりアーカイブ。 2017年1月15日閲覧。
- ^ 「インフルエンザ(季節性)ファクトシート」世界保健機関(WHO)2016年11月。2014年11月30日時点のオリジナルよりアーカイブ。 2017年1月15日閲覧。
- ^ 「インフルエンザ(季節性)」WHO 2018年11月6日。2019年10月14日時点のオリジナルよりアーカイブ。 2019年10月14日閲覧。
- ^ 「対象グループにおけるインフルエンザワクチン接種率の評価方法(2016年)」 WHO /Europe 2018年3月19日。2019年10月14日時点のオリジナルよりアーカイブ。 2019年10月14日閲覧。
- ^ 「2019~2020年冬季インフルエンザワクチン接種に関する推奨事項」 WHO /Europe . 2019年9月24日. 2019年10月14日時点のオリジナルよりアーカイブ。 2019年10月14日閲覧。
- ^ a bカナダ予防接種ガイドのインフルエンザに関する章と2019~2020年季節性インフルエンザワクチンに関する声明(PDF)(レポート)。カナダ公衆衛生庁。2019年5月。カタログ番号:HP37-25E-PDF; 発行番号:180883。2020年7月16日時点のオリジナルからアーカイブ(PDF) 。 2020年6月2日閲覧。
- ^ 「重症インフルエンザのリスクグループ」欧州疾病予防管理センター(ECDC) 2017年10月20日. 2019年10月22日時点のオリジナルよりアーカイブ。 2019年10月22日閲覧。
- ^ 「ECDCレビュー – 季節性インフルエンザに関するWHOの新たな勧告…」欧州疾病予防管理センター(ECDC)。2017年5月10日時点のオリジナルよりアーカイブ。 2016年12月25日閲覧。
- ^ 「ECDCガイダンス:インフルエンザワクチン接種の優先リスクグループ」(PDF) .欧州疾病予防管理センター(ECDC) pp. 7– 8.オリジナル(PDF)から2016年12月25日時点のアーカイブ。 2016年12月25日閲覧。
- ^ 「インフルエンザワクチン」 nhs.uk 2024年3月6日。
- ^ 「プライベートインフルエンザ予防接種 | 薬局の予約 | 患者アクセス」www.patientaccess.com。
- ^ Grohskopf LA, Ferdinands JM, Blanton LH, Broder KR, Loehr J (2024年8月). 「ワクチンによる季節性インフルエンザの予防と管理:米国予防接種実施諮問委員会の勧告、2024~25年インフルエンザシーズン」(PDF) . MMWR. 勧告と報告書. 73 ( 5): 1– 25. doi : 10.15585/mmwr.rr7305a1 . PMC 11501009. PMID 39197095 .
- ^ a b c「小児とインフルエンザ(インフルエンザ)」米国疾病予防管理センター(CDC)2019年10月23日。2019年11月11日時点のオリジナルよりアーカイブ。
 この記事には、パブリック ドメインであるこのソースからのテキストが組み込まれています。
この記事には、パブリック ドメインであるこのソースからのテキストが組み込まれています。 - ^ Rahman K (2021年10月21日). 「米軍が義務付けているワクチンの全リスト」 . Newsweek . 2023年12月19日時点のオリジナルよりアーカイブ。
- ^ 「生弱毒化インフルエンザワクチン [LAIV](鼻腔スプレー型インフルエンザワクチン)」米国疾病予防管理センター(CDC) 2019年9月16日。2019年10月14日時点のオリジナルよりアーカイブ。 2019年10月14日閲覧。
 この記事には、パブリック ドメインであるこのソースからのテキストが組み込まれています。
この記事には、パブリック ドメインであるこのソースからのテキストが組み込まれています。 - ^ 「インフルエンザワクチン接種:臨床医・医療従事者向け概要 - 季節性インフルエンザ(インフルエンザ)」米国疾病予防管理センター(CDC)。2018年9月6日。2008年2月24日時点のオリジナルよりアーカイブ。
 この記事には、パブリック ドメインであるこのソースからのテキストが組み込まれています。
この記事には、パブリック ドメインであるこのソースからのテキストが組み込まれています。 - ^ 「Fluzone、Fluzone High-Dose、Fluzone Intradermal」米国食品医薬品局(FDA)2017年7月11日。2017年7月22日時点のオリジナルよりアーカイブ。 2020年6月1日閲覧。
- ^ Couch RB, Winokur P, Brady R, Belshe R, Chen WH, Cate TR, 他 (2007年11月). 「高齢者における高用量三価インフルエンザワクチンの安全性と免疫原性」. Vaccine . 25 ( 44): 7656–63 . doi : 10.1016/j.vaccine.2007.08.042 . PMC 2243220. PMID 17913310 .
- ^ Lee JK, Lam GK, Shin T, Kim J, Krishnan A, Greenberg DP, et al. (2018年5月). 「高齢者に対する高用量インフルエンザワクチンと標準用量インフルエンザワクチンの有効性と効果:系統的レビューとメタアナリシス」Expert Rev Vaccines . 17 (5): 435– 443. doi : 10.1080 / 14760584.2018.1471989 . PMID 29715054. S2CID 21688517 .
- ^ Robertson CA, DiazGranados CA, Decker MD, Chit A, Mercer M, Greenberg DP (2016年12月). 「Fluzone高用量インフルエンザワクチン」 . Expert Rev Vaccines . 15 (12): 1495– 1505. doi : 10.1080/14760584.2016.1254044 . PMID 27813430 .
- ^ 65歳以上の成人における高用量(Fluzone High-Dose)およびMF59アジュバント添加(Fluad)三価不活化インフルエンザワクチンの有効性と効果に関する文献レビューの最新情報(PDF)(報告書)。オタワ:カナダ公衆衛生局。2018年5月。HP40-210/2018E-PDF。2020年7月21日時点のオリジナルからアーカイブ(PDF) 。 2020年6月1日閲覧。
- ^ Tanner L (2013年1月13日). 「病院、インフルエンザ予防接種を拒否する従業員を厳しく取り締まる」 NBCニュース. 2013年12月3日時点のオリジナルよりアーカイブ。 2014年7月24日閲覧。
- ^米国疾病予防管理センター(CDC)(2010年12月)「妊婦における季節性インフルエンザおよび2009年H1N1インフルエンザワクチン接種率 - 10州、2009~2010年インフルエンザシーズン」(PDF)。『疾病・死亡週報』 59 ( 47):1541~ 45。PMID 21124293。 2017年6月25日時点のオリジナルよりアーカイブ(PDF)。
 この記事には、パブリック ドメインであるこのソースからのテキストが組み込まれています。
この記事には、パブリック ドメインであるこのソースからのテキストが組み込まれています。 - ^ a b Altman LK (2008年2月28日). 「委員会、18歳までの子供にインフルエンザ予防接種を勧告」 .ニューヨーク・タイムズ. 2015年1月22日時点のオリジナルよりアーカイブ。
- ^ 「ACIP、2016~2017年のインフルエンザシーズンにおけるLAIVの使用を否決」(プレスリリース)。米国疾病予防管理センター(CDC)。2016年6月22日。 2016年11月25日時点のオリジナルよりアーカイブ。 2016年11月26日閲覧。
 この記事には、パブリック ドメインであるこのソースからのテキストが組み込まれています。
この記事には、パブリック ドメインであるこのソースからのテキストが組み込まれています。 - ^ 「予防接種スケジュール」 . 米国疾病予防管理センター(CDC). 2014年11月5日時点のオリジナルよりアーカイブ。 2014年11月4日閲覧。
 この記事には、パブリック ドメインであるこのソースからのテキストが組み込まれています。
この記事には、パブリック ドメインであるこのソースからのテキストが組み込まれています。 - ^ 「インフルエンザワクチンに関するよくある質問」 Healthdirect、オーストラリア保健省、オーストラリア政府。2019年4月1日。2019年5月29日時点のオリジナルよりアーカイブ。 2019年5月29日閲覧。
- ^ 「インフルエンザファクトシート」。Healthdirect、オーストラリア保健省、オーストラリア政府。2019年4月1日。2019年5月29日時点のオリジナルよりアーカイブ。 2019年5月29日閲覧。
- ^ 「ヘルスケアの利用 – インフルエンザワクチン接種率 – OECDデータ」。theOECD。2020年8月8日時点のオリジナルよりアーカイブ。2020年4月24日閲覧。
- ^ a b Han YK, Michie S, Potts HW, Rubin GJ (2016年3月). 「2009/10年インフルエンザA型H1N1v(「豚インフルエンザ」)パンデミックにおけるインフルエンザワクチン接種率の予測因子:英国における5つの全国調査の結果」 .予防医学. 84 : 57–61 . doi : 10.1016/j.ypmed.2015.12.018 . PMC 4766366. PMID 26757401 .
- ^ Bish A, Yardley L, Nicoll A, Michie S (2011年9月). 「パンデミックインフルエンザワクチン接種の普及に関連する要因:系統的レビュー」. Vaccine . 29 (38): 6472–84 . doi : 10.1016/j.vaccine.2011.06.107 . PMID 21756960 .
- ^ Brien S, Kwong JC, Buckeridge DL (2012年2月). 「2009年パンデミックA/H1N1インフルエンザワクチン接種の決定要因:系統的レビュー」. Vaccine . 30 (7): 1255–64 . doi : 10.1016/j.vaccine.2011.12.089 . PMID 22214889 .
- ^ Thomas RE, Lorenzetti DL (2018年5月). 「地域社会における60歳以上のインフルエンザワクチン接種率向上のための介入」 .コクラン・システマティック・レビュー・データベース. 5 (5) CD005188. doi : 10.1002 / 14651858.CD005188.pub4 . PMC 6494593. PMID 29845606 .
- ^米国疾病予防管理センター(CDC)(2009年10月)「インフルエンザA(H1N1)2009単価ワクチンの最新情報」(PDF)。『疾病・死亡週報』58(39)1100-01。PMID 19816398。 2011年6月29日時点のオリジナルよりアーカイブ(PDF)
 この記事には、パブリック ドメインであるこのソースからのテキストが組み込まれています。
この記事には、パブリック ドメインであるこのソースからのテキストが組み込まれています。 - ^ラ・トーレ G、ディ・ティエネ D、カデドゥ C、リッチャルディ W、ボッチャ A (2009 年 12 月)。 「イタリアの医療従事者におけるパンデミック H1N1 インフルエンザの予防措置に関する行動、2009 年 10 月」。ユーロ監視。14 (49)。PMID 20003908。
- ^ Amodio E, Anastasi G, Marsala MG, Torregrossa MV, Romano N, Firenze A (2011年2月). 「シチリア島(イタリア)の主要教育病院における医療従事者における2009年パンデミックインフルエンザA(H1N1)ワクチン接種」. Vaccine . 29 (7): 1408–12 . doi : 10.1016/j.vaccine.2010.12.041 . PMID 21199700 .
- ^ Chor JS, Ngai KL, Goggins WB, Wong MC, Wong SY, Lee N, 他 (2009年8月). 「香港の医療従事者におけるパンデミック前のインフルエンザワクチン接種の受け入れ意向:WHOの異なる警戒レベルにおける2つのアンケート調査」 . BMJ . 339 b3391. doi : 10.1136/bmj.b3391 . PMC 2731837. PMID 19706937 .
- ^ Schnirring L (2011年8月18日). 「CDC、インフルエンザワクチン接種の推奨事項を更新」 .感染症研究政策センター(CIDRAP) . 2019年10月25日時点のオリジナルよりアーカイブ。2019年10月24日閲覧。
- ^米国疾病予防管理センター(CDC)(2011年8月)「医療従事者におけるインフルエンザワクチン接種率 - 米国、2010~2011年インフルエンザシーズン」(PDF)。『疾病・死亡率週報』60(32):1073~77。PMID 21849963。 2017年5月25日時点のオリジナルよりアーカイブ(PDF)
 この記事には、パブリック ドメインであるこのソースからのテキストが組み込まれています。
この記事には、パブリック ドメインであるこのソースからのテキストが組み込まれています。 - ^米国疾病予防管理センター(CDC)(2012年9月)「医療従事者におけるインフルエンザワクチン接種率:2011~2012年インフルエンザシーズン、米国」(PDF )。『疾病・死亡週報』 61 : 753 ~ 757。PMID 23013720。 2017年6月24日時点のオリジナルよりアーカイブ(PDF)
 この記事には、パブリック ドメインであるこのソースからのテキストが組み込まれています。
この記事には、パブリック ドメインであるこのソースからのテキストが組み込まれています。 - ^ Bull AL, Bennett N, Pitcher HC, Russo PL, Richards MJ (2007年2月). 「ビクトリア州公立病院の医療従事者におけるインフルエンザワクチン接種率」. The Medical Journal of Australia . 186 (4): 185–86 . doi : 10.5694 / j.1326-5377.2007.tb00858.x . PMID 17309419. S2CID 25091208 .
- ^ a b Abbasi J (2019年11月) . 「万能インフルエンザワクチンの探索がヒートアップ」. JAMA . 322 (20): 1942–1944 . doi : 10.1001/jama.2019.16816 . PMID 31693060. S2CID 207903441 .
- ^ a b c Greenfieldboyce N (2007年11月8日). 「インフルエンザワクチンを作る新旧の方法(ラジオ放送)」NPR . 2019年10月24日時点のオリジナルよりアーカイブ。 2019年10月23日閲覧。
- ^ Nachbagauer R, Krammer F (2017年4月). 「ユニバーサルインフルエンザウイルスワクチンと治療用抗体」 .臨床微生物学および感染. 23 (4): 222– 228. doi : 10.1016/j.cmi.2017.02.009 . PMC 5389886. PMID 28216325 .
- ^ Balfour H (2021年6月2日). 「ヒト初となるユニバーサルインフルエンザワクチンの試験開始」 . European Pharmaceutical Review . 2022年3月29日時点のオリジナルよりアーカイブ。2022年2月6日閲覧。
第I相試験(NCT04896086)では、実験的ワクチンであるFluMos-v1の安全性と免疫原性を評価する。
- ^ Bernstein DI, Guptill J, Naficy A, Nachbagauer R, Berlanda-Scorza F, Feser J, 他 (2020年1月). 「キメラヘマグルチニンをベースとしたユニバーサルインフルエンザウイルスワクチン候補の免疫原性:ランダム化プラセボ対照第1相臨床試験の中間結果」 . The Lancet. Infectious Diseases . 20 (1): 80– 91. doi : 10.1016 / S1473-3099(19)30393-7 . PMC 6928577. PMID 31630990 .
- ^ Nachbagauer R, Feser J, Naficy A, Bernstein DI, Guptill J, Walter EB, et al. (2021年1月). 「キメラヘマグルチニンをベースとしたユニバーサルインフルエンザウイルスワクチンは、ランダム化プラセボ対照第I相試験において、広範かつ長期的な免疫を誘導する」 . Nature Medicine . 27 (1): 106– 114. doi : 10.1038/s41591-020-1118-7 . PMID 33288923 .
- ^ 「広範な世界的アクセスのためのインフルエンザワクチン戦略」 Path 、 2007年10月。2019年10月14日時点のオリジナルよりアーカイブ。2009年9月16日閲覧。
- ^ a b「how it's made」(PDF) 。2010年7月5日時点のオリジナル(PDF)からアーカイブ。
- ^ 「インフルエンザワクチンウイルスと試薬」世界保健機関(WHO)。 2013年5月27日時点のオリジナルよりアーカイブ。
- ^ 「インフルエンザワクチン(不活化)の製造および管理に関する勧告」(PDF)世界保健機関(WHO)。2013年10月28日時点のオリジナルよりアーカイブ(PDF)。2013年5月27日閲覧。
- ^ a b Racaniello V (2009年12月). 「卵子におけるインフルエンザウイルスの増殖」 . Virology Blog. 2014年12月25日時点のオリジナルよりアーカイブ。
- ^ Izzat F (2012年4月). 「ニワトリ胚におけるウイルス培養」 . Youtube. 2015年5月26日時点のオリジナルよりアーカイブ。
- ^ a b「インフルエンザワクチンの製造方法」米国疾病予防管理センター(CDC)。2019年11月26日。2019年12月2日時点のオリジナルよりアーカイブ。 2019年12月2日閲覧。
 この記事には、パブリック ドメインであるこのソースからのテキストが組み込まれています。
この記事には、パブリック ドメインであるこのソースからのテキストが組み込まれています。 - ^ Seemann G, Kock M (2008). 「受精卵 – ワクチン製造における貴重な製品」 . Lohmann Breeders . 2023年11月23日時点のオリジナルよりアーカイブ。 2023年10月19日閲覧。
- ^ Bright RA, Carter DM, Daniluk S, Toapanta FR, Ahmad A, Gavrilov V, et al. (2007年5月). 「インフルエンザウイルス様粒子は、不活化インフルエンザウイルス全粒子や組換えヘマグルチニンよりも広範な免疫応答を誘発する」. Vaccine . 25 (19): 3871–78 . doi : 10.1016/j.vaccine.2007.01.106 . PMID 17337102 .
- ^ 「DNAワクチンによるプライミングで鳥インフルエンザワクチンの効果向上(NIHニュース)」 2011年10月3日。2012年9月27日時点のオリジナルよりアーカイブ。
- ^ ClinicalTrials.govにおける「鳥インフルエンザ予防ワクチン」の臨床試験番号NCT00776711
- ^ ClinicalTrials.gov の臨床試験番号NCT01086657「 健康な成人を対象とした、単価インフルエンザウイルス(H5N1)ワクチン A/Indonesia/05/2005(サノフィパスツール社)単独投与または組換えDNAプラスミド(H5)ワクチン VRC-AVIDNA036-00-VP(VRC、NIAID)投与後のプライムブースト間隔の安全性と免疫原性に関するオープンラベルランダム化第I相試験」
- ^生物製剤評価研究センター. 「承認製品 – 2012年11月20日承認書 – Flucelvax」 . 米国食品医薬品局(FDA). 2012年12月3日時点のオリジナルよりアーカイブ。
 この記事には、パブリック ドメインであるこのソースからのテキストが組み込まれています。
この記事には、パブリック ドメインであるこのソースからのテキストが組み込まれています。 - ^ 「Seqirus社、4歳以上の人を対象としたFlucelvax Quadrivalent(インフルエンザワクチン)のFDA承認を取得」(プレスリリース)Seqirus . 2016年5月23日。 2017年1月16日時点のオリジナルよりアーカイブ。 2017年1月15日閲覧。
- ^ Roos R (2019年10月14日). 「FDA、昆虫細胞で培養した初のインフルエンザワクチンを承認」 .感染症研究政策センター(CIDRAP) . 2019年10月14日時点のオリジナルよりアーカイブ。 2019年10月14日閲覧。
- ^ 「Flublok」 . 米国食品医薬品局(FDA). 2018年2月26日. STN 125285. 2019年10月14日時点のオリジナルよりアーカイブ。 2019年10月14日閲覧。
 この記事には、パブリック ドメインであるこのソースからのテキストが組み込まれています。
この記事には、パブリック ドメインであるこのソースからのテキストが組み込まれています。 - ^ 「Flublok Quadrivalent」 . 米国食品医薬品局(FDA). 2019年8月2日. STN 125285. 2019年10月14日時点のオリジナルよりアーカイブ。 2019年10月14日閲覧。
 この記事には、パブリック ドメインであるこのソースからのテキストが組み込まれています。
この記事には、パブリック ドメインであるこのソースからのテキストが組み込まれています。 - ^ a b「Supemtek:ECの決定待ち」欧州医薬品庁(EMA) 2020年9月17日. 2020年9月23日時点のオリジナルよりアーカイブ。2020年9月21日閲覧。テキストは、欧州医薬品庁の著作権が付与されているこの情報源からコピーされました。出典を明記すれば、複製は許可されます。
- ^ 「Supemtek製品情報」。医薬品連合登録簿。2023年3月5日時点のオリジナルよりアーカイブ。 2023年3月3日閲覧。
- ^ a b Sparrow E, Wood JG, Chadwick C, Newall AT, Torvaldsen S, Moen A, et al. (2021年1月). 「2019年における季節性およびパンデミックインフルエンザワクチンの世界生産能力」 . Vaccine . 39 ( 3): 512– 520. doi : 10.1016/j.vaccine.2020.12.018 . PMC 7814984. PMID 33341308 .
- ^ Jit M, Newall AT, Beutels P (2013年4月). 「季節性インフルエンザワクチン接種戦略の影響と費用対効果を推定するための重要な課題」 . Human Vaccines & Immunotherapeutics . 9 (4): 834–40 . doi : 10.4161 /hv.23637 . PMC 3903903. PMID 23357859 .
- ^ Postma MJ, Baltussen RP, Palache AM, Wilschut JC (2006年4月). 「高齢者インフルエンザワクチン接種の費用対効果に関するさらなるエビデンス」. Expert Review of Pharmacoeconomics & Outcomes Research . 6 (2): 215–27 . doi : 10.1586 / 14737167.6.2.215 . hdl : 1765/75033 . PMID 20528557. S2CID 12765724 .
- ^ Newall AT, Kelly H, Harsley S, Scuffham PA (2009). 「高齢者におけるインフルエンザワクチン接種の費用対効果:50~64歳層の経済評価に関する批判的レビュー」 . PharmacoEconomics . 27 ( 6): 439–50 . doi : 10.2165/00019053-200927060-00001 . PMID 19640008. S2CID 20855671 .
- ^ Newall AT, Viboud C, Wood JG (2010年6月). 「50歳以上のオーストラリア人におけるインフルエンザに起因する死亡率:異なるモデル化アプローチの比較」 .疫学と感染. 138 (6): 836–42 . doi : 10.1017/S095026880999118X . PMID 19941685. S2CID 29939376 .
- ^ Newall AT, Dehollain JP, Creighton P, Beutels P, Wood JG (2013年8月). 「小児におけるインフルエンザワクチン接種の費用対効果の理解:方法論的選択と季節変動」 . PharmacoEconomics . 31 ( 8): 693– 702. doi : 10.1007/s40273-013-0060-7 . PMID 23645539. S2CID 8616720 .
- ^ Newall AT, Scuffham PA (2011年12月). 「インフルエンザの費用対効果モデルにおける不確実性と変動性」 . Australian and New Zealand Journal of Public Health . 35 (6): 576, 著者返信 576–77. doi : 10.1111/j.1753-6405.2011.00788.x . PMID 22151168. S2CID 22402257 .
- ^ Gatwood J, Meltzer MI, Messonnier M, Ortega-Sanchez IR, Balkrishnan R, Prosser LA (2012年1月). 「健康な就労年齢の成人に対する季節性インフルエンザワクチン接種:経済評価のレビュー」. Drugs . 72 ( 1): 35– 48. doi : 10.2165/11597310-000000000-00000 . PMID 22191794. S2CID 46305863 .
- ^ Newall AT, Jit M, Beutels P (2012年8月). 「小児インフルエンザワクチン接種の経済的評価:批判的レビュー」 . PharmacoEconomics . 30 (8): 647–60 . doi : 10.2165/11599130-000000000-00000 . PMID 22788257. S2CID 38289883 .
- ^ Newall AT, Wood JG, Oudin N, MacIntyre CR (2010年2月). 「医薬品を用いたパンデミックインフルエンザ緩和戦略の費用対効果」 . Emerging Infectious Diseases . 16 (2): 224–30 . doi : 10.3201/eid1602.090571 . PMC 2957998. PMID 20113551 .
- ^ 「インフルエンザゲノム配列プロジェクト – 概要」。国立衛生研究所 – 国立アレルギー・感染症研究所。2011年6月27日時点のオリジナルよりアーカイブ。 2013年5月27日閲覧。
- ^ Lampos V, Yom-Tov E, Pebody R, Cox IJ (2015). 「ユーザー生成インターネットコンテンツによる健康介入の影響評価」(PDF) .データマイニングと知識発見. 29 (5): 1434– 1457. doi : 10.1007/s10618-015-0427-9 . S2CID 215415165. 2021年8月28日時点のオリジナルよりアーカイブ。2022年8月15日閲覧。
- ^ Wagner M, Lampos V, Yom-Tov E, Pebody R, Cox IJ (2017年12月). 「ソーシャルメディアコンテンツを用いたイングランドにおける新しい小児インフルエンザ予防接種プログラムの人口への影響の推定」 . Journal of Medical Internet Research . 19 (12): e416. doi : 10.2196/jmir.8184 . PMC 6257312. PMID 29269339 .
- ^ 「急性呼吸器感染症(2009年9月更新)」世界保健機関(WHO)2009年9月。2009年9月29日時点のオリジナルよりアーカイブ。2009年9月16日閲覧。
- ^ 「パンデミックインフルエンザプロトタイプワクチンの臨床試験に関する表」世界保健機関(WHO)2009年7月。 2009年3月6日時点のオリジナルよりアーカイブ。 2009年9月21日閲覧。
- ^ 「FDA、2009年型H1N1インフルエンザウイルスのワクチンを承認」(プレスリリース)2009年9月15日。2009年10月15日時点のオリジナルよりアーカイブ。 2009年10月15日閲覧。
 この記事には、パブリック ドメインであるこのソースからのテキストが組み込まれています。
この記事には、パブリック ドメインであるこのソースからのテキストが組み込まれています。 - ^ Keown A (2020年2月4日). 「FDAがSeqirusのAudenzを潜在的なインフルエンザパンデミックに対するワクチンとして承認」 BioSpace . 2020年2月5日時点のオリジナルよりアーカイブ。2020年2月5日閲覧。
- ^ 「Audenz」 . 米国食品医薬品局(FDA). 2020年1月31日. STN: 125692. 2020年8月6日時点のオリジナルよりアーカイブ。2020年2月5日閲覧。
 この記事には、パブリック ドメインであるこのソースからのテキストが組み込まれています。
この記事には、パブリック ドメインであるこのソースからのテキストが組み込まれています。 - ^ a b「人獣共通インフルエンザワクチンSeqirus EPAR」欧州医薬品庁(EMA) 2023年10月9日。 2024年9月26日閲覧。
- ^ a b c Cho A, Wrammert J (2016年4月). 「インフルエンザ万能ワクチン開発における広域中和抗体の影響」 Current Opinion in Virology 17 : 110–115 . doi : 10.1016 /j.coviro.2016.03.002 . PMC 4940123. PMID 27031684 .
- ^奥野裕、伊勢川裕、笹尾F、上田S (1993年5月)。「A型インフルエンザウイルスH1株とH2株の血球凝集素間で保存されている共通の中和エピトープ」。ウイルス学ジャーナル。67 (5): 2552–2558。土井: 10.1128/JVI.67.5.2552-2558.1993。PMC 237575。PMID 7682624。
- ^ a b c d Soema PC, Kompier R, Amorij JP, Kersten GF (2015年8月). 「現行および次世代インフルエンザワクチン:製剤および製造戦略」 . European Journal of Pharmaceutics and Biopharmaceutics . 94 : 251–263 . doi : 10.1016/j.ejpb.2015.05.023 . hdl : 1887/43765 . PMID 26047796 .
- ^ Deng L, Cho KJ, Fiers W, Saelens X (2015年2月). 「M2eベースのユニバーサルインフルエンザAワクチン」 .ワクチン. 3 (1): 105–36 . doi : 10.3390/vaccines3010105 . PMC 4494237. PMID 26344949 .
- ^ Gottlieb T, Ben-Yedidia T (2014年11月). 「エピトープに基づくユニバーサルインフルエンザワクチンへのアプローチ」. Journal of Autoimmunity . 54 : 15–20 . doi : 10.1016/j.jaut.2014.07.005 . PMID 25172355 .
- ^ Toussi DN, Massari P (2014年4月). 「分子的に定義されたToll様受容体リガンドの免疫アジュバント効果」 .ワクチン. 2 (2): 323–53 . doi : 10.3390/vaccines2020323 . PMC 4494261. PMID 26344622 .
- ^ Sederstrom J (2019年7月19日). 「研究者らが経口インフルエンザワクチンと治療の選択肢を探る」 . Drug Topics . 2020年6月8日時点のオリジナルよりアーカイブ。2020年1月27日閲覧。
- ^ Jasty M, Bragdon CR, Schutzer S, Rubash H, Haire T, Harris WH (1989年12月). 「多孔質コーティングを施した犬用全股関節置換術における骨の成長.後方散乱走査型電子顕微鏡法と画像解析による定量化」. Scanning Microscopy . 3 (4): 1051–6 , discussion 1056–57. doi : 10.1016/s1473-3099(15)00252-2 . PMID 2633331 .
- ^ Liebowitz D, Gottlieb K, Kolhatkar NS, Garg SJ, Asher JM, Nazareno J, et al. (2020年4月). 「経口インフルエンザワクチンの有効性、免疫原性、安全性:プラセボ対照および実薬対照の第2相ヒトチャレンジ試験」. The Lancet. Infectious Diseases . 20 (4). Elsevier: 435– 444. doi : 10.1016 / S1473-3099(19)30584-5 . PMID 31978354. S2CID 210892802 .
- ^ Behrouzi B, Bhatt DL, Cannon CP, Vardeny O, Lee DS, Solomon SD, et al. (2022年4月29日). 「インフルエンザワクチン接種と心血管リスクの関連性:メタ分析」 . JAMA Network Open . 5 (4) e228873. doi : 10.1001/jamanetworkopen.2022.8873 . PMC 9055450. PMID 35486404 .
- ^ Behrouzi B, Udell JA (2022年1月13日). 「ユニバーサルインフルエンザワクチン:生涯にわたる心臓保護への挑戦?」 . Nature Reviews Cardiology . 19 (3): 145– 146. doi : 10.1038 / s41569-021-00670-w . PMC 8757624. PMID 35027698 .
- ^ Holodinsky JK, Zerna C, Malo S, Svenson LW, Hill MD (2022年11月30日). 「カナダ、アルバータ州におけるインフルエンザワクチン接種と脳卒中リスクの関連性:人口ベース研究」 . Lancet Public Health . 7 (11): e914– e922. doi : 10.1016/S2468-2667(22)00222-5 . PMID 36334607 .
- ^ Hjelholt AJ, Bergh C, Bhatt DL, Frobert O, Kjolby MF (2023年8月25日). 「インフルエンザワクチン接種の多面的効果」 .ワクチン. 11 (9): 1419. doi : 10.3390/vaccines11091419 . PMC 10536538. PMID 37766096 .
- ^ Triggle N (2021年10月8日). 「この冬、新型コロナワクチンとともにインフルエンザ予防接種が不可欠」 BBCニュース. 2021年11月14日時点のオリジナルよりアーカイブ。 2022年8月13日閲覧。
- ^ Callaway E (2022年5月16日). 「インフルエンザワクチンはCOVID-19のリスクを軽減できる可能性がある」 . Nature . 605 (7911): 602. Bibcode : 2022Natur.605..602C . doi : 10.1038/d41586-022-01315-9 . PMID : 35581411. S2CID : 248859545 .
- ^ Jefferson T (2006年10月28日). 「インフルエンザワクチン接種:政策とエビデンス」 . BMJ . 333 (7574): 912– 915. doi : 10.1136/bmj.38995.531701.80 . ISSN 0959-8138 . PMC 1626345. PMID 17068038 .
- ^ Brownlee S, Lenzer J (2009年11月1日). 「ワクチンは重要か?」 .アトランティック誌. 2012年10月30日時点のオリジナルよりアーカイブ。2025年9月1日閲覧。
- ^ Rabin RC (2012年11月5日). 「インフルエンザシーズン到来に伴うインフルエンザ予防接種の再評価」 .ニューヨーク・タイムズ. 2016年11月10日時点のオリジナルよりアーカイブ。 2016年12月30日閲覧。
「このワクチンは過剰に宣伝し、大げさに宣伝しすぎました」と、感染症研究政策センターとインフルエンザ研究監視卓越センターの所長、マイケル・T・オスターホルム氏は述べた。「宣伝されているほどの効果はありません。すべてはセールスマンの仕事、広報活動に過ぎません。」
- ^インフルエンザレポート(オンラインブック) 2016年5月10日アーカイブ、 Wayback Machineの章「鳥インフルエンザ」 Timm C. HarderとOrtrud Werner著
- ^ equiflunet_vaccines 2006年1月10日アーカイブ、 Wayback Machine
- ^ “UAE Equestrian & Racing Federation” . 2005年3月22日.オリジナルよりアーカイブ。 2005年3月22日.
- ^ 「FEIガイドライン」(PDF)。2007年10月26日時点のオリジナルよりアーカイブ(PDF) 。
- ^ 「高病原性鳥インフルエンザに対する家禽のワクチン接種 - 利用可能なワクチンとワクチン接種戦略」 efsa.europa.eu 2023年10月10日2024年5月9日閲覧。
- ^ 「鳥インフルエンザウイルス(HPAI)の候補ワクチンウイルス(CVV)の作成」米国疾病予防管理センター(CDC) 2024年6月3日。 2024年6月15日閲覧。
- ^ 「豚インフルエンザウイルスが風土病化」 2007年9月15日。2009年4月29日時点のオリジナルよりアーカイブ。
- ^ 「カスタムワクチン:豚」 。2009年4月30日時点のオリジナルよりアーカイブ。
- ^ Karaca K, Dubovi EJ, Siger L, Robles A, Audonnet JC, Jiansheng Y, 他 (2007年2月). 「カナリア痘ベクター馬インフルエンザウイルスワクチンの犬における犬インフルエンザウイルスに対する体液性免疫応答誘導能の評価」. American Journal of Veterinary Research . 68 (2): 208–12 . doi : 10.2460/ajvr.68.2.208 . PMID 17269888 .
さらに読む
- 予防接種の免疫学的基礎シリーズ:モジュール23:インフルエンザワクチン.世界保健機関(WHO). 2017年10月. HDL : 10665/259211 . ISBN 978-92-4-151305-0。
- Ramsay M. 編 (2021年1月21日). 「第19章:インフルエンザ」 .感染症に対する予防接種. イングランド公衆衛生局. 2019年11月12日時点のオリジナルよりアーカイブ。 2019年10月24日閲覧。
- Hall E、Wodi AP、Hamborsky J、Morelli V、Schillie S編(2021年)「第12章 インフルエンザ」。『ワクチン予防可能疾患の疫学と予防』 (第14版)。ワシントンD.C.:米国疾病予防管理センター(CDC)。2016年12月30日時点のオリジナルよりアーカイブ。 2019年10月24日閲覧。
- Budd A, Blanton L, Grohskopf L, Campbell A, Dugan V, Wentworth DE, et al. (2019年3月29日). 「第6章:インフルエンザ」 . Roush SW, Baldy LM, Hall MA (編).ワクチン予防可能疾患のサーベイランスマニュアル. アトランタ, GA: 米国疾病予防管理センター(CDC). 2020年8月1日時点のオリジナルよりアーカイブ。 2019年10月24日閲覧。
- 国家予防接種諮問委員会(2020年5月)「カナダ予防接種ガイド インフルエンザに関する章および2020~2021年季節性インフルエンザワクチンに関する声明」(PDF)。カナダ公衆衛生庁。カタログ番号:HP37-25F-PDF; 発行番号:200003。2020年8月3日時点のオリジナルからアーカイブ(PDF) 。 2020年6月2日閲覧。
- Young K、Gemmill I、Harrison R、他(国家予防接種諮問委員会)(2020年5月7日)「2020~2021年NACI季節性インフルエンザワクチン声明の要約」カナダ感染症報告書第46巻第5号。
- 国家予防接種諮問委員会(NACI)(2018年5月)。65歳以上の成人におけるサブユニットウイルスおよびスプリットウイルス不活化インフルエンザワクチンの有効性と免疫原性の比較に関するNACI文献レビュー(PDF)。カナダ政府。ISBN 978-0-660-26438-7. Cat.: HP40-213/2018E-PDF; Pub.: 180039. 2020年7月18日時点のオリジナルよりアーカイブ(PDF) . 2020年1月12日閲覧。
- Gemmill I、Young K、他(米国国家予防接種諮問委員会)(2018年6月7日)「高齢者におけるサブユニットウイルスおよびスプリットウイルス不活化インフルエンザワクチンの有効性の比較に関するNACI文献レビューの要約」カナダ感染症報告書第44巻第6号。
- Rajaram S, Wojcik R, Moore C, Ortiz de Lejarazu R, de Lusignan S, Montomoli E, 他 (2020年8月). 「候補インフルエンザウイルスと卵由来ワクチンの製造がワクチンの有効性に与える影響:文献レビューと専門家のコンセンサス」 . Vaccine . 38 (38): 6047– 6056. doi : 10.1016/j.vaccine.2020.06.021 . hdl : 11577/3540427 . PMID 32600916 .
外部リンク
- 不活化インフルエンザワクチン情報声明、米国疾病予防管理センター(CDC)
- 生経鼻インフルエンザワクチン情報声明、米国疾病予防管理センター(CDC)
- 季節性インフルエンザ(インフルエンザ)ワクチン接種と予防可能な疾患、米国疾病予防管理センター(CDC)
- 季節性インフルエンザとインフルエンザワクチンに関する誤解、米国疾病予防管理センター(CDC)
- 米国国立医学図書館医学件名表題集(MeSH)におけるインフルエンザワクチン
