窒素循環

窒素循環は、窒素が大気、陸上、海洋の生態系を循環する中で、様々な化学形態に変換される生物地球化学循環です。窒素の変換は、生物学的プロセスと物理的プロセスの両方によって行われます。窒素循環における重要なプロセスには、固定、アンモニア化、硝化、脱窒などがあります。地球の大気の大部分(78%)は大気窒素であり、[ 16 ]最大の窒素源となっています。しかし、大気窒素は生物学的利用能が限られているため、多くの生態系において利用可能な窒素が不足しています。
窒素循環は、窒素の利用可能性が一次生産や分解を含む主要な生態系プロセスの速度に影響を与える可能性があるため、生態学者にとって特に興味深い分野です。化石燃料の燃焼、人工窒素肥料の使用、廃水への窒素の排出といった人間の活動は、地球規模の窒素循環を劇的に変えてきました。[ 17 ] [ 18 ] [ 19 ]人間による地球規模の窒素循環の改変は、自然環境システムだけでなく、人間の健康にも悪影響を及ぼす可能性があります。[ 20 ] [ 21 ]
プロセス
| シリーズの一部 |
| 生物地球化学循環 |
|---|
 |
窒素は、有機窒素、アンモニウム(NH+4)、亜硝酸塩(NO−2)、硝酸塩(NO−3窒素は、大気中に放出される有機窒素(N 2 O)、亜酸化窒素(N 2 )、一酸化窒素(NO)、または無機窒素ガス(N 2)です。有機窒素は、生物、腐植土、または有機物分解の中間生成物の形で存在します。窒素循環で説明されているプロセスは、窒素物質をある形から別の形に変換します。これらのプロセスの多くは、微生物によって実行され、エネルギーを収穫するため、または成長に必要な形で窒素を蓄積するために行われます。たとえば、動物の尿に含まれる窒素廃棄物は、土壌中の硝化細菌によって分解され、植物が利用します。横の図は、これらのプロセスがどのように組み合わさって窒素循環を形成するかを示しています。
窒素固定
大気中、工業中、生物学的プロセスを通じて窒素ガス ( N2 )を硝酸塩と亜硝酸塩に変換することを窒素固定といいます。大気中の窒素は、植物が吸収できる形に処理、つまり「固定」する必要があります。年間 50 億~ 100 億 kg が落雷によって固定されますが、ほとんどの固定は、ジアゾトロフと呼ばれる自由生活細菌または共生細菌によって行われます。これらの細菌は窒素固定酵素を持っており、この酵素は窒素ガスと水素を結合させてアンモニアを生成します。アンモニアは細菌によって他の有機化合物に変換されます。ほとんどの生物学的窒素固定は、さまざまな細菌や一部の古細菌に含まれるモリブデン(Mo)-ニトロゲナーゼの活性によって起こります。モリブデン-ニトロゲナーゼは、複数の金属含有補欠分子族を持つ複雑な2成分酵素です。 [ 22 ]自由生活細菌の例としては、アゾトバクターがあります。根粒菌などの共生窒素固定細菌は、通常、マメ科植物(エンドウ豆、アルファルファ、ニセアカシアなど)の根粒に生息します。ここで細菌は植物と共生関係を築き、炭水化物と交換にアンモニアを生成します。この関係により、マメ科植物は窒素に乏しい土壌の窒素含有量を増加させることがよくあります。マメ科植物以外の一部の植物も、このような共生関係を築くことがあります。現在、固定窒素全体の約30%は、高温高圧下で窒素ガスと水素源(天然ガスまたは石油)をアンモニアに変換するハーバー・ボッシュ法[ 23 ]によって工業的に生産されています。 [ 24 ]
同化
植物は根毛を通して土壌から硝酸塩またはアンモニウムを吸収することができます。吸収された硝酸塩は、まず亜硝酸イオンに還元され、その後アンモニウムイオンに変換されてアミノ酸、核酸、クロロフィルに取り込まれます。根粒菌と共生関係にある植物では、一部の窒素は根粒から直接アンモニウムイオンとして同化されます。現在では、根粒菌のバクテロイドと植物の間では、より複雑なアミノ酸循環が行われていることが分かっています。植物はバクテロイドにアミノ酸を供給するため、アンモニアの同化は不要であり、バクテロイドは(新たに固定された窒素とともに)アミノ酸を植物に返すことで、相互依存関係を形成しています。[ 25 ]多くの動物、真菌、その他の従属栄養生物は、アミノ酸、ヌクレオチド、その他の小さな有機分子を摂取することで窒素を獲得しますが、他の従属栄養生物(多くの細菌を含む)は、アンモニウムなどの無機化合物を唯一の窒素源として利用できます。様々な窒素源の利用は、すべての生物において厳密に制御されています。
アンモニフィケーション
植物や動物が死ぬか、動物が排泄物を排出するとき、窒素の最初の形態は有機であり、アミノ酸やDNAなどの形で存在します。[ 26 ]細菌や真菌は、アンモニア化または無機化と呼ばれる一連のプロセスを経て、この有機窒素をアンモニア、時にはアンモニウムに変換します。これは、有機化合物が関与する窒素循環ステップの最後のステップです。[ 27 ]脱水素酵素、プロテアーゼ、グルタミン酸脱水素酵素やグルタミン合成酵素などの脱アミノ酵素を含む無数の酵素が関与しています。[ 28 ]窒素の無機化とアンモニア化は、土壌中の有機窒素、[ 29 ]土壌微生物バイオマス、および平均年間降水量と正の相関関係があります。[ 30 ]これらは温度の変化にも密接に反応します。[ 31 ]しかし、これらのプロセスは、炭素と窒素の比率が高い植生が存在する場合[ 32 ] [ 33 ]や糖による施肥がある場合には遅くなります。[ 34 ] [ 35 ]

硝化作用
アンモニウムから硝酸塩への変換は、主に土壌細菌やその他の硝化細菌によって行われます。硝化の初期段階では、アンモニウム(NH+4)は、ニトロソモナス属などの細菌によって行われ、アンモニアを亜硝酸塩(NO−2)。ニトロバクターなどの他の細菌種は、亜硝酸塩(NO−2)を硝酸塩(NO−3)。アンモニアガスは植物にとって有毒であるため、アンモニア(NH 3)を硝酸塩または亜硝酸塩に変換すること が重要です。
硝酸塩は溶解度が非常に高く、土壌が陰イオンを保持しにくいため、地下水に入り込む可能性がある。地下水中の硝酸塩濃度の上昇は飲料水の使用に関して懸念される。なぜなら、硝酸塩は乳児の血中酸素濃度を阻害し、メトヘモグロビン血症や青色児症候群を引き起こす可能性があるからである。[ 38 ]地下水が川の流れを補給している場所では、硝酸塩に富む地下水は富栄養化の一因となり、藻類、特に藍藻類の増加につながる。硝酸塩はアンモニアのように魚類に直接毒性はないが、この富栄養化に寄与すると魚類に間接的な影響を及ぼす可能性がある。窒素は、一部の水域で深刻な富栄養化問題の一因となっている。2006年以降、英国と米国では窒素肥料の施用がますます規制されている。これは、リン肥料の管理と同じ流れで起こっており、リン肥料の制限は通常、富栄養化した水域の回復に不可欠であると考えられています。
脱窒
脱窒とは、硝酸塩を窒素ガス(N2脱窒は嫌気性条件下で起こる。このプロセスは、シュードモナス属やパラコッカス属などの細菌種によって行われる。これらの細菌は、呼吸の際に酸素の代わりに硝酸塩を電子受容体として利用する。これらの通性嫌気性細菌は好気性条件でも生存できる。脱窒は嫌気性条件、例えば水浸しの土壌で起こる。脱窒細菌は土壌中の硝酸塩を使って呼吸を行い、結果として植物には利用できない不活性な窒素ガスを生成する。脱窒は自由生活微生物だけでなく、嫌気性繊毛虫の偏性共生菌でも起こる。[ 39 ]
- 窒素循環の古典的な表現
- 生態系を通じた窒素の流れ。細菌は循環の重要な要素であり、高等生物が同化できる様々な形態の窒素化合物を提供する。
- 窒素循環の簡略図。青は窒素の貯蔵、緑は窒素をある場所から別の場所へ移動させるプロセス、赤は関与するバクテリアを表しています。
硝酸塩からアンモニウムへの異化還元
異化的硝酸塩還元によるアンモニウム化(DNRA)、または硝酸塩/亜硝酸塩のアンモニア化は嫌気性呼吸プロセスです。DNRAを行う微生物は有機物を酸化し、硝酸塩を電子受容体として亜硝酸塩に還元し、さらにアンモニウム(NO−3 → いいえ−2 → NH+4)。[ 40 ]脱窒細菌と硝酸アンモニウム化細菌は環境中の硝酸塩をめぐって競合するが、DNRAは二窒素ガスを生成するのではなく、生物が利用可能な窒素を可溶性アンモニウムとして保存する働きをする。[ 41 ]
嫌気性アンモニア酸化
ANの好気性AMMオニアOX化プロセスは、 ANAMMOXプロセスとも呼ばれ、これら3つの単語の最初の音節をつなげた造語です。この生物学的プロセスは酸化還元均化反応であり、アンモニア(電子を与える還元剤)と亜硝酸塩(電子を受け取る酸化剤)が3つの電子を授受して1分子の二原子窒素(N)に変換されます。2)ガスと2つの水分子から構成されます。このプロセスは、海洋における窒素変換の大部分を占めています。ANAMMOX化学反応の化学量論的にバランスの取れた式は、アンモニウムイオンにアンモニア分子とその共役塩基が含まれるように次のように表されます。
- NH+4+ いいえ−2 → N 2 + 2 H 2 O (Δ G ° =−357 kJ⋅mol −1)。[ 42 ]
これは、エネルギーを放出する発エルゴンプロセス(ここでは発熱反応でもある)であり、反応生成物と試薬間の ギブズ自由エネルギーの差である Δ G °の負の値で示されます。
その他のプロセス
ほとんどの生態系では窒素固定が植物が利用可能な窒素の主な供給源であるが、窒素に富む岩盤のある地域では、この岩盤の分解も窒素源として機能している。[ 43 ] [ 44 ] [ 45 ]硝酸塩の還元も鉄循環の一部であり、無酸素条件下ではFe(II)はNOに電子を供与することができる。−3そしてFe(III)に酸化され、NO−3NOに還元される−2、N 2 O、N 2、およびNH+4条件や微生物の種類によって異なります。[ 46 ]クジラ目の糞便は海洋窒素循環の接合部としても機能し、海洋環境の表層部に窒素を濃縮してから様々な海洋層に拡散させ、最終的に海洋の一次生産性を高めます。[ 47 ]
海洋窒素循環
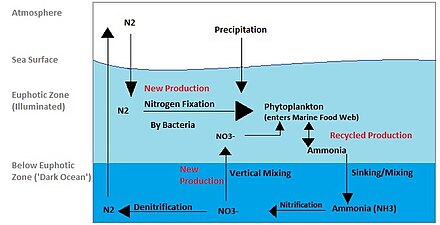


窒素循環は海洋においても重要なプロセスです。全体的な循環は似ていますが、海洋における窒素の移動には異なる役割[ 50 ]とモードがあります。窒素は降水、流出、または窒素として海水中に入ります。2大気から窒素は植物プランクトンによって利用されないため、N2そのため、主にシアノバクテリアによって行われる窒素固定を受けなければならない。[ 51 ]海洋循環に固定窒素が供給されなければ、固定窒素は約 2000 年で使い果たされてしまう。[ 52 ]植物プランクトンは、有機物の初期合成のために、生物学的に利用可能な形の窒素を必要とする。アンモニアと尿素はプランクトンからの排泄物によって水中に放出される。窒素源は、有機物の下方移動によって有光層から除去される。これは、植物プランクトンの沈降、垂直混合、または垂直移動者の排泄物の沈降によって起こり得る。沈降の結果、アンモニアは有光層より低い深さに導入される。バクテリアはアンモニアを亜硝酸塩と硝酸塩に変換できるが、光によって阻害されるため、これは有光層より下で起こらなければならない。[ 53 ]アンモニア化または鉱化は、バクテリアによって有機窒素をアンモニアに変換するために行われる。その後、硝化が起こり、アンモニウムは亜硝酸塩と硝酸塩に変換されます。[ 54 ]硝酸塩は、鉛直混合と湧昇によって光合成層に戻り、そこで植物プランクトンに吸収されて循環が継続されます。N2脱窒作用によって大気中に戻すことができます。
アンモニウムは、植物プランクトンにとって好ましい固定窒素源と考えられています。これは、アンモニウムの同化に酸化還元反応が関与しないため、エネルギー消費量が少ないためです。硝酸は同化に酸化還元反応を必要としますが、アンモニウムよりも豊富に存在するため、ほとんどの植物プランクトンは、この還元に必要な酵素(硝酸還元酵素)を持つように適応しています。ただし、ほとんどのプロクロロコッカス属や一部のシネココッカス属など、注目に値するよく知られた例外があり、これらは窒素をアンモニウムとしてしか取り込むことができません。[ 52 ]
海洋中の栄養塩は均一に分布しているわけではない。湧昇域は有光層下から窒素を供給し、沿岸域は流出水から窒素を供給し、湧昇は沿岸域で容易に起こる。しかし、貧栄養水域では年間を通して、温帯水域では植物プランクトンによる窒素の吸収速度が低下し、その結果、基礎生産が低下する。[ 55 ]窒素の様々な形態の分布も海洋全体で異なっている。
湧昇域を除く表層水では、硝酸塩が枯渇しています。沿岸の湧昇域では、生産量の増加により、通常、硝酸塩とクロロフィルの濃度が高くなります。しかし、表層硝酸塩濃度は高いもののクロロフィル濃度が低い地域があり、これらはHNLC(高窒素・低クロロフィル)地域と呼ばれます。HNLC地域の最も有力な説明は、海洋における鉄の不足に関連しており、これは海洋のダイナミクスと栄養循環において重要な役割を果たしている可能性があります。鉄の供給量は地域によって異なり、砂塵(砂嵐など)によって海洋に運ばれたり、岩石から浸出したりします。鉄は、海洋生態系の生産性を真に制限する要素として注目されています。
アンモニウムと亜硝酸塩は、水深50~80m(有光層の下限)で最高濃度を示し、それより深度が深くなるにつれて濃度は低下します。この分布は、亜硝酸塩とアンモニウムが中間種であるという事実によって説明できます。これらはどちらも水柱を通して急速に生成され、消費されます。[ 52 ]海中のアンモニウムの量は、硝酸塩よりも約3桁少ないです。[ 52 ]アンモニウム、亜硝酸塩、硝酸塩のうち、亜硝酸塩のターンオーバー速度が最も速いです。亜硝酸塩は、硝酸塩の同化、硝化、脱窒の過程で生成されますが、すぐに再び消費されます。
新しい窒素と再生された窒素
有光層に入る窒素は、生産層外から新たに到来するため、新規窒素と呼ばれます。[ 51 ]新規窒素は有光層下から、または外部から来ます。外部源としては、深層水からの湧昇と窒素固定が挙げられます。有機物が植物プランクトンによって摂取され、呼吸され、アンモニアとして水中に排出され、再び有機物に取り込まれる場合、それは循環型/再生型生産とみなされます。
新たな生産は海洋環境の重要な要素です。その理由の一つは、持続可能な漁獲量を生み出す海洋全体の能力は、継続的な新たな窒素の投入によってのみ決定されるためです。[ 55 ]再生窒素域から魚を漁獲すると窒素が減少し、ひいては一次生産も減少します。これは生態系に悪影響を及ぼします。しかし、新たな窒素域から魚を漁獲すれば、窒素は補充されます。
将来の酸性化
右の図に示すように、追加の二酸化炭素(CO 2)は海に吸収され、水と反応して炭酸(H2二酸化炭素3)が形成され、重炭酸塩(HCO−3)と水素(H+)イオン(灰色の矢印)が減少すると、生体内で利用可能な炭酸塩(CO2−3)を減少させ、海洋のpHを低下させる(黒矢印)。これは、 Hを利用するジアゾ栄養菌(灰色矢印)による窒素固定を促進すると考えられる。+イオンは窒素をアンモニア(NH3)およびアンモニウムイオン(NH+4しかし、pHが低下し、より多くのアンモニアがアンモニウムイオンに変換される(灰色の矢印)と、アンモニアから亜硝酸塩への酸化は減少します(NO– 2)、硝化と脱窒作用(黒矢印)の全体的な減少につながります。これは、海洋中の固定窒素のさらなる蓄積につながり、富栄養化につながる可能性があります。灰色の矢印は関連プロセスの増加を示し、黒の矢印は減少を示しています。[ 49 ]
窒素循環に対する人間の影響
.jpg/440px-Global_-_Global_Fertilizer_and_Manure,_Version_1_Nitrogen_Fertilizer_Application_(6074011960).jpg)
.jpg/440px-Global_Global_Fertilizer_and_Manure,_Version_1_Nitrogen_in_Manure_Production_(6173194512).jpg)
マメ科植物(特に大豆、アルファルファ、クローバー)の広範な栽培、化学肥料製造におけるハーバー・ボッシュ法の利用拡大、そして車両や工場からの汚染排出の結果、人類は窒素を生物学的に利用可能な形態に転換する年間量を2倍以上に増加させました。 [ 38 ]さらに、人類は窒素微量ガスを地球から大気圏へ、また陸域から水圏へ輸送することに大きく貢献してきました。地球規模の窒素循環に対する人類による変化は、車両排出量と工業型農業が最も多い先進国とアジアで最も激しくなっています。[ 56 ]
反応性窒素であるNrの生成は、世界的な工業化により、過去1世紀で10倍以上に増加しました。[ 2 ] [ 57 ]この形態の窒素は、様々なメカニズムを介して生物圏を通じてカスケードをたどり、その生成速度が脱窒速度よりも速いため蓄積されています。[ 58 ]湖や海洋へのNrの埋没は人為的投入と並行して増加しており、現在では産業革命前のNr埋没フラックスの2倍になっています。 反応性窒素は、水中で脱窒されるか、堆積物に埋没して蓄積する可能性があります。この埋没したNrは、嵐や洪水などの出来事によって堆積物がかき乱されるまで潜在的な状態にあり、大量の窒素が水に再導入されて脱窒され、環境に影響を与える可能性があります。[ 59 ]
亜酸化窒素(N2O )は農業における施肥、バイオマス燃焼、牛や飼育場、産業源の結果として大気中に上昇している。[ 60 ] N2Oは成層圏で有害な影響を及ぼし、分解して大気中のオゾン層破壊の触媒として作用します。亜酸化窒素も温室効果ガスであり、現在、二酸化炭素とメタンに次いで地球温暖化の3番目に大きな要因となっています。大気中の二酸化炭素ほど豊富ではありませんが、同質量の場合、地球を温暖化する能力は二酸化炭素の約300倍です。[ 61 ]
アンモニア(NH3大気中のアンモニア( HNO3 )濃度は、人間の活動の結果として3倍に増加しました。大気中では反応物質としてエアロゾルとして作用し、空気の質を低下させ、水滴に付着して最終的に硝酸(HNO3)となり、酸性雨を引き起こします。大気中のアンモニアと硝酸は呼吸器系にもダメージを与えます。
雷の非常に高い温度により、自然に少量のNOが生成される。×、ニューハンプシャー州3、およびHNO3しかし、高温燃焼はNOのフラックスを6~7倍に増加させた。×大気中に放出される。その生成量は燃焼温度に依存し、温度が高いほどNO×化石燃料の燃焼が主な要因ですが、バイオ燃料や水素の燃焼も同様に寄与しています。しかし、内燃機関の燃焼室に水素を直接噴射する速度を制御することで、 NOを生成する高温燃焼を防ぐことができます。×。
アンモニアと亜酸化窒素は大気化学に著しい変化をもたらします。これらは対流圏(下層大気)オゾン層の前駆物質であり、スモッグや酸性雨の原因となり、植物にダメージを与え、生態系への窒素流入を増加させます。生態系のプロセスは窒素施肥によって促進されますが、人為的な流入は窒素飽和をもたらし、生産性を低下させ、植物、動物、魚類、そして人間の健康に悪影響を及ぼす可能性があります。[ 38 ]
窒素の利用可能性が高まると窒素を必要とするイネ科植物が増加し、窒素に乏しく種の多様性に富んだヒースランドが劣化し、生物多様性の減少につながる可能性がある。[ 62 ]
人間による窒素循環の改変の結果

自然システムへの影響
窒素沈着量の上昇は、陸上生態系と水生生態系の両方にいくつかの悪影響を及ぼすことが示されている。[ 63 ] [ 64 ]窒素ガスとエアロゾルは特定の植物種に直接毒性を及ぼし、窒素汚染の大きな点源付近の植物の地上部の生理機能と成長に影響を与える。窒素化合物の蓄積によって特定の生態系における利用可能性が高まり、最終的に種の構成、植物の多様性、窒素循環が変化するため、植物種の変化も起こる可能性がある。アンモニアとアンモニウム(窒素の還元型)は、敏感な植物種に対する毒性が増すため、時間の経過とともに有害となる可能性があり、[ 65 ]特に窒素源として硝酸塩を使用することに慣れている植物の根と新芽の発育が悪くなる。窒素沈着量が増加すると土壌の酸性化も引き起こし、土壌中の塩基性陽イオンの浸出とアルミニウムやその他の潜在的に有毒な金属の量が増えるとともに、硝化作用が減少し、植物由来のリターが増加する。窒素の沈着量の増加によって引き起こされる継続的な変化により、害虫や病原体などの生態学的ストレスや撹乱に対する環境の感受性が高まり、その結果、長期的な活力にほとんど影響を与えないような状況に対する回復力が低下する可能性があります。
水生生態系における無機窒素の利用可能性の増加によってもたらされるさらなるリスクには、水質の酸性化、淡水および海水系の富栄養化、および人間を含む動物への毒性問題がある。 [ 66 ]富栄養化は多くの場合、水柱内の溶存酸素レベルの低下、つまり低酸素状態や無酸素状態を引き起こし、水生動物の死を引き起こす可能性がある。比較的固着性の底生生物、つまり海底に生息する生物は移動性がないため特に脆弱であるが、大量の魚が死ぬことも珍しくない。メキシコ湾のミシシッピ川河口付近の海洋のデッドゾーンは、藻類ブルームによる低酸素症のよく知られた例である。[ 67 ] [ 68 ]窒素の農業用流出を減らすための努力はいくつか行われているが、デッドゾーンの面積は大幅に縮小していない。[ 69 ]ニューヨーク州のアディロンダック湖、キャッツキル山地、ハドソン高原、レンセリア高原、ロングアイランドの一部では、硝酸性雨の沈着の影響が見られ、魚類やその他の多くの水生生物が死滅しています。[ 70 ]
淡水は酸性を中和する能力が低いため、窒素沈着が少なくても酸性化が起こりやすい。[ 71 ]この酸性化は魚類や水生無脊椎動物に悪影響を及ぼす可能性がある[ 72 ]が、より酸性の環境に耐えられる植物プランクトンには有利となる。[ 73 ]
アンモニア(NH3)は魚類にとって非常に有毒であるため、下水処理施設から排出されるアンモニア濃度は厳重に監視する必要があります。魚類の死滅を防ぐには、排出前に曝気処理による硝化を行うことが望ましい場合が多くあります。陸上散布は曝気処理の魅力的な代替手段となり得ます。
人体への影響:飲料水中の硝酸塩の蓄積
人間の活動からNr(反応性窒素)が漏出すると、自然水環境に硝酸塩が蓄積し、人の健康に有害な影響を及ぼす可能性があります。農業における窒素肥料の過剰使用は、地下水や表層水の硝酸塩汚染の大きな原因となっています。[ 74 ] [ 75 ]硝酸塩は溶解度が高く土壌による保持力が低いため、土壌層から地下水に容易に漏れ出し、硝酸塩汚染を引き起こします。地下水の硝酸塩汚染の他の非点源としては、家畜の飼料、動物や人間の汚染、都市廃棄物や産業廃棄物などがあります。地下水は多くの場合、主要な生活用水源として機能しているため、特に規制が不十分で不衛生な水が使用されている小規模コミュニティの給水では、飲料水生産中に地下水から表層水や飲料水に硝酸塩汚染が広がる可能性があります。[ 76 ]
飲料水のWHO基準は50mg NO−3短期暴露ではL −1、3 mg NOでは−3L −1の慢性的な影響。[ 77 ]硝酸塩は人体に入ると、胃の中でニトロソ化反応によって有機化合物と反応してニトロソアミンとニトロソアミドを形成し、これらはいくつかの種類の癌(例えば、口腔癌や胃癌)に関与している。[ 78 ]
人間の健康への影響:大気質
人間の活動は、地球規模の大気窒素汚染に関連する窒素ガスを排出することで、地球規模の窒素循環を劇的に変えてきました。大気中の反応性窒素(Nr)フラックスの発生源は複数あります。農業由来の反応性窒素は、アンモニア(NH3)、窒素酸化物(NO)などの大気放出を引き起こします。×)および亜酸化窒素(N2O)。エネルギー生産、輸送、産業における燃焼プロセスでは、NOの放出を介して新たな反応性窒素が形成されることもある。×、意図しない廃棄物です。これらの反応性窒素が下層大気に放出されると、スモッグ、粒子状物質、エアロゾルの形成を引き起こし、これらはすべて大気汚染による人体への悪影響の主な原因となります。[ 79 ]大気中では、NO2硝酸(HNO3)、さらにNH3硝酸アンモニウム(NH 4 NO 3 )を形成し、粒子状硝酸塩の形成を促進する。さらに、NH3他の酸性ガス(硫酸や塩酸)と反応してアンモニウム含有粒子を形成し、これが光化学スモッグの二次有機エアロゾル粒子の前駆体となる。[ 80 ]
参照
参考文献
- ^デビッド・ファウラー;マイリ・コイル。スキバ、ユテ;サットン、マークA.ケープ、J. ニール。レイス、ステファン。シェパード、ルーシー・J.アラン・ジェンキンス。ブルーナ・グリゼッティ。ジョンソン州ギャロウェイ。ヴィトセク、P;リーチ、A;ボウマン、AF。バターバッハ・バール、K;デンテナー、F;スティーブンソン、D;アマン、M;ヴォス、M (2013 年 7 月 5 日)。「21世紀の地球規模の窒素循環」。ロンドン王立協会の哲学トランザクション。シリーズ B、生物科学。368 (1621) 20130164.土井: 10.1098/rstb.2013.0164。PMC 3682748。PMID 23713126。
- ^ a b Galloway, JN; Townsend, AR; Erisman, JW; Bekunda, M.; Cai, Z.; Freney, JR; Martinelli, LA; Seitzinger, SP; Sutton, MA (2008). 「窒素循環の変容:最近の動向、疑問、そして潜在的な解決策」(PDF) . Science . 320 (5878): 889– 892. Bibcode : 2008Sci...320..889G . doi : 10.1126/science.11 36674. ISSN 0036-8075 . PMID 18487183. S2CID 16547816. 2011年11月8日時点のオリジナルよりアーカイブ(PDF) . 2019年9月23日閲覧。
- ^ Vitousek, PM; Menge, DNL; Reed, SC; Cleveland, CC (2013). 「生物学的窒素固定:陸生生態系における速度、パターン、生態学的制御」 . Philosophical Transactions of the Royal Society B: Biological Sciences . 368 (1621) 20130119. doi : 10.1098/rstb.2013.0119 . PMC 3682739. PMID 23713117 .
- ^ a b Voss, M.; Bange, HW; Dippner, JW; Middelburg, JJ; Montoya, JP; Ward, B. (2013). 「海洋窒素循環:最近の発見、不確実性、そして気候変動の潜在的な関連性」 . Philosophical Transactions of the Royal Society B: Biological Sciences . 368 (1621) 20130121. doi : 10.1098/rstb.2013.0121 . PMC 3682741. PMID 23713119 .
- ^ a bデビッド・ファウラー;マイリ・コイル。スキバ、ユテ;サットン、マークA.ケープ、J. ニール。レイス、ステファン。シェパード、ルーシー・J.アラン・ジェンキンス。ブルーナ・グリゼッティ。ジョンソン州ギャロウェイ。ヴィトセク、P;リーチ、A;ボウマン、AF。バターバッハ・バール、K;デンテナー、F;スティーブンソン、D;アマン、M;ヴォス、M (2013 年 7 月 5 日)。「21世紀の地球規模の窒素循環」。ロンドン王立協会の哲学トランザクション。シリーズ B、生物科学。368 (1621) 20130164.土井: 10.1098/rstb.2013.0164。PMC 3682748。PMID 23713126。
- ^ Vuuren, Detlef P van; Bouwman, Lex F; Smith, Steven J; Dentener, Frank (2011). 「大気への人為的反応性窒素排出量の世界予測:科学文献におけるシナリオの評価」Current Opinion in Environmental Sustainability . 3 (5): 359– 369. Bibcode : 2011COES....3..359V . doi : 10.1016/j.cosust.2011.08.014 . hdl : 1874/314192 . ISSN 1877-3435 . S2CID 154935568 .
- ^ Pilegaard, K. (2013). 「土壌からの一酸化窒素排出を制御するプロセス」 . Philosophical Transactions of the Royal Society B: Biological Sciences . 368 (1621) 20130126. doi : 10.1098/rstb.2013.0126 . PMC 3682746. PMID 23713124 .
- ^ Levy, H.; Moxim, WJ; Kasibhatla, PS (1996). 「対流圏NOxの全球3次元時間依存雷源」. Journal of Geophysical Research: Atmospheres . 101 (D17): 22911– 22922. Bibcode : 1996JGR...10122911L . doi : 10.1029/96jd02341 . ISSN 0148-0227 .
- ^ Sutton, MA; Reis, S.; Riddick, SN; Dragosits, U.; Nemitz, E.; Theobald, MR; Tang, YS; Braban, CF; Vieno, M. (2013). 「気候依存的なアンモニア排出・沈着パラダイムに向けて」 . Philosophical Transactions of the Royal Society B: Biological Sciences . 368 (1621) 20130166. doi : 10.1098/ rstb.2013.0166 . PMC 3682750. PMID 23713128 .
- ^ Dentener, F.; Drevet, J.; Lamarque, JF; Bey, I.; Eickhout, B.; Fiore, AM; Hauglustaine, D.; Horowitz, LW; Krol, M. (2006). 「地域および地球規模における窒素および硫黄の沈着:マルチモデル評価」(PDF) . Global Biogeochemical Cycles . 20 (4) 2005GB002672: n/a. Bibcode : 2006GBioC..20.4003D . doi : 10.1029/2005GB002672 . S2CID 839759 .
- ^ a b c Duce, RA; LaRoche, J.; Altieri, K.; Arrigo, KR; Baker, AR; Capone, DG; Cornell, S.; Dentener, F.; Galloway, J. (2008). 「大気中の人為的窒素が外洋に与える影響」. Science . 320 ( 5878): 893–7 . Bibcode : 2008Sci...320..893D . doi : 10.1126/science.1150369. hdl : 21.11116 /0000-0001-CD7A-0 . PMID 18487184. S2CID 11204131 .
- ^ Bouwman, L.; Goldewijk, KK; Van Der Hoek, KW; Beusen, AHW; Van Vuuren, DP; Willems, J.; Rufino, MC; Stehfest, E. (2011-05-16). 「1900年から2050年にかけて畜産によって誘発された農業における窒素・リン循環の地球規模変化の探究」 . Proceedings of the National Academy of Sciences . 110 (52): 20882–7 . doi : 10.1073 / pnas.1012878108 . PMC 3876211. PMID 21576477 .
- ^ Solomon, Susan (2007). Climate change 2007: the physical science basis . Intergovernmental Panel on Climate Change [by] Cambridge University Press. ISBN 978-0-521-88009-1. OCLC 228429704 .
- ^サットン、マーク・A.編 (2011-04-14).欧州窒素評価:発生源、影響、政策的視点. ケンブリッジ大学出版局. ISBN 978-1-107-00612-6. OCLC 690090202 .
- ^ Deutsch, Curtis; Sarmiento, Jorge L.; Sigman, Daniel M.; Gruber, Nicolas; Dunne, John P. (2007). 「海洋における窒素の流入と消失の空間的結合」. Nature . 445 ( 7124): 163– 167. Bibcode : 2007Natur.445..163D . doi : 10.1038/nature05392 . ISSN 0028-0836 . PMID 17215838. S2CID 10804715 .
- ^スティーブン・B・キャロル、スティーブン・D・ソルト(2004年)『園芸家のためのエコロジー』 Timber Press、p.93、ISBN 978-0-88192-611-8。
- ^ Kuypers, MMM; Marchant, HK; Kartal, B (2011). 「微生物の窒素循環ネットワーク」. Nature Reviews Microbiology . 1 (1): 1– 14. doi : 10.1038/nrmicro.2018.9 . hdl : 21.11116/0000-0003-B828-1 . PMID 29398704 . S2CID 3948918 .
- ^ Galloway, JN; et al. (2004). 「窒素循環:過去、現在、そして未来の世代」. Biogeochemistry . 70 (2): 153– 226. Bibcode : 2004Biogc..70..153G . doi : 10.1007/s10533-004-0370-0 . S2CID 98109580 .
- ^ Reis, Stefan; Bekunda, Mateete; Howard, Clare M; Karanja, Nancy; Winiwarter, Wilfried; Yan, Xiaoyuan; Bleeker, Albert; Sutton, Mark A (2016-12-01). 「統合とレビュー:窒素管理の課題への取り組み:地球規模から地域規模へ」 . Environmental Research Letters . 11 (12) 120205. Bibcode : 2016ERL....11l0205R . doi : 10.1088/1748-9326/11/12/120205 . hdl : 10568/78380 . ISSN 1748-9326 .
- ^ Gu, Baojing; Ge, Ying; Ren, Yuan; Xu, Bin; Luo, Weidong; Jiang, Hong; Gu, Binhe; Chang, Jie (2012-08-17). 「中国における大気中の反応性窒素:発生源、最近の傾向、そして被害額」. Environmental Science & Technology . 46 (17): 9420– 9427. Bibcode : 2012EnST...46.9420G . doi : 10.1021/es301446g . ISSN 0013-936X . PMID 22852755 .
- ^ Kim, Haryun; Lee, Kitack; Lim, Dhong-Il; Nam, Seung-Il; Kim, Tae-Wook; Yang, Jin-Yu T.; Ko, Young Ho; Shin, Kyung-Hoon; Lee, Eunil (2017-05-11). 「北西太平洋堆積物における広範囲にわたる人為起源窒素」. Environmental Science & Technology . 51 (11): 6044–52 . Bibcode : 2017EnST...51.6044K . doi : 10.1021/acs.est.6b05316 . ISSN 0013-936X . PMID 28462990 .
- ^ Moir, JWB編 (2011).細菌における窒素循環:分子解析. Caister Academic Press . ISBN 978-1-904455-86-8。
- ^ Smith, B.; Richards, RL; Newton, WE (2013) [2004].窒素固定触媒:ニトロゲナーゼ、関連化学モデルおよび商業プロセス. Kluwer. ISBN 978-1-4020-3611-8。
- ^ Smil, V (1997). Cycles of Life . Scientific American Library. ISBN 978-0-7167-5079-6。
- ^ウィリー、ジョアン・M. (2011).プレスコットの微生物学(第8版). マグロウヒル. p. 705. ISBN 978-0-07-337526-7。
- ^ 「窒素循環:プロセス、関係者、そして人間の影響 | Scitableで科学を学ぶ」 www.nature.com . 2025年2月13日閲覧。
- ^ Strock, JS (2008)、「アンモニア化」、生態学百科事典、エルゼビア、pp. 162– 165、doi : 10.1016/B978-008045405-4.00256-1、ISBN 978-0-08-045405-4、 2025年2月13日取得
- ^カベロ、P.ロルダン、メリーランド州。カスティージョ、F. Moreno-Vivián, C. (2009-01-01)、「Nitrogen Cycle」、Schaechter、Moselio (編)、Encyclopedia of Microbiology (Third Edition)、オックスフォード: Academic Press、pp. 299–321、ISBN 978-0-12-373944-5、 2025年3月18日取得
- ^マリオン, GM; ブラック, CH (1988). 「チャパラル火災サイクルのクロノシーケンスに沿った潜在的に利用可能な窒素とリン」 .米国土壌科学会誌. 52 (4): 1155– 1162. Bibcode : 1988SSASJ..52.1155M . doi : 10.2136/sssaj1988.03615995005200040048x . ISSN 1435-0661 .
- ^リー、ジャオレイ;ティアン、ダシュアン。ワン・ビンシュエ。ワン・ジンソン。王、宋。チェン、ハン YH;徐暁峰。王昌輝。彼、ニアンペン。ニウ、シュリ(2019)。「微生物は地球規模の土壌窒素の無機化と利用可能性を促進します。 」地球変動生物学。25 (3): 1078–1088。Bibcode : 2019GCBio..25.1078L。土井:10.1111/gcb.14557。ISSN 1365-2486。PMID 30589163。
- ^ Pierre, S.; Hewson, I.; Sparks, JP; Litton, CM; Giardina, C.; Groffman, PM; Fahey, TJ (2017). 「熱帯山岳地帯の平均年間気温勾配における窒素循環に伴うアンモニア酸化菌の個体数変動」 . Ecology . 98 (7): 1896– 1907. Bibcode : 2017Ecol...98.1896P . doi : 10.1002/ecy.1863 . ISSN 1939-9170 . PMID 28419436 .
- ^ Gosz, JR (1981). 「針葉樹生態系における窒素循環」 .生態学報(33): 405– 426. ISSN 0346-6868 . JSTOR 45128679 .
- ^ Vitousek, Peter M.; Gosz, James R.; Grier, Charles C.; Melillo, Jerry M.; Reiners, William A. (1982). 「森林生態系における潜在的硝化作用と硝酸塩移動性の比較分析」 .生態学モノグラフ. 52 (2): 155– 177. Bibcode : 1982EcoM...52..155V . doi : 10.2307/1942609 . ISSN 1557-7015 . JSTOR 1942609 .
- ^ Zagal, Erick; Persson, Jan (1994-10-01). 「4段階の窒素添加速度におけるグルコース分解中の硝酸塩の固定化と再ミネラル化」 .土壌生物学・生化学. 26 (10): 1313– 1321. Bibcode : 1994SBiBi..26.1313Z . doi : 10.1016/0038-0717(94)90212-7 . ISSN 0038-0717 .
- ^ DeLuca, TH; Keeney, DR (1993-01-01). 「草原および耕作土壌におけるグルコース誘導硝酸塩同化作用」 . Biogeochemistry . 21 (3): 167– 176. Bibcode : 1993Biogc..21..167D . doi : 10.1007/BF00001116 . ISSN 1573-515X .
- ^ Sparacino-Watkins, Courtney; Stolz, John F.; Basu, Partha (2013-12-16). 「硝酸およびペリプラズム硝酸還元酵素」 . Chem . Soc. Rev. 43 ( 2): 676– 706. doi : 10.1039/c3cs60249d . PMC 4080430. PMID 24141308 .
- ^ Simon, Jörg; Klotz, Martin G. (2013). 「微生物による窒素化合物の変換に関わる生体エネルギーシステムの多様性と進化」 . Biochimica et Biophysica Acta (BBA) - Bioenergetics . 1827 (2): 114– 135. doi : 10.1016/j.bbabio.2012.07.005 . PMID 22842521 .
- ^ a b c Vitousek, PM; Aber, J; Howarth, RW; Likens, GE; Matson, PA; Schindler, DW; Schlesinger, WH; Tilman, GD (1997). 「人間による地球窒素循環の改変:その起源と影響」(PDF) . Ecological Applications . 1 (3): 1– 17. doi : 10.1890/1051-0761(1997)007[0737:HAOTGN]2.0.CO;2 . hdl : 1813/60830 . ISSN 1051-0761 .
- ^グラフ、ジョン・S.ショーン、シーナ。キッツィンガー、カタリーナ。アーメルカンプ、セーレン。ヴェーレ、クリスチャン。ヒュッテル、ブルーノ。シューベルト、カールステン J.カイパース、マルセルMM;ヤナ州ミルッカ(2021年3月3日)。「嫌気性内部共生生物は、脱窒によって繊毛虫宿主のためにエネルギーを生成します。 」自然。591 (7850): 445–450。Bibcode : 2021Natur.591..445G。土井: 10.1038/s41586-021-03297-6。ISSN 0028-0836。PMC 7969357。PMID 33658719。
- ^ Lam, Phyllis; Kuypers, Marcel MM (2011). 「酸素極小帯における微生物による窒素プロセス」. Annual Review of Marine Science . 3 : 317–345 . Bibcode : 2011ARMS....3..317L . doi : 10.1146/annurev-marine-120709-142814 . hdl : 21.11116/0000-0001-CA25-2 . PMID 21329208 .
- ^ Marchant, HK; Lavik, G.; Holtappels, M.; Kuypers, MMM (2014). 「潮間帯の透水性堆積物における硝酸塩の運命」. PLOS ONE . 9 (8) e104517. Bibcode : 2014PLoSO...9j4517M . doi : 10.1371/journal.pone.0104517 . PMC 4134218. PMID 25127459 .
- ^ "Anammox" . Anammox - MicrobeWiki . MicrobeWiki. 2015年9月27日時点のオリジナルよりアーカイブ。 2015年7月5日閲覧。
- ^ 「窒素研究は植物の世界を揺るがす可能性がある」 NPR.org 2011年9月6日。2011年12月5日時点のオリジナルよりアーカイブ。 2011年10月22日閲覧。
- ^ Schuur, EAG (2011). 「生態学:深海からの窒素」 . Nature . 477 ( 7362): 39– 40. Bibcode : 2011Natur.477...39S . doi : 10.1038/477039a . PMID 21886152. S2CID 2946571 .
- ^ Morford, SL; Houlton, BZ; Dahlgren, RA (2011). 「窒素に富む岩盤からの森林生態系の炭素・窒素貯蔵量の増加」Nature . 477 (7362): 78– 81. Bibcode : 2011Natur.477...78M . doi : 10.1038/nature10415 . PMID 21886160 . S2CID 4352571 .
- ^ Burgin, Amy J.; Yang, Wendy H.; Hamilton, Stephen K.; Silver, Whendee L. (2011). 「炭素と窒素を超えて:微生物エネルギー経済が多様な生態系における元素循環とどのように結びつくか」. Frontiers in Ecology and the Environment . 9 (1): 44– 52. Bibcode : 2011FrEE....9...44B . doi : 10.1890/090227 . hdl : 1808/21008 . ISSN 1540-9309 .
- ^ Roman, J.; McCarthy, JJ (2010). 「クジラのポンプ:海洋哺乳類は沿岸流域における一次生産性を高める」 . PLOS ONE . 5 (10) e13255. Bibcode : 2010PLoSO...513255R . doi : 10.1371 / journal.pone.0013255 . PMC 2952594. PMID 20949007 .
- ^ Pajares Moreno, S.; Ramos, R. (2019). 「海洋窒素循環に関与するプロセスと微生物:知識とギャップ」 . Frontiers in Marine Science . 6 739. Bibcode : 2019FrMaS...6..739P . doi : 10.3389/fmars.2019.00739 .
 資料はこのソースからコピーされたもので、Creative Commons Attribution 4.0 International Licenseに基づいて利用可能です。
資料はこのソースからコピーされたもので、Creative Commons Attribution 4.0 International Licenseに基づいて利用可能です。 - ^ a b O'Brien, Paul A.; Morrow, Kathleen M.; Willis, Bette L.; Bourne, David G. (2016). 「海洋酸性化が自由生活型から宿主関連型までの海洋微生物に及ぼす影響」 . Frontiers in Marine Science . 3 : 47. Bibcode : 2016FrMaS...3...47O . doi : 10.3389/fmars.2016.00047 .
 資料はこのソースからコピーされたもので、Creative Commons Attribution 4.0 International Licenseに基づいて利用可能です。
資料はこのソースからコピーされたもので、Creative Commons Attribution 4.0 International Licenseに基づいて利用可能です。 - ^ Moulton, Orissa M; Altabet, Mark A; Beman, J Michael; Deegan, Linda A; Lloret, Javier; Lyons, Meaghan K; Nelson, James A; Pfister, Catherine A (2016年5月). 「沿岸生態系におけるマクロバイオータと微生物の関連性:窒素循環におけるパターンと示唆」. Frontiers in Ecology and the Environment . 14 (4): 200–8 . Bibcode : 2016FrEE...14..200M . doi : 10.1002/fee.1262 . hdl : 1912/8083 . ISSN 1540-9295 .
- ^ a bミラー、チャールズ (2008).生物海洋学. ブラックウェル. pp. 60– 62. ISBN 978-0-632-05536-4。
- ^ a b c dグルーバー、ニコラス(2008年)『海洋環境中の窒素』エルゼビア、pp. 1-35、ISBN 978-0-12-372522-6。
- ^ミラー、チャールズ (2008).生物海洋学. ブラックウェル. pp. 60– 62. ISBN 978-0-632-05536-4。
- ^ Boyes, Elliot, Susan, Michael. 「学習単元:窒素循環の海洋環境」 . 2012年4月15日時点のオリジナルよりアーカイブ。 2011年10月22日閲覧。
{{cite web}}: CS1 maint: 複数の名前: 著者リスト (リンク) - ^ a b Lalli, Parsons, Carol, Timothy (1997). Biological oceanography: An introduction . Butterworth-Heinemann. ISBN 978-0-7506-3384-0。
{{cite book}}: CS1 maint: 複数の名前: 著者リスト (リンク) - ^ Holland, Elisabeth A.; Dentener, Frank J.; Braswell, Bobby H.; Sulzman, James M. (1999). 「現代および産業革命以前の地球規模の反応性窒素収支」. Biogeochemistry . 46 ( 1–3 ): 7. Bibcode : 1999Biogc..46....7H . doi : 10.1007/BF01007572 . S2CID 189917368 .
- ^ Gu, Baojing; Ge, Ying; Ren, Yuan; Xu, Bin; Luo, Weidong; Jiang, Hong; Gu, Binhe; Chang, Jie (2012-09-04). 「中国における大気中の反応性窒素:発生源、最近の傾向、そして被害額」. Environmental Science & Technology . 46 (17): 9420–7 . Bibcode : 2012EnST...46.9420G . doi : 10.1021/es301446g . ISSN 0013-936X . PMID 22852755 .
- ^ Cosby, B. Jack; Cowling, Ellis B.; Howarth, Robert W.; Seitzinger, Sybil P.; Erisman, Jan Willem; Aber, John D.; Galloway, James N. (2003-04-01). 「窒素カスケード」 . BioScience . 53 (4): 341– 356. doi : 10.1641/0006-3568(2003)053[0341:TNC]2.0.CO;2 . ISSN 0006-3568 . S2CID 3356400 .
- ^ Wang, Mei; Houlton, Benjamin Z. ; Wang, Sitong; Ren, Chenchen; van Grinsven, Hans JM; Chen, Deli; Xu, Jianming; Gu, Baojing (2021-11-28). 「人為的要因による世界の湖沼堆積物中の反応性窒素埋没の増加」 . The Innovation . 2 (4) 100158. Bibcode : 2021Innov...200158W . doi : 10.1016/j.xinn.2021.100158 . ISSN 2666-6758 . PMC 8527044. PMID 34704084 .
- ^ Chapin, SF; Matson, PA; Mooney, HA (2002). 『陸生生態系生態学の原理』 Springer. p. 345. ISBN 0-387-95443-0。
- ^環境問題に関する科学委員会(SCOPE)国際バイオ燃料プロジェクト迅速評価会議議事録、2008年9月22~25日、ドイツ、グンマースバッハ、RW HowarthおよびS. Bringezu編。2009年エグゼクティブサマリー、3ページ。Wayback Machineで2009年6月6日にアーカイブ。
- ^ Aerts, Rien & Berendse, Frank (1988) . 「湿地ヒースランドにおける栄養塩類供給量の増加が植生動態に及ぼす影響」. Vegetatio . 76 (1/2): 63– 69. doi : 10.1007/BF00047389 . JSTOR 20038308. S2CID 34882407 .
- ^ Bobbink, R.; Hicks, K.; Galloway, J.; Spranger, T.; Alkemade, R.; Ashmore, M.; Bustamante, M.; Cinderby, S.; Davidson, E. (2010-01-01). 「陸生植物多様性に対する窒素沈着影響の地球規模評価:統合」(PDF) . Ecological Applications . 20 (1): 30– 59. Bibcode : 2010EcoAp..20...30B . doi : 10.1890/08-1140.1 . ISSN 1939-5582 . PMID 20349829. S2CID 4792945. 2019年9月30日時点のオリジナルよりアーカイブ(PDF ) . 2019年9月30日閲覧。
- ^劉雪軍;ドゥアン、レイ。莫、江明。ドゥ、エンザイ。沈建林。ルー、シアンカイ。張英。周暁兵。彼、チュネ(2011)。 「中国における窒素の堆積とその生態学的影響:概要」。環境汚染。159 (10): 2251–2264。ビブコード: 2011EPoll.159.2251L。土井: 10.1016/j.envpol.2010.08.002。PMID 20828899。
- ^ Britto, Dev T.; Kronzucker, Herbert J. (2002). 「高等植物におけるNH4+毒性:批判的レビュー」. Journal of Plant Physiology . 159 (6): 567– 584. doi : 10.1078/0176-1617-0774 .
- ^ Camargoa, Julio A.; Alonso, Álvaro (2006). 「水生生態系における無機窒素汚染の生態学的および毒性学的影響:地球規模評価」Environment International . 32 (6): 831– 849. Bibcode : 2006EnInt..32..831C . doi : 10.1016/j.envint.2006.05.002 . hdl : 10261/294824 . PMID 16781774 .
- ^ラバレー、ナンシー N. ;ターナー、R. ユージーン;ワイズマン、ウィリアム J. ジュニア (2002)。 「メキシコ湾低酸素症、別名「デッドゾーン」". Annu. Rev. Ecol. Syst . 33 (1): 235– 63. Bibcode : 2002AnRES..33..235R . doi : 10.1146/annurev.ecolsys.33.010802.150513 . JSTOR 3069262 .
- ^ Dybas, Cheryl Lyn. (2005). 「世界の海洋におけるデッドゾーンの拡大」 . BioScience . 55 (7): 552– 557. doi : 10.1641/0006-3568(2005)055[0552:DZSIWO]2.0.CO;2 .
- ^ 「メキシコ湾の『デッドゾーン』は平均より大きいと科学者らが発見|アメリカ海洋大気庁」 www.noaa.gov 2024年8月1日 2025年4月8日閲覧。
- ^ニューヨーク州環境保全局「酸性沈着の環境影響:湖沼」 [1] 2010年11月24日アーカイブ、 Wayback Machine
- ^ 「海洋酸性化に関するFAQ - ウッズホール海洋研究所」ウッズホール海洋研究所。2025年3月19日閲覧。
- ^ Bednaršek, Nina; Newton, Jan A.; Beck, Marcus W.; Alin, Simone R.; Feely, Richard A.; Christman, Natasha R.; Klinger, Terrie (2021-04-15). 「季節変動のあるサリッシュ海における現在の河口酸性化による深刻な生物学的影響」 . Science of the Total Environment . 765 142689. Bibcode : 2021ScTEn.76542689B . doi : 10.1016/j.scitotenv.2020.142689 . ISSN 0048-9697 . PMID 33077233 .
- ^エリスマン, ジャン・ウィレム; ギャロウェイ, ジェームズ・N.; ザイツィンガー, シビル; ブリーカー, アルバート; ディセ, ナンシー・B.; ペトレスク, AM・ロクサナ; リーチ, アリソン・M.; デ・フリース, ウィム (2013-07-05). 「人間による地球窒素循環の改変の結果」. Philosophical Transactions of the Royal Society B: Biological Sciences . 368 (1621) 20130116. doi : 10.1098/rstb.2013.0116 . PMC 3682738. PMID 23713116 .
- ^ Power, JF; Schepers, JS (1989). 「北米における地下水の硝酸塩汚染」.農業・生態系・環境. 26 ( 3–4 ): 165–187 . Bibcode : 1989AgEE...26..165P . doi : 10.1016/0167-8809(89)90012-1 . ISSN 0167-8809 .
- ^ストレベル、O.デュニスフェルト、WHM。ベッチャー、J. (1989)。 「西ヨーロッパの地下水の硝酸塩汚染」。農業、生態系、環境。26 ( 3–4 ): 189–214。Bibcode : 1989AgEE...26..189S。土井:10.1016/0167-8809(89)90013-3。ISSN 0167-8809。
- ^ Fewtrell, Lorna (2004). 「飲料水中の硝酸塩、メトヘモグロビン血症、そして世界の疾病負担:考察」 . Environmental Health Perspectives . 112 (14): 1371–4 . Bibcode : 2004EnvHP.112.1371F . doi : 10.1289 / ehp.7216 . PMC 1247562. PMID 15471727 .
- ^グローバルヘルスオブザーバトリー: (GHO) . 世界保健機関. OCLC 50144984 .
- ^キャンター、ラリー・W.(2019年1月22日)「地下水の硝酸塩汚染の図解」、地下水の硝酸塩、ラウトレッジ、pp.39-71 、 doi : 10.1201 /9780203745793-3、ISBN 978-0-203-74579-3、S2CID 133944481
- ^ Kampa, Marilena; Castanas, Elias (2008). 「大気汚染による人体への健康影響」. Environmental Pollution . 151 (2): 362– 367. Bibcode : 2008EPoll.151..362K . doi : 10.1016/j.envpol.2007.06.012 . PMID 17646040. S2CID 38513536 .
- ^ Erisman, JW; Galloway, JN; Seitzinger, S.; Bleeker, A.; Dise, NB; Petrescu, AMR; Leach, AM; de Vries, W. (2013-05-27). 「人間による地球窒素循環の改変がもたらす結果」 . Philosophical Transactions of the Royal Society B: Biological Sciences . 368 (1621) 20130116. doi : 10.1098/rstb.2013.0116 . PMC 3682738. PMID 23713116 .




