有機ルテニウム化学は、炭素とルテニウムの化学結合を含む有機金属化合物の化学です。いくつかの有機ルテニウム触媒は商業的に興味深いものであり[1]、有機ルテニウム化合物は癌治療への応用が検討されています[2] 。鉄は周期表の第8族でルテニウムのすぐ上にあるため、この化学は有機鉄化学と化学量 論的に類似しています。ルテニウムを導入するための最も重要な試薬は、塩化ルテニウム(III)とトリルテニウムドデカカルボニルです。
有機金属化合物において、ルテニウムは-2([Ru(CO) 4 ] 2-)から+6([RuN(Me)4] -)までの酸化状態をとることが知られています。最も一般的なのは、以下に示すように+2の酸化状態です。
配位子
他の後周期遷移金属と同様に、ルテニウムはソフトな配位子とより良好に結合します。[3]ルテニウムにとって 最も重要な配位子は以下のとおりです。
- ハロゲン化物、特に塩化物
- ホスフィン、特にトリフェニルホスフィン
- N-複素環式カルベン(NHC)
- シクロペンタジエニル配位子
- 様々なアレーンおよびジエン
- 一酸化炭素
- 水素化物、特にShvo触媒において
- 金属カルベン、特にGrubbs触媒において
ホスフィン配位子
トリフェニルホスフィンやトリシクロヘキシルホスフィンなどの単座ホスフィン配位子が最も一般的ですが、二座ホスフィン配位子も有機ルテニウム化合物に有用です。 特にBINAPは、多くの不斉ルテニウム触媒にとって有用な不斉配位子です。 [4] [5] [6] [7]
N-複素環式カルベン配位子
NHC配位子は有機ルテニウム錯体において非常に一般的になっています。[8] [9] NHC配位子は、正確な立体的および電子的パラメータで調製でき、不斉触媒に使用するためにキラルにすることができます。[10] NHCは、強い供与性を示すL型配位子 として、ホスフィン配位子の代替としてよく使用されます。注目すべき例は、第1世代触媒のホスフィンがNHCに置き換えられた 第2世代グラブス触媒です。
シクロペンタジエニル配位子
親化合物であるルテノセンは配位飽和しており、反応性基を含まないため、反応性がありません。Shvo 触媒([Ph 4 (η 5 -C 4 CO)] 2 H]}Ru 2 (CO) 4 (μ-H))も配位飽和していますが、反応性の高いOH基とRuH基を備えているため、移動水素化で機能します。[11]移動水素化によるアルデヒド、ケトンの水素化、アルデヒドからエステルへの不均化、およびアリルアルコールの異性化に 使用されます
クロロ(シクロペンタジエニル)ビス(トリフェニルホスフィン)ルテニウムは反応性の高いクロロ基を有しており、有機基質によって容易に置換されます。
アレーンおよびアルケン配位子
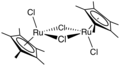
Ru-アレーン錯体の一例として、(シメン)ルテニウムジクロリド二量体があり、これは移動水素化のための多用途触媒の前駆体です。[12] アセナフチレンは、トリルテニウムドデカカルボニルから誘導される有用な触媒です。[13] Ru(C 6 Me 6 ) 2のヘキサメチルベンゼン配位子のハプティシティは、金属中心の酸化状態に依存します。[14]化合物Ru( COD )( COT )は、ノルボルナジエンを二量化することができます。

多核有機ルテニウム錯体の抗がん特性が研究されています。研究されている化合物には、二核、三核、四核錯体、およびテトラ、ヘキサ、オクタメタラケージが含まれます。[2]
カルボニル
主なルテニウムカルボニルは、トリルテニウムドデカカルボニル、Ru⁻ ( CO) ⁻です。一般的な試薬であるFe(CO) ⁻およびFe⁻ ( CO) ⁻の類似体はあまり有用ではありません。ルテニウムペンタカルボニルは容易に 脱カルボニル化します。
- Ru⁻ (CO) ⁻ +⁻CO⇌⁻Ru(CO) ⁻
三塩化ルテニウムのカルボニル化により、一連のRu(II)クロロカルボニルが得られます。これらはRu⁻ (CO) ⁻の前駆体です。
参考文献
- ^ 有機金属化合物の合成:実践ガイド小宮三四郎編 小宮三四郎、富良野正之 1997
- ^ ab Babak, Maria V.; Wee, Han Ang (2018). 「第6章 がん治療のための多核有機金属ルテニウム-アレーン錯体」. Sigel, Astrid; Sigel, Helmut; Freisinger, Eva; Sigel, Roland KO (編).メタロドラッグ:抗がん剤の開発と作用. 生命科学における金属イオン. 第18巻. ベルリン: de Gruyter GmbH. pp. 171– 198. doi :10.1515/9783110470734-012. PMID 29394025
- ^ Barthazy, P.; Stoop, RM; Wörle, M.; Togni, A.; Mezzetti, A. (2000). 「金属媒介CF結合形成に向けて:16電子フッ素錯体[RuF(dppp) 2 ]PF6 ( dppp = 1,3-ビス(ジフェニルホスフィノ)プロパン)の合成と反応性」Organometallics . 19 : 2844–2852 . doi :10.1021/om0000156.
- ^ 例:Organic Syntheses, Coll. Vol. 10, p.276 (2004); Vol. 77, p.1 (2000). リンク
- ^ 例:Organic Syntheses, Coll. Vol. 9, p.589 (1998); Vol. 71, p.1 (1993). リンク
- ^ 例:Organic Syntheses , Coll. Vol. 9, p.169 (1998); Vol. 72, p.74 (1995). リンク
- ^ 例:Organic Syntheses, Vol. 81, p.178 (2005). リンク
- ^ Öfele, K.; Tosh, E.; Taubmann, C.; Herrmann, WA (2009). "Carbocyclic Carbene Metal Complexes". Chemical Reviews . 109 (8): 3408– 3444. doi :10.1021/cr800516g. PMID 19449832
- ^ Samojłowicz, C.; Bieniek, M.; Grela, K. (2009). 「N-ヘテロ環カルベン配位子を有するルテニウム系オレフィンメタセシス触媒」. Chemical Reviews . 109 (8): 3708– 3742. doi :10.1021/cr800524f. PMID 19534492
- ^ Benhamou, L.; Chardon, E.; Lavigne, G.; Bellemin-Laponnaz, S.; César, V. (2011). 「N-ヘテロ環カルベン前駆体の合成経路」(PDF) . Chemical Reviews . 111 (12): 2705– 2733. doi :10.1021/cr100328e. PMID 21235210
- ^ Conley, B.; Pennington-Boggio, M.; Boz, E.; Williams, T. (2010). 「Shvo触媒の発見、応用、および触媒機構」. Chemical Reviews . 110 (4): 2294–2312 . doi :10.1021/cr9003133. PMID 20095576.
- ^ Organic Syntheses , Organic Syntheses, Vol. 82, p.10 (2005). リンク
- ^ 例: Organic Syntheses , Organic Syntheses, Vol. 82, p.188 (2005). リンク
- ^ ハットナー、ゴットフリート; ランゲ、ジークフリート;フィッシャー、エルンスト・O. (1971). 「ビス(ヘキサメチルベンゼン)-ルテニウム(0)の分子構造」. Angewandte Chemie International Edition in English . 10 (8): 556– 557. doi :10.1002/anie.197105561.