 | |
| 名称 | |
|---|---|
| 推奨IUPAC名
トリフルオロエタンペルオキソ酸 | |
別名
| |
| 識別子 | |
| |
3Dモデル(JSmol)
|
|
| ChemSpider |
|
PubChem CID
|
|
| UNII | |
コンプトックスダッシュボード (EPA)
|
|
| |
| |
| 性質 | |
| C 2 H F 3 O 3 | |
| モル質量 | 130.022 g·mol |
| 外観 | 無色の液体 |
| 沸点 | 162℃ (324℉; 435K) |
| 溶解度 | アセトニトリル、ジクロロメタン、ジエチルエーテル、スルホランに可溶 |
特に記載がない限り、データは標準状態(25 °C [77 °F]、100 kPa)における材料のものです。
| |
トリフルオロ過酢酸(トリフルオロペルオキシ酢酸、TFPAA)は、有機フッ素化合物であり、トリフルオロ酢酸のペルオキシ酸類似体であり、縮合構造式はCFです
3COOOH。[注1]ケトンのバイヤー・ビリガー酸化など、有機酸化反応における強力な酸化剤です。[1]有機過酸の中で最も反応性が高く、他の過酸が効果のない、比較的反応性の低いアルケンをエポキシドに酸化することができます。 [2]また、セレノエーテルをセロンに変換するなど、一部の官能基のカルコゲンを酸化することもできます。[3]爆発の危険性がある物質であり[4]、市販されていませんが、必要に応じて迅速に調製できます。[5]実験試薬 としての使用は、ウィリアム・D・エモンズによって開拓され、開発されました。[6] [7]
プロパティ
標準周囲温度および圧力下では、トリフルオロ過酢酸は無色の液体で、沸点は162 °Cです。[8]アセトニトリル、ジクロロメタン、ジエチルエーテル、スルホラン に溶け、水と容易に反応します。[5]すべての過酸と同様に、爆発の危険性があり、注意して取り扱う必要があります。[4]市販されていませんが、研究室で製造し、-20 °Cで最大数週間保存できます。[5]一部の製造方法では、残留過酸化水素とトリフルオロ酢酸を含む混合物が生成されますが、そのような混合物を加熱することは非常に危険です。過酸化水素は、加熱前に安全のために二酸化マンガンを使用して分解することができます。[5] [8]
製造
トリフルオロ過酢酸は、トリフルオロ酢酸無水物を濃(90%)[2]過酸化水素水溶液 で処理する有機合成[9]プロセスによって容易に製造できます
- CF
3COOCOCF
3 + H
2O
2 → CF
3COOOH + CF
3COOH
無水物は水と接触するとトリフルオロ酢酸を形成するため、過剰の無水物は過酸化物反応物から溶媒を除去する働きもします。 [9]
- CF
3COOCOCF
3 + H
2O → 2 CF
3COOH
より希釈された過酸化水素溶液(30%)は、トリフルオロ酢酸からのいくつかの反応でトリフルオロ過酢酸を形成するために使用できます。[2]
- CF
3COOH + H
2O
2 → CF
3COOOH + H
2O
純粋または高濃度の過酸化水素溶液を扱う際の危険を避けるために、過酸化水素-尿素を用いて過酸を得ることができます。[5]この方法は水を使用しないため、完全に無水の過酸が得られます。[10]これは、特定の酸化反応中に水の存在が副反応を引き起こす場合に有利です。[11]
- CF
3COOCOCF
3 + H
2O
2·CO(NH
2)
2 → CF
3COOOH + CF
3COOH + CO(NH
2)
2
合成にpH緩衝剤が必要であり、かつ水の存在が許容される場合、別の方法が開発されている。トリフルオロ酢酸無水物と過炭酸ナトリウム(2Na)を反応させる。
2CO
33時間
2O
2、トリフルオロ過酢酸と炭酸ナトリウムを生成するので、追加の緩衝液は不要になる。[5] [12]
- 3 CF
3COOCOCF
3 + 4 Na
2CO
3 · 3/2 H
2O
2 → 6CF
3 COOOH + 4Na
2CO
3 + 3 H
2O
トリフルオロ過酢酸はin situで生成することもできるため[13]、後で使用するために試薬を事前に合成するのではなく、標的基質と迅速に反応させることができます
歴史と用途

6H
5I(OOCCF
3)
2
トリフルオロ過酢酸は主に酸化剤として使用されます。[5] [7] 1953年9月、アメリカ化学会誌にウィリアム・D・エモンズとアーサー・F・フェリスによる論文が掲載され、この試薬はin situで生成され、アニリンをニトロベンゼンに酸化できることが報告されました。[13] その後2年間で、エモンズはこの試薬の調製方法を報告し、その応用に関する6つの論文をこの雑誌に掲載しました。[14] [15] [16]エモンズは、実験試薬としてのトリフルオロ過酢酸の先駆者[6]および開発者[7]として記憶されており、トリフルオロ過酢酸はその後、多くの異なるタイプの合成反応の 試薬として有用となっています
一例として、超原子価ヨウ素化合物(ビス(トリフルオロアセトキシ)ヨード)ベンゼン(CF
3COO)
2IC
6H
5酸性条件下でホフマン転位を行うために使用されます。 [17]この超原子価化合物は2つの方法で入手可能であり、どちらが選択されるかは通常、利用可能な材料によって異なります。酢酸類似体から交換反応によって 調製できます。 [18]またはヨードベンゼンをトリフルオロ過酢酸とトリフルオロ酢酸の組み合わせと反応させることによって調製できます。[17]

バイヤー・ビリガー酸化

トリフルオロ過酢酸は、同種の過酸や過酸化物に比べて高い酸性度を有することから、バイヤー・ビリガー酸化反応に用いられる最も強力な試薬の一つである[ 19] 。17 この反応はケトンを直鎖エステルまたはラクトンに変換するもので、1899年に初めて報告したアドルフ・フォン・バイヤーとヴィクター・ビリガーにちなんで命名された。 [1]この反応はクリギー中間体[5]を経由して進行すると考えられており、次の例に見られるように、隣接位置の立体化学を保持しながら、酸素原子挿入の位置に関して良好な位置選択性と化学選択性を示す。リン酸二ナトリウム(Na
2HPO
4)はpH緩衝剤[2]として添加され、酸性度の高いトリフルオロ酢酸副産物がエステル生成物の
加水分解[20]やエステル交換反応[21]を引き起こすのを防ぎます

エポキシ化
プリレジャエフ反応は、過酸を酸化剤として用いてアルケンをエポキシドに変換する反応であり[22]、1909年に初めて報告されました。[23]この反応は、トロパンアルカロイドであるスコピン の合成の最終段階として用いられてきました。この方法では、二鉄ノナカルボニルを介した[4+3]環化付加反応を用いて二環式骨格を構築し、次にジイソブチルアルミニウムヒドリドを用いたケトンのジアステレオ選択的還元によってヒドロキシル官能基を導入し、プリレジャエフトリフルオロ過酢酸エポキシ化反応によって合成が完了します。[24]

トリフルオロ過酢酸は他の過酸に比べて反応性が高いため、1-ヘキセンなどの比較的電子不足のアルケンやメチルメタクリレートなどのα,β-不飽和エステルなど、過酸エポキシ化に一般的に抵抗性のある基質をうまく酸化することができます。[2] 混合物に緩衝化されたトリフルオロ酢酸をさらに含めると、エポキシドの代わりにビシナルヒドロキシ-トリフルオロ酢酸構造が得られ、これは酸性メタノールで処理することでジオールに変換できます。例えば、以下の1-ドデセンから1,2-ドデカンジオールへの変換が挙げられます。[2]

近接カルボニル官能基を持つアリルアルコール化合物の場合、エポキシドは環拡大反応を起こしてジオキソランを形成する。[5] [11] 以下のプロセスは、天然物であるネオスポロールの全合成の一部として使用された。[11] [25]

異性体化合物スポロルの合成にも、同様のジオキソラン形成が関与している。この場合、過酸化水素から誘導されたトリフルオロ過酢酸(おそらく微量の水分を含む)を使用したため、閉環ジオキソランではなく、主にヘミアセタールが得られた。一方、尿素錯体を用いたことで、水分を含まない物質が得られ、ジオキソランを主生成物として得ることに成功した。[ 11]このジオキソランは、合成の後の段階で、スポロルに見られる1,3-ジオキサン系 へと拡張される。 [25]
ヘテロ原子の酸化
低酸化状態のヘテロ原子を含む官能基は、トリフルオロ過酢酸によって酸化されます。[5] [7]一般的な例としては、ヨウ素(例えば、前述のヨードベンゼンから超原子価ヨウ素化合物の形成)、窒素、硫黄、セレンの 酸化が挙げられます
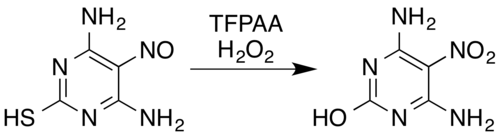
窒素含有化合物の場合、オキシム[5]および芳香族第一級アミン[15]からニトロ化合物[7](電子吸引性置換基を有する場合も含む、例えばペンタフルオロアニリンからペンタフルオロニトロベンゼン[26])、ニトロソアミンからニトラミン[7] [14]、芳香族N -オキシドおよび芳香族アジンN -オキシドの形成[5] [27] 、およびニトロソ化合物からニトロ化合物またはニトラミンへの変換[5]などが知られている。 例えば、過酸化水素とトリフルオロ過酢酸の混合物は、ニトロソ置換ピリミジン4,6-ジアミノ-5-ニトロソピリミジン-2-チオールをニトロ類似体に酸化すると同時に、酸化加水分解脱硫によってチオール部分を除去する:[5] [28]
カルコゲン元素の場合、硫化物基(R-S-R)はトリフルオロ過酢酸によって酸化され、条件によってはスルホキシド(R-S(O)-R)および/またはスルホン(R-S(O) 2 -R)の形態となる。 [5] 類似のセレン系では、トリフルオロ過酢酸によるセレノエーテル(R-Se-R)の酸化により、単離可能な生成物であるセレノキシド(R-Se(O)-R)を形成せずにセロン(R-Se(O ) 2 -R)が生成する。 [3]この反応は、Rがアリール基である場合に特に効果的である。[29]スルフィニルクロリド(RS(O)Cl) を生成するための一般的な方法は、対応するチオールとスルフリルクロリド(SO
2Cl
2)。代わりにスルフェニルクロリド(RSCl)が生成する場合は、2,2,2-トリフルオロ-1,1-ジフェニルエタンチオールの場合のように、その後のトリフルオロ過酢酸酸化により目的の生成物が得られます。[30]

チオフェンのトリフルオロ過酢酸酸化は、S酸化とエポキシ化の両方が起こり得る、競合する反応経路を示している。 [31] [注 2] 主要経路では最初にスルホキシドが生成されるが、この化学物質はさらなる酸化が起こる前にすぐにディールス・アルダー型の二量化を起こす。反応生成物の中にチオフェン-S-オキシドもチオフェン-S , S-ジオキシドも見つからない。 [5] [31]その後、二量体はさらに酸化され、S-オキシド部分の1つがS , S-ジオキシドに変換される。副次的な反応経路では、プリレジャエフエポキシ化[22]によりチオフェン-2,3-エポキシドが生成され、これはすぐに異性体のチオフェン-2-オンに転位する。[31] トラッピング実験[35]は、このエポキシド経路がS-オキシド中間体の代替反応ではないことを実証しており、同位体標識実験は、1,2-水素化物シフト(NIHシフト)が起こり、したがってカチオン中間体が関与していることを実証している。[31] トリフルオロ過酢酸の調製方法の選択は、水が競合塩基として作用するため、マイナー反応経路を抑制するため重要である。[31]

酸性転位を伴う酸化
トリフルオロ過酢酸と三フッ化ホウ素を併用すると、アルケンと芳香族環の酸化が起こり、同時に分子骨格が転位する。 [5]
アルケンの場合、反応はケトン生成物を与えるが、その反応機構は単純にエポキシ化とそれに続くBF3触媒によるワグナー・メーアヴァイン転位ではない:[ 36 ]

芳香族化合物については、有機合成の報告書でヘキサメチルベンゼンから2,3,4,5,6,6-ヘキサメチル-2,4-シクロヘキサジエノンへの変換が示されている。 [9]

アレーンの酸化分解
トリフルオロ過酢酸は、芳香族環を単純に酸化してカルボニル化合物を生成する(酸性転位を伴う酸化の項参照)だけでなく、環内の炭素-炭素結合を完全に切断することができる。アルキル芳香族構造の他の酸化反応では、反応性の高いベンジル位のアルキル鎖が切断されて安息香酸や関連化合物が得られるが、トリフルオロ過酢酸は「逆酸化」を引き起こし、アルキル基はそのまま残したまま芳香族環自体を切断する。[37] [38]

特定の種類の結合に対する選択性により、石炭などの炭化水素の複雑な混合物を分解して構造の詳細を決定するために使用することができます。 [39] [37]
ヘテロ原子を含む芳香族系は、ヘテロ原子の酸化が優先的に起こり、過酸による求電子攻撃に対して環を不活性化するため、この開環反応に対して耐性を示す。例えば、プリン、ピリジン、キノリンはN-オキシドを形成し、[5]、オクタフルオロジベンゾチオフェンのような硫黄系はスルホンに変換される。[7] [40]
環活性化置換基を有する芳香族系は、開環反応を経ずに 酸化されてフェノールを生成することができる。例えば、メシチレンはトリフルオロ過酢酸と反応してメシトール(2,4,6-トリメチルフェノール)を生成する。[7] 7-オキソデアセトアミドコルヒチン のバイヤー・ビリガー酸化によるラクトンの生成を試みた研究者らは、目的の生成物を得ることはできなかったものの、芳香環を酸化して高収率でフェノール誘導体を生成することに成功した。[5] [41]

注記
参考文献
- ^ ab Kürti, László; Czakó, Barbara (2005).有機合成における命名反応の戦略的応用. Elsevier Academic Press . p. 28. ISBN 978-0-12-429785-2。
- ^ abcdef 檜山 爲次郎 (2000). 「8.2 トリフルオロ酢酸とトリフルオロ過酢酸」.有機フッ素化合物:化学と応用.シュプリンガー・サイエンス&ビジネス・メディア. pp. 255– 257. ISBN 978-3-662-04164-2。
- ^ ab 片岡 剛; 吉松 正之 (1995). 「アルキルカルコゲニド:セレンおよびテルル系官能基」。Steven V. Ley編. 合成:単結合で結合したヘテロ原子1個を持つ炭素。包括的な有機官能基変換。エルゼビア。277~296ページ。ISBN 978-0-08-042323-4。
- ^ ab Carey, Francis A.; Sundberg, Richard J. (2007). 「5.5 エポキシドを含む付加反応」.上級有機化学:パートA:構造と機構(第5版). Springer Science & Business Media . pp. 503– 514. ISBN 978-0-387-44897-8。
- ^ abcdefghijklmnopqrs キャスター、ケネス・C.;ラオ、A.ソマセカー;モハン、H.ラマ;マクグラス、ニコラス・A.;ブリチャセック、マシュー (2012). 「トリフルオロ過酢酸」.有機合成試薬百科事典. e-EROS 有機合成試薬百科事典. doi :10.1002/047084289X.rt254.pub2. ISBN 978-0-471-93623-7。
- ^ ab Freeman, Jeremiah P. (2002年11月14日). 「William D. Emmons: November 18, 1924 – December 8, 2001」(PDF) . Org. Synth. 80 : xxvii– xxix. 2015年3月16日時点のオリジナル(PDF)からアーカイブ。2017年1月21日閲覧
- ^ abcdefgh チェンバース、リチャード・D. (2004). 「酸素、硫黄、または窒素を含む機能性化合物およびその誘導体」.フッ素と有機化学. CRC Press . pp. 242– 243. ISBN 978-0-8493-1790-3。
- ^ ab Luxon, SG (1992).化学実験室における危険(第5版).王立化学協会. p. 627. ISBN 978-0-85186-229-3。
- ^ abc Hart, Harold; Lange, Richard M.; Collins, Peter M. (1968). "2,3,4,5,6,6-ヘキサメチル-2,4-シクロヘキサジエン-1-オン". Organic Syntheses . 48 : 87. doi :10.15227/orgsyn.048.0087;集成第5巻598ページ。
- ^ Cooper, Mark S.; Heaney, Harry ; Newbold, Amanda J.; Sanderson, William R. (1990). 「尿素-過酸化水素を用いた酸化反応:無水過酸化水素の安全な代替物」. Synlett . 1990 (9): 533– 535. doi :10.1055/s-1990-21156. S2CID 196724921.
- ^ abcd Ziegler, Fredrick E.; Metcalf, Chester A.; Nangia, Ashwini; Schulte, Gayle (1993). 「スポロルとネオスポロルの構造と全合成」. J. Am. Chem. Soc. 115 (7): 2581– 2589. Bibcode :1993JAChS.115.2581Z. doi :10.1021/ja00060a006.
- ^ Kang, Ho-Jung; Jeong, Hee-Sun (1996). 「バイヤー・ビリガー反応のためのトリフルオロペルオキシ酢酸の新生成法」Bull. Korean Chem. Soc. 17 (1): 5– 6.
- ^ ab エモンズ, ウィリアム・D. ; フェリス, アーサー・F. (1953). 「ペルトリフルオロ酢酸による酸化反応」. J. Am. Chem. Soc. 75 (18): 4623– 4624. Bibcode :1953JAChS..75.4623E. doi :10.1021/ja01114a539.
- ^ ab エモンズ, ウィリアム D. (1954). 「ペルオキシトリフルオロ酢酸. I. ニトロソアミンからニトロアミンへの酸化」. J. Am. Chem. Soc. 76 (13): 3468– 3470. Bibcode :1954JAChS..76.3468E. doi :10.1021/ja01642a029.
- ^ ab エモンズ, ウィリアム D. (1954). 「ペルオキシトリフルオロ酢酸. II. アニリンからニトロベンゼンへの酸化」. J. Am. Chem. Soc. 76 (13): 3470– 3472. Bibcode :1954JAChS..76.3470E. doi :10.1021/ja01642a030.
- ^ エモンズ, ウィリアム・D. ; パガーノ, アンジェロ・S. ; フリーマン, ジェレミア・P. (1954). 「ペルオキシトリフルオロ酢酸. III. オレフィンの水酸化」. J. Am. Chem. Soc. 76 (13): 3472– 3474. Bibcode :1954JAChS..76.3472E. doi :10.1021/ja01642a031.
エモンズ, ウィリアム・D. ; パガーノ, アンジェロ・S. (1955). 「ペルオキシトリフルオロ酢酸. IV. オレフィンのエポキシ化」. J. Am. Chem. Soc. 77 (1): 89– 92. Bibcode :1955JAChS..77...89E. doi :10.1021/ja01606a029.
エモンズ, ウィリアム・D. ; ルーカス, ジョージ・B. (1955). 「ペルオキシトリフルオロ酢酸. V. ケトンからエステルへの酸化」. J. Am. Chem. Soc. 77 (8): 2287– 2288. Bibcode :1955JAChS..77.2287E. doi :10.1021/ja01613a077.
エモンズ, ウィリアム D. ; パガーノ, アンジェロ S. (1955). 「ペルオキシトリフルオロ酢酸. VI. オキシムのニトロパラフィンへの酸化」. J. Am. Chem. Soc. 77 (17): 4557– 4559. Bibcode :1955JAChS..77.4557E. doi :10.1021/ja01622a036. - ^ ab Aubé, Jeffrey; Fehl, Charlie; Liu, Ruzhang; McLeod, Michael C.; Motiwala, Hashim F. (1993). 「6.15 Hofmann, Curtius, Schmidt, Lossen, and Related Reactions」.ヘテロ原子操作. 包括的有機合成II. 第6巻. pp. 598– 635. doi :10.1016/B978-0-08-097742-3.00623-6. ISBN 978-0-08-097743-0。
- ^ Almond, MR; Stimmel, JB; Thompson, EA; Loudon, GM (1988). 「[I,I-ビス(トリフルオロアセトキシ)]ヨードベンゼン:シクロブタンカルボキサミドからのシクロブチルアミン塩酸塩を用いた弱酸性条件下でのホフマン転位」. Organic Syntheses . 66 : 132. doi :10.15227/orgsyn.066.0132;集成第8巻、132ページ。
- ^ マイヤーズ、アンドリュー・G.「化学115ハンドアウト:酸化」(PDF)ハーバード大学。2017年5月16日時点のオリジナル(PDF)からアーカイブ。 2017年1月10日閲覧。
- ^ Carruthers, William (1971). 「6.3 オレフィンの酸化」.有機合成の現代的方法.ケンブリッジ大学出版局. pp. 259– 280. ISBN 978-0-521-09643-0。
- ^ Carruthers, William (1971). 「6.5 ケトンのバイヤー・ビリガー酸化」.有機合成の現代的方法.ケンブリッジ大学出版局. pp. 287– 290. ISBN 978-0-521-09643-0。
- ^ ab Hagen, Timothy J. (2007). 「プリレジャエフ反応」. Li, Jie Jack; Corey, EJ (編).官能基変換の名称反応. John Wiley & Sons . pp. 274– 281. ISBN 978-0-470-17650-4。
- ^ Prileschajew, Nikolaus (1909). "Oxydation ungesättigter Verbindungen mittels organischer Superoxyde" [有機スーパーオキシドによる不飽和化合物の酸化]. Ber. Dtsch. Chem. Ges. (ドイツ語). 42 (4): 4811– 4815. doi :10.1002/cber.190904204100
- ^ 早川雄三; 馬場雄三; 牧野誠;野依亮(1978). 「遷移金属カルボニルによる炭素-炭素結合形成促進. 19. ポリブロモケトン-鉄カルボニル反応によるトロパンアルカロイドの一般合成」. J. Am. Chem. Soc. 100 (6): 1786– 1791. Bibcode :1978JAChS.100.1786H. doi :10.1021/ja00474a021.
- ^ ab ピルング, マイケル・C.、モアヘッド, アンドリュー・T.、ヤング, ブルース・G. 編 (2000). 「10. ネオスポロール、スポロール」.パートB:二環式および三環式セスキテルペン. 天然物の全合成. 第11巻.ジョン・ワイリー・アンド・サンズ. pp. 222– 224. ISBN 978-0-470-12963-0。
- ^ Brooke, GM; Burdon, J.; Tatlow, JC (1961). 「芳香族ポリフルオロ化合物。第7部。ペンタフルオロニトロベンゼンとアンモニアの反応」。J . Chem. Soc. : 802– 807. doi :10.1039/JR9610000802
- ^ Williams, W. Michael; Dolbier, William R. (1969). 「アジン酸化物の熱的および光化学的転位.I. 熱分解によるニトリルへの変換」. J. Org. Chem. 34 (1): 155– 157. doi :10.1021/jo00838a034.
- ^ Taylor, Edward C. ; McKillop, Alexander (1965). 「5-ニトロピリミジンの新合成」J. Org. Chem. 30 (9): 3153– 3155. doi :10.1021/jo01020a067.
- ^ Taylor, PC (1995). 「ビニルおよびアリールカルコゲニド:硫黄、セレン、テルルをベースとした官能基」. Ley, Steven V. (編). 合成:単結合で結合したヘテロ原子1個を持つ炭素. 包括的有機官能基変換. Elsevier . pp. 705–736. ISBN 978-0-08-042323-4。
- ^ Page, PCB; Wilkes, RD; Reynolds, D. (1995). 「アルキルカルコゲニド:硫黄系官能基」。Ley , Steven V. (編). 合成:単結合で結合したヘテロ原子1個を持つ炭素。包括的な有機官能基変換。エルゼビア。113~276ページ。ISBN 978-0-08-042323-4。
- ^ abcde Treiber, Alexander (2002). 「酸触媒過酸酸化によるチオフェンの芳香族ヒドロキシル化の機構」. J. Org. Chem. 67 (21): 7261– 7266. doi :10.1021/jo0202177. PMID 12375952.
- ^ Mansuy, Daniel; Valadon, Philippe; Erdelmeier, Irene; López Garcia, Pilar; Amar, Claudine; Girault, Jean-Pierre; Dansette, Patrick M. (1991). 「新規反応性代謝物としてのチオフェンS-オキシド:シトクロムP-450依存性酸化による生成および求核剤との反応」J. Am. Chem. Soc. 113 (20): 7825– 7826. Bibcode :1991JAChS.113.7825M. doi :10.1021/ja00020a089.
- ^ Correia, Maria A.; Hollenberg, Paul F. (2015). 「シトクロムP450酵素の阻害」. Ortiz de Montellano, Paul R. (編).シトクロムP450: 構造、メカニズム、生化学(第4版). Springer . pp. 177– 260. ISBN 978-3-319-12108-6。
- ^ マシェリー、アンヌ=クリスティン;ダンセット、パトリック・M. (2015).「毒性代謝物につながる生体内変換:化学的側面」。カミーユ・ジョルジュ・ワームート、ダヴィッド・オルダス、ピエール・ラボワソン、ディディエ・ログナン(編)『医薬化学の実践』(第4版)。エルゼビア。585 ~ 614ページ。ISBN 978-0-12-417213-5。
- ^ アンスリン、エリック・V.、ダハティ、デニス・A. (2006).「8.8 メカニズム研究のための様々な実験」.現代物理有機化学. 大学科学図書. pp. 471– 482. ISBN 978-1-891389-31-3。
- ^ Hart, Harold; Lerner, Lawrence R. (1967). 「ペルオキシトリフルオロ酢酸-三フッ化ホウ素による酸化反応。IX. ペルオキシトリフルオロ酢酸-フッ化ホウ素を用いたアルケンからケトンへの直接酸化」J. Org. Chem. 32 (9): 2669– 2673. doi :10.1021/jo01284a004.
- ^ ab Deno, Norman C. ; Greigger, Barbara A. ; Stroud, Stephen G. (1978). 「石炭の構造を解明するための新しい方法」. Fuel . 57 (8): 455– 459. Bibcode :1978Fuel...57..455D. doi :10.1016/0016-2361(78)90153-9.
- ^ デノ, ノーマン C. ; グレイガー, バーバラ A. ; メッサー, ローレン A. ; マイヤー, マイケル D. ; ストラウド, スティーブン G. (1977). 「アルキルベンゼンの芳香環酸化」. Tetrahedron Lett. 18 (20): 1703– 1704. doi :10.1016/S0040-4039(01)93253-8.
- ^ デノ, ノーマン C. ; カリー, ケネス W. ; グレイガー, バーバラ A. ; ジョーンズ, A. ダニエル ; ラキツキー, ウォルター G. ; スミス, カレン A. ; ワグナー, カレン ; ミナード, ロバート D. (1980). 「イリノイ No. 6 モントレー炭のジヒドロ芳香族構造」 . Fuel . 59 (10): 694– 698. Bibcode :1980Fuel...59..694D. doi :10.1016/0016-2361(80)90021-6.
- ^ Chambers, RD; Cunningham, JA; Spring, DJ (1968). 「ポリフルオロアリール有機金属化合物.第8部.オクタフルオロジベンゾフランの合成および求核置換反応」.J . Chem. Soc. C : 1560– 1565. doi :10.1039/J39680001560.
- ^ Berg, Ulf; Bladha, Håkan; Mpamposa, Konstantinos (2004). 「コルヒチンモチーフの立体化学的変異.チオコルヒコンの過酸酸化.合成,構造形成および微小管形成阻害」. Org. Biomol. Chem. 2 (14): 2125– 2130. doi :10.1039/B402840F. PMID 15254641.
