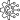この記事は技術的すぎるため、ほとんどの読者には理解しにくいかもしれません。技術的な詳細を削除せずに、 (2013年12月) |

有機化学において、ヨウ化ビニル(ヨードアルケンとも呼ばれる)官能基は、1つ以上のヨウ化物置換基(炭素-炭素二重結合で、炭素の1つまたは両方がヨウ素に結合している)を持つアルケンである。ヨウ化ビニルは、有機合成において重要な構成要素や前駆体として役立つ多用途の分子である。これらは、スティル反応、ヘック反応、薗頭カップリング、鈴木カップリングなど、炭素-炭素結合を形成する遷移金属触媒クロスカップリング反応でよく使用される。[1]明確に定義された構造を持つヨウ化ビニルの合成は 、天然物 や 医薬品の立体選択的 合成 において重要である。
プロパティ
ビニルヨウ化物は求核条件下では一般的に安定である。S N 2反応では、求電子中心に隣接する炭素上のR基の立体的衝突により、バックアタックは困難である(図1a参照)。 [2]さらに、ヨウ化物上の孤立電子対がアルケンのπ*に供与され、正電荷の減少に伴い炭素上の求電子性が低下する。また、この立体電子効果によりCI結合が強化され、ヨウ化物の除去が困難になる(図1b参照)。[3] S N 1反応の場合、CI結合が強化されるため解離は困難であり、ヨウ化物の損失により不安定なカルボカチオンが生成される(図1c参照)[2]。

クロスカップリング反応では、典型的にはヨウ化ビニルは塩化ビニルや臭化ビニルよりも速く、より穏やかな条件下で反応する。反応性の順序は炭素-ハロゲン結合の強さに基づく。CI結合はハロゲンの中で最も弱く、 CIの結合解離エネルギーは57.6kcal/molであるのに対し、フッ化物、塩化物、臭化物はそれぞれ115、83.7、72.1kcal/molである。[4]結合が弱いため、ヨウ化ビニルはハロゲン化ビニルほど容易に重合せず、むしろ分解してヨウ化物を放出する。[5]一般に、ヨウ化ビニルは一般的な還元条件に耐えられず、ヨウ化ビニルをオレフィンまたは不飽和アルカンに還元する と考えられている。[6]しかし、文献には、プロパルギルアルコールのアルキンがヨウ化ビニルの存在下でPd / CaCO 3またはクラブトリー触媒上で水素を使用して還元されたという証拠があります。[7]

その他のアプリケーション

ヨウ化ビニルは遷移金属クロスカップリング反応の有用な基質として用いられるほか、強塩基で脱離して対応するアルキンを得ることができ、適切なビニルグリニャール試薬に変換することもできる。ヨウ化ビニルはマグネシウム-ハロゲン交換反応によってグリニャール試薬に変換される(図1a参照)。[8]この合成法は、高温と長い反応時間を必要とし、官能基許容度に影響するため、適用範囲が限られている。しかし、電子吸引基を持つヨウ化ビニルは交換速度を高めることができる(図1b参照)。[8]また、塩化リチウムの添加はマグネシウム-ハロゲン交換を促進するのに役立つ(図1c参照)。塩化リチウムは有機マグネシウム試薬の凝集体を分解すると予測される。[9]
合成方法
ヨウ化ビニルは、ヨウ素化や置換反応などの方法によって合成されます。多くの天然物や薬物は特定の構造と寸法を持っているため、明確に定義された形状(位置化学と立体化学)を持つヨウ化ビニルは合成において重要です。位置化学の例は、ヨウ化物がオレフィンのアルファ位またはベータ位のどちらに配置されているかです。EZ表記法やシス-トランスアルケン形状などの立体化学は、鈴木カップリングなどの一部の遷移金属クロスカップリング反応がオレフィン形状を保持できるため重要です。合成では、次の合成段階でカップリング反応を準備するために、さまざまな位置にヨウ化ビニルを導入することが有用です。以下は、ヨウ化ビニルを導入および合成するためのさまざまな手段と方法です。
アルキンからの合成
ヨウ化ビニルを製造するための一般的かつ最も簡単な方法は、1当量のヨウ化水素酸(HI)をアルキンに付加することです。この方法では、マルコフニコフ則に従って、一般的に2-ヨード-1-アルケンまたはα-ヨウ化ビニルが生成します。しかし、この反応は良好な反応速度で進行せず、また、非常に高い立体選択性も得られません。[10]そのため、ほとんどの合成法では、ヨウ化水素酸源を添加する前にヒドロメタル化工程を経ることがよくあります。
α-ビニルヨウ化物
アルキンの末端からα-ビニルヨウ化物を導入するのは難しいステップです。さらに、ビニル金属中間体は弱求核性であることがあり、例えばビニルアルミニウムは触媒条件下でCC結合を形成できます。しかし、Hoveydaグループはニッケルベースの触媒(Ni(dppp)Cl 2)、DIBAL-HとN-ヨードコハク酸イミド(NIS)を使用することで、副生成物をほとんどまたは全く生成せずにα-ビニルヨウ化物を選択的に生成することを実証しました。[11]また、彼らは同じ条件下でのヒドロアルミネーション反応で、Ni(PPh 3 ) 2 Cl 2を用いたβに対する逆選択性を観察し、副生成物はほとんどまたは全く生成しませんでした。この方法の利点は、安価(市販されている)、スケーラブル、ワンポット反応であることです。

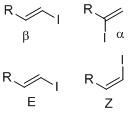
もう一つの方法は、ヒドロメタル化ではなく、ヨウ素/ヒドロホスフィン二成分系によるヒドロヨウ化であり、これは小川らのグループによって開発された。[12]
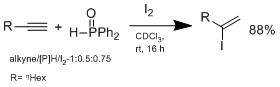
ヒドロヨウ素化はマルコフニコフ型付加物によって進行し、ヒドロホスフィンを添加しなければ反応は観察されません。小川らが提唱する妥当な機構では、ヒドロホスフィンがHIと反応して中間体錯体を形成し、これにHIが配位してアルケンにマルコフニコフ型ヒドロヨウ素化反応を起こすと考えられています。この系の利点は、反応条件が穏やかで、幅広い官能基を許容できることです。

β-ビニルヨウ化物
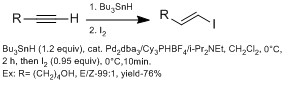
これらは、一般的に、ヒドロメタル化(アルミニウムを用いるDIBAL-H(ヒドロアルミ化)、ホウ素を用いる(ヒドロホウ素化)、HZrCp 2 Cl(ヒドロジルコニウム化))を用いるα-ビニルヨウ化物よりもβ-ビニルヨウ化物を製造する上で多くの方法である。[13]しかし、様々な官能基を持つアルキンとのヒドロメタル化は、副生成物との反応が不良になることが多い。Chongグループは、高いE立体選択性を持つパラジウム触媒とBu 3 SnHを用いたヒドロスズ化を用いて実証した。[13]彼らは、立体的にかさ高い配位子を使用すると、β-ビニルヨウ化物に対してより高い位置選択性が得られることを観察した。この技術の利点は、この技術が幅広い官能基を許容できることである。
Z選択的β-ビニルヨウ化物はE-β-ビニルヨウ化物よりも導入がやや難しく、多くの場合、複数のステップが必要です。ヒドロアルミネーションおよびヒドロホウ素化は通常syn形式で進行するため、選択的にE形状が優先されます。大島グループは、HInClでのヒドロインデーションを使用してZ形状が選択的に優先することを実証しました。[14]彼らは、反応がラジカル機構によって進行することを示唆しました。彼らは、HInClがラジカル付加によってアルキンにZ形状で付加すると予測しています。ラジカルInCl 2と中間体錯体の反応性が低いため(2回目の付加なし)、E形状に異性化しません。2回目の付加が起こると、ジインジウム中間体を介して異性化が発生します。彼らは、アルキンとアルケンの環化を用いた機構研究でラジカル機構を確認しています。

代替
分子にヨウ化ビニルを導入する方法としては、置換反応が最も有効であると考えられる。ヨウ化ビニルは他のハロゲン化ビニルよりも反応性が高いため、ハロゲン交換反応も有用である。Buchwaldらは、温和な条件下で銅触媒を用いて臭化ビニルからヨウ化ビニルへのハロゲン交換反応を実証している[15] 。この方法は当初、ハロゲン化アリールで試験された条件であるため、様々な官能基を許容できる可能性がある。この交換反応の位置化学および立体化学への応用範囲は、現在未開拓である。

ハロゲン交換は、オレフィンの構造を保持するジルコニウム誘導体でも行うことができる[16]
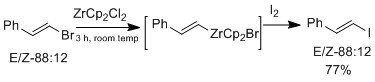
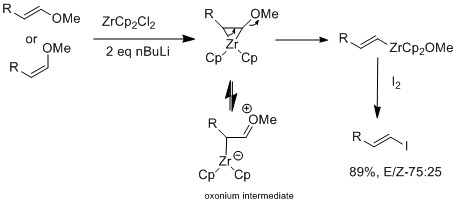
Marekらは、E-ビニルエーテルまたはZ-ビニルエーテルにジルコニウム触媒を用いる研究をさらに進め、E-ビニルエーテルを選択的に合成した[16] 。ジルコニウムの親酸素性により、β位のアルコキシ基が脱離し、中間体であるビニルジルコニウム錯体が形成される。E-幾何構造の選択性は立体構造によるものではなく、反応自体が協調的ではない。機構研究では異性化が観察されており、これはE-幾何構造の生成物がZ-幾何構造よりも好ましいことを示唆している。ハロゲン交換反応とE-ビニルエーテル反応の結果の違いは、オキソニウム中間体が存在する場合にのみ異性化が観察される点である。

興味深い置換反応として、ブラウンらが行ったビニルボロン酸からヨウ化ビニルへの反応がある[17] 。ヨウ化物または塩基の添加順序によって、ホウ酸ビニルはヨウ化ビニルの異なる立体異性体を生成する(図2a参照)。しかし、ホイティングらは、ブラウンらの方法が立体障害の大きいボロン酸エステルには適用できない(反応しない)ことに気づいた[18] 。彼らは、ヨウ化物源の電気陽性度が十分ではなかったと考えた。そこで彼らは、ヨウ化物よりも極性が高いIClを用いることにし、同様の結果を得た(図2b参照)。
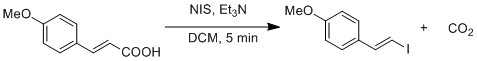
カルボン酸からヨウ化物へのラジカル置換は、改良ハンスディーカー反応によって実証されている。[19] OI結合のホモリシス開裂によりCO2とビニルラジカルが生成される。ビニルラジカルはヨウ化物ラジカルと再結合してヨウ化ビニルを形成する。
ヨウ素脱シリル化
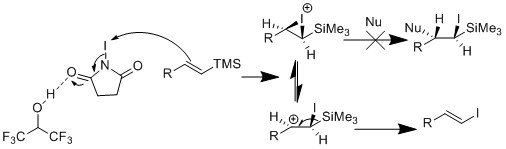
ヨウ化脱シリル化は、ヨウ化物によるシラン基の置換反応です。ヨウ化脱シリル化の利点は、有毒なスズ試薬を必要とせず、中間体であるビニルシランが安定で無毒であり、取り扱いや保管が容易なことです。ビニルシランは、末端アルキンから合成することも、他の方法で合成することもできます。
岸らの研究グループは、アセトニトリルとクロロアセトニトリルの混合溶媒中でNISを用いてビニルシリルからヨウ化ビニルを穏やかに合成したことを報告した[20]。彼らは、ビニルシリル基質によってはオレフィンの構造が保持される一方、他の基質ではオレフィンの構造が反転することを観察した。彼らは、R基の大きさがオレフィンの構造に影響を与えると推論した。R基が小さい場合、溶媒であるアセトニトリルが反応に関与し、オレフィンの構造が反転する。R基が大きい場合、溶媒は関与できず、オレフィンの構造が保持される。

ザカリアンらは、オレフィン構造の保持率が高いHFIP中で反応を行うことを決定した[21] 。彼らは、HFIPはアセトニトリルとは異なり求核性の低い溶媒であると推論した。さらに、HFIPは水素結合によってNISを活性化するため、反応速度が加速されることを観察した。
残念ながら、上記の条件下でのヨウ化脱シリル化は、酸素官能基を有する高度に官能化された分子において、複数の副産物を生成する可能性がある。VilarrasaとCostaのグループは、HIとI 2を生成するラジカル反応がアルコールの保護基の切断を促進し、他のアルケン結合にも付加する可能性があるという仮説を立てた。[22]彼らは酢酸銀や炭酸銀などの銀添加剤を用いて実験を行い、銀が過剰のヨウ化物と反応してヨウ化銀を形成することを明らかにした。そして、これらの条件でより良い変換率を達成した。
名前反応
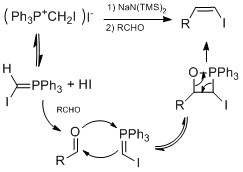
いくつかの有名なヨウ化ビニル合成法では、アルデヒドまたはケトンをヨウ化ビニルに変換する。バートンのヒドラゾンヨウ素化法では、ヒドラジンをアルデヒドまたはケトンに加えてヒドラゾンを形成する。次に、ヨウ化物とDBUを加えてヒドラゾンをヨウ化ビニルに変換する。[23] [24]この方法は、ダニシェフスキーによるタキソールの天然物合成[25]やシャイルによるコルチスタチンAの天然物合成[26]に使用されている。 別の方法は、ヨードホルムと塩化クロム(II)を使用してアルデヒドからヨウ化ビニルをE幾何形状に高い立体選択性で製造するタカイオレフィン化である。[27] Z幾何形状に高い立体選択性を得るために、ストーク・ジャオオレフィン化はウィッティヒのような反応で進行する。低温でHMPAの存在下で高収率とZ立体選択性が発生した。[28]
以下は、(+)-3-(E)-および(+)-3-(Z)-ピナチフィデニンの全合成において、タカイオレフィン化とストーク-ジャオオレフィン化の両方を用いた例である。[29]

消去法
ヨウ化ビニルは、アルケンとヨウ化物に分解する傾向があるため、隣接 二ヨウ化物の脱離反応によって脱離が起こることはほとんどない。 [30]ベイカーグループは、脱炭酸反応を用いることで脱離が起こることを明らかにした。[31]

参照
参考文献
- ^ Xie, Meihua; Wang, Jialiang; Zhang, Wei; Wang, Shaowu (2009-06-15). 「アセチレンスルホンのカルボジン化とそれに続くハロゲン化によるビニルハライドの位置特異的および立体特異的合成」 . Journal of Organometallic Chemistry . 694 (14): 2258– 2262. doi :10.1016/j.jorganchem.2009.03.006. ISSN 0022-328X.
- ^ ab Klein, David R. (2011-08-24). 有機化学. Wiley. ISBN 978-1-118-13750-5。
- ^ メータ、ブーピンダー;メタ、まんじゅう (2005-01-01)。有機化学。 PHI ラーニング。ISBN 978-81-203-2441-1。
- ^ Blanksby, Stephen J.; Ellison, G. Barney (2003-04-01). 「有機分子の結合解離エネルギー」 . Accounts of Chemical Research . 36 (4): 255– 263. doi :10.1021/ar020230d. ISSN 0001-4842. PMID 12693923.
- ^ Herman, Jan A.; Roberge, Pierre (1962年12月). 「溶液中におけるヨウ化ビニルのX線誘起重合」 . Journal of Polymer Science . 62 (174). Bibcode :1962JPoSc..62S.116H. doi :10.1002/pol.1962.1206217444. ISSN 0022-3832.
- ^ Zhang, Xing; Liu, Jun; Sun, Xue; Du, Yuguo (2013-02-04). 「ヨウ化ビニル存在下でのアルキンからアルケンへの効率的なシス還元:レイオドリドAのC22–C31フラグメントの立体選択的合成」 . Tetrahedron . 69 (5): 1553– 1558. doi :10.1016/j.tet.2012.12.008. ISSN 0040-4020.
- ^ Denton, Richard W.; Parker, Kathlyn A. (2009-07-02). 「官能基適合性:ヨウ化ビニル存在下でのプロパルギルアルコール還元」. Organic Letters . 11 (13): 2722– 2723. doi :10.1021/ol900927a. ISSN 1523-7060. PMC 2726658. PMID 19476372 .
- ^ ab Rottländer, Mario; Boymond, Laure; Cahiez, Gérard; Knochel, Paul (1999-02-01). 「ヨウ素−マグネシウム交換反応による官能基化アルケニルマグネシウム試薬の立体選択的調製」 . The Journal of Organic Chemistry . 64 (4): 1080– 1081. doi :10.1021/jo981941l. ISSN 0022-3263.
- ^ Ren, Hongjun; Krasovskiy, Arkady; Knochel, Paul (2004-11-01). 「i-PrMgCl·LiClを用いた官能基化非環式アルケニルマグネシウム試薬の立体選択的調製」 . Organic Letters . 6 (23): 4215– 4217. doi :10.1021/ol048363h. ISSN 1523-7060. PMID 15524446.
- ^ Kropp, Paul J.; Crawford, Scott D. (1994年6月). 「表面媒介反応. 4. アルキンのハロゲン化水素化」 . The Journal of Organic Chemistry . 59 (11): 3102– 3112. doi :10.1021/jo00090a031. ISSN 0022-3263.
- ^ Gao, Fang; Hoveyda, Amir H. (2010-08-18). 「アリールおよびアルキル置換末端アルキンのα選択的Ni触媒ヒドロアルミネーション:内部ビニルアルミニウム、ハロゲン化物、またはボロネートの実用的合成」アメリカ化学会誌. 132 (32): 10961– 10963. Bibcode :2010JAChS.13210961G. doi :10.1021/ja104896b. ISSN 0002-7863. PMC 2921967. PMID 20698643 .
- ^ 川口 真一; 小川 明也 (2010-05-07). 「ヨウ素−ヒドロホスフィン二成分系を用いたアルキンの高選択的ヒドロヨウ化」 .オーガニックレターズ. 12 (9): 1893– 1895. doi :10.1021/ol1005246. ISSN 1523-7060. PMID 20359187.
- ^ ab Darwish, Alla; Chong, J. Michael (2012-01-14). 「末端アルキンのPd触媒ヒドロスタノレーションによるE-ビニルヨウ化物の合成」 . Tetrahedron . 68 (2): 654– 658. doi :10.1016/j.tet.2011.10.104. ISSN 0040-4020.
- ^ 高見 一明; 三上 聡; 頼光 秀樹; 篠久保 博; 大島 幸一郎 (2003-08-01). 「トリエチルボランを介したヒドロガリウム化およびヒドロインデーション:有機ガリウムおよび有機インジウムへの新規合成法」 . The Journal of Organic Chemistry . 68 (17): 6627– 6631. doi :10.1021/jo0344790. ISSN 0022-3263. PMID 12919026.高見一明、他「トリエチルボランを介したヒドロガリウム化およびヒドロインデーション:有機ガリウムおよび有機インジウムへの新規アプローチ」The Journal of Organic Chemistry 68.17 (2003): 6627-6631.
- ^ Klapars, Artis; Buchwald, Stephen L. (2002-12-01). 「銅触媒によるアリールハライドにおけるハロゲン交換:芳香族フィンケルシュタイン反応」 . Journal of the American Chemical Society . 124 (50): 14844– 14845. Bibcode :2002JAChS.12414844K. doi :10.1021/ja028865v. ISSN 0002-7863. PMID 12475315.
- ^ ab Liard, Annie; Marek, Ilan (2000-10-01). 「EまたはZエノールエーテルからのEビニルジルコニウム誘導体の立体選択的合成」 . The Journal of Organic Chemistry . 65 (21): 7218– 7220. doi :10.1021/jo005561n. ISSN 0022-3263. PMID 11031055.
- ^ Brown, Herbert C.; Hamaoka, Tsutomu; Ravindran, N. (1973-10-23). 「ChemInform Abstract: 塩基の影響下におけるアルケニルボロン酸とヨウ素の反応:末端アルキンをヒドロボレーションによってトランス-1-アルケニルヨウ化物へと立体特異的に変換する簡便な方法」 . Chemischer Informationsdienst . 4 (43). doi :10.1002/chin.197343207. ISSN 0009-2975.
- ^ Stewart, Sarah K; Whiting, Andrew (1995-05-29). 「ICIを用いたビニルボロネートピナコールエステルからのビニルヨウ化物の立体選択的合成」 . Tetrahedron Letters . 36 (22): 3929– 3932. doi :10.1016/0040-4039(95)00644-R. ISSN 0040-4039.
- ^ Das, Jaya Prakash; Roy, Sujit (2002-11-01). 「α,β-不飽和カルボン酸の触媒的ボロジン-フンスディーカー反応:触媒の効率は?」 . The Journal of Organic Chemistry . 67 (22): 7861– 7864. doi :10.1021/jo025868h. ISSN 0022-3263. PMID 12398515.
- ^ Stamos, Dean P; Taylor, Andrew G; Kishi, Yoshito (1996-11-25). 「ビニルシランからのヨウ化ビニルの穏やかな合成」 . Tetrahedron Letters . 37 (48): 8647– 8650. doi :10.1016/S0040-4039(96)02000-X. ISSN 0040-4039.
- ^ Ilardi, Elizabeth A.; Stivala, Craig E.; Zakarian, Armen (2008-05-01). 「ビニルシランの立体選択的ヨード脱シリル化における唯一の溶媒としてのヘキサフルオロイソプロパノール」 . Organic Letters . 10 (9): 1727– 1730. doi :10.1021/ol800341z. ISSN 1523-7060. PMID 18386904.
- ^ シデラ、ミレイア;コスタ、アンナ M.ヴィララサ、ジャウメ (2011-09-16)。「アンフィジノリド B/D の合成に関連した TIPS、TBDPS、および TBS 置換アルケンのヨード脱シリル化」。有機的な文字。13 (18): 4934–4937。土井:10.1021/ol2020187。ISSN 1523-7060。PMID 21866884。
- ^ Barton, DHR; O'Brien, RE; Sternhell, S. (1962-01-01). 「88. ヒドラゾンの新しい反応」 . Journal of the Chemical Society : 470– 476. doi :10.1039/JR9620000470. ISSN 0368-1769.
- ^ バートン, デレク HR; バシアード, ジョージ; フォーリー, ジャン=ルイ (1988-01-01). 「強有機塩基存在下におけるヨウ素および臭化フェニルセレネニルによるヒドラゾンの酸化に関する研究;ヨウ化ビニルおよびフェニルビニルセレニドの合成のための改良法」 . Tetrahedron . 44 (1): 147– 162. doi :10.1016/S0040-4020(01)85102-4. ISSN 0040-4020.
- ^ Danishefsky, Samuel J.; Masters, John J.; Young, Wendy B.; Link, JT; Snyder, Lawrence B.; Magee, Thomas V.; Jung, David K.; Isaacs, Richard CA; Bornmann, William G.; Alaimo, Cheryl A.; Coburn, Craig A.; Di Grandi, Martin J. (1996-01-01). 「バッカチンIIIおよびタキソールの全合成」 . Journal of the American Chemical Society . 118 (12): 2843– 2859. Bibcode :1996JAChS.118.2843D. doi :10.1021/ja952692a. ISSN 0002-7863.ダニシェフスキー、サミュエル J. 他「バッカチンIIIとタキソールの全合成」アメリカ化学会誌 118.12 (1996): 2843-2859
- ^ Lee, Hong Myung; Nieto-Oberhuber, Cristina; Shair, Matthew D. (2008-12-17). 「強力かつ選択的な内皮細胞増殖阻害剤、(+)-コルチスタチンAのエナンチオ選択的合成」 . Journal of the American Chemical Society . 130 (50): 16864– 16866. Bibcode :2008JAChS.13016864L. doi :10.1021/ja8071918. ISSN 0002-7863. PMID 19053422.
- ^ 高井 健; 新田 健; 内本 健 (1986年11月). 「ハロホルム-塩化クロム系を用いたアルデヒド(RCHO)→(E)-ハロアルケン(RCH:CHX)の簡便かつ選択的な変換法」 .アメリカ化学会誌. 108 (23): 7408– 7410. doi :10.1021/ja00283a046. ISSN 0002-7863.
- ^ コウノトリ、ギルバート;趙、康(1989-01-01)。 「(Z)-1-ヨード-1-アルケンの立体選択的合成」。四面体の文字。30 (17): 2173–2174。土井: 10.1016/S0040-4039(00)99640-0。ISSN 0040-4039。
- ^ Kim, Hyoungsu; Choi, Won Jun; Jung, Jaeyoon; Kim, Sanghee; Kim, Deukjoon (2003-08-01). 「オレフィン幾何構造依存的内部アルキル化による8員環エーテル環の構築:(+)-3-( E )-および(+)-3-( Z )-ピナチフィデニンの初の不斉全合成」 . Journal of the American Chemical Society . 125 (34): 10238– 10240. Bibcode :2003JAChS.12510238K. doi :10.1021/ja035538u. ISSN 0002-7863. PMID 12926946.
- ^ Katritzky, Alan R.; Meth-Cohn, Otto; Rees, Charles Wayne (1995-12-15). 包括的有機官能基変換:合成:単結合で結合したヘテロ原子1個を持つ炭素. Elsevier. ISBN 978-0-08-042323-4。
- ^ ベイカー、レイモンド;カストロ、ホセ・L. (1990-01-01). 「(+)-マクベシンIの全合成」 . Journal of the Chemical Society, Perkin Transactions 1 (1): 47– 65. doi :10.1039/P19900000047. ISSN 1364-5463.