カテキン
 | |
 | |
| 名前 | |
|---|---|
| IUPAC名 (2 R ,3 S )-2-(3,4-ジヒドロキシフェニル)-3,4-ジヒドロ-2 H -クロメン-3,5,7-トリオール | |
| その他の名前 シアニダノールシアニダノール(+)-カテキンD -カテキンカテキン酸カテキュ酸シアニドール デキスシアニダノール(2 R ,3 S )-カテキン2,3-トランス-カテキン(2 R ,3 S )-フラバン-3,3′,4′,5,7-ペントール | |
| 識別子 | |
| |
3Dモデル(JSmol) | |
| チェビ |
|
| チェムブル | |
| ケムスパイダー |
|
| ECHA 情報カード | 100.005.297 |
| EC番号 |
|
| ケッグ | |
PubChem CID | |
| ユニイ |
|
CompToxダッシュボード(EPA) | |
| |
| |
| プロパティ | |
| C 15 H 14 O 6 | |
| モル質量 | 290.271 g·mol −1 |
| 外観 | 無色の固体 |
| 融点 | 175~177℃(347~351°F、448~450K) |
| 紫外線可視光線(λmax) | 276 nm |
カイラル回転([α] D) | +14.0° |
| 危険 | |
| 労働安全衛生(OHS/OSH): | |
主な危険 | 哺乳類の体細胞に対して変異原性があり、細菌および酵母に対しても変異原性がある |
| GHSラベル: | |
 | |
| 警告 | |
| H315、H319、H335 | |
| P261、P264、P271、P280、P302+P352、P304+P340、P305+P351+P338、P312、P321、P332+P313、P337+P313、P362、P403+P233、P405、P501 | |
| 致死量または濃度(LD、LC): | |
LD 50(中間投与量) | (+)-カテキン:ラットで10,000 mg/kg(RTECS)、マウスで10,000 mg/kg、ラットで3,890 mg/kg(その他の供給源) |
| 安全データシート(SDS) | サイエンスラボアプリケム |
| 薬理学 | |
| オーラル | |
| 薬物動態: | |
| 尿 | |
特に記載がない限り、データは標準状態(25 °C [77 °F]、100 kPa)における材料のものです。 | |
カテキン(ˈ k æ t ɪ k ɪ n)は、フラバン-3-オールの一種で、植物において抗酸化作用を持つ二次代謝物の一種です。ポリフェノールの一種で、フラボノイドと呼ばれるグループに属します。
カテキン化学ファミリーの名称は、ミモザ・カテチュ(アカシア・カテチュLf)のタンニン液または煮沸抽出物であるカテチュに由来しています。[ 1 ]
化学

カテキンは、2つのベンゼン環(A環とB環と呼ばれる)と、 3位の炭素にヒドロキシル基を持つジヒドロピラン複素環(C環)を有します。A環はレゾルシノール部位に類似し、B環はカテコール部位に類似しています。分子の2位と3位の炭素には2つのキラル中心があります。そのため、4つのジアステレオ異性体が存在します。そのうち2つはトランス配置でカテキンと呼ばれ、残りの2つはシス配置でエピカテキンと呼ばれます。
最も一般的なカテキン異性体は(+)-カテキンです。もう一つの立体異性体は(−)-カテキンまたはent-カテキンです。最も一般的なエピカテキン異性体は(−)-エピカテキン(L-エピカテキン、エピカテコール、(−)-エピカテコール、L-アカカテキン、L-エピカテコール、エピカテキン、2,3-シス-エピカテキン、または(2R , 3R ) -(−)-エピカテキンとも呼ばれます)です。
異なるエピマーはキラルカラムクロマトグラフィーを用いて分離することができる。[ 2 ]
特定の異性体を参照せずに、分子全体を単にカテキンと呼ぶことができます。異なるエナンチオマーの混合物は、(±)-カテキンまたはDL-カテキン、および(±)-エピカテキンまたはDL-エピカテキンと呼ばれます。
カテキンとエピカテキンは、凝縮タンニンの一種である プロアントシアニジンの構成要素です。
- ジアステレオ異性体ギャラリー
- (+)-カテキン (2 R ,3 S )
- (−)-カテキン (2 S ,3 R )
- (−)-エピカテキン (2 R ,3 R )
- (+)-エピカテキン (2 S ,3 S )

さらに、C環の柔軟性により、B環が擬似エクアトリアル位(E配座異性体)または擬似アキシャル位(A配座異性体)に位置する2つの配座異性体が存在する。研究により、(+)-カテキンは水溶液中でA配座異性体とE配座異性体の混合物を形成し、それらの配座平衡は33:67と評価されていることが確認されている。 [ 3 ]
フラボノイドであるカテキンは、試験管内で高濃度になると抗酸化物質として作用しますが、他のフラボノイドと比較すると抗酸化能は低いです。[ 4 ]一重項酸素を消去する能力は、カテキンの化学構造、つまり環Bのカテコール部分の存在と環Cの二重結合を活性化するヒドロキシル基の存在に関係しているようです。[ 5 ]
酸化
電気化学実験により、(+)-カテキンの酸化機構はカテコール基とレゾルシノール基に関連した段階的な反応で進行し、pH依存性であることが示された。カテコールの3′,4′-ジヒドロキシル電子供与基の酸化が最初に非常に低い正電位で起こり、可逆反応である。その後酸化されたレゾルシノール基の水酸基は不可逆的な酸化反応を起こすことが示された。[ 6 ]
ラッカーゼ-ABTS系は(+)-カテキンをオリゴマー生成物に酸化する[ 7 ]が、そのうちプロアントシアニジンA2は二量体である。
スペクトルデータ

| 紫外線可視 | |
|---|---|
| ラムダマックス: | 276 nm |
| 吸光係数(log ε ) | 4.01 |
| IR | |
| 主な吸収帯 | 1600 cm −1(ベンゼン環) |
| 核磁気共鳴 | |
| プロトンNMR (500 MHz、CD3OD): 参考文献[ 8 ] d:二重線、dd:二重線の中の二重線、 m:多重線、s:一重線 | δ : 2.49 (1H, dd, J = 16.0, 8.6 Hz, H-4a), 2.82 (1H, dd, J = 16.0, 1.6 Hz, H-4b), 3.97 (1H, m, H-3), 4.56 (1H, d, J = 7.8 Hz, H-2), 5.86 (1H, d, J = 2.1 Hz, H-6), 5.92 (1H, d, J = 2.1 Hz, H-8), 6.70 (1H, dd, J = 8.1, 1.8 Hz, H-6′), 6.75 (1H, d, J = 8.1 Hz, H-5′), 6.83 (1H, d, J = 1.8 Hz, H-2′) |
| 炭素13NMR | |
| その他のNMRデータ | |
| MS | |
| 主破片 の塊 | ESI-MS [M+H] + m / z : 291.0 273 水分損失 139 逆ディールス・アルダー 123 165 147 |
自然現象
(+)-カテキンと(-)-エピカテキン、そしてそれらの没食子酸抱合体は、維管束植物に広く含まれる成分であり、ウンカリア・リンコフィラなどの伝統的なハーブ療法の成分として頻繁に使用されています。この2つの異性体は、主にカカオや茶葉、そしてブドウ(Vitis vinifera)に含まれています 。[ 9 ] [ 10 ] [ 11 ]
食品中
ヨーロッパとアメリカ合衆国におけるカテキンの主な食物源は、お茶と 梨状果である。[ 12 ] [ 13 ]
カテキンとエピカテキンはココアに含まれており、[ 14 ]あるデータベースによると、分析された食品の中で最も高いカテキン含有量(108 mg/100 g)を持ち、次いでプルーンジュース(25 mg/100 ml)、ソラマメの鞘(16 mg/100 g)となっています。[ 15 ]アサイーオイルはアサイーヤシ(Euterpe oleracea)の果実から得られ、(+)-カテキン(67 mg/kg)を含んでいます。[ 16 ]
カテキンは多様な食品に含まれており、[ 15 ]桃[ 17 ]から緑茶や酢まで含まれています。[ 15 ] [ 18 ]カテキンは大麦に含まれており、生地の変色を引き起こす主なフェノール化合物です。[ 19 ]モノマー性の(+)-カテキンまたは(-)-エピカテキンに関連する味は、わずかに渋いと表現されますが、苦くはありません。[ 20 ]
代謝
生合成
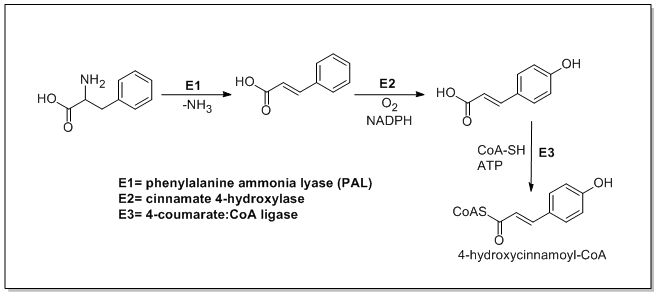
カテキンの生合成は、4-ヒドロキシシンナモイルCoAスターターユニットから始まり、PKSIII経路を介して3つのマロニルCoAが付加されることによって鎖伸長が起こります。4-ヒドロキシシンナモイルCoAは、シキミ酸経路を介してL-フェニルアラニンから生合成されます。L-フェニルアラニンはまずフェニルアラニンアンモニアリアーゼ(PAL)によって脱アミノ化され、ケイ皮酸が形成されます。ケイ皮酸は次にケイ皮酸4-ヒドロキシラーゼによって4-ヒドロキシシン皮酸に酸化されます。次にカルコン合成酵素が4-ヒドロキシシンナモイルCoAと3分子のマロニルCoAの縮合を触媒し、カルコンを形成します。カルコンはカルコンイソメラーゼによってナリンゲニンへと異性化され、ナリンゲニンはフラボノイド3'-ヒドロキシラーゼによってエリオジクチオールへと酸化され、さらにフラバノン3-ヒドロキシラーゼによってタキシフォリンへと酸化される。タキシフォリンはジヒドロフラバノール4-還元酵素とロイコアントシアニジン還元酵素によって還元され、カテキンとなる。カテキンの生合成経路は以下に示す通りである[ 21 ] [ 22 ] [ 23 ]。
ロイコシアニジン還元酵素(LCR)は、2,3-トランス-3,4-シス-ロイコシアニジンを用いて(+)-カテキンを生成する酵素であり、プロアントシアニジン(PA)特異的経路における最初の酵素である。その活性は、マメ科植物であるMedicago sativa(ウマゴヤシ) 、Lotus japonicus(ミヤコグサ) 、Lotus uliginosus (ハコベ) 、Hedysarum sulfurescens (ヘディサルム・サルフェレッセンス) 、Robinia pseudoacacia(ニセアカシア)の葉、花、種子で測定されている[ 24 ]。この酵素はVitis vinifera(ブドウ)にも存在する[ 25 ] 。
生分解
カテキンオキシゲナーゼはカテキンの分解に重要な酵素であり、真菌や細菌に存在します。[ 26 ]
細菌においては、(+)-カテキンの分解はアシネトバクター・カルコアセチカスによって行われる。カテキンはプロトカテク酸(PCA)とフロログルシノールカルボン酸(PGCA)に代謝される。[ 27 ]また、ブラディリゾビウム・ジャポニカムによっても分解される。フロログルシノールカルボン酸はさらに脱炭酸されてフロログルシノールとなり、これが脱水酸化されてレゾルシノールとなる。レゾルシノールは水酸化されてヒドロキシキノールとなる。プロトカテク酸とヒドロキシキノールは、プロトカテク酸3,4-ジオキシゲナーゼとヒドロキシキノール1,2-ジオキシゲナーゼによってジオール内分解され、 β-カルボキシ-シス、シス-ムコン酸 、マレイルアセテートが形成される。[ 28 ]
真菌の中では、カテキンの分解はChaetomium cupreumによって達成される。[ 29 ]
ヒトの代謝

-epicatechin_metabolism_in_humans_as_a_function_of_time_post-oral_intake.jpg/440px-Schematic_representation_of_(−)-epicatechin_metabolism_in_humans_as_a_function_of_time_post-oral_intake.jpg)
Catechins are metabolised upon uptake from the gastrointestinal tract, in particular the jejunum,[31] and in the liver, resulting in so-called structurally related epicatechin metabolites (SREM).[32] The main metabolic pathways for SREMs are glucuronidation, sulfation and methylation of the catechol group by catechol-O-methyl transferase, with only small amounts detected in plasma.[33][30] The majority of dietary catechins are however metabolised by the colonic microbiome to gamma-valerolactones and hippuric acids which undergo further biotransformation, glucuronidation, sulfation and methylation in the liver.[33]
The stereochemical configuration of catechins has a strong impact on their uptake and metabolism as uptake is highest for (−)-epicatechin and lowest for (−)-catechin.[34]
Biotransformation
Biotransformation of (+)-catechin into taxifolin by a two-step oxidation can be achieved by Burkholderia sp.[35]
(+)-Catechin and (−)-epicatechin are transformed by the endophytic filamentous fungus Diaporthe sp. into the 3,4-cis-dihydroxyflavan derivatives, (+)-(2R,3S,4S)-3,4,5,7,3′,4′-hexahydroxyflavan (leucocyanidin) and (−)-(2R,3R,4R)-3,4,5,7,3′,4′-hexahydroxyflavan, respectively, whereas (−)-catechin and (+)-epicatechin with a (2S)-phenyl group resisted the biooxidation.[36]
Leucoanthocyanidin reductase (LAR) uses (2R,3S)-catechin, NADP+ and H2O to produce 2,3-trans-3,4-cis-leucocyanidin, NADPH, and H+. Its gene expression has been studied in developing grape berries and grapevine leaves.[37]
Glycosides
- (2R、3S) −カテキン−7− O −β− D−グルコピラノシドは、大麦(Hordeum vulgare L.)および麦芽から単離することができる。[ 38 ]
- エピゲオシド(カテキン-3- O -α- L -ラムノピラノシル-(1-4)-β- D -グルコピラノシル-(1-6)-β- D -グルコピラノシド)は、エピギヌム・アウリツムの根茎から単離することができる。[ 39 ]
研究
-epicatechin_metabolism.pdf/page1-440px-Inter-species_differences_in_(-)-epicatechin_metabolism.pdf.jpg)
血管機能
食事研究からの限られた証拠は、カテキンが内皮依存性血管拡張に影響を及ぼし、ヒトの正常な血流調節に寄与する可能性があることを示唆している。 [ 40 ] [ 41 ]緑茶カテキンは、特に収縮期血圧が130mmHgを超える場合に血圧を改善する可能性がある。[ 42 ] [ 43 ]
消化中の広範な代謝のため、血管に対するこの効果の原因となるカテキン代謝物の運命と活性、および実際の作用機序は不明である。[ 33 ] [ 44 ]
有害事象
カテキンとその代謝物は赤血球に強く結合して自己抗体の産生を誘発し、溶血性貧血や腎不全を引き起こす可能性がある。[ 45 ]このため、ウイルス性肝炎の治療に使用されていたカテキン含有薬剤カテルゲンは 1985年に市場から撤退した。[ 46 ] [ 47 ]
緑茶に含まれるカテキンは肝毒性がある可能性があり[ 48 ]、欧州食品安全機関は1日あたり800mgを超えないように推奨しています。[ 49 ]
他の
ある限定的なメタアナリシスでは、緑茶とそのカテキンの摂取量を1日7杯に増やすと、前立腺がんのリスクがわずかに減少することが示されました。[ 50 ]ナノ粒子法は、カテキンの潜在的な送達システムとして予備研究が行われています。[ 51 ]
植物の効果
一部の植物が地中に放出するカテキンは、アレロパシーの一種として、近隣の植物の成長を妨げることがある。[ 52 ]この行動がしばしば研究されるヤグルマギク(Centaurea maculosa)は、根を通して地中にカテキン異性体を放出し、抗生物質や除草剤としての効果がある可能性がある。一つの仮説は、標的植物の根を通して活性酸素種の波を引き起こし、アポトーシスによって根の細胞を死滅させるというものである。[ 53 ]ヨーロッパの生態系のほとんどの植物はカテキンに対する防御機能を持っているが、北米の生態系ではCentaurea maculosaが侵略的で制御不能な雑草であるため、カテキンに対して防御されている植物はほとんどない。[ 52 ]
カテキンはイチゴの葉において感染阻害因子として作用する。[ 54 ]エピカテキンとカテキンはColletotrichum kahawaeの付着器のメラニン形成を阻害することでコーヒーノキ病を予防する可能性がある。[ 55 ]
参考文献
- ^ 「カチューシャとカテキューの植物起源」国連食糧農業機関(FAO)2011年11月5日。2019年2月10日時点のオリジナルよりアーカイブ。 2016年7月26日閲覧。
- ^リナルド D、バティスタ JM、ロドリゲス J、ベンファッティ AC、ロドリゲス CM、ドス サントス LC、他。 (2010 年 8 月)。 「キラル HPLC-PAD-CD を使用したByrsonima種の葉からのカテキン ジアステレオマーの測定」。キラリティー。22 (8): 726–733 .土井: 10.1002/chir.20824。PMID 20143413。
- ^ Kríz Z, Koca J, Imberty A, Charlot A, Auzély-Velty R (2003年7月). 「NMR、マイクロカロリメトリー、分子モデリング技術の組み合わせによる(+)-カテキンとβ-シクロデキストリンの錯体形成の調査」.有機・生体分子化学. 1 (14): 2590– 2595. doi : 10.1039/B302935M . PMID 12956082 .
- ^ Pietta PG (2000年7月). 「抗酸化物質としてのフラボノイド」. Journal of Natural Products . 63 (7): 1035– 1042. Bibcode : 2000JNAtP..63.1035P . doi : 10.1021/np9904509 . PMID 10924197. S2CID 23310671 .
- ^ Tournaire C, Croux S, Maurette MT, Beck I, Hocquaux M, Braun AM, Oliveros E (1993年8月). 「フラボノイドの抗酸化活性:一重項酸素(1Δg )消光の効率」. Journal of Photochemistry and Photobiology B: Biology . 19 (3): 205– 215. doi : 10.1016/1011-1344(93)87086-3 . PMID 8229463 .
- ^ Janeiro P, Oliveira Brett AM (2004). 「カテキンの電気化学的酸化メカニズム」. Analytica Chimica Acta . 518 ( 1–2 ): 109– 115. Bibcode : 2004AcAC..518..109J . doi : 10.1016/j.aca.2004.05.038 . hdl : 10316/5128 .
- ^ Osman AM, Wong KK, Fernyhough A (2007年4月). 「ラッカーゼ/ABTS系は(+)-カテキンをオリゴマー生成物に酸化する」.酵素と微生物技術. 40 (5): 1272– 1279. doi : 10.1016/j.enzmictec.2006.09.018 .
- ^ Lin YP, Chen TY, Tseng HW, Lee MH, Chen ST (2009年6月). 「Phoenix hanceana var. formosanaから単離された神経細胞保護化合物」. Phytochemistry . 70 (9): 1173– 1181. Bibcode : 2009PChem..70.1173L . doi : 10.1016 / j.phytochem.2009.06.006 . PMID 19628235. S2CID 28636157 .
- ^アイズプルア・オライゾラ O、オルマサバル M、バジェホ A、オリバレス M、ナバロ P、エチェバリア N、ウソビアガ A (2015 年 1 月)。 「ヴィティス・ヴィニフェラブドウ廃棄物からの脂肪酸とポリフェノールの超臨界流体連続抽出の最適化」。食品科学ジャーナル。80 (1): E101 – E107。土井: 10.1111/1750-3841.12715。PMID 25471637。
- ^ Freudenberg K, Cox RF, Braun E (1932). 「カカオ豆のカテキン」.アメリカ化学会誌. 54 (5): 1913– 1917. Bibcode : 1932JAChS..54.1913F . doi : 10.1021/ja01344a026 .
- ^ “辻村みちよ (1888–1969)” . 2015年11月21日時点のオリジナルよりアーカイブ。2015年11月10日閲覧。
- ^ Chun OK, Chung SJ, Song WO (2007年5月). 「米国成人の推定食事性フラボノイド摂取量と主要食品源」 . The Journal of Nutrition . 137 (5): 1244– 1252. doi : 10.1093/jn/137.5.1244 . PMID 17449588 .
- ^ Vogiatzoglou A, Mulligan AA, Lentjes MA, Luben RN, Spencer JP, Schroeter H, et al. (2015). 「ヨーロッパの成人(18~64歳)におけるフラボノイド摂取量」 . PLOS ONE . 10 (5) e0128132. Bibcode : 2015PLoSO..1028132V . doi : 10.1371/journal.pone.0128132 . PMC 4444122. PMID 26010916 .
- ^ Kwik-Uribe C, Bektash RM (2008). 「ココアフラバノール – 測定、バイオアベイラビリティ、および生体活性」(PDF) . Asia Pacific Journal of Clinical Nutrition . 17 (Suppl. 1): 280– 283. PMID 18296356 .
- ^ a b c「緑茶抽出液中のポリフェノール」フェノール・エクスプローラー、v3.5、2014年。 2014年11月1日閲覧。
- ^ Pacheco-Palencia LA, Mertens-Talcott S, Talcott ST (2008年6月). 「アサイー(Euterpe oleracea Mart.)由来の植物化学物質強化オイルの化学組成、抗酸化特性、および熱安定性」. Journal of Agricultural and Food Chemistry . 56 (12): 4631– 4636. Bibcode : 2008JAFC...56.4631P . doi : 10.1021/jf800161u . PMID 18522407 .
- ^ Cheng GW, Crisosto CH (1995). 「モモおよびネクタリンの皮組織の緩衝液抽出物の褐変電位、フェノール組成、およびポリフェノールオキシダーゼ活性」アメリカ園芸学会誌. 120 (5): 835– 838. doi : 10.21273/JASHS.120.5.835 .
- ^ガルベス MC、バローゾ CG、ペレス=ブスタマンテ JA (1994)。 「さまざまな酢サンプルのポリフェノール化合物の分析」。レーベンスミッテル・ウンターシュング・アンド・フォルシュングのためのツァイツシュリフト。199 (1): 29–31 .土井: 10.1007/BF01192948。S2CID 91784893。
- ^ Quinde-Axtell Z, Baik BK (2006年12月). 「大麦穀物のフェノール化合物と食品の変色への影響」. Journal of Agricultural and Food Chemistry . 54 (26): 9978– 9984. Bibcode : 2006JAFC...54.9978Q . doi : 10.1021/jf060974w . PMID 17177530 .
- ^ Kielhorn, S.; Thorngate, JH III (1999). 「フラバン-3-オール類(+)-カテキンおよび(-)-エピカテキンに関連する口腔感覚」. Food Quality and Preference . 10 (2): 109– 116. doi : 10.1016/S0950-3293(98)00049-4 .
- ^ Rani A, Singh K, Ahuja PS, Kumar S (2012年3月). 「茶葉中のカテキン生合成の分子制御 [ Camellia sinensis (L.) O. Kuntze]」. Gene . 495 (2): 205– 210. doi : 10.1016/j.gene.2011.12.029 . PMID 22226811 .
- ^ Punyasiri PA, Abeysinghe IS, Kumar V, Treutter D, Duy D, Gosch C, 他 (2004年11月). 「茶樹Camellia sinensisにおけるフラボノイド生合成:主要なエピカテキンおよびカテキン経路の酵素特性」Archives of Biochemistry and Biophysics . 431 (1): 22– 30. doi : 10.1016/j.abb.2004.08.003 . PMID 15464723 .
- ^ Dewick PM (2009).薬用天然物:生合成アプローチ(第3版). 英国:John Wiley & Sons. ISBN 978-0-470-74167-2。
- ^ Skadhauge B, Gruber MY, Thomsen KK, Von Wettstein D (1997年4月). 「発育中のマメ科植物組織におけるロイコシアニジン還元酵素活性とプロアントシアニジンの蓄積」. American Journal of Botany . 84 (4): 494– 503. doi : 10.2307/2446026 . JSTOR 2446026 .
- ^ Maugé C, Granier T, d'Estaintot BL, Gargouri M, Manigand C, Schmitter JM, et al. (2010年4月). 「ブドウ(Vitis vinifera )由来ロイコアントシアニジン還元酵素の結晶構造と触媒機構」. Journal of Molecular Biology . 397 (4): 1079– 1091. doi : 10.1016/j.jmb.2010.02.002 . PMID 20138891 .
- ^ Arunachalam, M.; Mohan Raj, M.; Mohan, N.; Mahadevan, A. (2003). 「カテキンの生分解」(PDF) . Proceedings of the Indian National Science Academy . B69 (4): 353– 370. 2012年3月16日時点のオリジナル(PDF)からのアーカイブ。
- ^アルナーチャラム M、モハン N、シュガデフ R、チェラパン P、マハデヴァン A (2003 年 6 月)。 「 Acinetobacter calcoaceticus MTC 127による (+)-カテキンの分解」。 Biochimica et Biophysica Acta (BBA) - 一般科目。1621 (3): 261–265。土井: 10.1016/S0304-4165(03)00077-1。PMID 12787923。
- ^ Hopper W, Mahadevan A (1997). 「 Bradyrhizobium japonicumによるカテキンの分解」.生分解. 8 (3): 159– 165. doi : 10.1023/A:1008254812074 . S2CID 41221044 .
- ^ Sambandam T, Mahadevan A (1993年1月). 「カテキンの分解とChaetomium cupreum由来カテキンオキシゲナーゼの精製および部分的特性解析」. World Journal of Microbiology & Biotechnology . 9 (1): 37– 44. doi : 10.1007 / BF00656513 . PMID 24419836. S2CID 1257624 .
- ^ a b c d Ottaviani JI, Borges G, Momma TY, Spencer JP, Keen CL, Crozier A, Schroeter H (2016年7月). 「ヒトにおける[2- 14 C](−)-エピカテキンのメタボローム:ポリフェノール性生理活性物質の有効性、安全性、および作用機序の評価への示唆」 . Scientific Reports . 6 29034. Bibcode : 2016NatSR...629034O . doi : 10.1038/srep29034 . PMC 4929566. PMID 27363516 .
- ^ Actis-Goretta L, Lévèques A, Rein M, Teml A, Schäfer C, Hofmann U, et al. (2013年10月). 「腸管灌流法を用いた健常者における(−)-エピカテキンの腸管吸収、代謝、排泄の評価」 . The American Journal of Clinical Nutrition . 98 (4): 924– 933. doi : 10.3945/ajcn.113.065789 . PMID 23864538 .
- ^ Ottaviani JI, Momma TY, Kuhnle GK, Keen CL, Schroeter H (2012年4月). 「ヒトにおける構造的に関連する(−)-エピカテキン代謝物:新規化学合成標準物質を用いた評価」 . Free Radical Biology & Medicine . 52 (8): 1403– 1412. doi : 10.1016/j.freeradbiomed.2011.12.010 . PMID 22240152 .
- ^ a b c「フラボノイド」ライナス・ポーリング研究所、オレゴン州立大学、コーバリス。2016年。 2016年7月24日閲覧。
- ^ Ottaviani JI, Momma TY, Heiss C, Kwik-Uribe C, Schroeter H, Keen CL (2011年1月). 「フラバノールの立体化学構造は、ヒトにおけるフラバノールの濃度と代謝、そして生体内での生物学的活性に影響を与える」. Free Radical Biology & Medicine . 50 (2): 237– 244. doi : 10.1016/j.freeradbiomed.2010.11.005 . PMID 21074608 .
- ^松田 M、大塚 Y、ジン S、和崎 J、渡辺 J、渡辺 T、大崎 M (2008 年 2 月)。 「2段階の酸化による(+)-カテキンのタキシフォリンへの生体内変換: 熱帯泥炭から単離された新規の(+)-カテキン分解細菌、バークホルデリア種KTC-1による(+)-カテキン代謝の一次段階」。生化学および生物物理学研究コミュニケーション。366 (2): 414–419。Bibcode : 2008BBRC..366..414M。土井:10.1016/j.bbrc.2007.11.157。PMID 18068670。
- ^渋谷 浩、アグスタ 明、大橋 功、前原 聡、シマンジュンタク P (2005年7月). 「茶樹から単離された内生菌Diaporthe sp.による(+)-カテキンおよび(-)-エピカテキンの3,4-ジヒドロキシフラバン誘導体への生酸化」 . Chemical & Pharmaceutical Bulletin . 53 (7): 866– 867. doi : 10.1248/cpb.53.866 . PMID 15997157 .
- ^ Bogs J, Downey MO, Harvey JS, Ashton AR, Tanner GJ, Robinson SP (2005年10月). 「発育中のブドウの果実および葉におけるプロアントシアニジンの合成とロイコアントシアニジン還元酵素およびアントシアニジン還元酵素をコードする遺伝子の発現」 . Plant Physiology . 139 (2): 652– 663. doi : 10.1104/pp.105.064238 . JSTOR 4281902. PMC 1255985. PMID 16169968 .
- ^ Friedrich W, Galensa R (2002). 「大麦( Hordeum vulgare L.)および麦芽由来の新規フラバノール配糖体の同定」.欧州食品研究技術誌. 214 (5): 388– 393. doi : 10.1007/s00217-002-0498-x . S2CID 84221785 .
- ^ジン QD、ムー QZ (1991). 「[ Epigynum auritumのグリコシド構成成分に関する研究]」。Yao Xue Xue Bao (Acta Pharmaceutica Sinica) (中国語)。26 ( 11) : 841–845。PMID 1823978 。
- ^ Hooper L, Kay C, Abdelhamid A, Kroon PA, Cohn JS, Rimm EB, Cassidy A (2012年3月). 「チョコレート、ココア、フラバン-3-オールの心血管系の健康への影響:ランダム化試験の系統的レビューとメタアナリシス」 . The American Journal of Clinical Nutrition . 95 (3): 740– 751. doi : 10.3945/ajcn.111.023457 . PMID 22301923 .
- ^ Ellinger S, Reusch A, Stehle P, Helfrich HP (2012年6月). 「ココア製品を介して摂取されたエピカテキンはヒトの血圧を低下させる:ベイズ的アプローチを用いた非線形回帰モデル」 .アメリカ臨床栄養学ジャーナル. 95 (6): 1365– 1377. doi : 10.3945/ajcn.111.029330 . PMID 22552030 .
- ^ Khalesi S, Sun J, Buys N, Jamshidi A, Nikbakht-Nasrabadi E, Khosravi-Boroujeni H (2014年9月). 「緑茶カテキンと血圧:ランダム化比較試験の系統的レビューとメタアナリシス」. European Journal of Nutrition . 53 (6): 1299– 1311. doi : 10.1007/ s00394-014-0720-1 . PMID 24861099. S2CID 206969226 .
- ^ Aprotosoaie AC, Miron A, Trifan A, Luca VS, Costache II (2016年12月). 「カカオポリフェノールの心血管系への影響—概要」 . Diseases . 4 ( 4): 39. doi : 10.3390/diseases4040039 . PMC 5456324. PMID 28933419 .
- ^ Schroeter H, Heiss C, Balzer J, Kleinbongard P, Keen CL, Hollenberg NK, 他 (2006年1月). 「(−)-エピカテキンは、フラバノールを豊富に含むココアのヒト血管機能に対する有益な効果を媒介する」 . Proceedings of the National Academy of Sciences of the United States of America . 103 (4): 1024– 1029. Bibcode : 2006PNAS..103.1024S . doi : 10.1073/pnas.0510168103 . PMC 1327732. PMID 16418281 .
- ^ Martinez SE, Davies NM, Reynolds JK (2013). 「フラボノイドの毒性と安全性」.分析法、前臨床および臨床薬物動態、安全性、毒性. John Wiley & Son. p. 257. ISBN 978-0-470-57871-1。
- ^ボード JC (1987)。 Okolicsányi L、Csomós G、Crepaldi G (編)。肝胆道疾患の評価と管理。ベルリン: Springer-Verlag。 p. 371.土井:10.1007/978-3-642-72631-6。ISBN 978-3-642-72631-6. S2CID 3167832 .
- ^ “Ruhen der Zulassung für Catergen” [Catergen の承認停止] (PDF) . Deutsches Ärzteblatt (ドイツ語)。82 (38): 2706.
- ^カナダ保健省 (2017年11月15日). 「緑茶エキス含有天然健康製品に関する安全性レビュー概要 – 肝障害(肝毒性)の潜在的リスクの評価」 www.canada.ca . 2022年5月6日閲覧。
- ^ Younes M, Aggett P, Aguilar F, Crebelli R, Dusemund B, Filipič M, et al. (2018年4月). 「緑茶カテキンの安全性に関する科学的意見」 . EFSAジャーナル. 16 (4): e05239. doi : 10.2903/j.efsa.2018.5239 . PMC 7009618. PMID 32625874 .
- ^ Guo Y, Zhi F, Chen P, Zhao K, Xiang H, Mao Q, 他 (2017年3月). 「緑茶と前立腺がんのリスク:系統的レビューとメタアナリシス」 . Medicine . 96 ( 13) e6426. doi : 10.1097/MD.0000000000006426 . PMC 5380255. PMID 28353571 .
- ^ Ye JH, Augustin MA (2018). 「カテキン送達のためのナノ粒子およびマイクロ粒子:物理的および生物学的性能」. Critical Reviews in Food Science and Nutrition . 59 (10): 1563– 1579. doi : 10.1080 / 10408398.2017.1422110 . PMID 29345975. S2CID 29522787 .
- ^ a b Broz AK, Vivanco JM, Schultz MJ, Perry LG, Paschke MW (2006). 「植物の侵入における二次代謝物とアレロパシー:Centaurea maculosaの事例研究」 . Taiz L, Zeiger E, Møller IM, Murphy A (編). Plant Physiology and Development (第6版). Sinauer Associates.
- ^ Bais HP, Vepachedu R, Gilroy S, Callaway RM, Vivanco JM (2003年9月). 「アレロパシーと外来植物の侵入:分子・遺伝子から種間相互作用まで」. Science . 301 ( 5638): 1377– 1380. Bibcode : 2003Sci...301.1377B . doi : 10.1126/science.1083245 . PMID 12958360. S2CID 26483595 .
- ^山本 正之、中塚 聡、大谷 浩、河本 健、西村 聡 (2000年6月). 「(+)-カテキンはイチゴの葉において感染抑制因子として作用する」.植物病理学. 90 (6): 595– 600. Bibcode : 2000PhPat..90..595Y . doi : 10.1094/PHYTO.2000.90.6.595 . PMID 18944538 .
- ^ Chen Z, Liang J, Zhang C, Rodrigues CJ (2006年10月). 「エピカテキンとカテキンはColletotrichum kahawaeの付着器メラニン形成を阻害することでコーヒーノキ病を予防する可能性がある」. Biotechnology Letters . 28 (20): 1637– 1640. doi : 10.1007/s10529-006-9135-2 . PMID 16955359. S2CID 30593181 .
外部リンク
 ウィキメディア・コモンズの(+)-カテキン関連メディア
ウィキメディア・コモンズの(+)-カテキン関連メディア