心臓胸部外科
 心臓胸部外科医が手術を行う。 | |
| 職業 | |
|---|---|
| 名前 |
|
職業の種類 | 専門 |
活動分野 | 医学、外科 |
| 説明 | |
必要な教育 |
|
雇用分野 | 病院、診療所 |
心臓胸部(CT)手術は、胸腔内の臓器の外科的治療に関わる医学の分野であり、一般的には心臓(心臓病)、肺(肺疾患)、およびその他の胸膜または縦隔構造の病状の治療を行います。
ほとんどの国では、心臓胸部外科は、心臓外科(心臓と大血管を含む)と胸部外科(肺、食道、胸腺などを含む)にさらに細分化されています。例外は、米国、オーストラリア、ニュージーランド、英国、インド、およびポルトガルなどの一部の欧州連合諸国です。[ 1 ]
トレーニング
心臓外科の研修は、通常、資格を有する外科医になるために4年から6年(またはそれ以上)の研修から構成されます。[ 2 ]心臓外科の研修は、胸部外科や血管外科と組み合わされる場合があり、心血管(CV)/心臓胸部(CT)/心血管胸部(CVT)外科と呼ばれます。心臓外科医は、医学部を卒業してすぐに心臓外科の研修を受けることも、まず一般外科の研修を修了してからフェローシップを受けることもできます。心臓外科医は、小児心臓外科、心臓移植、成人性心疾患、虚弱心の問題、その他心臓に関する多くの問題など、 さまざまなトピックのフェローシップを行うことで、心臓外科をさらに専門分野とすることができます。
オーストラリアとニュージーランド
心臓胸部外科の外科教育研修(SET)プログラムは競争率が高く、通常は医学部修了後数年を経て6年間です。研修は二国間(オーストラリアとニュージーランド)の研修プログラムによって運営・監督されます。研修期間中は複数の試験が行われ、研修最終年に最終フェローシップ試験が行われます。研修修了後、外科医にはオーストラリア王立外科医師会(FRACS)のフェローシップが授与され、専門医資格が認められます。一般外科の研修プログラムを修了し、FRACSを取得した研修生は、大学の承認があれば、心臓胸部外科のフェローシップ研修を4年間受ける選択肢があります。心臓胸部外科医の資格を得るには、大学院(医学部卒業後)で最低でも8~10年の研修が必要です。現在、研修場所や公立(教育)病院の枠をめぐる競争は非常に激しく、オーストラリアの労働力計画に関する懸念が生じています。
カナダ
歴史的に、カナダの心臓外科医は一般外科を修了した後、CV/CT/CVTのフェローシップを取得していました。1990年代に、カナダの心臓外科研修プログラムは、医学部卒業後の6年間の「ダイレクトエントリー」プログラムに変更されました。このダイレクトエントリー形式により、レジデントは一般外科プログラムでは得られない心臓外科関連の経験を積むことができます(例:心エコー検査、冠動脈疾患管理ユニット、心臓カテーテル検査など)。このプログラムのレジデントは、胸部外科および血管外科の研修にも時間を費やします。通常、その後、成人心臓外科、心不全/移植、低侵襲心臓外科、大動脈外科、胸部外科、小児心臓外科、または心臓ICUのいずれかのフェローシップを取得します。現在、一般外科を修了し、心臓外科への進学を希望するカナダの候補者は、米国で心臓胸部外科のフェローシップを取得することがよくあります。カナダ王立内科医外科大学では、資格を有する一般外科医を対象に、アルバータ大学、ブリティッシュコロンビア大学、トロント大学などの複数の研修施設で提供される 3 年間の心臓外科フェローシップも提供しています。
胸部外科は、カナダでは一般外科または心臓外科の独立した 2 ~ 3 年間のフェローシップです。
カナダの心臓手術プログラム:
- アルバータ大学– 1位
- ブリティッシュコロンビア大学– 1位
- カルガリー大学– 1位
- ダルハウジー大学– 隔年で1名
- ラヴァル大学– 3年ごとに1ポジション
- マニトバ大学– 1位
- マギル大学– 3年に1人
- マクマスター大学– 隔年で1名
- モントリオール大学– 3年ごとに1位
- オタワ大学– 1位
- トロント大学– 1位
- ウェスタン大学– 1位
アメリカ合衆国

米国における心臓外科の研修は、一般胸部外科と統合され、心臓胸部外科または胸部外科と呼ばれます。米国の心臓胸部外科医とは、まず一般外科のレジデンシー(通常5~7年)を修了し、その後、心臓胸部外科のフェローシップ(通常2~3年)を修了した医師を指します。心臓胸部外科のフェローシップは通常2~3年ですが、認定は、研修期間ではなく、執刀医として執刀した手術件数と、厳格な専門医試験の合格に基づいて行われます。研修期間を短縮するための他の 2 つの経路が開発されました。(1) 同じ施設での 4 年間の一般外科研修と 3 年間の心臓胸部外科研修からなる複合一般胸部外科レジデンシー、および (2) 6 年間の統合心臓胸部レジデンシー (一般外科レジデンシーと心臓胸部レジデンシーの代わり) で、それぞれ多くのプログラム (20 以上) で確立されています。[ 3 ] 応募者は医学部を卒業してすぐに統合 6 年間 (I-6) プログラムにマッチングしますが、これらのポジションの応募プロセスは非常に競争が激しく、2010 年には米国で 10 の定員に対して約 160 人の応募がありました。2013 年 5 月現在、承認されているプログラムが 20 あり、以下が含まれます。
米国の統合6年間心臓胸部外科プログラム:
- ウィスコンシン医科大学
- スタンフォード大学– 2つのポジション
- ノースカロライナ大学チャペルヒル校
- バージニア大学
- コロンビア大学– 2つのポジション
- ペンシルベニア大学
- ピッツバーグ大学– 2つのポジション
- ワシントン大学
- ノースウェスタン大学
- マウントサイナイ病院(ニューヨーク)
- メリーランド大学
- カリフォルニア大学ロサンゼルス校UCLA – レジデントポジション2名、移植フェローシップ1名、先天性レジデントポジション1名
- テキサス大学サンアントニオ校健康科学センター
- サウスカロライナ医科大学
- 南カリフォルニア大学– 2つのポジション
- ロチェスター大学
- カリフォルニア大学デービス校
- インディアナ大学
- ケンタッキー大学
- エモリー大学
- ミシガン大学
- イェール大学
アメリカ胸部外科委員会(ABS)は、先天性心臓外科の特別なパスウェイ認定証を提供しています。この認定証の取得には通常、1年間の追加のフェローシップ期間が必要です。他の国では、先天性心臓外科医は小児科研修について正式な認定機関による評価と認定を受けていないため、この正式な認定証は他に類を見ないものです。
心臓手術
| 心臓胸部外科 | |
|---|---|
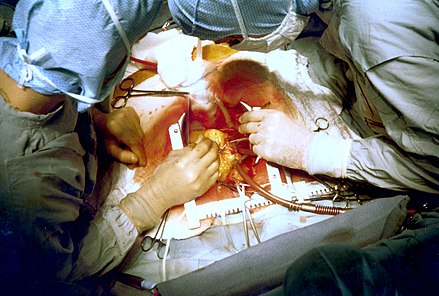 2人の心臓外科医が冠動脈バイパス手術と呼ばれる心臓手術を行っています。患者の心臓を強制的に露出させるために、鋼鉄製の牽引器具が使用されていることに注目してください。 | |
| ICD-9-CM | 35~37歳 |
| メッシュ | D006348 |
| OPS-301 コード | 5-35...5-37 |
心膜(心臓を包んでいる袋)に対する最も古い手術は19世紀に行われ、フランシスコ・ロメロ(1801)[ 4 ]、ドミニク・ジャン・ラレー、ヘンリー・ダルトン、ダニエル・ヘイル・ウィリアムズによって行われた。[ 5 ]心臓自体に対する最初の手術は、1895年9月4日にノルウェーの外科医アクセル・カッペレンによって、クリスチャニア(現在のオスロ)のリクスホスピタレットで行われた。彼は、左腋窩を刺されて到着時に重度のショック状態にあった24歳の男性の出血している冠動脈を結紮した。アクセスは左開胸によって行われた。患者は目を覚まし、24時間は元気そうに見えたが、体温が上昇して体調が悪くなり、最終的には術後3日目に、剖検で縦隔炎と判明した原因で死亡した。 [ 6 ] [ 7 ]合併症なく行われた最初の心臓手術は、ドイツのフランクフルトのルートヴィヒ・レーンによるもので、 1896年9月7日に右心室の刺し傷を修復した。 [ 8 ] [ 9 ]
大血管手術(大動脈縮窄症の修復、ブラロック・タウシッグシャント作成、動脈管開存症の閉鎖)は20世紀以降に普及し、心臓外科の領域に属するものの、技術的には心臓外科とはみなされません。心臓外科手術の中でも最もよく知られているのが、冠動脈バイパス移植(CABG)、別名「バイパス手術」です。
心臓奇形への早期アプローチ
1925年当時、心臓弁の手術は知られていませんでした。ヘンリー・サターは、僧帽弁狭窄症の若い女性の手術に成功しました。彼は左心房の付属器に開口部を作り、そこに指を挿入して損傷した僧帽弁を触診し、検査しました。患者は数年間生存しましたが[ 10 ]、サターの当時の医師仲間は、この手術は正当化されないと判断し、手術を継続できませんでした[ 11 ] 。 [ 12 ]
心臓外科は第二次世界大戦後大きく変化した。1948年、4人の外科医がリウマチ熱による僧帽弁狭窄症の手術を成功させた。ホレス・スミシー(1914-1948)はピーター・ベント・ブリガム病院のドワイト・ハーケン医師がパンチを使って僧帽弁の一部を切除した手術を復活させた。フィラデルフィアのハーネマン病院のチャールズ・ベイリー(1910-1993)、ボストンのドワイト・ハーケン、ガイズ病院のラッセル・ブロックは皆サターの手術法を採用した。これらの人々は数ヶ月以内にそれぞれ独立して手術を開始した。この時はサターの技術が改良はされたものの広く採用された。[ 11 ] [ 12 ]
1947年、ミドルセックス病院のトーマス・ホームズ・セラーズ(1902-1987)は、肺動脈狭窄を伴うファロー四徴症患者を手術し、狭窄した肺動脈弁の分離に成功しました。1948年、ラッセル・ブロックは、おそらくセラーの研究を知らなかったと思われますが、特別に設計された拡張器を3例の肺動脈狭窄症に使用しました。1948年後半には、ファロー四徴症にしばしば伴う漏斗部筋狭窄を切除するための穿孔器を設計しました。心臓バイパスの導入により弁への直接手術が可能になるまで、このような「盲目的」手術は数千回実施されました。[ 11 ]
開胸手術
開胸手術は、患者の心臓を開き、心臓の内部構造を手術する処置です。トロント大学のウィルフレッド・G・ビゲローは、心臓内病変の修復は、血液と心臓の動きを止め、心臓を停止させて血液を抜くことでより効果的に行えることを発見しました。低体温法を用いた先天性心疾患の心臓内手術は、 1952年9月2日にミネソタ大学のC・ウォルトン・リレハイとF・ジョン・ルイスによって初めて成功しました。翌年、ソ連の外科医アレクサンドル・アレクサンドロヴィチ・ヴィシュネフスキーが、局所麻酔下での初の心臓手術を行いました。
外科医たちは、低体温の限界、つまり複雑な心臓内修復には時間がかかり、患者は体、特に脳への血流が必要であることを認識していました。患者は人工的な方法で心臓と肺の機能を補う必要があるため、心肺バイパスと呼ばれます。フィラデルフィアのジェファーソン医科大学のジョン・ヘイシャム・ギボンは、1953年に酸素化装置による体外循環の初めての成功例を報告しましたが、その後の失敗に失望し、この方法を断念しました。1954年、リリーハイは、患者の母親または父親を「人工心肺」として使用する制御交差循環技術による一連の手術を成功させました。ミネソタ州ロチェスターのメイヨークリニックのジョン・W・カークリンは、一連の手術でギボンタイプのポンプ酸素化装置を使用し始め、すぐに世界各地の外科医がそれに続きました。
ナジー・ズーディは、1960年2月25日、オクラホマ州オクラホマシティのマーシー病院で、7歳のテリー・ジーン・ニックスに世界初の全意図的血液希釈開心術を施行した。手術は成功したが、ニックスは3年後の1963年に死亡した。[ 13 ] 1961年3月、ズーディ、キャリー、グリアは、 3歳の子供に開心術を施行した。+1 ⁄ 2、全意図的血液希釈装置を用いて行われた。1985年、ズーディはバプテスト病院でナンシー・ロジャースにオクラホマ州初の心臓移植を成功させた。移植は成功したが、癌を患っていたロジャースは手術後54日で感染症で亡くなった。 [ 14 ]
現代の心拍動下手術
1990年代以降、外科医は「オフポンプバイパス手術」、すなわち前述の体外循環を伴わない冠動脈バイパス手術を行うようになりました。この手術では、手術中は心臓は拍動していますが、心臓を安定させることで、閉塞部をバイパスする導管血管を接続するためのほぼ静止した作業領域が確保されます。米国では、ほとんどの導管血管は内視鏡下血管採取(EVH)と呼ばれる手法を用いて内視鏡的に採取されています。
一部の研究者は、オフポンプアプローチは術後灌流症候群などの術後合併症が少なく、全体的な成績も良好であると考えています。2007年時点での研究結果は議論の余地があり、外科医の好みと病院の結果が依然として大きな役割を果たしています。
低侵襲手術
ロボット支援心臓手術は、近年人気が高まっている新しい心臓手術法です。これは、心臓外科医がロボットを操作しながら、機械を用いて手術を行うものです。この手術法の主な利点は、患者の切開創の大きさです。外科医が少なくとも手を入れることができる程度の切開創が必要ではなく、ロボットのはるかに小さな「手」が患者の体内に入るために、鉛筆ほどの大きさの穴よりも大きくする必要はありません。[ 15 ]
2024年9月、リヤドのキングファイサル専門病院・研究センターで、同病院の心臓外科部長でロボット工学・低侵襲手術プログラムの責任者である外科医フェラス・カリエル氏の指揮の下、初の完全ロボット心臓移植が成功した。 [ 16 ] 2024年12月、ウエストバージニア大学で、WVU心臓血管研究所の理事長であり、胸部外科学会の副会長でもある外科医ヴィナイ・バドワール氏の指揮の下、ロボットによる大動脈弁置換術(AVR)と冠動脈バイパス移植手術(CABG)を組み合わせた初のロボット手術が、1つの小さな切開を通して成功した。[ 17 ] [ 18 ]
小児心臓血管外科
小児心臓血管外科は、小児の心臓の手術です。小児の心血管疾患を修復する最初の手術は、スウェーデンでクラレンス・クラフォードが12歳の少年の大動脈縮窄症を修復したときに行われました。[ 20 ]先天性心疾患を緩和する最初の試みは、1944年にジョンズホプキンス病院で、ウィリアム・ロングマイア、デントン・クーリー、およびブラロックの経験豊富な技術者であるヴィヴィアン・トーマスの協力を得て、アルフレッド・ブラロックによって行われました。 [ 21 ]バイパス機械を 使用せずに先天性心疾患を修復する技術は、1940年代後半から1950年代前半に開発されました。その中には、1952年にルイスとリリヘイが5歳児に対して低体温、流入閉塞、直視を使用して行った心房中隔欠損の開胸修復術があります。 1954年、リリーハイは4歳児の心室中隔欠損症の直接修復術において、その男児とその父親の間の交差循環を用いて灌流を維持した。 [ 22 ]彼はその後も交差循環を継続し、ファロー四徴症の初の修正手術を行い、その結果を1955年の米国外科学会で発表した。後に、小児心臓血管外科は、前述のようにギボンとリリーハイが開発した人工心肺装置に大きく依存することになる。
心臓手術のリスク
心臓手術と体外循環技術の発達により、これらの手術における死亡率は比較的低い水準にまで低下しました。例えば、先天性心疾患の修復における死亡率は現在4~6%と推定されています。[ 23 ] [ 24 ]心臓手術における大きな懸念事項は、神経学的損傷の発生率です。心臓手術を受けた人の5%に脳卒中が発生し、脳卒中リスクのある患者では発生率が高くなります。 [ 25 ]体外循環に起因する神経認知障害のより軽微な一群は、後灌流症候群(「ポンプヘッド」と呼ばれることもあります)として知られています。後灌流症候群の症状は当初永続的であると考えられていましたが、[ 26 ]一時的なものであり、永続的な神経学的障害は伴わないことが示されました。[ 27 ]
外科ユニットと個々の外科医のパフォーマンスを評価するために、EuroSCOREと呼ばれる一般的なリスクモデルが作成されています。これは、患者の健康状態に関するいくつかの要素を取り込み、事前に計算されたロジスティック回帰係数を用いて、退院までの生存率をパーセンテージで算出しようとします。英国では、このEuroSCOREを使用して、すべての心臓胸部外科センターの内訳を示し、ユニットと個々の外科医のパフォーマンスが許容範囲内であったかどうかをある程度示すことができました。結果はCQCのウェブサイトで公開されています。[ 28 ] しかし、使用された正確な方法論は現在まで公表されておらず、結果の根拠となった生データも公表されていません。
感染症は、心臓胸部外科手術における主要な非心臓性合併症です。感染症には、縦隔炎、感染性心筋炎または心膜炎、心内膜炎、心臓デバイス感染症、肺炎、膿胸、血流感染症などがあります。予防的または術後に抗生物質を使用すると、 クロストリディオイデス・ディフィシル腸炎が発生する可能性があります。
心臓胸部外科手術後の患者は、吐き気、嘔吐、嚥下障害、誤嚥性肺炎のリスクがある。[ 29 ]
胸部外科
胸膜切除術は、胸膜の一部を切除する外科手術です。気胸や中皮腫の治療に用いられることがあります。[ 30 ]気胸の場合は、壁側胸膜の頂端部分と横隔膜部分のみが切除されます。
肺容量減少手術
肺容量減少手術(LVRS)は、他の治療オプションが十分でない肺気腫性COPDの特定の患者の生活の質を改善できる可能性がある。肺気腫によって特に損傷を受けた肺の部分を切除することで、残っている比較的良好な肺が拡張し、より効率的に機能できるようになる。有益な効果は、達成された残気量の減少と相関している。[ 31 ] 従来のLVRSでは、気腫性の非嚢胞性肺の最も重篤な影響を受けた領域を切除する(目標は20~30%)。これは、基礎にある肺気腫のために末期COPDの患者に対して行われる小開胸を伴う外科的選択肢であり、肺の弾性収縮力と横隔膜機能を改善できる。
全国肺気腫治療試験(NETT)は、LVRSと非外科的治療を比較した大規模多施設共同研究(N = 1218)でした。結果は、主に上葉肺気腫と運動能力の低下を除けば、LVRS群に全生存率の優位性は認められず、運動能力はLVRS群で有意に改善したことを示唆しました。[ 32 ]その後の研究では、より広範な治療範囲でより良い転帰が得られることが示されています。[ 33 ]
LVRSの合併症としては、長時間の空気漏れ(胸腔チューブをすべて除去するまでの手術後の平均期間は10.9±8.0日)などがある[ 34 ] 。
上葉気腫が優位な患者では、肺容量減少手術により健康状態と肺機能が改善される可能性がありますが、早期死亡や有害事象のリスクも高まります。[ 35 ]
LVRSはヨーロッパでは広く使用されていますが、米国での応用はほとんど実験的です。[ 36 ]
より侵襲性の低い治療法としては、気管支鏡による肺容量減少手術があります。[ 37 ]
肺がんの手術
すべての肺がんが手術に適しているわけではありません。病期、部位、細胞型は手術適応の重要な制限因子です。さらに、全身状態が悪く、パフォーマンスステータスが低い、あるいは肺予備能が不十分な患者は、生存率が低い可能性があります。慎重に対象者を選定したとしても、手術死亡率は全体で約4.4%です。[ 38 ]
非小細胞肺癌のステージ分類では、IA、IB、IIA、IIB期が外科的切除に適している。[ 39 ]
肺予備能はスパイロメトリーで測定されます。過度の息切れやびまん性肺疾患の兆候がなく、FEV 1 が2リットルを超えるか予測値の80%を超える場合、肺切除術の適応となります。FEV 1 が1.5リットルを超える場合、肺葉切除術の適応となります。[ 40 ]
肺がん手術前に運動プログラムに参加することで手術後の合併症のリスクが軽減される可能性を示唆する弱い証拠がある。[ 41 ]
合併症
肺がん手術後の患者の8~25%に長期のエアリーク(PAL)が発生する可能性があります。[ 42 ] [ 43 ]この合併症により胸腔ドレーンの抜去が遅れ、肺切除(肺がん手術)後の入院期間が長くなります。[ 44 ] [ 45 ]手術用シーラントの使用により長期のエアリークの発生率が低下する可能性がありますが、この介入だけでは肺がん手術後の入院期間が短縮されることは示されていません。[ 46 ]
肺癌手術後の肺合併症を減らすために非侵襲的陽圧換気法を使用することを支持する強力な証拠はない。 [ 47 ]
種類
- 肺葉切除術(肺葉の切除)[ 48 ]
- 肺葉切除(肺葉の一部を切除する)
- 区域切除術(肺の特定の葉の解剖学的部分の切除)
- 肺切除術(肺全体の切除)
- 楔状切除
- スリーブ/気管支形成術(肺葉切除中に主気管支の管状部分を切除し、その後気管支の再建を行う)
- VATS肺葉切除術(肺葉切除術に対する低侵襲アプローチで、痛みの軽減、活動への早期復帰、入院費用の削減が期待できる)[ 49 ] [ 50 ]
- 食道切除術(食道の除去)
参照
参考文献
- ^ 「ポルトガル語Ordem dos Médicos – 医療専門分野」 (ポルトガル語)。2012 年 1 月 23 日のオリジナルからアーカイブ。
- ^ 「胸部外科専門分野の説明」アメリカ医師会。 2020年9月28日閲覧。
- ^ 「Integrated Thoracic Surgery Residency Programs – TSDA」 www.tsda.org 。2018年1月31日時点のオリジナルよりアーカイブ。2018年5月8日閲覧。
- ^ Aris A (1997). 「フランシスコ・ロメロ、最初の心臓外科医」. Ann Thorac Surg . 64 (3): 870–1 . doi : 10.1016/s0003-4975(97)00760-1 . PMID 9307502 .
- ^ 「学術外科のパイオニア – 扉を開く:現代のアフリカ系アメリカ人の学術外科医」。2016年3月29日時点のオリジナルよりアーカイブ。 2016年2月12日閲覧。学術外科のパイオニア、米国国立医学図書館
- ^心臓外科のランドマーク、Stephen Westaby、Cecil Bosher著、 ISBN 1-899066-54-3
- ^ラウフ、N. (2019)。「デン・ノルスケ・レゲフォニングのためのティッズスクリフト」。den Norske Laegeforening の Tidsskrift。139(14)。土井: 10.4045/tidsskr.19.0505。PMID 31592616。
- ^ Absolon KB, Naficy MA (2002).人間における最初の心臓手術成功、1896年:ルートヴィヒ・レーン(1849–1930)の生涯、時代、そして業績に関する記録. Rockville, MD : Kabel, 2002
- ^ Johnson SL (1970).『心臓外科の歴史 1896–1955』 ボルチモア: ジョンズ・ホプキンス・プレス. p. 5.
- ^英国人名辞典– ヘンリー・サター (2004–08)
- ^ a b cハロルド・エリス(2000)『外科の歴史』223ページ以降
- ^ a bローレンス・H・コーン(2007年)「成人の心臓手術」6ページ以上
- ^ウォーレン、クリフ、「ナジ・ズーディ博士 - 彼の科学的研究はすべての道をオクラホマシティに導いた」『Distinctly Oklahoma』2007年11月、30~33ページ
- ^ “NDepth: 伝説の心臓外科医、ナジ・ズーディ博士 | Newsok.com” . 2012年4月25日時点のオリジナルよりアーカイブ。 2012年4月16日閲覧。伝説の心臓外科医、ナヒ・ズーディ博士、オクラホマン紙、2010 年 1 月
- ^次の話題: 遠隔操作による手術ジーナ・コラタ;ニューヨーク・タイムズ; 2000 年 4 月 4 日。
- ^ AI駆動型ロボットがサウジアラビアの医療をどのように変革しているかアラブニュース; 2024年10月17日。
- ^決断、切開、そして精密:ウェストバージニア大学で世界初のロボットによる心臓弁置換・心臓バイパス手術を受ける女性; ジム・ビセット;パーカーズバーグ・ニュース・アンド・センチネル; 2024年12月7日。
- ^ STS会員のVinay Badhwar博士が歴史上初のロボットAVRおよびCABG手術を主導;胸部外科学会;2024年12月5日。
- ^ Wikipedia: 大動脈縮窄症。縮窄症は心臓(つまり心臓)の狭窄ではなく、心臓の近くにある大きな血管である大動脈の狭窄です。
- ^ Crafoord C, Nyhlin G (1945). 「先天性大動脈縮窄症とその外科的治療」J Thorac Surg . 14 : 347– 361. doi : 10.1016/S0096-5588(20)31801-8 .
- ^ Blalock A, Taussig HB (1948). 「肺動脈狭窄または肺動脈閉鎖を伴う心臓奇形の外科的治療」JAMA . 128 : 189–202 . doi : 10.1001/jama.1945.02860200029009 .
- ^ Lillehei CW, Cohen M, Warden HE; et al. (1955). 「制御交叉循環法を用いた心室中隔欠損症8例の直視下閉鎖術の結果」.外科・婦人科・産科. 10月 (4): 447–66 . PMID 13256320 .
{{cite journal}}: CS1 maint: 複数の名前: 著者リスト (リンク) - ^ Stark J, Gallivan S, Lovegrove J, Hamilton JR, Monro JL, Pollock JC, Watterson KG (2000). 「小児先天性心疾患手術後の死亡率と外科医の手術パフォーマンス」Lancet . 355 (9208): 1004–7 . doi : 10.1016 / s0140-6736(00)90001-1 . PMID 10768449. S2CID 26116465 .
{{cite journal}}: CS1 maint: 複数の名前: 著者リスト (リンク) - ^ Klitzner, Thomas S.; Lee, Maggie; Rodriguez, Sandra; Chang, Ruey-Kang R. (2006). 「小児患者における外科手術死亡率の性差」先天性心疾患. 1 (3): 77– 88. doi : 10.1111/j.1747-0803.2006.00013.x . PMID 18377550 .
- ^ Jan Bucerius; Jan F. Gummert; Michael A. Borger; Thomas Walther; et al. (2003). 「心臓手術後の脳卒中:成人患者16,184名を対象とした連続リスク因子分析」 . The Annals of Thoracic Surgery . 75 (2): 472– 478. doi : 10.1016/S0003-4975(02)04370-9 . PMID 12607656 .
- ^ Newman M; Kirchner J; Phillips-Bute B; Gaver V; et al. (2001). 「冠動脈バイパス手術後の神経認知機能の長期評価」 . N Engl J Med . 344 (6): 395– 402. doi : 10.1056/NEJM200102083440601 . PMID 11172175 .
- ^ Van Dijk D; Jansen E; Hijman R; Nierich A; et al. (2002). 「オフポンプおよびオンポンプ冠動脈バイパス移植手術後の認知転帰:ランダム化試験」JAMA . 287 (11): 1405–12 . doi : 10.1001/jama.287.11.1405 . PMID 11903027 .
- ^ 「英国における心臓手術」 。 2011年11月5日時点のオリジナルよりアーカイブ。2011年10月21日閲覧。2009年3月までの3年間の英国における心臓手術の結果に関するCQCウェブサイト
- ^ Ford C., McCormick D., Parkosewich J., et al. 心臓胸部手術後の患者における早期経口水分補給の安全性と有効性 Am. J. Crit. Care. 2020;29(4):292–300. doi:10.4037/ajcc2020841
- ^ Aziz, Fahad (2017年1月7日). 「胸郭切除術」 . Medscape . 2017年10月6日時点のオリジナルよりアーカイブ。 2017年10月4日閲覧。
- ^ Shah, Pallav L.; Weder, Walter; Kemp, Samuel V.; Herth, Felix J.; Slebos, Dirk-Jan; Geffen, Wouter H. van (2019年2月7日). 「肺気腫に対する肺容積を減少させる外科的および内視鏡的介入:系統的レビューとメタアナリシス」 . The Lancet Respiratory Medicine . 7 (4): 313– 324. doi : 10.1016/S2213-2600(18)30431-4 . ISSN 2213-2600 . PMID 30744937. S2CID 73428098 .
- ^ Fishman, A; Martinez, F; Naunheim, K; Piantadosi, S; Wise, R; Ries, A; Weinmann, G; Wood, DE (2003年5月22日). 「重症肺気腫に対する肺容量減少手術と薬物療法を比較する無作為化試験」 . The New England Journal of Medicine . 348 (21): 2059–73 . doi : 10.1056/nejmoa030287 . PMID 12759479 .
- ^ Caviezel, C; Schneiter, D; Opitz, I; Weder, W (2018年8月). 「NETT選択基準を超える肺容量減少手術」 . Journal of Thoracic Disease . 10 (Suppl 23): S2748– S2753. doi : 10.21037/jtd.2018.08.93 . PMC 6129809. PMID 30210828 .
- ^ Hopkins, PM; Seale, H.; Walsh, J.; Tam, R.; Kermeen, F.; Bell, S.; McNeil, K. (2006年2月1日). 「51: 従来の肺容量減少手術後の長期成績は、肺気腫に対する肺移植の結果を上回る」. The Journal of Heart and Lung Transplantation . 25 (2, Supplement): S61. doi : 10.1016/j.healun.2005.11.053 .
- ^ van Agteren, JE; Carson, KV; Tiong, LU; Smith, BJ (2016年10月14日). 「びまん性肺気腫に対する肺容量減少手術」 . The Cochrane Database of Systematic Reviews . 2016 (10) CD001001. doi : 10.1002/14651858.CD001001.pub3 . PMC 6461146. PMID 27739074 .
- ^クロネマイヤー、ボブ(2018年2月)「注目すべき4つのCOPD治療法」DrugTopics . 162 (2):18.
- ^ Gang Hou (2015年12月30日). 「慢性閉塞性肺疾患における気管支鏡による肺容量減少:歴史と進歩」 . Journal of Translational Internal Medicice . 3 (4): 147– 150. doi : 10.1515/jtim - 2015-0023 . PMC 4936455. PMID 27847904 .
- ^ Strand, TE; Rostad H; Damhuis RA; Norstein J (2007年6月). 「肺癌切除後30日死亡率の危険因子とその大きさの予測」 . Thorax . 62 ( 11): 991–7 . doi : 10.1136/thx.2007.079145 . PMC 2117132. PMID 17573442 .
- ^ Mountain, CF (1997). 「肺癌の国際病期分類システムの改訂」 . Chest . 111 (6): 1710–1717 . doi : 10.1378/chest.111.6.1710 . PMID 9187198. 2003年9月5日時点のオリジナルよりアーカイブ。
- ^ Colice, GL; Shafazand S; Griffin JP; et al. (2007年9月). 「切除手術が考慮される肺癌患者の生理学的評価:ACCPエビデンスに基づく臨床実践ガイドライン(第2版)」 . Chest . 132 (Suppl. 3): 161S– 177S. doi : 10.1378/chest.07-1359 . PMID 17873167. 2013年4月14日時点のオリジナルよりアーカイブ。
- ^ Cavalheri, Vinicius; Granger, Catherine (2017). 「非小細胞肺がん患者に対する術前運動トレーニング」 . The Cochrane Database of Systematic Reviews . 2017 (6) CD012020. doi : 10.1002/14651858.CD012020.pub2 . ISSN 1469-493X . PMC 6481477. PMID 28589547 .
- ^ Novoa, Nuria M.; Jiménez, Marcelo F.; Varela, Gonzalo (2017). 「胸腔チューブをいつ抜去するか」.胸部外科クリニック. 27 (1): 41– 46. doi : 10.1016/j.thorsurg.2016.08.007 . ISSN 1558-5069 . PMID 27865326 .
- ^バリンジャー、クリスティーナ;タルバート、スティーブ(2017)「肺切除後の胸部ドレナージシステムとエアリークの管理」 Journal of Thoracic Disease 9 ( 12): 5399– 5403. doi : 10.21037/jtd.2017.11.15 . ISSN 2072-1439 . PMC 5756963. PMID 29312751 .
- ^ Pompili, Cecilia; Miserocchi, Giuseppe (2016). 「肺切除後のエアリーク:病態生理と患者への影響」 . Journal of Thoracic Disease . 8 (Suppl 1): S46–54. doi : 10.3978/j.issn.2072-1439.2015.11.08 . ISSN 2072-1439 . PMC 4756241. PMID 26941970 .
- ^ Coughlin, Shaun M.; Emmerton-Coughlin, Heather MA; Malthaner, Richard (2012). 「肺切除後の胸腔チューブ管理:系統的レビューとメタアナリシス」. Canadian Journal of Surgery . 55 (4): 264– 270. doi : 10.1503/cjs.001411 . ISSN 1488-2310 . PMC 3404148. PMID 22854148 .
- ^ Belda-Sanchís, José; Serra-Mitjans, Mireia; Iglesias Sentis, Manuela; Rami, Ramon (2010年1月20日). 「肺癌患者における肺切除後の空気漏れを予防するための外科用シーラント」 . The Cochrane Database of Systematic Reviews . 2010 (1) CD003051. doi : 10.1002/14651858.CD003051.pub3 . ISSN 1469-493X . PMC 7138070. PMID 20091536 .
- ^ Torres, Maria Fs; Porfírio, Gustavo Jm; Carvalho, Alan Pv; Riera, Rachel (2019). 「肺癌患者における肺切除後の合併症予防のための非侵襲的陽圧換気」 . The Cochrane Database of Systematic Reviews . 3 (3) CD010355. doi : 10.1002/14651858.CD010355.pub3 . ISSN 1469-493X . PMC 6402531. PMID 30840317 .
- ^ Fell, SC; TJ Kirby (2005).一般胸部外科(第6版). Lippincott Williams & Wilkins. pp. 433– 457. ISBN 978-0-7817-3889-7。
- ^ Nicastri DG, Wisnivesky JP, Litle VR, et al. (2008年3月). 「胸腔鏡下肺葉切除術:安全性、退院時の独立性、疼痛、および化学療法耐容能に関する報告」 . J Thorac Cardiovasc Surg . 135 (3): 642–7 . doi : 10.1016/j.jtcvs.2007.09.014 . PMID 18329487 .
- ^ Casali G, Walker WS (2009年3月). 「胸部補助下肺葉切除術:費用はいくらかかるのか?」 . Eur J Cardiothorac Surg . 35 (3): 423–8 . doi : 10.1016/j.ejcts.2008.11.008 . PMID 19136272 .
