亜鉛化合物
亜鉛化合物は、周期表の第12族に属する元素である亜鉛を含む化合物です。ほとんどの化合物における亜鉛の酸化数は+2です。亜鉛は、亜鉛(II)とともに遷移後主族元素に分類されます。亜鉛化合物は、その特徴のない外観と挙動で注目に値します。一般的に無色であり(酸化数+2の他の元素の化合物は着色しますが)、酸化還元反応を起こしにくく、一般的に対称的な構造をとります。[ 1 ] [ 2 ] [ 3 ] [ 4 ]
一般的な特徴
化合物中では、Zn 2+イオンの電子配置は [Ar] 3d 10である。そのため、Zn 2+ は錯体と化合物の両方で対称的な配位構造をとる傾向がある。ZnO と ZnS (閃亜鉛鉱) の両方において、亜鉛は 4 つの配位子 (それぞれ酸化物と硫化物) に四面体結合している。ZnCl 4 2−など多くの錯体は四面体である。四面体配位の亜鉛は、炭酸脱水酵素などの金属酵素中に見出される。亜鉛塩を水に溶解したときに存在するアクア錯体[Zn(H 2 O) 6 ] 2+などの 6 配位八面体錯体も一般的である。5 配位数と 7 配位数は、特殊な有機配位子によって課される場合がある。
多くの亜鉛(II)塩は、対応するマグネシウム(II)塩と同形(同じ種類の結晶構造を持つ)です。この類似性は、Zn 2+と Mg 2+がほぼ同じイオン半径と満たされた電子殻を持つという事実に起因しています。原子番号が大きく異なる2つの元素が同じイオン半径を持つのは、 dブロックの収縮によるものです。カルシウムはマグネシウムよりもいくらか大きいですが、原子番号がカルシウムから亜鉛へと増加するにつれて、サイズは着実に小さくなります。
亜鉛(II)錯体は速度論的に不安定であり、亜鉛-配位子結合は他の配位子と急速に交換されます。このため、亜鉛イオンは多くの酵素の触媒中心に存在します。
亜鉛(I)
亜鉛の酸化数が+1の化合物は非常に稀である。[ 5 ]これらの化合物は化学式RZn 2 Rで表され、水銀(I)イオン(Hg 2 2+ )の金属間結合に類似したZn-Zn結合を含む。この点で、亜鉛はマグネシウムに類似しており、低原子価化合物ではMg-Mg結合が特徴付けられている。[ 6 ]
その他の酸化状態
亜鉛の酸化状態が+1または+2以外の化合物は知られていない。計算によると、酸化状態が+4の亜鉛化合物は存在しない可能性が高い。[ 7 ]
色と魅力

亜鉛化合物は、主族元素の化合物と同様に、ほとんど無色です。化合物が有色の陰イオンまたは配位子を含む場合は例外です。ただし、セレン化亜鉛とテルル化亜鉛はどちらも電荷移動反応により着色します。酸化亜鉛は加熱すると、一部の酸素原子が失われ、欠陥構造が形成されるため黄色に変わります。亜鉛を含む化合物は、配位子がラジカルである場合を除いて、 通常は反磁性です。
金属亜鉛の反応性
亜鉛は強力な還元剤であり、標準酸化還元電位は-0.76 Vです。純粋な亜鉛は空気中で急速に変色し、不動態皮膜を形成します。この皮膜の組成は複雑ですが、その成分の一つはおそらく塩基性炭酸亜鉛、Zn 5 (OH) 6 CO 3です。[ 8 ]この不動態皮膜によって亜鉛と水の反応は遅くなります。この皮膜が塩酸や硫酸などの酸によって腐食されると、反応は進行し、水素ガスが発生します。[ 1 ] [ 9 ]
- Zn + 2 H + → Zn 2+ + H 2
亜鉛は酸と同様にアルカリとも反応します。
カルコゲンやハロゲンなどの酸化剤と反応して、Zn は ZnS や ZnCl 2などの二元化合物を形成します。
二元化合物


酸化亜鉛(ZnO)は、亜鉛の最も重要な合成化合物であり、幅広い用途に使用されています。[ 2 ]ウルツ鉱型結晶構造で結晶化します。両性で、酸に溶解すると水溶性Zn 2+イオンとなり、アルカリに溶解すると亜鉛酸イオン(別名テトラヒドロキソ亜鉛酸イオン)[Zn(OH) 4 ] 2- となります。水酸化亜鉛(Zn(OH) 2)も両性です。
硫化亜鉛(ZnS)は、閃亜鉛鉱型結晶構造とウルツ鉱型結晶構造という2つの密接に関連した構造で結晶化し、これらは式MAの化合物に共通する構造です。ZnとSはどちらも、もう一方のイオンによって四面体配位されています。ZnSの有用な特性の一つは、そのリン光性です。他のカルコゲニドであるZnSeとZnTeは、電子機器や光学機器に応用されています。[ 10 ]
4種類のハロゲン化亜鉛のうち、ZnF2最もイオン性が高いのに対し、他のZnCl2、臭化亜鉛2、およびZnI2は比較的低い融点を持ち、より共有結合性が高いと考えられている。[ 2 ]ニクトゲニドZn3北2(高融点であることで有名[ 11 ])、Zn3P2、亜鉛3として2およびZn3SB2、様々な用途がある。[ 12 ]亜鉛の他の二元化合物には過酸化亜鉛ZnO2、水素化亜鉛ZnH2、炭化亜鉛ZnC2。[ 13 ]
塩
硝酸亜鉛Zn(NO3)2(酸化剤として使用される)、塩素酸亜鉛Zn(ClO3)2、硫酸亜鉛ZnSO4(「白硫酸」として知られる)、リン酸亜鉛Zn3(PO4)2(プライマー顔料として使用)、モリブデン酸亜鉛ZnMoO4(白色顔料として使用される)、クロム酸亜鉛ZnCrO4(数少ない有色の亜鉛化合物の1つ)、亜ヒ酸亜鉛Zn(AsO 2 ) 2(無色の粉末)、およびヒ酸亜鉛八水和物Zn(AsO4)2•8時間2O (白色粉末、ケティジャイトとも呼ばれる)は、亜鉛の一般的な無機化合物の例です。後者の2つの化合物は、どちらも殺虫剤と木材防腐剤に使用されています。[ 14 ]亜鉛の有機化合物の最も単純な例の1つは、酢酸亜鉛Zn(O2CCH3)2は、いくつかの医薬用途があります。亜鉛塩は通常、水溶液中で完全に解離します。例外として、陰イオンが錯体を形成する場合があり、例えば硫酸亜鉛の場合は[Zn(H 2 O) n (SO 4 ]錯体が形成されることがあります(log K = 約2.5)。[ 15 ]
複合体
亜鉛錯体の最も一般的な構造は四面体です。しかしながら、初期の遷移金属の錯体に匹敵する八面体錯体も珍しくありません。Zn 2+は、Ahrland、Chatt、Davies [ 16 ]の分類においてクラスAのアクセプターであり、第二列の硫黄やリンよりも第一列のドナー原子である酸素や窒素とより強い錯体を形成します。HSAB理論によれば、Zn 2+は硬い酸です。
水溶液中では八面体錯体[Zn(H 2 O) 6 ] 2+が優勢な種である。[ 17 ]亜鉛塩の水溶液は、アクアイオンが加水分解を受け、条件にもよるがp Kaが約9であるため、弱酸性である。[ 18 ]
- [Zn(H 2 O) 6 ] 2+ ⇌ [Zn(H 2 O) 5 (OH)] + + H +
塩基性酢酸亜鉛や塩基性炭酸亜鉛(Zn 3 (OH) 4 (CO 3 )•H 2 O)などの塩基性塩が容易に得られる理由は、加水分解によって説明できます。加水分解の理由は、亜鉛イオンの電荷密度が高いためです。亜鉛イオンは、配位水分子のOH結合から電子を引き離し、水素イオンを放出します。Zn 2+の分極作用は、亜鉛が炭酸脱水酵素などの酵素に存在する理由の一つです。

フッ素錯体は知られていないが、他のハロゲン化物や擬ハロゲン化物である[ZnX 3 ] −および[ZnX 4 ] 2−との錯体は合成可能である。チオシアン酸錯体は、亜鉛イオンが窒素結合異性体である[Zn(NCS) 4 ] 2−であるのに対し、硫黄結合異性体である[Cd(SCN) 4 ] 2−は硫黄結合しているため、亜鉛イオンのクラスA受容体としての性質を示す。亜鉛ジチオリン酸と亜鉛フィンガー錯体(下図)が示すように、亜鉛イオンはクラスA受容体であっても硫黄供与体との錯体形成を妨げるものではない。
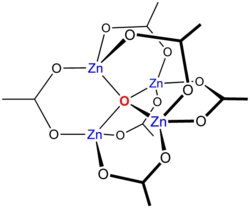
亜鉛アセチルアセトネート錯体 Zn(acac) 2は興味深い。配位子が二座配位なので、四面体構造が予想される。しかし、実際にはこの化合物は三量体 Zn 3 (acac) 6であり、各 Zn イオンは 5 つの酸素原子によって配位され、歪んだ三方両錐構造となっている。[ 2 ]特定の立体化学的要件を持つ配位子を選択することで、他の 5 配位構造を設計することができる。例えば、三座配位子であるテルピリジンは [Zn(terpy)Cl 2 ]錯体を形成する。 別の例としては、トリス(2-アミノエチル)アミンなどの 三脚型配位子が挙げられる。四角錐状の5 配位亜鉛は、テトラ(4-ピリジル)ポルフィナトモノピリジン亜鉛(II) に見られる[ 19 ] [ 20 ] [ 21 ] シアン化亜鉛化合物Zn(CN) 2は2配位ではありません。これは、架橋シアン配位子によって連結された四面体亜鉛中心からなる高分子構造をとります。シアン基は頭尾不規則構造を示し、亜鉛原子は1~4個の炭素原子に隣接し、残りは窒素原子です。これら2つの例は、構造と化学量論を関連付けることが難しい場合があることを示しています。
亜鉛アミドZn(NR 1 R 2 ) 2 (R 1 =CMe 3、R 2 =SiMe 3 )では配位数が2であるが、この配位子は非常に大きいため、2つ以上存在できるスペースはない。[ 22 ]
バイオコンプレックス


非常に多くの金属酵素は亜鉛(II)を含みます。また、多くのタンパク質も構造上の理由から亜鉛を含んでいます。亜鉛イオンは常に少なくとも3つのアミノ酸側鎖である配位子と4配位しています。ヒスチジン側鎖のイミダゾール窒素は一般的な配位子です。以下は、2種類の亜鉛-タンパク質複合体の典型的な例です。
休止状態の炭酸脱水酵素の活性部位では、亜鉛イオンが3つのヒスチジン残基に配位している。4番目の位置は水分子で占められており、加水分解時と同様に強く分極している(上記参照)。二酸化炭素が活性部位に入ると、部分的に負に帯電した酸素原子、あるいは水分子が解離している場合は完全に負に帯電した酸素原子による求核攻撃を受ける。CO2は速やかに重炭酸イオンに変換される。[ 23 ]
- [(-hys) 3 Zn(H 2 O)] 2+ + CO 2 → [(-hys) 3 Zn] 2+ + HCO 3 − + H +
グルタミン酸カルボキシペプチダーゼIIなどのいくつかのペプチダーゼも同様に作用すると考えられており、亜鉛イオンが求核試薬の形成を促進します。[ 23 ]
ジンクフィンガーモチーフは、タンパク質中の強固なサブストラクチャーであり、 DNAなどの他の分子へのタンパク質の結合を容易にします。[ 24 ]この場合、4つの配位位置すべてがヒスチジン残基とシステイン残基によって占められています。亜鉛イオンの周りの四面体構造は、 αヘリックスフラグメントと反平行βシートフラグメントを互いに特定の方向に 拘束します。
体液中の濃度が高いマグネシウムイオンは、その錯体が亜鉛の錯体よりもはるかに弱いため、これらの機能を果たすことができません。
有機金属化合物

有機亜鉛化合物は亜鉛-炭素共有結合を含む。ジエチル亜鉛((C2H5)2亜鉛(II)は1848年に初めて報告された。これは亜鉛とヨウ化エチルの反応で作られ、金属−炭素シグマ結合を含むことが知られる最初の化合物である。[ 25 ]銅(II)が類似の化合物を形成しない理由は長い間謎であった。1980年代になって初めてその理由が判明した。亜鉛化合物はベータ水素化物脱離反応を起こさないが、遷移金属銅の化合物は起こる。アルキルおよびアリール亜鉛化合物は線状C—Zn—Cモチーフを含む。亜鉛中心が配位不飽和であるため、化合物は強力な求電子剤である。実際、低分子量化合物は空気と接触すると自然発火し、水分子と反応して直ちに破壊される。亜鉛アルキルの使用は、より扱いやすいグリニャール試薬の使用に大部分取って代わられた。これは、亜鉛とマグネシウムの化学的性質のもう一つのつながりを示している。
シアン化亜鉛、Zn(CN)2は、いくつかの有機反応の触媒として使用されます。[ 26 ]
亜鉛(I)の有機金属化合物はM-M結合を含む。現在ではデカメチルジジンコセンが知られている。[ 27 ]
参照
参考文献
- ^ a bホレマン、アーノルド F.ウィバーグ、エゴン。ヴィバーグ、ニルス (1985)。 「ジンク」。Lehrbuch der Anorganischen Chemie (ドイツ語) (91–100 版)。ウォルター・デ・グルイテル。ページ 1034–1041。ISBN 978-3-11-007511-3。
- ^ a b c dグリーンウッド, ノーマン・N. ; アーンショウ, アラン (1997).元素化学(第2版).バターワース・ハイネマン. doi : 10.1016/C2009-0-30414-6 . ISBN 978-0-08-037941-8。
- ^ Housecroft, CE; Sharpe, AG (2008).無機化学(第3版). Prentice Hall. ISBN 978-0-13-175553-6。
- ^コットン、F.アルバート;ウィルキンソン、ジェフリー; ムリーリョ、カルロスA.; ボッホマン、マンフレッド(1999年)、Advanced Inorganic Chemistry(第6版)、ニューヨーク:Wiley-Interscience、ISBN 0-471-19957-5
- ^ Wang, Yuzhong; Brandon Quillian; Pingrong Wei; Hongyan Wang; Xiao-Juan Yang; Yaoming Xie; R. Bruce King; Paul v R. Schleyer; H. Fritz Schaefer III; Gregory H. Robinson (2005). 「Zn−Zn結合の化学について、RZn−ZnR (R = [{(2,6-Pr i 2 C 6 H 3 )N(Me)C} 2 CH]): 合成、構造、および計算」J. Am. Chem. Soc . 127 (34): 11944– 11945. doi : 10.1021/ja053819r . PMID 16117525 .
- ^ Green, SP; Jones C.; Stasch A. (2007年12月). 「Mg-Mg結合を有する安定なマグネシウム(I)化合物」 . Science . 318 (5857): 1754– 1757. Bibcode : 2007Sci...318.1754G . doi : 10.1126/science.11 50856. PMID 17991827 .
- ^ Kaupp M.; Dolg M.; Stoll H.; Von Schnering HG (1994). 「第12族元素の化学における酸化状態+IV。フッ化亜鉛(IV)、フッ化カドミウム(IV)、フッ化水銀(IV)の第一原理研究」(PDF) .無機化学. 33 (10): 2122– 2131. doi : 10.1021/ic00088a012 .
- ^ポーター、フランク・C. (1994).亜鉛および亜鉛合金の耐食性. CRC Press. p. 121. ISBN 978-0-8247-9213-8。
- ^ハイザーマン、デイビッド・L. (1992). 「元素番号30:亜鉛」.化学元素とその化合物の探究. ニューヨーク: TABブックス. pp. 123–124 . ISBN 978-0-8306-3018-9。
- ^ 「硫化亜鉛」 American Elements . 2009年2月3日閲覧。
- ^アカデミック・アメリカン百科事典.ダンベリー、コネチカット州:グロリアー社. 1994年. p. 202. ISBN 978-0-7172-2053-3. 2007年11月1日閲覧。
- ^ 「リン化亜鉛」 American Elements . 2009年2月3日閲覧。
- ^ Shulzhenko, AA; Ignatyeva, I. Yu; Osipov AS; Smirnova TI (2000). 「高圧高温下におけるZn-C系における相互作用の特異性」. Diamond and Related Materials . 9 (2): 129– 133. Bibcode : 2000DRM.....9..129S . doi : 10.1016/S0925-9635(99)00231-9 .
- ^ペリー、DL(1995年)『無機化合物ハンドブック』CRCプレス、 pp.448-458、ISBN 978-0-8493-8671-8。
- ^ IUPAC SCデータベース
- ^ Ahrland, S.; Chatt, J.; Davies, NR (1958). 「リガンド原子とアクセプター分子およびイオンの相対親和力」. Quart. Rev. 12 ( 3): 265– 276. doi : 10.1039/QR9581200265 .
- ^バージェス、J.溶液中の金属イオン、(1978) エリス・ホーウッド、ニューヨーク、p 147
- ^ Baes, CF; Mesmer, RE『陽イオンの加水分解』 (1976) Wiley, New York
- ^ Collins, DM; Hoard, JL (1970). テトラ(4-ピリジル)ポルフィナトモノピリジン亜鉛(II)の結晶構造と分子立体化学. ポルフィリン骨格における結合ひずみの評価. アメリカ化学会誌, 92, 3761-3371.
- ^ Vogel, GC; Stahlbush, JR (1976). 「シクロヘキサン中におけるテトラフェニルポルフィン亜鉛と数種の中性ドナーとの付加物形成に関する熱力学的研究」. Inorg. Chem. 16 (4): 950– 953. doi : 10.1021/ic50170a049 .
- ^ Vogel, GC; Bechman, BA (1976)「ピリジンと亜鉛テトラフェニルポルフィンのフェニル置換誘導体との結合」無機化学, 15, 483-484
- ^ Rees, WS; Green, DM; Hesse, W. (1992). 「Zn{N[(C(CH 3 ) 3 )(Si(CH 3 ) 3 )]} 2の合成とX線回折結晶構造.ホモレプティック亜鉛アミドの初めての固体特性評価」. Polyhedron . 11 (13): 1697– 1699. doi : 10.1016/S0277-5387(00)83726-2 .
- ^ a bシュライバー, DF; アトキンス, PW (1999). 「第19章 生無機化学」.無機化学(第3版). オックスフォード大学出版局. ISBN 978-0-19-850330-9。
- ^ Berg JM (1990). 「ジンクフィンガードメイン:仮説と現在の知見」Annu Rev Biophys Biophys Chem . 19 : 405–21 . doi : 10.1146/annurev.bb.19.060190.002201 . PMID 2114117 .
- ^ E. Frankland (1850). 「有機ラジカルの単離について」 . Quarterly Journal of the Chemical Society . 2 (3): 263– 296. doi : 10.1039/QJ8500200263 .
- ^ Rasmussen, JK; Heilmann, SM (1990). 「カルボニル化合物のin situシアノシリル化:O-トリメチルシリル-4-メトキシマンデロニトリル」 .有機合成学全集. 7 : 521.
- ^ Resa, I.; Carmona, E.; Gutierrez-Puebla, E.; Monge, A. (2004). 「デカメチルジジンコセン、Zn-Zn結合を有するZn(I)の安定化合物」. Science . 305 ( 5687): 1136–8 . Bibcode : 2004Sci...305.1136R . doi : 10.1126/science.11 01356. PMID 15326350. S2CID 38990338 .