新興ウイルス
新興ウイルス (エマージングウイルス)とは、新たに出現し、発生率や地理的範囲が著しく増加しているか、近い将来に増加する可能性があるウイルスである。 [ 1 ]新興ウイルスは新興感染症の主な原因であり、伝染病やパンデミックにつながる可能性のある病気の発生を引き起こす可能性があることから、世界的に公衆衛生上の課題を引き起こしている。[ 2 ]新興ウイルスは病気を引き起こすだけでなく、深刻な経済的影響を与えることもある。[ 3 ]最近の例としては、 2002~2004年のSARS(SARS-CoV-1)の発生と2019 ~2023年のCOVID-19(SARS-CoV-2 )のパンデミックを引き起こしたSARS関連コロナウイルスがある。[ 4 ] [ 5 ]その他の例としては、HIV/AIDSを引き起こすヒト免疫不全ウイルス、エボラ出血熱の原因ウイルスなどがある。[ 6 ]鳥インフルエンザの原因となるH5N1インフルエンザウイルス、[ 7 ] 2009年の豚インフルエンザの大流行を引き起こしたH1N1 /09 [ 8 ] ( H1N1の以前の出現株は1918年のスペイン風邪の大流行を引き起こした)。[ 9 ]ヒトにおけるウイルスの出現は、多くの場合、人獣共通感染症、つまり他の動物からヒトへのウイルス性疾患の種間ジャンプの結果である。人獣共通感染症ウイルスは動物のリザーバーに存在するため、根絶が非常に困難であり、そのためヒト集団で持続感染を引き起こす可能性がある。[ 10 ]
新興ウイルスは、再興ウイルスや新たに検出されたウイルスと混同してはならない。再興ウイルスは、一般的に、以前に出現したウイルスが再び増加しているものと考えられている[ 1 ] [ 11 ]。例えば、麻疹[ 12 ] 。新たに検出されたウイルスは、以前には認識されておらず、種の中で風土病または流行性感染症として循環していたウイルスである。[ 13 ] 。新たに検出されたウイルスは、明確な手がかりを残さなかったり、細胞培養で分離または増殖できなかったりするため、分類を逃れた可能性がある。[ 14 ]例としては、ヒトライノウイルス(風邪の主な原因で、1956年に初めて特定された)、[ 15 ] C型肝炎(最終的に1989年に特定された)、[ 16 ] およびヒトメタニューモウイルス(2001年に初めて説明されたが、19世紀から循環していたと考えられている)が挙げられる。[ 17 ]このようなウイルスの検出は技術主導であるため、報告される数は増加する可能性があります。
人獣共通感染症
新しいウイルス種の自然発生は稀であることから、ヒトにおける新興ウイルスの最も一般的な原因は人獣共通感染症である。この現象はすべての新興または再興病原体の73%を占めると推定されており、ウイルスが不釣り合いに大きな役割を果たしている。[ 18 ] RNAウイルスは特に多く、新興および再興病原体の37%を占めている。[ 18 ]野鳥、げっ歯類、コウモリなど、幅広い動物が人獣共通感染症ウイルスと関連している。[ 19 ]特定の動物リザーバーに関連する可能性のある特定の人獣共通感染症を、ある時点で予測することは不可能である。[ 20 ]
人獣共通感染症の流出は、狂犬病ウイルスのようにヒトからヒトへの感染がそれ以上起こらない自己限定的な「行き止まり」感染に至る場合もあれば、エボラウイルスのように人獣共通感染症の病原体がヒトからヒトへの感染を継続できる感染例に至る場合もある。[ 6 ]人獣共通感染症のウイルスがヒトからヒトへの感染を継続できる場合、アウトブレイクが発生する可能性がある。[ 22 ]一部の流出事象では、ウイルスがヒトへの感染にのみ適応する結果となる場合もあり(HIVウイルスの場合のように)、[ 23 ]この場合、ヒトは病原体の新たなリザーバーとなる。
人獣共通感染の「ジャンプ」が成功するかどうかは、ヒトに感染可能なウイルス変異体を保有する動物とヒトとの接触にかかっています。宿主域の制限を克服し、効率的なヒトからヒトへの感染を維持するために、動物由来のウイルスは通常、突然変異、遺伝子組換え、そして再集合を起こします。[ 20 ] RNAウイルスは複製速度が速く、突然変異率が高いため、新たな宿主集団への侵入に適応する可能性が高くなります。[ 3 ]
動物由来の例
コウモリ

コウモリは多くの生態系に不可欠な一員であるが、[ 24 ]新興ウイルス感染源としても頻繁に関与していることが指摘されている。[ 25 ]コウモリの免疫系は、ウイルス感染に対する炎症反応を抑制するように進化しており、それによって進化するウイルスに対して寛容な宿主となり、結果として人獣共通感染ウイルスの主要なリザーバーとなっている。[ 26 ]コウモリは、宿主種あたりの人獣共通感染ウイルスの数が他のどの哺乳類よりも多く、分子生物学的研究では、重症急性呼吸器症候群関連コロナウイルスやエボラ/マールブルグ出血熱フィロウイルスなど、いくつかの有名な人獣共通感染ウイルスの自然宿主であることが実証されている。[ 27 ]スピルオーバーイベントの可能性という点では、コウモリはこれまでげっ歯類に割り当てられていた主導的な役割を引き継いでいる。[ 26 ]コウモリからのウイルスの感染経路には、咬傷、[ 28 ]唾液のエアロゾル化(例えば、エコーロケーション中)、糞便/尿など、いくつかの経路があります。[ 29 ]
コウモリは独特の生態・行動のため、ウイルス感染や伝播に対して生まれつき感受性が高い。多くのコウモリ種(例えば、ブラウンコウモリ)は密集したねぐらに集まるため、種内外のウイルス伝播が促進される。さらに、コウモリは都市部に広く生息しているため、人間が糞尿で汚染された生息地に侵入することもある。コウモリの飛行能力と移動パターンは、コウモリが広い地域に病気を拡散させ、同時に新しいウイルスを獲得する能力も持っていることを意味する[ 30 ] 。さらに、コウモリは持続的なウイルス感染を経験し、その非常に長い寿命(一部のコウモリ種は35年の寿命を持つ)と相まって、ウイルスを維持し、他の種に伝播させるのに役立っている。コウモリがウイルス宿主として有力である他の特性としては、食性、冬眠習性、再感染に対する感受性などが挙げられる[ 30 ] 。
ウイルス出現の要因
ウイルスの出現は、多くの場合、自然と人間の活動の両方の結果である。特に、生態学的変化は人獣共通感染症ウイルスの出現と再出現を大きく促進する可能性がある。[ 31 ]森林伐採、再植林、生息地の断片化、灌漑などの要因はすべて、人間が野生動物と接触する方法に影響を与え、結果的にウイルスの出現を促進する可能性がある。[ 3 ] [ 32 ]特に、病原体保有宿主種の生息地の喪失は、人獣共通感染症の出現に重要な役割を果たしている。[ 33 ]さらに、気候変動は生態系と媒介動物の分布に影響を与える可能性があり、それが今度は媒介動物媒介性ウイルスの出現に影響を与える可能性がある。その他の生態学的変化、例えば、種の導入や捕食者の減少も、ウイルスの出現と蔓延に影響を与える可能性がある。一部の農業慣行、例えば、畜産の集約化や家畜の排泄物の不適切な管理・処分も、人獣共通感染症のリスク増加と関連している。[ 3 ] [ 34 ]
ウイルスは、感染に対して脆弱な人間集団の形成によっても出現することがある。例えば、野生ウイルスの消失やワクチン接種プログラムの終了などにより交差防御免疫が喪失した後にウイルスが出現することがある。また、先進国では国民の高齢化や肥満関連疾患の割合が高く、国民の免疫抑制状態が強く、感染リスクが高い可能性がある。[ 3 ]対照的に、貧しい国では栄養失調や慢性感染により免疫不全の人口を抱えている可能性があり、これらの国でも安定したワクチン接種プログラムが実施されている可能性は低い。[ 3 ]さらに、人間の人口動態の変化[ 3 ]、例えば免疫学的に未熟な個人の出生や移住などにより、大規模なウイルス感染を可能にする感受性集団が形成される可能性がある。
ウイルスの出現を促進する可能性のある他の要因には、グローバリゼーションが含まれます。特に、国際貿易と人間の旅行/移動は、新しい地域へのウイルスの持ち込みにつながる可能性があります。[ 3 ]また、人口密度の高い都市は病原体の急速な伝播を促進するため、制御されていない都市化(つまり、都市部での人々の移動と定住の増加)はウイルスの出現を促進する可能性があります。[ 35 ]動物の移動もウイルスの出現につながる可能性があり、渡り鳥の個体群によって拡散したウエストナイルウイルスの場合がそうでした。 [ 36 ]さらに、食品の生産と消費に関する人間の慣行も、ウイルス出現のリスクに寄与する可能性があります。特に、ウェットマーケット(つまり、生きた動物の市場)は、人々と野生動物/家畜が存在する密度が高いため、ウイルスの伝播に理想的な環境です。[ 29 ]ブッシュミートの消費も病原体の出現に関連しています。[ 29 ]
防止
人獣共通感染症の制御と予防は、新しい病原体の特定、公衆衛生サーベイランス(血清学的調査を含む)、および伝播のリスクの分析など、さまざまなレベルでの適切な世界的サーベイランスに依存しています。[ 37 ]世界中で発生する人獣共通感染症の複雑さから、予防には学際的なアプローチが必要です。[ 37 ]ワンヘルスモデルは、新しいウイルス性疾患を含む、ヒトにおける人獣共通感染症の出現を防ぐための世界戦略として提案されています。[ 37 ]ワンヘルスの概念は、野生生物学、獣医学、医学、農学、生態学、微生物学、疫学、生物医学工学など、相互に関連するさまざまな分野の専門家間の理解と協力を促進することにより、地域的にも世界的にも動物、人間、環境の健康を促進することを目指しています。[ 37 ] [ 38
新興ウイルスの毒性
宿主はこれまで遭遇したことのない病原体に対して免疫学的にナイーブであるため、新興ウイルスは疾患を引き起こす能力の点でしばしば極めて毒性が強い。その高い毒性は、新たな宿主への適応の欠如にも起因する。ウイルスは通常、自然宿主の免疫系に強い選択圧をかけ、それが今度はウイルスに強い選択圧をかける。 [ 39 ]この共進化は、自然宿主が感染に対処できることを意味する。しかし、ウイルスが新たな宿主(例えばヒト)に感染すると、共進化の欠如のために新たな宿主は感染に対処できず、その結果、宿主の免疫エフェクターとウイルスの免疫調節因子の間にミスマッチが生じる。
さらに、伝播を最大限に高めるために、ウイルスはしばしば自然に弱毒化(すなわち毒性が低下する)し、感染した動物が他の動物に効率的に感染するのに十分な期間生存できるようにします。[ 40 ]しかし、弱毒化には時間がかかるため、新しい宿主集団は当初この現象の恩恵を受けません。さらに、人獣共通感染症ウイルスは動物のリザーバーにも自然に存在するため、[ 10 ]その生存は新しい宿主間の伝播に依存しません。これは、新興ウイルスが伝播を最大限に高めるために弱毒化する可能性がさらに低く、毒性を維持することを意味します。
新興ウイルスはしばしば非常に毒性が強いものの、宿主側の自然免疫、自然抗体、受容体特異性といったいくつかの要因によってその毒性は制限されます。宿主が過去に新興ウイルスに類似した病原体に感染したことがある場合、宿主は交差防御免疫の恩恵を受ける可能性があります。
新興ウイルスの例
インフルエンザA

インフルエンザは感染力の強い呼吸器感染症で、世界人口の約9%が罹患し、毎年30万人から50万人が死亡しています。[ 41 ] [ 42 ]インフルエンザウイルスは、そのコアタンパク質に基づいて、A型、B型、C型、D型に分類されます。[ 43 ] [ 44 ] A型とB型のどちらもヒトに流行を引き起こす可能性がありますが、インフルエンザA型はパンデミックの可能性と高い変異率も持っているため、公衆衛生上最も重要です。[ 44 ] [ 45 ]
インフルエンザAウイルスは、表面糖タンパク質であるヘマグルチニン(HA)とノイラミニダーゼ(NA)の組み合わせに基づいて、さらにサブタイプに分類されます。ほとんどのインフルエンザAサブタイプの主な自然宿主は野生の水鳥です。[ 44 ]しかし、一連の突然変異により、これらのウイルスの小さなサブセットはヒト(および他の動物)への感染に適応しました。[ 46 ]特定のインフルエンザAサブタイプがヒトに感染できるかどうかを決定する重要な要因は、その結合特異性です。鳥インフルエンザAは末端α2,3結合シアリン酸を持つ細胞表面受容体に優先的に結合しますが、ヒトインフルエンザAは末端α2,6結合シアリン酸を持つ細胞表面受容体に優先的に結合します。突然変異により、一部の鳥インフルエンザAウイルスは、結合特異性をα2,3結合型からα2,6結合型シアリン酸に変化させることに成功している。[ 47 ]しかし、ヒトに出現するためには、鳥インフルエンザAウイルスは、ヒトの酸性の呼吸器系で安定するように変異するだけでなく、哺乳類細胞での機能に合わせてRNAポリメラーゼを適応させる必要がある。[ 48 ] [ 49 ]
インフルエンザAウイルスは、適応と宿主スイッチを経て、ヒトに流行やパンデミックを引き起こす可能性があります。HAとNAの構造に小さな変化(抗原ドリフト)が頻繁に起こり、ウイルスは免疫認識を逃れて繰り返しアウトブレイク(季節性インフルエンザ)を引き起こすことができます。 [ 43 ]異なるインフルエンザA亜型間(例えば、ヒトと動物の亜型間)の遺伝子再集合によって引き起こされるHAとNAの構造の大きな変化(抗原シフト)は、代わりに大規模な地域的/世界的なパンデミックを引き起こす可能性があります。[ 43 ]ヒトで抗原的に異なるインフルエンザA株が出現したため、20世紀だけで4回のインフルエンザパンデミックが発生しました。 [ 50 ]
さらに、動物インフルエンザAウイルス(例:豚インフルエンザ)はヒトインフルエンザウイルスとは異なるものの、ヒトにおいて人獣共通感染を引き起こす可能性があります。これらの感染は、主に感染動物や汚染された環境との直接接触によって起こりますが、ヒトからヒトへの効率的な感染には至りません。その例としては、H5N1インフルエンザやH7N9インフルエンザが挙げられます。[ 44 ]
SARS-CoV-1
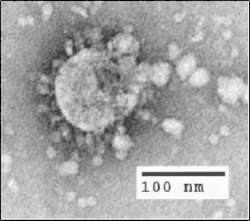
2002年に、病原性の高いSARS-CoV(重症急性呼吸器症候群コロナウイルス)株が人獣共通感染症の病原体保有生物から出現し、世界中で約8,000人が感染し、高齢者の死亡率は50%以上に近づいた。[ 51 ] SARS-CoV-1は症状が出た後が最も伝染性が高いため、厳格な公衆衛生対策の導入により、流行は効果的に食い止められた。[ 51 ] SARS-CoV-1の自然保有宿主はキクガシラコウモリと考えられているが、このウイルスは数種類の小型肉食動物(例:ハクビシンやタヌキ)でも確認されている。SARS - CoV -1の出現は、中国の湿った市場によって促進されたと考えられている。そこでは、ウイルス陽性のハクビシンが中間宿主として機能し、SARS-CoV-1をヒト(および他の種)に感染させた。[ 51 ] [ 52 ]しかし、最近の分析では、SARS-CoV-1がコウモリから人間に直接感染し、その後、人間とジャコウネコの間で交差感染した可能性があることが示唆されています。[ 51 ]
細胞に感染するために、SARS-CoV-1はスパイク表面糖タンパク質を使用して宿主ACE-2を認識し結合し、これを細胞侵入受容体として使用します。[ 51 ]この特性の発達は、SARS-CoV-1がコウモリから他の種に「ジャンプ」することを可能にする上で重要でした。
MERSコロナウイルス

2012年に初めて報告されたMERS-CoV(中東呼吸器症候群コロナウイルス)は、人獣共通感染症のリザーバーからヒトに高病原性コロナウイルスが持ち込まれた2番目の事例です。この新興ウイルスの死亡率は約35%で、報告された症例の80%はサウジアラビアで発生しています。[ 53 ] MERS-CoVはコウモリに由来する可能性が高いものの、[ 54 ]ヒトコブラクダが中間宿主である可能性が示唆されています。MERS-CoVはこれらの哺乳類の間で20年以上にわたり循環していたと考えられており、[ 54 ]新しいラクダ飼育方法がMERS-CoVのヒトへの流出を引き起こしたと考えられています。[ 55 ]研究によると、ヒトは感染したヒトコブラクダとの直接的または間接的な接触によってMERS-CoVに感染する可能性がありますが、ヒトからヒトへの感染は限られています。[ 53 ]
MERS-CoVは、スパイク表面タンパク質を使って宿主のDPP4表面受容体に結合し、細胞内に侵入します。このスパイク表面タンパク質のコアサブドメインはSARS-CoVのものと類似点がありますが、受容体結合サブドメイン(RBSD)は大きく異なります。[ 54 ]
ブルータング病

ブルータング病はブルータングウイルスによって引き起こされる非伝染性の媒介性疾患で、反芻動物(特にヒツジ)に感染する。[ 56 ]気候変動は媒介動物の分布に影響を与え、この疾患の発生と世界的蔓延に関係していると考えられている。ブルータングウイルスの自然媒介動物はアフリカユスリカのC. imicolaで、通常はアフリカと亜熱帯アジアに限られている。しかし、地球温暖化によってC. imicolaの分布範囲が拡大し、現在でははるかに北の分布範囲を持つ別の媒介動物(C. pulcarisまたはC. obsoletus)と重複している。この変化によってブルータングウイルスは媒介動物を飛び越えることが可能となり、ブルータング病がヨーロッパへ北上する原因となった。[ 57 ]
参照
参考文献
- ^ a b Holland DJ (1998年2月). 「新興ウイルス」. Current Opinion in Pediatrics . 10 (1): 34– 40. doi : 10.1097/00008480-199802000-00007 . PMID 9529635 .
- ^ Devaux CA (2012年2月). 「新興・再興ウイルス:チクングニアウイルスの流行が示す世界的な課題」 . World Journal of Virology . 1 (1): 11– 22. doi : 10.5501/wjv.v1.i1.11 . PMC 3782263. PMID 24175207 .
- ^ a b c d e f g h Lindahl JF, Grace D (2015). 「人間の行動が感染症のリスクに与える影響:レビュー」 .感染生態学と疫学. 5 (1) 30048. Bibcode : 2015InfEE...530048L . doi : 10.3402/iee.v5.30048 . PMC 4663196. PMID 26615822 .
- ^ Morens DM, Fauci AS (2020年9月). 「新興パンデミック疾患:COVID-19への道」 . Cell . 182 (5): 1077–1092 . Bibcode : 2020Cell..182.1077M . doi : 10.1016/j.cell.2020.08.021 . PMC 7428724. PMID 32846157 .
- ^ Zheng J (2020). 「SARS-CoV-2:世界的な脅威を引き起こす新興コロナウイルス」 .国際生物科学ジャーナル. 16 (10): 1678– 1685. doi : 10.7150/ijbs.45053 . PMC 7098030. PMID 32226285 .
- ^ a b Holmes EC, Dudas G, Rambaut A, Andersen KG (2016年10月). 「エボラウイルスの進化:2013~2016年の流行からの洞察」 . Nature . 538 ( 7624): 193– 200. Bibcode : 2016Natur.538..193H . doi : 10.1038/nature19790 . PMC 5580494. PMID 27734858 .
- ^ Wei P, Cai Z, Hua J, Yu W, Chen J, Kang K, 他 (2016). 「新興感染症における中国の経験から得られた苦悩と成果:SARSからH7N9まで」. BioMed Research International . 2016 5717108. doi : 10.1155/2016/5717108 . PMC 4971293. PMID 27525272 .
- ^ Smith GJ, Vijaykrishna D, Bahl J, Lycett SJ, Worobey M, Pybus OG, 他 (2009年6月). 「2009年豚由来H1N1インフルエンザA流行の起源と進化ゲノミクス」 . Nature . 459 (7250): 1122–5 . Bibcode : 2009Natur.459.1122S . doi : 10.1038/nature08182 . hdl : 10722/59392 . PMID 19516283 .
- ^ Taubenberger JK, Morens DM (2006年1月). 「1918年のインフルエンザ:すべてのパンデミックの母」 . Emerging Infectious Diseases . 12 (1): 15– 22. doi : 10.3201/eid1201.050979 . PMC 3291398. PMID 16494711 .
- ^ a b Eidson M. 「人獣共通感染症」ブリタニカ2020年4月16日閲覧。
- ^ミケル・ポルタ編 (2008). 『疫学辞典』 オックスフォード大学出版局, 米国. p. 78. ISBN 978-0-19-971815-3。
- ^ Fraser-Bell C (2019). 「麻疹の世界的再出現 - 2019年最新情報」 . Global Biosecurity . 1 (3). doi : 10.31646/gbio.43 . ISSN 2652-0036 .
- ^ Woolhouse M, Scott F, Hudson Z, Howey R, Chase-Topping M (2012年10月). 「ヒトウイルス:発見と出現」 .ロンドン王立協会哲学論文集. シリーズB, 生物科学. 367 (1604): 2864–71 . doi : 10.1098 / rstb.2011.0354 . PMC 3427559. PMID 22966141 .
- ^ Leland DS, Ginocchio CC (2007年1月). 「テクノロジー時代のウイルス検出における細胞培養の役割」 . Clinical Microbiology Reviews . 20 (1): 49– 78. Bibcode : 2007CliMR..20...49L . doi : 10.1128/CMR.00002-06 . PMC 1797634. PMID 17223623 .
- ^ Kennedy JL, Turner RB, Braciale T, Heymann PW, Borish L (2012年6月). 「ライノウイルス感染症の病因」 . Current Opinion in Virology . 2 (3): 287–93 . doi : 10.1016 / j.coviro.2012.03.008 . PMC 3378761. PMID 22542099 .
- ^ Houghton M (2009年11月). 「C型肝炎ウイルスの同定に至る長く曲がりくねった道」 . Journal of Hepatology . 51 (5): 939–48 . doi : 10.1016/j.jhep.2009.08.004 . PMID 19781804 .
- ^ de Graaf M, Osterhaus AD, Fouchier RA, Holmes EC (2008年12月). 「ヒトおよび鳥類メタニューモウイルスの進化ダイナミクス」 . The Journal of General Virology . 89 (Pt 12): 2933– 2942. doi : 10.1099/vir.0.2008/006957-0 . hdl : 1765/28848 . PMID 19008378 .
- ^ a b Woolhouse ME , Gowtage-Sequeria S (2005年12月). 「宿主域と新興・再興病原体」 .新興感染症. 11 (12): 1842–7 . doi : 10.3201/eid1112.050997 . PMC 3367654. PMID 16485468 .
- ^ Kruse H, kirkemo AM, Handeland K (2004年12月). 「野生動物は人獣共通感染症の発生源となる」 . Emerging Infectious Diseases . 10 (12): 2067–72 . doi : 10.3201/eid1012.040707 . PMC 3323390. PMID 15663840 .
- ^ a b Domingo E (2010). 「ウイルス出現のメカニズム」 .獣医学研究. 41 (6): 38. doi : 10.1051/vetres/2010010 . PMC 2831534. PMID 20167200 .
- ^ Baum SG (2008). 「人獣共通感染症 ― こんな仲間がいれば、敵など必要だろうか?」 .アメリカ臨床気候学会誌. 119 : 39–51 , ディスカッション51–2. PMC 2394705. PMID 18596867 .
- ^ Parrish CR, Holmes EC, Morens DM, Park EC, Burke DS, Calisher CH, 他 (2008年9月). 「異種間ウイルス伝播と新たな流行病の出現」 . Microbiology and Molecular Biology Reviews . 72 (3): 457–70 . doi : 10.1128/ MMBR.00004-08 . PMC 2546865. PMID 18772285 .
- ^エイズ研究所。「HIVはどこから来たのか?」エイズ研究所。 2020年4月16日閲覧。
- ^全米科学財団 (2012年10月31日). 「夜の生活:なぜ私たちはいつもコウモリが必要なのか - ハロウィーンだけではない」 .全米科学財団. 2020年4月14日閲覧。
- ^ Shi Z (2013年8月). 「コウモリウイルスに関連する新興感染症」 . Science China Life Sciences . 56 (8): 678–82 . doi : 10.1007/s11427-013-4517- x . PMC 7088756. PMID 23917838 .
- ^ a b Subudhi S, Rapin N, Misra V (2019). 「コウモリにおける免疫系の調節とウイルスの持続性:ウイルスのスピルオーバーの理解」 .ウイルス. 11 (2): 192. doi : 10.3390/v11020192 . PMC 6410205. PMID 30813403 .
- ^ O'Shea TJ, Cryan PM, Cunningham AA, Fooks AR, Hayman DT, Luis AD, 他 (2014年5月). 「コウモリの飛翔と人獣共通感染症ウイルス」 . Emerging Infectious Diseases . 20 (5): 741–5 . Bibcode : 2014EIDis..20..741O . doi : 10.3201/eid2005.130539 . PMC 4012789. PMID 24750692 .
- ^ Wang LF, Anderson DE (2019年2月). 「コウモリのウイルスと動物およびヒトへの潜在的なスピルオーバー」 . Current Opinion in Virology . 34 : 79–89 . Bibcode : 2019COVir..34...79W . doi : 10.1016/j.coviro.2018.12.007 . PMC 7102861. PMID 30665189 .
- ^ a b c Kuzmin IV, Bozick B, Guagliardo SA, Kunkel R, Shak JR, Tong S, Rupprecht CE (2011年6月). 「コウモリ、新興感染症、そして狂犬病パラダイムの再考」. Emerging Health Threats Journal . 4 : 7159. doi : 10.3402/ehtj.v4i0.7159 . PMC 3168224. PMID 24149032 .
- ^ a b Calisher CH , Childs JE, Field HE, Holmes KV, Schountz T (2006年7月). 「コウモリ:新興ウイルスの重要なリザーバー宿主」 . Clinical Microbiology Reviews . 19 (3): 531–45 . doi : 10.1128/CMR.00017-06 . PMC 1539106. PMID 16847084 .
- ^ Woolhouse M, Gaunt E (2007). 「新規ヒト病原体の生態学的起源」Critical Reviews in Microbiology . 33 (4): 231– 42. doi : 10.1080/10408410701647560 . PMID 18033594 . S2CID 19213392 .
- ^ von Csefalvay C (2023)、「宿主ベクターと多宿主システム」、感染症の計算モデル、エルゼビア、pp. 121– 149、doi : 10.1016/b978-0-32-395389-4.00013-x、ISBN 978-0-323-95389-4、 2023年3月2日取得
{{citation}}: CS1 maint: ISBNによる作業パラメータ(リンク) - ^ Penakalapati G, Swarthout J, Delahoy MJ, McAliley L, Wodnik B, Levy K, Freeman MC (2017年10月). 「動物の糞便への曝露とヒトの健康:系統的レビューと研究の優先順位の提案」 . Environmental Science & Technology . 51 (20): 11537– 11552. Bibcode : 2017EnST...5111537P . doi : 10.1021 / acs.est.7b02811 . PMC 5647569. PMID 28926696 .
- ^ Neiderud CJ (2015). 「都市化が新興感染症の疫学に及ぼす影響」 .感染生態学と疫学. 5 (1) 27060. Bibcode : 2015InfEE...527060N . doi : 10.3402/iee.v5.27060 . PMC 4481042. PMID 26112265 .
- ^ Rappole JH, Derrickson SR, Hubálek Z (2000). 「西半球における渡り鳥とウエストナイルウイルスの蔓延」 .新興感染症. 6 (4): 319–28 . doi : 10.3201/eid0604.000401 . PMC 2640881. PMID 10905964 .
- ^ a b c d Rahman MT, Sobur MA, Islam MS, et al. (2020年9月). 「人獣共通感染症:病因、影響、および制御」 . Microorganisms . 8 ( 9): 1405. Bibcode : 2020Miorg...8.1405R . doi : 10.3390/microorganisms8091405 . PMC 7563794. PMID 32932606 .
- ^ von Csefalvay C (2023)、「宿主ベクターと多宿主システム」、感染症の計算モデル、エルゼビア、pp. 121– 149、doi : 10.1016/b978-0-32-395389-4.00013-x、ISBN 978-0-323-95389-4、 2023年3月2日取得
{{citation}}: CS1 maint: ISBNによる作業パラメータ(リンク) - ^ Domínguez-Andrés J, Netea MG (2019年12月). 「歴史的移住と進化プロセスがヒトの免疫に及ぼす影響」 . Trends in Immunology . 40 (12): 1105– 1119. doi : 10.1016/j.it.2019.10.001 . PMC 7106516. PMID 31786023 .
- ^ Longdon B, Hadfield JD, Day JP, Smith SC, McGonigle JE, Cogni R, 他 (2015年3月). 「病原体宿主シフトに伴う毒性変化の原因と結果」 . PLOS Pathogens . 11 (3) e1004728. doi : 10.1371/journal.ppat.1004728 . PMC 4361674. PMID 25774803 .
- ^ Clayville LR (2011年10月). 「インフルエンザの最新情報:現在利用可能なワクチンのレビュー」 . P & T. 36 ( 10): 659–84 . PMC 3278149. PMID 22346299 .
- ^ UNICEF. 「インフルエンザ」 . UNICEF . 2020年4月14日閲覧。
- ^ a b c世界保健機関. 「インフルエンザ」 . 世界保健機関. 2013年6月17日時点のオリジナルよりアーカイブ。 2020年4月13日閲覧。
- ^ a b c d世界保健機関. 「インフルエンザ(鳥インフルエンザおよびその他の人獣共通感染症)」 . WHO . 2020年4月13日閲覧。
- ^米国疾病予防管理センター(2019年11月18日)「インフルエンザ」 CDC 。 2020年4月13日閲覧。
- ^ Byrd-Leotis L, Cummings RD, Steinhauer DA (2017年7月). 「宿主受容体とインフルエンザウイルスのヘマグルチニンおよびノイラミニダーゼの相互作用」 . International Journal of Molecular Sciences . 18 (7): 1541. Bibcode : 2017IJMSc..18.1541B . doi : 10.3390/ijms18071541 . PMC 5536029. PMID 28714909 .
- ^ Lewis DB (2006). 「鳥インフルエンザからヒトインフルエンザへ」. Annual Review of Medicine . 57 : 139–54 . doi : 10.1146/annurev.med.57.121304.131333 . PMID 16409141 .
- ^ Long JS, Giotis ES, Moncorgé O, Frise R, Mistry B, James J, 他 (2016年1月). 「ANP32Aの種差がインフルエンザAウイルスポリメラーゼの宿主制限の基盤となる」 . Nature . 529 (7584): 101–4 . Bibcode : 2016Natur.529..101L . doi : 10.1038/nature16474 . PMC 4710677. PMID 26738596 .
- ^ Di Lella S, Herrmann A, Mair CM (2016年6月). 「インフルエンザウイルスヘマグルチニンのpH安定性の調節:宿主細胞適応戦略」. Biophysical Journal . 110 (11): 2293– 2301. Bibcode : 2016BpJ...110.2293D . doi : 10.1016/j.bpj.2016.04.035 . PMC 4906160. PMID 27276248 .
- ^ Alexander DJ (2006). 「鳥インフルエンザウイルスとヒトの健康」. Developments in Biologicals . 124 : 77–84 . PMID 16447497 .
- ^ a b c d e Bolles M, Donaldson E, Baric R (2011年12月). 「SARS-CoVと新興コロナウイルス:種間伝播のウイルス決定因子」 . Current Opinion in Virology . 1 (6): 624–34 . doi : 10.1016/j.coviro.2011.10.012 . PMC 3237677. PMID 22180768 .
- ^ Wang LF, Eaton BT (2007). 「コウモリ、ジャコウネコ、そしてSARSの出現」.野生動物と新興人獣共通感染症:種間伝播の生物学、状況、そして結果. Current Topics in Microbiology and Immunology. Vol. 315. pp. 325–44 . doi : 10.1007/978-3-540-70962-6_13 . ISBN 978-3-540-70961-9. PMC 7120088 . PMID 17848070 .
- ^ a b WHO. 「中東呼吸器症候群コロナウイルス(MERS-CoV)」 . WHO . 2020年4月15日閲覧。
- ^ a b c Sharif-Yakan A, Kanj SS (2014年12月). 「中東におけるMERS-CoVの出現:起源、伝播、治療、そして展望」 . PLOS Pathogens . 10 (12) e1004457. doi : 10.1371/journal.ppat.1004457 . PMC 4256428. PMID 25474536 .
- ^ Farag E, Sikkema RS, Vinks T, Islam MM, Nour M, Al-Romaihi H, et al. (2018年12月). 「カタールにおけるMERS -CoV出現の要因」 .ウイルス. 11 (1): 22. doi : 10.3390/v11010022 . PMC 6356962. PMID 30602691 .
- ^食料安全保障・公衆衛生センターIS. 「ブルータング」(PDF) . CFSPH . 2020年4月14日閲覧。
- ^ Purse BV, Mellor PS, Rogers DJ, Samuel AR, Mertens PP, Baylis M (2005年2月). 「気候変動とヨーロッパにおけるブルータングの最近の出現」. Nature Reviews. Microbiology . 3 (2): 171– 81. doi : 10.1038/nrmicro1090 . PMID 15685226. S2CID 62802662 .
さらに読む
- Artika IM, Ma'roef CN (2017年5月). 「新興ウイルスの取り扱いにおける実験室バイオセーフティ」 . Asian Pacific Journal of Tropical Biomedicine . 7 (5): 483– 491. doi : 10.1016/j.apjtb.2017.01.020 . PMC 7103938. PMID 32289025 .
外部リンク
- 「新興ウイルス」 MicrobiologyBytes 2007年。2007年2月24日時点のオリジナルよりアーカイブ。
- 「国立新興・人獣共通感染症センター(NCEZID)」 2021年11月19日。