水素結合触媒

水素結合触媒は、水素結合相互作用を利用して有機反応を促進・制御する有機触媒の一種です。生物系において、水素結合は多くの酵素反応において、基質分子の配向と反応障壁の低下という重要な役割を果たしています。[ 1 ]この分野は、ルイス酸触媒の研究に比べると比較的未発達です。[ 2 ]
水素結合供与体は、様々なメカニズムを通じて反応を触媒することができます。水素結合は陰イオン性中間体を安定化させることができます。また、陰イオンを捕捉することで、反応性の高い求電子カチオンの形成を可能にします。より酸性の強い供与体は、一般的な酸または特定の酸として作用し、求電子剤をプロトン化によって活性化します。強力なアプローチとして、反応における両方のパートナー、例えば求核剤と求電子剤を同時に活性化する方法があり、これは「二官能性触媒」と呼ばれます。いずれの場合も、触媒分子と基質が密接に結合していることから、水素結合触媒はエナンチオ選択性を誘導する強力な方法となります。
水素結合触媒は多くの場合、製造が簡単で、比較的堅牢であり、高いエナンチオマー純度で合成できます。水素結合供与体によって触媒される新しい反応は、アルドール付加、ディールス・アルダー付加環化、マンニッヒ反応など、一般的な有機反応の不斉変種を含め、ますます多くの発見が進んでいます。[ 3 ]
触媒戦略
四面体中間体の安定化
多くの有機反応は、アルデヒド、アミド、イミンなどの官能基の求核攻撃による四面体中間体の形成を伴います。これらの場合、水素結合供与体触媒は魅力的な戦略です。なぜなら、アニオン性の四面体中間体は、出発化合物よりも優れた水素結合受容体だからです。これは、初期の触媒-基質複合体と比較して、より多くの負電荷を持つ遷移状態が安定化されることを意味します。

例えば、典型的なアシル置換反応では、出発物質であるカルボニル化合物は、1つ、2つ、あるいはそれ以上の水素結合を介して触媒に配位します。求核剤の攻撃により、酸素は負電荷を帯び、最終的に四面体中間体に達します。そのため、形式的に負電荷を持つ酸素は、負電荷の増加により、出発物質であるカルボニル酸素よりもはるかに強い水素結合を形成します。エネルギー的には、これは中間体と遷移状態を低下させる効果があり、反応を加速させます。
この触媒様式は、セリンプロテアーゼなど多くの酵素の活性部位に見られる。[ 4 ]この例では、アミドカルボニル基が2つのN–H供与体に配位している。生物学においてカルボニル反応を促進するために設計されたこれらの多重配位部位は、「オキシアニオンホール」と呼ばれる。セリン求核剤が供給されると四面体中間体が形成され、オキシアニオンホールへの水素結合の増加によって安定化される。

多くの合成触媒は、様々な求電子剤を活性化するためにこの戦略を採用しています。例えば、キラルBINOL触媒を用いることで、エノンをアルデヒドに付加する森田・ベイリス・ヒルマン反応を高いエナンチオ選択性で進行させることができます。 [ 5 ]求核剤は、エノンへのPEt 3の共役付加によって生成されるエノラート型種であり、触媒に配位したアルデヒドにエナンチオ選択的に付加します。

カルボニルに加えて、イミンなどの他の求電子剤も使用できます。例えば、単純なキラルチオ尿素触媒を用いることで、芳香族イミンとシルイルケテンアセタールとの不斉マンニッヒ反応を高い収率でほぼ定量的な変換率で触媒することができます。[ 6 ]この反応の機構は完全に解明されておらず、反応は基質特異性が非常に高く、特定の芳香族求電子剤に対してのみ有効です。

この活性化様式は、求電子剤、求核剤、および触媒構造の組み合わせにまで及ぶ。さらに、ニトロソ化合物へのエノラート付加[ 7 ]やエポキシドの開環[ 8 ]など、オキシアニオン中間体を伴う類似の反応も、この戦略を用いて触媒されている。

アニオンフラグメントの安定化
研究されてきたもう一つの戦略は、遷移状態において部分的な負電荷を生じる反応の安定化です。応用例としては、協奏的かつペリ環式反応に最もよく見られます。反応の過程で、あるフラグメントが部分的な負電荷を生じ、遷移状態は水素結合を受け入れることで安定化されます。
代表的な例として、ヤコブセン研究グループが報告したエステル置換アリルビニルエーテルのクライゼン転位の触媒作用が挙げられる[ 9 ] 。キラルグアニジニウム触媒は、室温付近で高いエナンチオ選択性で反応を促進することが見出された。遷移状態において、アミジニウム触媒に配位したフラグメントは、酸素の電気陰性度と電子吸引性エステル基により部分的にアニオン性を示す。これにより水素結合の強度が高まり、遷移状態エネルギーが低下するため、反応が促進される。

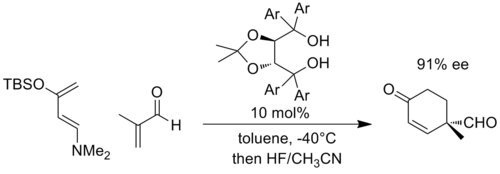
同様に、ディールス・アルダー反応などの付加環化反応においても、相手化合物が適切に置換されると負電荷が発生する。代表的な例として、Rawalらは、ディールス・アルダー反応を触媒できるα,α,α',α'-テトラアリール-2,2-二置換1,3-ジオキソラン-4,5-ジメタノール( TADDOL)をベースとしたキラル触媒を開発した。以下の例では、電子過剰のジエンと電子不足のジエノフィルとの反応により、エナールフラグメントに大きな負電荷が発生し、TADDOL(Ar = 1-ナフチル)への水素結合の増加によって遷移状態が安定化されると考えられる。[ 10 ]
アニオン結合
水素結合触媒は、ハロゲン化物などのアニオンを引き抜き、配位させることで求電子種の形成を補助し、反応を加速させることもできます。尿素触媒とチオ尿素触媒は、アニオン結合触媒において最も一般的な供与体であり、ハロゲン化物やその他のアニオンと結合する能力は文献で十分に確立されています。[ 11 ]キラルアニオン結合触媒の使用により、不斉イオン対が形成され、顕著な立体選択性が誘導されます。
アニオン結合触媒作用によって進行すると提案された最初の反応の一つは、チオ尿素触媒作用下でのTMSClによるヒドロキシラクタムのピクテ・スペングラー型環化反応である[ 12 ] 。提案された機構では、まずヒドロキシル基が塩化物に置換された後、鍵となるイオン対が形成される。活性化されたイミニウムイオンは、キラルなチオ尿素結合塩化物と密接に会合し、高い立体選択性で分子内環化が進行する。

不斉イオン対は分子間反応においても攻撃を受ける可能性がある。興味深い例として、エノールシラン求核剤のオキソカルベニウムイオンへの不斉付加は、触媒的にアニオン結合を介してオキソカルベニウムを形成することによって達成される。[ 13 ]アセタールから出発して、三塩化ホウ素を用いてクロロエーテルを生成し、エノールシランおよび触媒と反応させる。オキソカルベニウム-チオ尿素-塩化物錯体の形成機構は完全には解明されていない。反応条件下では、クロロエーテルがエピマー化し、チオ尿素が立体選択的に塩化物と結合して密接に会合したイオン対を形成すると考えられている。この不斉イオン対はその後、シランによって攻撃され、アルキル化生成物を生成する。

アニオン結合機構の一例としては、下の図に示すヤコブセンのアミドチオ尿素触媒によるイミンのヒドロシアン化がある。この反応は、計算、分光学、標識および速度論的実験を通じて最も広範に研究されている反応の1つでもある。[ 14 ]触媒に結合したイミンにシアン化物を直接付加することも検討されたが、触媒により制御されるイミニウム-シアン化物イオン対の形成を伴う代替機構の方が、障壁が20 kcal/mol低いと計算された。提案されている最も可能性の高い機構は、HCNと平衡状態にあるHNCに触媒が結合することから始まる。次に、この錯体がイミン分子をプロトン化し、触媒と結合してイミニウム-シアン化物イオン対を形成し、シアン化物アニオンを安定化させる。イミニウムは、触媒分子上のアミドカルボニルとも相互作用すると考えられる(下の二機能触媒を参照)。結合したシアン化物アニオンは回転し、炭素を介してイミニウムを攻撃します。研究者らは、イミンと尿素の結合は分光法によって観察され、初期の速度論実験によって裏付けられていたものの、イミンの結合はオフサイクルであり、すべての証拠はチオ尿素に結合したシアン化物が関与するこのメカニズムを示唆していると結論付けています。

プロトン化
水素結合触媒と一般的な酸触媒を区別することはしばしば困難である。[ 3 ]水素結合供与体は、穏やかな酸性からリン酸のような本質的に強いブレンステッド酸まで、様々な酸性度を持ち得る。反応の過程でのプロトン移動の程度を見ることは困難であり、ほとんどの反応で徹底的に調査されていない。しかしながら、強酸触媒は、この連続体上の極端な例であり、それらの触媒挙動に類似点があるため、しばしば水素結合触媒と同じグループに分類される。これらの反応の活性化機構には、求電子性パートナーの最初のプロトン化が含まれる。これは、基質をより求電子性にし、イオン対を生成する効果があり、これを通じて立体化学情報を伝達することができる。

基質のほぼ完全なプロトン化を伴う不斉触媒は、芳香族アルジミンと炭素求核剤とのマンニッヒ反応に効果的であることが報告されている。[ 15 ]さらに、フランのアザフリーデルクラフツ反応、ジアゾカルボニル化合物のアミドアルキル化、アルジミンの不斉ヒドロホスホニル化、移動水素化も報告されている。[ 3 ]キラルブレンステッド酸は、BINOLなどのキラルアルコールから容易に調製されることが多く、分子認識研究におけるその有用性が確立されているため、すでに文献に多く記載されている。[ 16 ]
多機能戦略
水素結合触媒の主な利点の一つは、反応を促進するために複数の非共有結合性相互作用を担う触媒を構築できることです。反応中に水素結合供与体を用いて反応中心を活性化または安定化するだけでなく、ルイス塩基、アレーン、あるいは追加の水素結合部位などの他の官能基を導入することで、さらなる安定化を図ったり、他の反応パートナーに影響を与えたりすることも可能です。
例えば、コリスミ酸のクライゼン転位を触媒する天然酵素コリスミ酸ムターゼは、上で論じた陰イオン性フラグメント安定化戦略の一例であるエノラート様フラグメントの安定化に関与する水素結合に加えて、他の多くの相互作用を特徴とする。 [ 17 ]重要な相互作用は、遷移状態における陽イオン-π相互作用による他の陽イオン性アリルフラグメントの安定化である。多くの追加の水素結合の使用には、いくつかの推定上の目的がある。酵素への複数の水素結合の安定化は、結合のエントロピーコストを克服するのに役立つ。さらに、相互作用は基質を反応性立体配座に保持するのに役立ち、酵素触媒反応の活性化エントロピーはほぼゼロであるが、溶液中の典型的なクライゼン転位の活性化エントロピーは非常に負である。

カチオン-π相互作用の利用は、合成触媒を用いた反応にも応用されている。アニオン結合戦略とカチオン-π戦略を組み合わせることで、エナンチオ選択的なカチオン性多環化反応を行うことができる。[ 18 ]遷移状態において、チオ尿素基が塩化物と結合し、芳香族系が関連するポリエンカチオンを安定化することが提案されている。これを裏付けるように、芳香族環のサイズが大きくなると、収率と立体選択性の両方が向上する。エナンチオ選択性は、アリール基の分極率と四重極モーメントの両方とよく相関する。

非常に多くの触媒や反応は、遷移状態を安定化するために求電子剤と結合するため、多くの二官能性触媒はルイス塩基性の水素結合受容体部位も呈する。代表的な例として、Dengらは立体選択的マイケル反応を促進できるチオ尿素アミン触媒を開発した。[ 19 ]提案された遷移状態では、チオ尿素N–H供与体の1つがマイケル受容体に配位し、負電荷の蓄積を安定化する。塩基性窒素孤立電子対は水素結合受容体として働き、求核剤を配位させるが、遷移状態では求核性エノラート付加を促進する一般的な塩基として働く。

求核性および求電子性のパートナーの両方を反応に関与させ、遷移状態でそれらを安定化させるというこのモチーフは、二機能触媒では非常に一般的であり、チオ尿素有機触媒に関する記事にはさらに多くの例が記載されています。
合成オリゴペプチドを触媒として用いるという比較的新しい戦略により、多くの触媒的手法が生まれています。[ 20 ]ペプチドは水素結合の可能性のある部位を複数有しており、これらが基質とどのように結合し、どのように反応を促進するのかは、一般的には解明されていません。ペプチドは非常にモジュール化されているという利点があり、これらの触媒はしばしば大規模なアレイでスクリーニングされます。この方法によって、以下に示すアルドール反応のような、高度にエナンチオ選択的な反応が発見されています。

合成ペプチドが触媒する他の変換反応には、ヒドロシアン化、アシル化、共役付加、アルデヒド-イミンカップリング、アルドール反応、臭素化などがあります。遷移状態の性質は不明ですが、多くの例において、触媒構造の小さな変化が反応性に劇的な影響を及ぼします。触媒反応の幾何学的要件を満たすには、ペプチド内および触媒と基質間の多数の水素結合が協調して機能する必要があると考えられています。これを超える触媒設計とメカニズムの理解は、ペプチドライブラリの試験を必要とする程度にとどまっています。
触媒設計
特権構造
触媒反応において用いられる水素結合供与体の種類は、反応ごとに、さらには類似した触媒戦略間でも大きく異なります。特定の系については広範な研究と最適化が行われている一方で、反応に最適な供与体や触媒構造と反応性の関係についての一般的な理解は大きく欠如しています。所望の反応を所望の選択性で促進するための構造を合理的に設計することは、まだ現実的ではありません。しかしながら、現代の水素結合触媒反応は、主に、実験的に様々な状況で効果的であると思われる少数の系に焦点を当てています。[ 21 ]これらは「特権構造」と呼ばれています。しかしながら、金属配位水素結合供与体など、他の構造骨格やモチーフも有望な結果を示していることは注目に値します。[ 22 ]

- 尿素とチオ尿素は、これまでで最も一般的に使用されている構造であり、様々な負に帯電した中間体を安定化させるだけでなく、陰イオン結合触媒としても機能します。二官能性尿素およびチオ尿素触媒は文献に豊富に報告されています。チオ尿素は、アミノ基がより正に帯電しているため、尿素よりも強い水素結合供与体(すなわち、より酸性度が高い)であることがしばしば見られます[ 23 ] 。量子化学分析により、この直感に反する現象は、OとSの相対的な電気陰性度では説明できず、カルコゲン原子の有効立体的大きさに起因することが明らかになりました[ 24 ]。
- グアニジニウムイオンおよびアミジニウムイオンは、尿素イオンおよびチオ尿素イオンと構造的に類似しており、同様の反応を触媒しますが、正電荷を有するため、より強力な供与体であり、はるかに強い酸性を示します。グアニジニウムイオンおよびアミジニウムイオンの触媒機構は、多くの場合、基質の部分的なプロトン化を伴うと考えられています。
- ジオール触媒は、基質と単一の水素結合を形成し、もう一方の水酸基は内部水素結合に関与すると考えられています。これらは、研究が行われた最も初期の水素結合触媒の一つです。これらは、遷移状態における部分的なアニオン電荷の安定化に最も一般的に用いられ、例えばヘテロディールス・アルダー反応におけるアルデヒドジエノフィルへの配位などが挙げられます。
- リン酸触媒は最も一般的な強酸触媒であり、イミンなどの塩基性基質とのキラルイオン対の形成によって作用します。
- スクアラミド触媒はメチルスクアレートなどの出発物質から容易に調製でき、少ない触媒量で高い活性を示す。スクアラミド触媒は、いくつかの状況においてチオ尿素有機触媒の代替となり得る。 [ 25 ] [ 26 ]スクアラミドはチオ尿素よりもハロゲン化物イオンに対する親和性が高い。 [ 27 ]

触媒チューニング
一般的に、ドナー部位の酸性度はドナーの強度とよく相関します。例えば、チオ尿素触媒に電子吸引性のアリール置換基を付加することは一般的な戦略であり、これにより酸性度が上昇し、ひいては水素結合の強度が高まります。しかし、ドナーの強度が所望の反応性とどのように相関するかは依然として明らかではありません。重要なのは、酸性度の高い触媒が必ずしもより効果的であるとは限らないということです。例えば、尿素はチオ尿素よりもpKaが約6単位低い酸性度ですが、尿素が反応の触媒として著しく劣っているというのは一般的には真実ではありません。[ 28 ]
さらに、触媒上の置換基の変化が及ぼす影響は、十分に理解されていることがほとんどありません。置換基を少し変えるだけで、反応性や選択性が完全に変化することがあります。その一例が、最初に十分に研究されたチオ尿素触媒の一つである二官能性ストレッカー反応触媒の最適化研究です。[ 29 ]具体的には、サリチルアルジミン置換基のX置換基を変化させたところ、典型的な電子吸引性または電子供与性の置換基は反応速度にほとんど影響を与えないことがわかりましたが、酢酸エステルやピバロエートなどのエステル置換基は顕著な反応速度加速を引き起こすようです。この観察結果は、反応過程においてX基が反応中心から遠く離れており、電子状態が原因ではないため、合理的に説明することは困難です。

合成アプリケーション
天然物合成
これまで、天然物合成において水素結合触媒が用いられた反応は数多く発見されているにもかかわらず、その例はほとんどない。一般的に、必要な触媒量が多く、基質特異性が極めて高いことから、水素結合触媒はまだ実用化には至っていない。
インドールアルカロイドである(+)-ヨヒンビン[ 30 ]のヤコブセン合成では、ピロール置換チオ尿素触媒を用いた初期のエナンチオ選択的ピクテ・スペングラー反応により、グラムスケールの生成物が94% eeおよび81%の収率で得られた。残りの合成工程は、還元アミノ化と分子内ディールス・アルダー反応を用いて短時間で完了した。

2008年、竹本は二官能性触媒を用いたマイケルカスケード反応を利用した(−)-エピバチジンの簡潔な合成法を発表した。[ 31 ] β-ニトロスチレンへの不斉マイケル付加反応の後、分子内マイケル付加反応により環状ケトエステルが75% eeで得られる。標準的な官能基操作と分子内環化反応により、天然物が得られる。

ビルディングブロックのスケーラブルな合成
全合成以外にも、水素結合触媒は入手困難なキラル小分子の大量合成にも応用されている。一例として、2009年にNature誌に報告された、チオ尿素触媒を用いたグラムスケールの非天然アミノ酸のストレッカー合成が挙げられる[ 32 ] 。この触媒は、ポリマー結合型か均一型かを問わず、天然tert-ロイシン由来であり、ベンズヒドリルアミンと水性HCNからストレッカー生成物の形成を触媒することができる(触媒量4 mol%)。ニトリルの加水分解と脱保護により、純粋な非天然tert-ロイシンが全収率84%、ee99%で生成される。

参照
さらに読む
- 水素結合触媒。エヴァンスグループ会議におけるピーター・H・フラー氏によるプレゼンテーション。リンク
- 不斉水素結合触媒。マクミラングループ会議におけるアンソニー・マストラッキオ氏による発表。リンク
- 不斉触媒における水素結合。レイトングループ会議におけるウッタム・タンバー氏による発表。リンク
- キラル水素結合供与体による不斉触媒反応。Wipfグループ会議におけるZhenglai Fang氏による発表(リンク)
- エナンチオ選択的有機触媒.ピーター・I・ダルコ編, Wiley-VCH: Weinheim, 2007.
参考文献
- ^ Jacobsen, EN; Knowles, RR (2010年9月). 「不斉触媒における魅力的な非共有結合相互作用:酵素と低分子触媒のつながり」 ( PDF) . Proc. Natl. Acad. Sci . 107 (48): 20678– 20685. Bibcode : 2010PNAS..10720678K . doi : 10.1073/pnas.1006402107 . PMC 2996434. PMID 20956302 .
- ^ Jacobsen, EN; Taylor, MS (2006年2月). 「キラル水素結合供与体による不斉触媒反応」. Angew. Chem. Int. Ed . 45 (10): 1521– 1539. doi : 10.1002/anie.200503132 . PMID 16491487 .
- ^ a b c Doyle, Abigail G.; Jacobsen, EN (2007年12月). 「不斉触媒における小分子水素結合供与体」. Chem. Rev. 107 ( 12): 5713– 5743. doi : 10.1021/cr068373r . PMID 18072808 .
- ^ Sinnott, M. (1998).包括的生物触媒, 第1巻. ロンドン: アカデミック・プレス. pp. 345– 379.
- ^ McDougal, NT; Shaus, SE (2003年9月). 「キラルブレンステッド酸触媒による非対称Morita−Baylis−Hillman反応」. J. Am. Chem. Soc . 125 (40): 12094– 12095. Bibcode : 2003JAChS.12512094M . doi : 10.1021/ja037705w . PMID 14518986 .
- ^ Wenzel, AG; Jacobsen, EN (2002). 「尿素誘導体触媒による不斉触媒マンニッヒ反応:β-アリール-β-アミノ酸のエナンチオ選択的合成」. J. Am. Chem. Soc . 124 (44): 12964– 12965. Bibcode : 2002JAChS.12412964W . doi : 10.1021/ja028353g . PMID 12405820 .
- ^ Yamamoto, H.; Momiyama, N. (2004年9月). 「アキラルエナミンのブロンステッド酸触媒による位置選択的およびエナンチオ選択的ニトロソアルドール合成」 . J. Am. Chem. Soc . 127 (4): 1080– 1081. doi : 10.1021/ja0444637 . PMC 1460970. PMID 15669829 .
- ^ Hine, J.; Linden, SM; Kanagasabapathy, VM (1985年12月). 「1,8-ビフェニレンジオールによるフェニルグリシジルエーテルとジエチルアミンの反応における二重水素結合触媒作用」. J. Org. Chem . 50 (25): 5096– 5099. doi : 10.1021/jo00225a021 .
- ^ Uyeda, C.; Jacobsen, EN (2008年7月). 「水素結合供与性触媒を用いたエナンチオ選択的クライゼン転位」 . J. Am. Chem. Soc . 130 (29): 9228– 9229. Bibcode : 2008JAChS.130.9228U . doi : 10.1021 /ja803370x . PMC 2547484. PMID 18576616 .
- ^ Rawal, Viresh H.; Thadani, AN; Stankovich, AR (2004). 「水素結合触媒によるエナンチオ選択的ディールス・アルダー反応」 . PNAS . 101 ( 16): 5846– 5850. Bibcode : 2004PNAS..101.5846T . doi : 10.1073/pnas.0308545101 . PMC 395998. PMID 15069185 .
- ^ Schmidtchen, FP; Berger, M. (1997年8月). 「陰イオン用人工有機ホスト分子」. Chem. Rev. 97 ( 5): 1609– 1646. doi : 10.1021/cr9603845 . PMID 11851460 .
- ^ Raheem, IT; Thiara, PS; Peterson, EA; Jacobsen, EN (2007年8月). 「ヒドロキシラクタムのエナンチオ選択的ピクテ-スペングラー型環化:アニオン結合による水素結合供与体触媒」. J. Am. Chem. Soc . 129 (44): 13404– 13405. doi : 10.1021/ja076179w . PMID 17941641 .
- ^ Reisman, SE; Doyle, AG (2008年5月). 「チオ尿素触媒によるオキソカルベニウムイオンへのエナンチオ選択的付加反応」 . J. Am. Chem. Soc . 130 (23): 7198– 7199. Bibcode : 2008JAChS.130.7198R . doi : 10.1021 /ja801514m . PMC 2574628. PMID 18479086 .
- ^ Zuend, SJ; Jacobsen, EN (2009年9月). 「アミドチオ尿素触媒によるエナンチオ選択的イミンヒドロシアノ化のメカニズム:複数の非共有結合性相互作用による遷移状態の安定化」 . J. Am. Chem. Soc . 131 (42): 15358– 15374. Bibcode : 2009JAChS.13115358Z . doi : 10.1021/ja9058958 . PMC 2783581. PMID 19778044 .
- ^ Uraguchi, D.; Terada, M. (2004年4月). 「キラルブレンステッド酸触媒を用いた求電子活性化による直接マンニッヒ反応」. J. Am. Chem. Soc . 126 (17): 5356– 5357. Bibcode : 2004JAChS.126.5356U . doi : 10.1021/ja0491533 . PMID 15113196 .
- ^ Jansen, ACA; Brussee, J. (1983年5月). 「s(−)-[1,1'-ビナフタレン]-2,2'-ジオールの高度立体選択的合成」. Tetrahedron Lett . 24 (31): 3261– 3262. doi : 10.1016/S0040-4039(00)88151-4 .
- ^ Lee, A.; Stewart, JD; Clardy, J.; Ganem, B. (1995年4月). 「構造研究によるコリスミ酸ムターゼの触媒機構に関する新たな知見」 . Chemistry & Biology . 2 (4): 195– 203. doi : 10.1016/1074-5521(95)90269-4 . PMID 9383421 .
- ^ Knowles, RR; Lin, S.; Jacobsen, EN (2010年4月). 「エナンチオ選択的チオ尿素触媒カチオン性多環化」. J. Am. Chem. Soc . 132 (14): 5030– 5032. Bibcode : 2010JAChS.132.5030K . doi : 10.1021/ja101256v . PMC 2989498. PMID 20369901 .
- ^ Wang, B.; Wu, F.; Wang, Y.; Liu, X.; Deng, L. (2007年1月). 「キナアルカロイドによる二官能性触媒作用で非隣接立体中心を生成するタンデム不斉反応におけるジアステレオ選択性の制御」. J. Am. Chem. Soc . 129 (4): 768– 769. Bibcode : 2007JAChS.129..768W . doi : 10.1021/ja0670409 . PMID 17243806 .
- ^ Wennemers, Helma (2011). 「ペプチドを用いた不斉触媒」. Chem. Commun . 47 (44): 12036– 12041. doi : 10.1039/C1CC15237H . PMID 21993353 .
- ^ PI ダルコ (2007)。エナンチオ選択的有機触媒作用。ワインハイム: ワイリー-VCH。ISBN 978-3-527-31522-2。
- ^ Xu, Weici; Arieno, Marcus; Löw, Henrik; Huang, Kaifang; Xie, Xiulan; Cruchter, Thomas; Ma, Qiao; Xi, Jianwei; Huang, Biao; Wiest, Olaf; Gong, Lei (2016年7月20日). 「金属テンプレート設計:わずか数ppmの触媒負荷で実現可能なエナンチオ選択的水素結合駆動触媒」 . Journal of the American Chemical Society . 138 (28): 8774– 8780. Bibcode : 2016JAChS.138.8774X . doi : 10.1021/jacs.6b02769 . ISSN 0002-7863 . PMC 8103658 . PMID 27336458。
- ^ Jakab, Gergely; Tancon, Carlo; Zhang, Zhiguo; Lippert, Katharina M.; Schreiner, Peter R. (2012). 「DMSO中の(チオ)尿素有機触媒平衡酸性度」. Organic Letters . 14 (7): 1724– 1727. doi : 10.1021/ol300307c . PMID 22435999 .
- ^ Nieuwland, Celine; Fonseca Guerra, Célia (2022). 「カルコゲン原子サイズがカルボキサミド、チオアミド、セレノアミドの水素結合供与能をどのように決定するか」 . Chemistry – A European Journal . 28 (31) e202200755. doi : 10.1002/chem.202200755 . hdl : 1887/3512406 . PMC 9324920. PMID 35322485 .
- ^ Chauhan, Pankaj; Mahajan, Suruchi; Kaya, Uğur; Hack, Daniel; Enders, Dieter (2015年2月9日). 「二官能性アミン-スクアラミド:非対称ドミノ/カスケード反応のための強力な水素結合有機触媒」 . Advanced Synthesis & Catalysis . 357 ( 2–3 ): 253– 281. doi : 10.1002/adsc.201401003 . ISSN 1615-4150 .
- ^ Malerich, Jeremiah P.; Hagihara, Koji; Rawal, Viresh H. (2008年11月5日). 「キラルスクアラミド誘導体は優れた水素結合供与触媒である」 . Journal of the American Chemical Society . 130 (44): 14416– 14417. Bibcode : 2008JAChS.13014416M . doi : 10.1021/ja805693p . ISSN 0002-7863 . PMC 2701638. PMID 18847268 .
- ^ Busschaert, Nathalie; Kirby, Isabelle L.; Young, Sarah; Coles, Simon J.; Horton, Peter N.; Light, Mark E.; Gale, Philip A. (2012年4月27日). 「スクアラミドの強力な膜貫通陰イオントランスポーターとしての役割」 . Angewandte Chemie International Edition . 51 (18): 4426– 4430. doi : 10.1002/anie.201200729 . ISSN 1433-7851 . PMID 22461434 .
- ^ Schreiner, Peter R. (2003). 「明示的な水素結合相互作用による金属フリー有機触媒」. Chem. Soc. Rev. 32 ( 5): 289– 296. doi : 10.1039/B107298F . PMID 14518182 .
- ^ Jacobsen, EN 「キラル水素結合供与体による非対称触媒反応」(PDF) . 2012年12月18日閲覧。
- ^ Jacobsen, EN; Dustin, JM; Zuend, SJ (2008年11月). 「(+)-ヨヒンビンの触媒的不斉全合成」. Org. Lett . 10 (5): 745– 748. doi : 10.1021/ol702781q . PMID 18257582 .
- ^竹本 義治; 宮部 英之 (2008年7月). 「多官能チオ尿素による不斉反応の発見と応用」 . Bull. Chem. Soc. Jpn . 81 (7): 785– 795. doi : 10.1246/bcsj.81.785 .
- ^ Zuend, SJ; Coughlin, MP; Lalonde, MP; Jacobsen, EN (2009年10月). 「非天然αアミノ酸のスケーラブルな触媒的非対称ストレッカー合成」 . Nature . 461 (7266): 968– 970. Bibcode : 2009Natur.461..968Z . doi : 10.1038/ nature08484 . PMC 2778849. PMID 19829379 .
