アンドロゲン
| アンドロゲン | |
|---|---|
| 薬物クラス | |
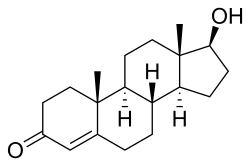 主要なアンドロゲンであるテストステロン | |
| クラス識別子 | |
| 同義語 | アンドロゲンホルモン;テストイド |
| 使用 | 性腺機能低下症、トランスジェンダー男性、パフォーマンス向上、ボディビルディング、その他 |
| ATCコード | G03B |
| 生物学的標的 | アンドロゲン受容体、mAR(例:GPRC6A、その他) |
| 外部リンク | |
| メッシュ | D000728 |
| 法的地位 | |
| ウィキデータ | |
アンドロゲン(ギリシャ語の「男」を意味する語源「 andr- 」に由来)は、アンドロゲン受容体に結合することで脊椎動物の男性的特徴の発達と維持を制御する天然または合成ステロイドホルモンです。[ 1 ] [ 2 ]これには、男性の主要な性器の発生と、思春期における男性の二次性徴の発達が含まれます。アンドロゲンは精巣、卵巣、副腎で合成されます。
思春期には男女ともにアンドロゲンが増加します。[ 3 ]男性における主要なアンドロゲンはテストステロンです。[ 4 ]ジヒドロテストステロン(DHT)とアンドロステンジオンは、男性の発達において同等の重要性を持っています。[ 4 ]子宮内のDHTは、陰茎、陰嚢、前立腺の分化を引き起こします。成人期には、DHTは脱毛、前立腺の肥大、そして脂腺の活動に寄与します。
アンドロゲンは一般的に男性ホルモンとしてのみ考えられていますが、女性にも存在します。ただし、その量は少なく、性欲や性的興奮に作用します。アンドロゲンは、すべてのヒトにおいてエストロゲンの前駆体です。
天然ホルモンとしての役割に加えて、アンドロゲンは医薬品としても使用されます。医薬品としてのアンドロゲンに関する情報については、アンドロゲン補充療法およびアナボリックステロイドの記事を参照してください。
種類と例
アンドロゲンの主なサブセットである副腎アンドロゲンは、副腎皮質の最内層である網状帯で合成される19炭素ステロイドで構成されています。副腎アンドロゲンは弱ステロイドとして機能しますが(一部は前駆物質です)、このサブセットには、デヒドロエピアンドロステロン(DHEA)、デヒドロエピアンドロステロン硫酸塩(DHEA-S)、アンドロステンジオン(A4)、アンドロステンジオール(A5)が含まれます。
テストステロンの他に、次のようなアンドロゲンがあります。
- デヒドロエピアンドロステロン(DHEA)は、副腎皮質でコレステロールから産生されるステロイドホルモンです。[ 5 ]アンドロゲンとエストロゲンの両方の性ホルモンの主前駆体です。DHEAはデヒドロイソアンドロステロンまたはデヒドロアンドロステロンとも呼ばれます。
- アンドロステンジオン(A4)は、精巣、副腎皮質、卵巣で産生されるアンドロゲン性ステロイドです。アンドロステンジオンは代謝によりテストステロンやその他のアンドロゲンに変換される一方で、エストロンの親構造でもあります。アンドロステンジオンのスポーツサプリメントやボディビルディングサプリメントとしての使用は、国際オリンピック委員会をはじめとするスポーツ団体によって禁止されています。
- アンドロステンジオール(A5)は、DHEAのステロイド代謝物であり、性ホルモンであるテストステロンとエストラジオールの前駆体です。
- アンドロステロンは、アンドロゲンの分解時に生成される化学副産物、またはプロゲステロンから派生した物質で、テストステロンの7分の1の強さで、軽度の男性化作用を発揮します。男性と女性の血漿および尿中に、ほぼ同量存在します。
- ジヒドロテストステロン(DHT)はテストステロンの代謝物であり、テストステロンよりも強力なアンドロゲンで、アンドロゲン受容体への結合力が強い。皮膚と生殖組織で生成される。
- A4とテストステロンは、11位にヒドロキシル基(-OH)またはケトン基(=O)が結合している場合もあります。この場合、11-ヒドロキシアンドロステンジオン、11-ケトアンドロステンジオン、11-ヒドロキシテストステロン、11-ケトテストステロンとなります。後者はテストステロンと同じ生理活性を持つため[ 6 ]、健康な人だけでなく、先天性副腎過形成、多嚢胞性卵巣症候群、早発副腎皮質機能低下症などの疾患を持つ患者にとっても非常に重要です。[ 6 ]
あらゆる生物学的検査方法を考慮して決定( 1970年頃): [ 7 ]
女性の卵巣および副腎のアンドロゲン
卵巣と副腎もアンドロゲンを産生しますが、その量は精巣よりもはるかに低いです。[ 8 ]
生物学的機能
男性の出生前発達
精巣の形成
哺乳類の発生過程において、生殖腺は当初、卵巣または精巣のいずれかになる能力を持つ。[ 9 ]ヒトでは、約4週目から、発達中の腎臓に隣接する中間中胚葉内に生殖腺原基が存在する。約6週目になると、形成中の精巣内で上皮性の性索が発達し、生殖細胞が生殖腺に移動する際にそれらを組み込む。男性では、特定のY染色体遺伝子、特にSRYが、初期の多分化能性腺から精巣への変換を含む、男性表現型の発達を制御する。男性では、性索は発達中の生殖腺に完全に侵入する。
アンドロゲン産生
発達中の精巣における性索の中胚葉由来上皮細胞はセルトリ細胞となり、精子形成を支える役割を果たします。ヒト胎児発育8週目までに、尿細管の間に非上皮細胞の少数の集団が出現します。これらはライディッヒ細胞です。ライディッヒ細胞は分化後すぐにアンドロゲンを産生し始めます。
アンドロゲン効果
アンドロゲンは、精子生成を支えるためにセルトリ細胞が必要とする傍分泌ホルモンとして機能する。また、発達中の男性胎児の男性化(陰茎および陰嚢の形成を含む)にも必要である。アンドロゲンの影響下で、中腎の残骸であるウォルフ管は、精巣上体、精管、精嚢へと発達する。アンドロゲンのこの作用は、セルトリ細胞から分泌されるホルモンであるミュラー管抑制ホルモン(MIH)によって補助されており、MIHは男性胎児において、胎児のミュラー管が卵管やその他の女性生殖器組織へと発達するのを防ぐ。MIHとアンドロゲンは協力して精巣を陰嚢へと移動させる。
早期規制
約 11~12 週目に胎児による下垂体ホルモンである黄体形成ホルモン(LH) の産生が始まる前に、8 週目にヒト絨毛性ゴナドトロピン(hCG) がライディッヒ細胞の分化とアンドロゲンの産生を促進します。標的組織におけるアンドロゲンの作用には、多くの場合、テストステロンから 5α-ジヒドロテストステロン(DHT)への変換が関与します。
男性の思春期の発達
思春期には、男性のアンドロゲンレベルが劇的に上昇します。アンドロゲンは、男性的な二次性徴の発達、精子形成と生殖能力の活性化、そして性欲の増大といった男性的な行動変化を媒介します。男性的な二次性徴には、男性的な体毛、声の低音化、喉仏の出現、肩幅の拡大、筋肉量の増加、陰茎の成長などがあります。
精子形成
思春期には、アンドロゲン、LH、卵胞刺激ホルモン(FSH)の産生が増加し、性索が空洞化して精細管が形成され、生殖細胞が精子への分化を開始します。成人期を通じて、アンドロゲンとFSHは協力して精巣のセルトリ細胞に作用し、精子の産生をサポートします。[ 10 ]外因性アンドロゲンサプリメントは男性避妊薬として使用できます。アンドロゲンサプリメントの使用によってアンドロゲンレベルが上昇すると、LHの産生が抑制され、ライディッヒ細胞による内因性アンドロゲンの産生がブロックされます。ライディッヒ細胞によるアンドロゲン産生によって精巣で局所的に高レベルのアンドロゲンが得られないと、精細管が変性して不妊症につながる可能性があります。このため、多くの経皮アンドロゲンパッチが陰嚢に貼付されます。
脂肪の蓄積
男性は一般的に女性よりも体脂肪が少ない。最近の研究では、アンドロゲンが脂肪細胞の機能を支えるシグナル伝達経路を阻害することで、一部の脂肪細胞の脂質蓄積能力を阻害することが示唆されている。[ 11 ]また、アンドロゲンはエストロゲンとは異なり、βアドレナリン受容体を増加させ、αアドレナリン受容体を減少させる。その結果、α2受容体のネガティブフィードバックの欠如によりエピネフリン/ノルエピネフリンのレベルが上昇し、エピネフリン/ノルエピネフリンが脂肪分解を誘導するβ受容体に作用することで脂肪蓄積が減少する。
筋肉量
男性は一般的に女性よりも骨格筋量が多い。アンドロゲンは骨格筋組織内の複数の細胞型に作用することで、協調的に骨格筋細胞の肥大を促進する。[ 12 ]筋芽細胞と呼ばれる細胞型は、筋肉を生成するためのアンドロゲン受容体を運搬する。筋芽細胞の融合により、アンドロゲン受容体レベルと関連したプロセスを経て筋管が形成される。 [ 13 ]アンドロゲンレベルの上昇は、アンドロゲン受容体の発現増加につながる。
脳
一部のニューロンはステロイドホルモンに敏感であるため、アンドロゲンの循環レベルは人間の行動に影響を与える可能性があります。アンドロゲンレベルは、人間の攻撃性や性欲の調節に関与していることが示唆されています。実際、アンドロゲンはマウス、ラット、霊長類など、いくつかの種の脳の構造を変化させ、性差を生み出す可能性があります。[ 14 ]エストロゲンをアンドロゲンに置き換えるトランスジェンダーホルモン補充療法を受けたトランスジェンダー男性の一般的な気分を示す最近の研究では、長期的な行動に大きな変化は見られませんでした。[ 15 ] [ 16 ] [ 17 ]
アンドロゲン単独で脳の構造を変化させる能力があることは多数の報告で示されているが[ 18 ]、どの神経解剖学的変化がアンドロゲンまたはエストロゲンに起因するかを特定することは、その変換の可能性のために困難である。
雄ラットを用いた神経新生(新しいニューロンの形成)研究から得られたエビデンスは、アンドロゲンが行動に及ぼす影響を解明する際に、海馬が有用な脳領域であることを示している。神経新生を検証するために、野生型の雄ラットと、アンドロゲン不応症(アンドロゲンに対する完全または部分的な不応性と外性器の欠損をもたらす遺伝的差異)の雄ラットを比較した。
両群の雄にブロモデオキシウリジン(BrdU)の神経注入を施し、神経新生を調べた。分析の結果、テストステロンとジヒドロテストステロンが成体海馬神経新生(AHN)を制御することが示された。野生型雄ラットでは成体海馬神経新生はアンドロゲン受容体を介して制御されていたが、TMF雄ラットでは制御されていなかった。活性化アンドロゲン受容体のAHNに対する役割をさらに試験するため、アンドロゲン受容体をめぐってテストステロンおよびジヒドロテストステロンと競合する抗アンドロゲン薬であるフルタミドとジヒドロテストステロンを正常雄ラットに投与した。ジヒドロテストステロンはBrdU細胞の数を増加させたが、フルタミドはこれらの細胞を阻害した。また、エストロゲンは効果がなかった。この研究は、アンドロゲンがAHNをどのように増加させるかを示している。[ 19 ]
研究者らは、軽度の運動がアンドロゲン合成にどのような影響を与え、それが成人海馬神経新生(AHN)におけるN-メチル-D-アスパラギン酸(NMDA)受容体の活性化を引き起こすのかについても調査しました。NMDAはカルシウムの流入を誘導し、AHNに極めて重要なシナプス可塑性をもたらします。
研究者らは、精巣摘出(ORX)(去勢)した雄ラットと偽去勢した雄ラットの両方にBrdUを注入し、新生細胞数の増加の有無を調べた。その結果、雄ラットの成人海馬新生(AHN)は、軽度の運動によって海馬におけるジヒドロテストステロンの合成が促進され、増加することが明らかになった。また、成人海馬新生はエストロゲン受容体の活性化によって増加したわけではないことが指摘された。[ 20 ]
アンドロゲン調節は、雄におけるうつ病の可能性を低下させます。思春期前の雄ラットにおいて、フルタミドを投与された新生児ラットは、対照ラットと比較して、うつ病様症状をより多く発現しました。
両群のラットに再びBrdUを注入し、生体組織内で細胞が増殖しているかどうかを観察した。これらの結果は、アンドロゲンの組織化が思春期前期の海馬神経新生にプラスの影響を与え、それがうつ病様症状の軽減につながる可能性を示している。[ 21 ]
社会的孤立は成人海馬神経新生を阻害する一方、正常なアンドロゲン調節は成人海馬神経新生を促進する。雄ラットを用いた研究では、テストステロンが社会的孤立を阻害し、その結果、海馬神経新生が恒常性(体内環境を安定に保つ調節)に達する可能性があることが示された。Brdu解析では、過剰なテストステロンは社会的孤立に対するこの阻害効果を増強しないことが示された。つまり、アンドロゲンの自然な循環レベルは、社会的孤立が成人海馬神経新生に及ぼす悪影響を打ち消すということである。[ 22 ]
女性特有の効果
アンドロゲンは、非ゲノム性でアンドロゲン受容体非依存性の経路を介して子宮筋層の弛緩に潜在的な役割を果たし、妊娠中の早産性子宮収縮を予防する可能性がある。[ 23 ]
アンドロゲン不応性
XY核型の胎児のアンドロゲンに対する反応能力が低下すると、不妊症やいくつかの形態のインターセックス状態など、いくつかの状態のいずれかが発生する可能性があります。
その他
特定の鳥類では、卵黄中のアンドロゲン濃度が、その後の社会的な優位性と正の相関関係にあることが報告されている。アメリカオオバンを参照のこと。
生物活性
アンドロゲンはアンドロゲン受容体(AR)に結合して活性化し、その生物学的効果の大部分を媒介します。
相対的な効力
あらゆる生物学的検査方法を考慮して決定( 1970年頃): [ 7 ]
| アンドロゲン | 効力(%) |
|---|---|
| テストステロン | 40 |
| 5α-ジヒドロテストステロン(DHT) | 100 |
| アンドロステンジオール | .0008 |
| アンドロステンジオン | .04 |
| デヒドロエピアンドロステロン | .02 |
| アンドロステロン | .06 |
5α-ジヒドロテストステロン(DHT)は、前立腺重量および管腔容積(上皮細胞機能刺激の指標)の正常維持において、テストステロンの2.4倍の効力を示した。一方、去勢後の前立腺細胞死の予防においては、DHTはテストステロンと同等の効力を示した。[ 24 ] 11-酸素化アンドロゲンの一種である11-ケトテストステロンは、テストステロンと同等の効力を有する。[ 25 ]
非ゲノム的作用
アンドロゲンは、古典的な核アンドロゲン受容体とは異なる膜アンドロゲン受容体を介してシグナルを伝達することもわかっています。 [ 26 ] [ 27 ] [ 28 ]
生化学

生合成
アンドロゲンはコレステロールから合成され、主に性腺(精巣と卵巣)と副腎で産生されます。精巣は卵巣よりもはるかに多くのアンドロゲンを産生します。テストステロンは、前立腺、肝臓、脳、皮膚でより強力なDHTに変換されます。
| セックス | 性ホルモン | 生殖期 | 血液生産率 | 性腺分泌率 | 代謝クリアランス率 | 基準範囲(血清レベル) | |
|---|---|---|---|---|---|---|---|
| モル濃度 | 質量濃度 | ||||||
| 男性 | アンドロステンジオン | – | 2.8 mg/日 | 1.6 mg/日 | 2200リットル/日 | 2.8~7.3 nmol/L | 80~210 ng/dL |
| テストステロン | – | 6.5 mg/日 | 6.2 mg/日 | 950リットル/日 | 6.9~34.7 nmol/L | 200~1000 ng/dL | |
| エストロン | – | 150μg/日 | 110μg/日 | 2050リットル/日 | 37~250ピコモル/リットル | 10~70 pg/mL | |
| エストラジオール | – | 60μg/日 | 50μg/日 | 1600リットル/日 | <37~210 pmol/L | 10~57 pg/mL | |
| エストロン硫酸塩 | – | 80μg/日 | 重要でない | 167リットル/日 | 600~2500ピコモル/L | 200~900 pg/mL | |
| 女性 | アンドロステンジオン | – | 3.2 mg/日 | 2.8 mg/日 | 2000リットル/日 | 3.1~12.2 nmol/L | 89~350 ng/dL |
| テストステロン | – | 190μg/日 | 60μg/日 | 500リットル/日 | 0.7~2.8 nmol/L | 20~81 ng/dL | |
| エストロン | 卵胞期 | 110μg/日 | 80μg/日 | 2200リットル/日 | 110~400ピコモル/リットル | 30~110 pg/mL | |
| 黄体期 | 260μg/日 | 150μg/日 | 2200リットル/日 | 310~660ピコモル/リットル | 80~180 pg/mL | ||
| 閉経後 | 40μg/日 | 重要でない | 1610リットル/日 | 22~230ピコモル/リットル | 6~60 pg/mL | ||
| エストラジオール | 卵胞期 | 90μg/日 | 80μg/日 | 1200リットル/日 | <37~360 pmol/L | 10~98 pg/mL | |
| 黄体期 | 250μg/日 | 240μg/日 | 1200リットル/日 | 699~1250ピコモル/リットル | 190~341 pg/mL | ||
| 閉経後 | 6μg/日 | 重要でない | 910リットル/日 | <37~140 pmol/L | 10~38 pg/mL | ||
| エストロン硫酸塩 | 卵胞期 | 100μg/日 | 重要でない | 146リットル/日 | 700~3600ピコモル/リットル | 250~1300 pg/mL | |
| 黄体期 | 180μg/日 | 重要でない | 146リットル/日 | 1100~7300ピコモル/リットル | 400~2600 pg/mL | ||
| プロゲステロン | 卵胞期 | 2mg/日 | 1.7 mg/日 | 2100リットル/日 | 0.3~3 nmol/L | 0.1~0.9 ng/mL | |
| 黄体期 | 25mg/日 | 24mg/日 | 2100リットル/日 | 19~45 nmol/L | 6~14 ng/mL | ||
注釈と出典 注記:循環血中のステロイドの濃度は、腺からの分泌速度、前駆体またはプレホルモンからステロイドへの代謝速度、そして組織によって抽出され代謝される速度によって決まります。ステロイドの分泌速度とは、単位時間あたりに腺から分泌される化合物の総量を指します。分泌速度は、経時的に腺からの静脈流出液を採取し、動脈血および末梢静脈血のホルモン濃度を差し引くことで評価されます。ステロイドの代謝クリアランス速度とは、単位時間あたりにホルモンが完全に除去された血液量と定義されます。ステロイドホルモンの産生速度とは、腺からの分泌やプロホルモンから目的のステロイドへの変換など、あらゆる供給源から血液中に化合物が流入する速度を指します。定常状態において、あらゆる供給源から血液中に流入するホルモンの量は、排出速度(代謝クリアランス速度)と血中濃度(産生速度 = 代謝クリアランス速度)の積に等しくなります。クリアランス率×濃度)。循環ステロイドプールへのプロホルモン代謝の寄与が小さい場合、生成率は分泌率に近似する。出典:テンプレートを参照。 | |||||||
代謝
医療用途
男性のテストステロン値低下(性腺機能低下症)は、テストステロン投与で治療できる場合があります。前立腺がんは、テストステロンの主要な供給源を除去する(精巣摘出術)か、アンドロゲンが受容体にアクセスするのを阻害する薬剤(抗アンドロゲン剤)で治療できる場合があります。
参照
参考文献
- ^ Moini J (2015).薬剤師技術者のための基礎薬理学. Cengage Learning. p. 338. ISBN 978-1-30-568615-1
アンドロゲンは、アンドロゲン受容体に結合して男性的な特徴の発達を刺激または制御する、通常はステロイドホルモンである天然または合成化合物の総称です
。 - ^ Gylys BA, Wedding ME (2017).医学用語体系:身体システムアプローチ. FA Davis. p. 82. ISBN 978-0-80-365868-4
男性的な特徴の発達を刺激する物質(通常はテストステロンやアンドロステロンなどのホルモン)の総称
。 - ^ 「一晩でニキビを自然に治す15の方法」 Fast Health Fitness、2016年5月17日。
- ^ a b Carlson N (2012年1月22日).行動生理学. 生殖行動. 第11版. ピアソン. p. 326. ISBN 978-0205239399。
- ^ 「アンドロゲン」 DIAsource. 2014年8月8日時点のオリジナルよりアーカイブ。 2013年6月26日閲覧。
- ^ a bアドリアアンセン BP、オーデ・アリンク SE、スウィンケルス DW、シュレーダー MA、スパン PN、スイープ FC、他。 (2024 年 1 月)。「小児における血清 11 酸素化アンドロゲンの基準間隔」(PDF)。欧州内分泌学ジャーナル。190 (1): 96–103 .土井: 10.1093/ejendo/lvae008。PMID 38243909。
- ^ a b Briggs MH, Brotherton J (1970年2月3日).ステロイド生化学と薬理学. ロンドン: アカデミック・プレス. ISBN 978-0-12-134650-8。
- ^アームストロングHL(2021年3月1日) 『性とセクシュアリティ百科事典:生物学、心理学、文化を理解する』[全2巻]。ブルームズベリー出版、USA。ISBN 979-8-216-14384-0
少量のテストステロンは腎臓の上にある副腎や卵巣からも分泌されます
。 - ^ Gilbert SF (2000). Developmental Biology (6th ed.). Sunderland, Massachusetts : Sinauer Associates . ISBN 978-0-87893-243-6。
- ^スティーブン・ナッセイ、サフラン・ホワイトヘッド(2001年)。サフラン・A・ホワイトヘッド、スティーブン・ナッセイ編著。『内分泌学:統合的アプローチ』オックスフォード:英国臓器研究所。ISBN 978-1-85996-252-7。
- ^ Singh R, Artaza JN, Taylor WE, Braga M, Yuan X, Gonzalez-Cadavid NF, Bhasin S (2006年1月). 「テストステロンは3T3-L1細胞における脂肪分化を阻害する:アンドロゲン受容体複合体のβ-カテニンおよびT細胞因子4との核移行は、標準的なWntシグナル伝達を迂回して脂肪分化転写因子のダウンレギュレーションを引き起こす可能性がある」 .内分泌学. 147 (1): 141– 154. doi : 10.1210/en.2004-1649 . PMC 4417624. PMID 16210377 .
- ^ Sinha-Hikim I, Taylor WE, Gonzalez-Cadavid NF, Zheng W, Bhasin S (2004年10月). 「ヒト骨格筋および培養筋サテライト細胞におけるアンドロゲン受容体:アンドロゲン処理によるアップレギュレーション」 . The Journal of Clinical Endocrinology and Metabolism . 89 (10): 5245– 5255. doi : 10.1210/jc.2004-0084 . PMID 15472231 .
- ^ Vlahopoulos S, Zimmer WE, Jenster G, Belaguli NS, Balk SP, Brinkmann AO, et al. (2005年3月). 「血清応答因子を介したアンドロゲン受容体のリクルートメントは筋原遺伝子の発現を促進する」 . The Journal of Biological Chemistry . 280 (9): 7786– 7792. doi : 10.1074/jbc.M413992200 . PMID 15623502 .
- ^ Cooke B, Hegstrom CD, Villeneuve LS, Breedlove SM (1998年10月). 「脊椎動物の脳の性分化:原理とメカニズム」. Frontiers in Neuroendocrinology . 19 (4): 323– 362. doi : 10.1006/frne.1998.0171 . PMID 9799588. S2CID 14372914 .
- ^ Irwig MS (2017年4月). 「トランスジェンダー男性に対するテストステロン療法」. The Lancet. Diabetes & Endocrinology . 5 (4): 301– 311. doi : 10.1016/S2213-8587(16)00036-X . PMID 27084565 .
- ^ Costantino A, Cerpolini S, Alvisi S, Morselli PG, Venturoli S, Meriggiola MC (2013年2月14日). 「テストステロン投与中および性別適合手術後の女性から男性への性転換者における性機能と気分に関する前向き研究」. Journal of Sex & Marital Therapy . 39 (4): 321– 335. doi : 10.1080/ 0092623X.2012.736920 . PMID 23470169. S2CID 34943756 .
- ^ Johnson JM, Nachtigall LB, Stern TA (2013年11月1日). 「男性のテストステロンレベルが気分に及ぼす影響:レビュー」. Psychosomatics . 54 (6): 509– 514. doi : 10.1016/j.psym.2013.06.018 . PMID 24016385 .
- ^ Zuloaga DG, Puts DA, Jordan CL, Breedlove SM (2008年5月). 「脳と行動の男性化におけるアンドロゲン受容体の役割:精巣女性化変異から学んだこと」 . Hormones and Behavior . 53 (5): 613– 626. doi : 10.1016/j.yhbeh.2008.01.013 . PMC 2706155. PMID 18374335 .
- ^ Hamson DK, Wainwright SR, Taylor JR, Jones BA, Watson NV, Galea LA (2013年9月). 「アンドロゲンは雄ラットの歯状回における成体ニューロンの生存をアンドロゲン受容体依存性メカニズムによって促進する」 .内分泌学. 154 (9): 3294– 3304. doi : 10.1210 /en.2013-1129 . hdl : 2429/63213 . PMID 23782943 .
- ^岡本 正之、北条 雄三、井上 健、松井 剛、川戸 誠、マキューエン BS、曽谷 浩(2012年8月)。「軽度の運動は海馬におけるジヒドロテストステロンを増加させ、アンドロゲンによる神経新生の媒介の証拠を提供する」。米国科学アカデミー紀要。109 ( 32 ) : 13100–13105。Bibcode : 2012PNAS..10913100O。doi : 10.1073 / pnas.1210023109。PMC 3420174。PMID 22807478。
- ^ Zhang JM, Tonelli L, Regenold WT, McCarthy MM (2010年8月). 「新生児期のフルタミド投与による海馬神経新生およびシナプス形成への影響は、思春期前雄ラットのうつ病様行動と相関する」 . Neuroscience . 169 (1): 544– 554. doi : 10.1016/j.neuroscience.2010.03.029 . PMC 3574794. PMID 20399256 .
- ^ Spritzer MD, Ibler E, Inglis W, Curtis MG (2011年11月). 「テストステロンと社会的孤立は雄ラットの歯状回における成体神経新生に影響を与える」 . Neuroscience . 195 : 180–190 . doi : 10.1016 /j.neuroscience.2011.08.034 . PMC 3198792. PMID 21875652 .
- ^ Makieva S , Saunders PT, Norman JE (2014). 「妊娠中のアンドロゲン:分娩における役割」 . Human Reproduction Update . 20 (4): 542– 559. doi : 10.1093/humupd/dmu008 . PMC 4063701. PMID 24643344 .
- ^ Wright AS, Thomas LN, Douglas RC, Lazier CB, Rittmaster RS (1996年12月). 「去勢ラットの前立腺における萎縮およびアポトーシスの予防におけるテストステロンとジヒドロテストステロンの相対的効力」. The Journal of Clinical Investigation . 98 (11): 2558– 2563. doi : 10.1172/JCI119074 . PMC 507713. PMID 8958218 .
- ^アドリアアンセン BP、オーデ・アリンク SE、スウィンケルス DW、シュローダー MA、スパン PN、スイープ FC、他。 (2024 年 1 月)。「小児における血清 11 酸素化アンドロゲンの基準間隔」(PDF)。欧州内分泌学ジャーナル。190 (1): 96–103 .土井: 10.1093/ejendo/lvae008。PMID 38243909。
- ^ Bennett NC, Gardiner RA, Hooper JD, Johnson DW, Gobe GC (2010年6月). 「アンドロゲン受容体シグナル伝達の分子細胞生物学」.国際生化学・細胞生物学誌. 42 (6): 813– 827. doi : 10.1016/j.biocel.2009.11.013 . PMID 19931639 .
- ^ Wang C, Liu Y, Cao JM (2014年9月). 「Gタンパク質共役受容体:ステロイドの非ゲノム作用における核外メディエーター」 . International Journal of Molecular Sciences . 15 (9): 15412– 15425. doi : 10.3390/ijms150915412 . PMC 4200746. PMID 25257522 .
- ^ Lang F, Alevizopoulos K, Stournaras C (2013年8月). 「腫瘍における膜アンドロゲン受容体の標的化」.治療標的に関する専門家の意見. 17 (8): 951– 963. doi : 10.1517/14728222.2013.806491 . PMID 23746222. S2CID 23918273 .