水の性質
 |
 | |||
| |||
 | |||
| 名前 | |||
|---|---|---|---|
| 推奨IUPAC名 水 | |||
| IUPAC体系名 オキシダン(一般的には使用されていない)[ 3 ] | |||
| その他の名前 | |||
| 識別子 | |||
| |||
3Dモデル(JSmol) | |||
| 3587155 | |||
| チェビ |
| ||
| チェムブル | |||
| ケムスパイダー |
| ||
| ドラッグバンク | |||
| EC番号 |
| ||
| 117 | |||
| ケッグ | |||
PubChem CID | |||
| RTECS番号 |
| ||
| ユニイ |
| ||
| |||
| |||
| プロパティ | |||
| H2お | |||
| モル質量 | 18.01528(33) g/モル | ||
| 外観 | ほぼ無色または白色の結晶性固体、わずかに青みがかったほぼ無色の液体、無色の気体[ 4 ] | ||
| 臭い | 無臭 | ||
| 密度 | |||
| 融点 | 0.00 °C (32.00 °F; 273.15 K) [ b ] | ||
| 沸点 | 99.98 °C (211.96 °F; 373.13 K) [ 17 ] [ b ] | ||
| 溶解度 | ハロアルカン、脂肪族・芳香族炭化水素、エーテルには溶けにくい。[ 8 ]カルボン酸塩、アルコール、ケトン、アミンには溶解性が向上する。メタノール、エタノール、プロパノール、イソプロパノール、アセトン、グリセロール、1,4-ジオキサン、テトラヒドロフラン、スルホラン、アセトアルデヒド、ジメチルホルムアミド、ジメトキシエタン、ジメチルスルホキシド、アセトニトリルとは混和する。ジエチルエーテル、メチルエチルケトン、ジクロロメタン、酢酸エチル、臭素とは部分的に混和する。 | ||
| 蒸気圧 | 3.1690キロパスカルまたは0.031276気圧(25℃)[ 9 ] | ||
| 酸性度( p Ka ) | 13.995 [ 10 ] [ 11 ] [ a ] | ||
| 塩基度(p K b) | 13.995 | ||
| 共役酸 | ヒドロニウムH 3 O + (pKa = 0) | ||
| 共役塩基 | 水酸化物OH – (pK b = 0) | ||
| 熱伝導率 | 0.6065 W/(m·K) [ 14 ] | ||
屈折率(nD ) | 1.3330 (20 °C) [ 15 ] | ||
| 粘度 | 0.890 mPa·s (0.890 cP ) [ 16 ] | ||
| 構造 | |||
| 六角 | |||
| C 2v | |||
| 曲がった | |||
| 1.8546 D [ 18 ] | |||
| 熱化学 | |||
熱容量(℃) | 75.385 ± 0.05 J/(mol・K) [ 17 ] | ||
| 69.95 ± 0.03 J/(mol・K) [ 17 ] | |||
標準生成エンタルピー(Δ f H ⦵ 298) | −285.83 ± 0.04 kJ/mol [ 8 ] [ 17 ] | ||
ギブスの自由エネルギー(Δ f G ⦵) | −237.24 kJ/モル[ 8 ] | ||
| 危険 | |||
| 労働安全衛生(OHS/OSH): | |||
主な危険 | |||
| NFPA 704(ファイアダイヤモンド) | |||
| 引火点 | 不燃性 | ||
| 関連化合物 | |||
その他の陰イオン | |||
関連溶剤 | |||
| 補足データページ | |||
| 水(データページ) | |||
特に記載がない限り、データは標準状態(25 °C [77 °F]、100 kPa)における材料のものです。 | |||
水(H 2 O)は極性無機化合物であり、室温では無味無臭の液体で、わずかに青みがかった色を除けばほぼ無色です。これまでで最も研究されている化合物であり[ 20 ]、「万能溶媒」[ 21 ]や「生命の溶媒」[ 22 ]と呼ばれています。地球の表面で最も豊富な物質であり[ 23 ] 、地球の表面で固体、液体、気体として存在する唯一の一般的な物質です。[ 24 ]また、宇宙で3番目に豊富な分子でもあります(分子状水素と一酸化炭素に次ぐ)。[ 23 ]
水分子は互いに水素結合を形成し、強い極性を持っています。この極性により、水は塩中のイオンを解離し、アルコールや酸などの他の極性物質と結合して溶解します。この水素結合により、水は多くの独特な性質を有しています。例えば、固体状態では液体状態よりも密度が低いこと、モル質量に対して比較的高い沸点(100℃)を持つこと、そして高い熱容量を持つことなどが挙げられます。
水は両性であり、溶液のpHに応じて酸または塩基の性質を示すことができる。+そしてOH−イオン。[ c ]両性イオンの性質に関連して、自己イオン化を起こす。活動の積、または近似的にH濃度は、+そしてOH−は定数なので、それぞれの濃度は互いに反比例する。[ 25 ]
物理的特性
水は化学式Hの化学物質である。2O ; 水分子1つには、 2つの水素原子 が1つの酸素原子に共有結合しています。[ 26 ]水は常温常圧下では無味無臭の液体です。液体の水は750nm付近の波長に弱い吸収帯を持ち、そのため青く見えます。[ 4 ]これは、白い内張りの浴槽や洗面台に水を満たした状態で容易に観察できます。氷河などの大きな氷結晶も青く見えます。
標準条件下では、水は主に液体であり、酸素族の他の類似の水素化物とは異なり、通常は気体です。水のこのユニークな性質は水素結合によるものです。水分子は常に互いに運動しており、水素結合は200フェムト秒(2×10−13秒)よりも速い時間スケールで絶えず破壊と再結合を繰り返しています。 [ 27 ]しかし、これらの結合は水の多くの特異な性質を生み出すのに十分な強さがあり、その一部は水を生命に不可欠なものにしています。
水、氷、蒸気
地球の大気と地表では、液体の状態が最も一般的であり、一般的に「水」という言葉で表現されます。固体の状態は氷と呼ばれ、一般的には角氷のような硬い結晶構造、または雪のような緩く集積した粒状結晶の構造をとります。一般的な六方晶系の氷のほか、結晶構造や非晶質構造の氷が知られています。気体の状態は水蒸気(または水蒸気)と呼ばれます。目に見える蒸気や雲は、空気中に浮遊する微細な水滴から形成されます。
水は超臨界流体を形成する。臨界温度は647 K、臨界圧力は22.064 MPaである。自然界では、これは極めて過酷な条件下でのみ稀に発生する。自然界で超臨界水が発生する可能性のある例としては、深海熱水噴出孔の最も高温の部分が挙げられる。この部分では、水は火山噴煙によって臨界温度まで加熱され、臨界圧力は噴出孔がある極深部の海水の重力によって発生する。この圧力は約2200メートルの深さで達する。これは海の平均深度(3800メートル)よりもはるかに浅い。[ 28 ]
熱容量と蒸発熱および融解熱

水は20℃で4184 J/(kg·K)(25℃で4182 J/(kg·K))という非常に高い比熱容量を持ち、これはヘテロ原子種の中でアンモニアに次いで2番目に高い値です。また、蒸発熱も高く(標準沸点で40.65 kJ/mol、2257 kJ/kg)、これらはいずれも分子間の広範な水素結合によるものです。これらの特異な特性により、水は気温の大きな変動を緩和することで地球の気候を穏やかに保っています。 1970年以降、気候システムに蓄えられた追加エネルギーの大部分は海洋に蓄積されています。[ 29 ]
水の比融解エンタルピー(一般的には潜熱として知られる)は0℃で333.55 kJ/kgです。氷を溶かすのに必要なエネルギー量は、氷を-160℃から融点まで温めるのと、同量の水を約80℃加熱するのとで同じです。一般的な物質の中で、これよりも高いのはアンモニアだけです。この特性により、氷河や流氷の氷は融解しにくくなります。機械式冷凍機の登場以前もそれ以降も、氷は食品の腐敗を防ぐために広く利用されており、現在も広く利用されています。
-10℃における氷の比熱容量は2030 J/(kg·K) [ 30 ]であり、100℃における水蒸気の比熱容量は2080 J/(kg·K)である。[ 31 ]
水と氷の密度

水の密度は1立方センチメートルあたり約1グラム(62ポンド/立方フィート)で、この関係はもともとグラムを定義するために使われました。[ 32 ]密度は温度とともに変化しますが、直線的ではありません。温度が上昇すると、密度は3.98℃(39.16°F)でピークに達し、その後減少します。[ 33 ]ほとんどの液体は熱膨張するため、密度は温度の関数としてのみ減少するため、最初の増加は異常です。0℃(32°F)から3.98℃(39.16°F)までの水やその他いくつかの液体で観測される増加[ d ]は、負の熱膨張として説明されます。通常の六角形の氷も液体の水よりも密度が低く、凍結すると水の密度は約9%減少します。[ 36 ] [ e ]

これらの特異な効果は、水素結合を介した水分子の非常に方向性のある結合によるものです。低温では、氷や液体の水は比較的低密度で低エネルギーの開いた格子構造をとります。0~4℃の温度上昇に伴い融解し、水素結合が切断されると、格子空隙の一部が水分子で満たされ、分子の密度が高まります。[ 33 ] [ 37 ]しかし、4℃を超えると熱膨張が支配的な効果となり、[ 37 ]沸点(100℃)付近の水は、4℃(39℉)の水よりも約4%密度が低くなります。[ 36 ] [ f ]
圧力が増加すると、氷は氷II、氷III、高密度非晶質氷(HDA)、超高密度非晶質氷(VHDA)など、液体の水よりも密度の高い他の多形へと変化する。 [ 38 ] [ 39 ]

地球上の多くの生命にとって、この特異な密度曲線と氷の密度が水より低いことは不可欠である。水の密度が氷点で最も高くなると、冬には表面の冷却によって対流混合が起こる。0 °Cに達すると、水域は下から凍りつき、そこにいるすべての生命が死滅する。[ 36 ]さらに、水は(熱容量が大きいため)優れた断熱材であるため、凍った湖の中には夏に完全に解けないものがある。[ 36 ]実際には、密度曲線の逆転によって地表温度が4 °C以下の安定した層構造が形成され、上に浮かぶ氷の層が下の水を断熱するため、[ 40 ]例えば中央シベリアのバイカル湖でさえ、冬には約1 mの厚さまでしか凍らない。一般に、十分に深い湖では、湖底の温度は年間を通じて約4 °C(39 °F)で一定に保たれる(図を参照)。[ 36 ]
塩水と氷の密度

海水の密度は、溶解した塩分濃度と温度によって決まります。氷は海に浮いていますが、そうでなければ海底から凍ってしまいます。しかし、海の塩分濃度は氷点を約1.9℃ [ 41 ]下げ(溶質を含む溶媒の凝固点降下による)、水の密度が最大となる温度を以前の凝固点である0℃まで下げます。そのため、海水では、氷点近くで水が冷たくなっても、冷たい水の下向きの対流が膨張によって妨げられません。海の氷点近くの冷たい水は沈み続けます。そのため、北極海のような冷たい海の底に生息する生物は、一般的に、凍った淡水湖や川の底よりも4℃も冷たい水の中で生息しています。
海水の表面が凍り始めると(通常の塩分濃度の海水の場合、-1.9 °C [ 41 ]、3.5%で)、形成される氷は実質的に塩分を含まず、密度は淡水の氷とほぼ同じです。この氷は表面に浮かび、「凍結した」塩分は、そのすぐ下の海水の塩分濃度と密度を高めます。このプロセスは、塩水排除と呼ばれます。この密度の高い塩水は対流によって沈み、入れ替わる海水も同じプロセスを経ます。これにより、表面に-1.9 °C [ 41 ]の実質的に淡水の氷が生成されます。形成される氷の下の海水の密度が増加すると、海水は海底に向かって沈んでいきます。大規模な塩水排除と冷たい塩水の沈降プロセスにより、極地からそのような水を運び去る海流が形成され、熱塩循環と呼ばれる地球規模の海流システムが形成されます。
混和性と凝縮

水は多くの液体と混ざり合い、エタノールもあらゆる割合で混ざります。水とほとんどの油は混ざり合わず、通常は上から密度が増加する層を形成します。これは極性を比較することで予測できます。水は比較的極性のある化合物であるため、エタノールやアセトンなどの極性の高い液体と混ざり合う傾向があります。一方、極性の低い化合物は炭化水素などの極性の低い液体と混ざらず、溶解性が低い傾向があります。
気体である水蒸気は、空気と完全に混ざります。一方、特定の温度で液体(または固体)と熱力学的に安定する最大水蒸気圧は、全大気圧に比べて比較的低くなります。たとえば、蒸気の部分圧が大気圧の 2% で、空気が 25 °C から冷却されて約 22 °C になると、水が凝結し始め、露点が決まり、霧または露が発生します。朝に霧が燃え尽きるのは、この逆のプロセスによります。室温で、たとえば熱いシャワーやお風呂を出すなどして湿度が上昇し、温度がほぼ同じままである場合、蒸気はすぐに相変化の圧力に達し、一般に蒸気と呼ばれる微細な水滴として凝結します。
飽和気体、つまり相対湿度100%の気体とは、空気中の水の蒸気圧が(液体の)水による蒸気圧と平衡状態にある状態です。水(または十分に冷たい氷)は、飽和空気にさらされても蒸発による質量減少は起こりません。空気中の水蒸気量が少ないため、相対湿度、つまり水蒸気による分圧と飽和分蒸気圧の比の方がはるかに有用です。相対湿度100%を超える蒸気圧は過飽和と呼ばれ、例えば上昇気流によって急激に空気が冷却された場合に発生します。[ g ]
蒸気圧

圧縮性
水の圧縮率は圧力と温度の関数である。0℃、つまり圧力ゼロの限界では、圧縮率は5.1 × 10 −10 Pa −1。圧力ゼロの限界では、圧縮率は最小値に達する。45℃付近で4.4 × 10 −10 Pa −1となり、その後温度上昇とともに再び増加する。圧力が増加すると圧縮率は低下し、0℃、100メガパスカル(1,000バール)で3.9 × 10 −10 Pa −1 。 [ 42 ]
水の体積弾性率は約2.2GPaである[ 43 ] 。非気体、特に水の圧縮率が低いため、しばしば非圧縮性であると想定される。水の圧縮率が低いということは、水深4キロメートル(2.5マイル)の深海において圧力が40MPaであっても、体積の減少はわずか1.8%にとどまることを意味する[ 43 ] 。
水氷の体積弾性率は0 Kで11.3 GPaから273 Kで8.6 GPaまでの範囲です。[ 44 ]温度の関数としての氷の圧縮率の大きな変化は、他の一般的な固体と比較して氷の熱膨張係数が比較的大きいことに起因します。
三重点
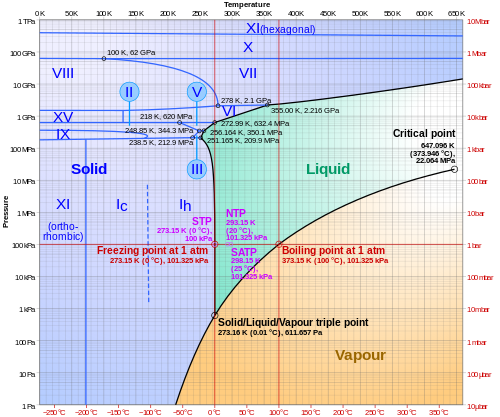
通常の固体、液体、気体の水が平衡状態で共存する温度と圧力は、水の三重点である。1954年以来、この点は温度の基本単位であるケルビンの定義に使用されてきた[ 45 ] [ 46 ]が、 2019年以降、ケルビンは水の三重点ではなく、ボルツマン定数を用いて定義されるようになった[ 47 ] 。
氷には多くの多形(形態)が存在するため、水には他にも三重点があり、それらは3つの氷の多形、または2つの氷と液体の多形が平衡状態にある。[ 46 ]ゲッティンゲンのグスタフ・ハインリヒ・ヨハン・アポロン・タマンは、 20世紀初頭に他のいくつかの三重点に関するデータを提示した。1960年代には、カムブらがさらに多くの三重点を記録した。[ 48 ] [ 49 ] [ 50 ]
| 安定平衡状態にある相 | プレッシャー | 温度 |
|---|---|---|
| 液体の水、氷、 水蒸気 | 611.657 Pa [ 51 ] | 273.16 K (0.01 °C) |
| 液体の水、氷I h、氷III | 209.9 MPa | 251 K (-22 °C) |
| 液体の水、氷III、氷V | 350.1 MPa | −17.0℃ |
| 液体の水、氷V、氷VI | 632.4 MPa | 0.16℃ |
| 氷 I h、氷 II、氷 III | 213 MPa | −35℃ |
| 氷II、氷III、氷V | 344 MPa | −24℃ |
| 氷II、氷V、氷VI | 626 MPa | −70℃ |
融点
氷の融点は標準気圧で0℃(32℉、273K)ですが、純粋な液体の水は、機械的に撹乱されない限り、それよりはるかに低い温度まで過冷却されても凍結しません。均質核生成点である約231K(-42℃、-44℉)まで、液体状態を維持できます。 [ 52 ]通常の六方晶氷の融点は、中程度の高圧下では、水素結合の安定化エネルギーが分子間反発力を超えるため、 0.0073 °C (0.0131 °F)/atm [ h ]または約0.5 °C (0.90 °F)/70 atm [ i ]だけわずかに低下するが[ 53 ] 、209.9 MPa (2,072 atm) を超えると氷が多形(氷の結晶状態を参照)に変化するため、融点は圧力とともに著しく上昇し、2.216 GPa (21,870 atm) で355 K (82 °C) に達する(氷VIIの三重点[ 54 ])。
電気的特性
電気伝導性
外因性イオンを含まない純水は優れた電子絶縁体ですが、「脱イオン水」であっても完全にイオンを含まないわけではありません。水は液体状態では自動イオン化を起こし、2つの水分子が1つの水酸化物アニオン(OH)を形成します。−)と1つのヒドロニウムカチオン(H3お+自己イオン化のため、常温では純粋な液体の水は半導体ゲルマニウムと同等の固有電荷キャリア濃度を持ち、半導体シリコンよりも3桁も高い固有電荷キャリア濃度を持ちます。そのため、電荷キャリア濃度に基づくと、水は完全な誘電体や電気絶縁体ではなく、イオン電荷の限られた伝導体であると考えられます。[ 55 ]
水は非常に優れた溶媒であるため、ほとんどの場合、何らかの溶質(多くの場合、塩)が溶けています。水にそのような不純物がほんの少しでも含まれていると、イオンが電荷を運びやすくなり、水ははるかに容易に電気を伝導するようになります。
水の理論的な最大電気抵抗率は、25℃で約18.2 MΩ·cm(182 kΩ ·m)であることが知られています。 [ 56 ]この数値は、例えば半導体製造工場で使用されている逆浸透膜、超濾過、脱イオン化超純水システムで一般的に見られる値とよく一致しています。塩分や酸の汚染物質の濃度が1兆分の1(ppt)を超えると、超純水であっても抵抗率は最大数kΩ·m低下し始めます。
純水では、高感度機器は25.00 °Cで0.05501 ± 0.0001 μS / cmという非常にわずかな電気伝導率を検出できます。 [ 56 ]水は電気分解して酸素と水素ガスにすることもできますが、溶解したイオンがない場合、電流はほとんど伝導しないため、非常に遅いプロセスになります。氷では、主な電荷キャリアはプロトンです(プロトン伝導体を参照)。[ 57 ]氷は以前は1 × 10氷 の電気伝導率は、氷の表面欠陥によるものであると考えられており、表面欠陥がなければ、氷は測定できないほど小さい電気伝導率を持つ絶縁体となります。 [ 33 ]
極性と水素結合

水の重要な特徴の一つは、その極性です。酸素原子の頂点から2つの水素原子が曲がった分子構造をしています。酸素原子はまた、2つの孤立電子対を持っています。孤立電子対に起因するとされる効果の一つは、H–O–H気相の曲がり角が104.48° [ 58 ]であり、これは典型的な四面体角109.47°よりも小さいことです。孤立電子対は、水素原子にシグマ結合した電子よりも酸素原子に近いため、より多くの空間を必要とします。孤立電子対の反発力が増すと、O–H結合は互いに近づきます。[ 59 ]
水の構造上のもう一つの帰結は、水が極性分子であるということです。電気陰性度の差により、結合双極子モーメントは各HからOへと向かい、酸素は部分的に負に、各水素は部分的に正になります。大きな分子双極子は、2つの水素原子の間の領域から酸素原子へと向かいます。電荷の差により、水分子は凝集します(相対的に正の領域が相対的に負の領域に引き寄せられます)。この引力、すなわち水素結合は、水の溶媒特性など、多くの特性を説明しています。[ 60 ]
水素結合は水分子自体の共有結合に比べると比較的弱い引力ですが、水のいくつかの物理的特性に関与しています。これらの特性には、比較的高い融点と沸点が含まれます。水分子間の水素結合を切断するには、より多くのエネルギーが必要です。対照的に、硫化水素(H2S)は、硫黄の電気陰性度が低いため、水素結合が非常に弱い。H2硫化水素は水の約2倍のモル質量を持つにもかかわらず、室温では気体です。水分子間の結合が過剰であるため、液体の水は大きな比熱容量を持ちます。この高い比熱容量は、水に優れた蓄熱媒体(冷却剤)や熱シールドとして機能します。
凝集と接着

水分子は、水分子間の水素結合の集合的な作用により、互いに接近した状態(凝集力)を保っています。これらの水素結合は常に切断され、異なる水分子との新たな結合が形成されますが、液体の水サンプル中においては常に、分子の大部分がこのような結合によって保持されています。[ 61 ]
水は極性を持つため、高い接着性も備えています。清潔で滑らかなガラス上では、ガラスと水分子間の分子間力(接着力)が凝集力よりも強いため、水は薄い膜を形成します。生物細胞や器官では、水は親水性の膜やタンパク質表面、つまり水に強く引きつけられる表面と接触しています。アーヴィング・ラングミュアは親水性表面間に強い反発力があることを観察しました。親水性表面を脱水する、つまり強く保持された水和水層を除去するには、水和力と呼ばれるこれらの力に逆らう大きな作業を行う必要があります。これらの力は非常に大きいですが、ナノメートル以下になると急速に減少します。[ 62 ]これらは生物学において、特に細胞が乾燥雰囲気にさらされたり細胞外凍結によって脱水状態になったりする際に重要です。[ 63 ]

表面張力

水は25℃で71.99mN/mという非常に高い表面張力を持っています[ 64 ]。これは水分子間の水素結合の強さによるものです[ 65 ] 。これにより昆虫は水上を歩くことができます[ 65 ] 。
毛細管現象
水は強い凝集力と接着力を持っているため、毛細管現象を起こします。[ 66 ]水素結合と接着による強い凝集力により、樹木は100メートル以上も水を運ぶことができます。[ 65 ]


溶媒としての水

水は高い誘電率を有するため、優れた溶媒です。 [ 67 ]水によく溶ける物質は親水性(「親水性」)物質と呼ばれ、水によく溶けない物質は疎水性(「疎水性」)物質と呼ばれます。[ 68 ]物質が水に溶けるかどうかは、水分子同士が引き合う強い引力に匹敵するか、あるいはそれ以上の力を持つかどうかによって決まります。もし物質がこれらの強い分子間力を克服できない性質を持つ場合、分子は水から沈殿します。一般的な誤解とは異なり、水と疎水性物質は「反発」せず、疎水性表面の水和はエネルギー的には有利ですが、エントロピー的には有利ではありません。
イオン性化合物または極性化合物が水に入ると、水分子に囲まれます(水和)。水分子は比較的小さいため(約3オングストローム)、多数の水分子が溶質1分子を取り囲むことができます。水の部分的に負の双極子端は、溶質の正に帯電した成分に引き寄せられ、正の双極子端は逆に引き寄せられます。
一般的に、酸、アルコール、塩などのイオン性および極性物質は水に比較的溶けやすく、油脂などの非極性物質は溶けにくいです。非極性分子が水中に留まるのは、水分子が非極性分子と ファンデルワールス相互作用を起こすよりも、互いに水素結合する方がエネルギー的に有利だからです。
イオン性溶質の例としては食塩が挙げられます。塩化ナトリウムNaClはNa+陽イオンとCl−陰イオンはそれぞれ水分子に囲まれています。イオンは結晶格子から容易に溶液中に運ばれます。非イオン性溶質の例としては、砂糖が挙げられます。水の双極子は砂糖分子の極性領域(OH基)と水素結合を形成し、砂糖を溶液中に運び去ります。
量子トンネル効果
水中の量子トンネルダイナミクスは1992年に早くも報告されている。当時、置換基水モノマーの内部回転によって弱い水素結合を破壊・再生する運動があることが知られていた。[ 69 ] 2016年3月18日には、水六量体中の水素結合が量子トンネル効果によって切断できることが報告された。これまでに報告されていた水中のトンネル効果とは異なり、これは2つの水素結合の協調的な切断を伴うものであった。[ 70 ]同年後半には、水分子の量子トンネル効果の発見が報告された。[ 71 ]
電磁吸収
水は可視光線、近紫外線、遠赤外線に対しては比較的透明ですが、紫外線、赤外線、マイクロ波の大部分は吸収します。ほとんどの光受容体と光合成色素は、水をよく透過する光スペクトルの部分を利用します。電子レンジは、マイクロ波放射に対する水の不透明さを利用して、食品内の水分を加熱します。水が水色に見えるのは、可視光線の赤色部分の吸収が弱いためです。[ 4 ] [ 72 ]
構造
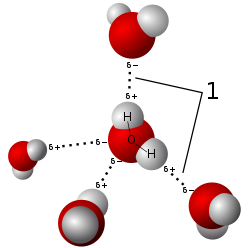
水分子 1 個は、酸素の孤立電子対を使って 2 つの結合を受け入れ、2 つの水素原子を供与できるため、最大 4 つの水素結合に参加できます。フッ化水素、アンモニア、メタノールなどの他の分子も水素結合を形成できます。ただし、これらの分子は 4 つの水素結合を形成できないため、水で観察されるような異常な熱力学的、運動学的、または構造的特性を示しません。水素原子を供与または受容できないか、かさ高い残基に立体効果があります。水中では、4 つの水素結合により分子間四面体構造が形成され、それによって開放構造と 3 次元結合ネットワークが形成され、4 °C 以下に冷却すると密度が異常に低下します。この繰り返される、絶えず再編成される単位は、液体全体に広がる 3 次元ネットワークを定義します。この見解は中性子散乱研究とコンピューター シミュレーションに基づいており、氷構造中の水分子の明確な四面体配列を考慮すると納得できます。
しかし、水の構造については別の理論が存在する。2004年、ストックホルム大学から発表された物議を醸した論文では、液体状態の水分子は通常4つではなく2つの分子とのみ結合し、鎖状や環状構造を形成すると示唆された。「水の弦理論」(物理学の弦理論と混同しないように)という造語が生まれた。これらの観察は、個々の酸素原子の局所的な環境を調べたX線吸収分光法に基づいていた。[ 73 ]
分子構造
2つの孤立電子対が酸素原子に及ぼす反発作用により、水は直線ではなく曲がった分子構造となり[ 74 ] 、極性を持つ。水素-酸素-水素の角度は104.45°で、理想的なsp 3混成の109.47°よりも小さい。原子価結合理論によれば、酸素原子の孤立電子対は物理的に大きく、そのため酸素原子と水素原子の結合よりも多くの空間を占める。[ 75 ]分子軌道理論による説明(ベントの法則)によれば、酸素原子の非結合混成軌道のエネルギーを下げ(s性を高めてp性を低くする)、それに応じて水素原子に結合した酸素原子の混成軌道のエネルギーを上げる(p性を高めてs性を低くする)と、占有分子軌道のエネルギーを下げるという正味の効果がある。これは、酸素原子の非結合混成軌道のエネルギーは酸素原子の孤立電子対のエネルギーに完全に寄与するのに対し、酸素原子の他の2つの混成軌道のエネルギーは結合軌道のエネルギーに部分的にしか寄与しない(寄与の残りは水素原子の1s軌道から来る)ためである。
化学的性質
自己イオン化
液体の水では自己イオン化が起こり、ヒドロニウムイオンと水酸化物イオンが生成されます。
この反応の平衡定数は水のイオン積として知られ、約10の値を持つ。25℃で-14 。中性pHでは、水酸化物イオン( OH−)は(溶媒和)水素イオン(H+)であり、 25℃では10 −7 mol L −1に近い値を示す。 [ 76 ]他の温度での値についてはデータページを参照のこと。
熱力学的平衡定数は、水を含むすべての生成物と反応物の 熱力学的活性の商です。
しかし、希薄溶液の場合、H 3 O +やOH -などの溶質の活量はその濃度で近似され、溶媒H 2 Oの活量は1で近似されるため、単純なイオン積が得られる。
地球化学
長期間にわたる水と岩石の相互作用は、通常、風化と水浸食(岩石や鉱物を土や堆積物に変える物理的プロセス)を引き起こします。しかし、特定の条件下では、水との化学反応も起こり、交代作用(鉱物水和)を引き起こします。交代作用は岩石の化学的変化の一種で、粘土鉱物を生成します。また、ポルトランドセメントが硬化する際にも起こります。
水氷は、その広大な結晶格子に埋め込まれる様々な小さな分子と、包接化合物(包接水和物)を形成することがあります。その中で最も有名なのは、メタン包接化合物(4CH )です。4·23時間2O、海底に自然に大量に存在します。
自然界の酸性度
雨は一般的に弱酸性で、二酸化炭素より強い酸が含まれていない場合、pHは5.2〜5.8です。[ 77 ]空気中に多量の窒素酸化物と硫黄酸化物が存在する場合、それらも雲や雨滴に溶解し、酸性雨を生成します。
同位体置換体
水素と酸素にはそれぞれ複数の同位体が存在し、水には複数の同位体が存在することが知られています。ウィーン標準平均海洋水は、現在の水同位体の国際標準です。天然に存在する水は、ほぼ完全に中性子を含まない水素同位体である水素同位体水素原子で構成されています。重水素(2HまたはD)、中性子1個を持つ水素同位体であり、20京分の1未満にはトリチウム(3HまたはT)は中性子を2つ持ちます。酸素には3つの安定同位体があり、16Oは99.76%存在し、17Oは0.04%、18水分子の0.2%に含まれるO。[ 78 ]
重水素酸化物、D2Oは、密度が高いため重水とも呼ばれます。原子炉では中性子減速材として使用されます。トリチウムは放射性で、半減期は4500日です。THOは自然界には微量しか存在せず、主に大気中の宇宙線誘起核反応によって生成されます。水素原子1個と重水素原子1個を含む水HDOは、通常の水中に低濃度(約0.03%)で自然に存在し、Dは2Oははるかに低い量(0.000003%)であり、そのような分子は原子が再結合する際に一時的なものとなります。
Hの最も顕著な物理的差異は2OとD2Oは、単純な比質量の違い以外にも、凝固や沸騰、その他の運動学的効果など、水素結合の影響を受ける性質を伴います。これは、重水素の原子核が陽子の2倍の重さであるため、結合エネルギーに顕著な差が生じるためです。沸点の差により、同位体同位体は分離可能です。Hの自己拡散係数は225℃でのOはDの値より23%高い2O . [ 79 ]水分子は互いに水素原子を交換するため、低純度の重水中では純粋な一酸化二水素Dよりも重水素(DOH)がはるかに多く見られます。2お。
純粋に単離されたDの摂取2Oは生化学的プロセスに影響を及ぼす可能性があり、大量に摂取すると腎臓や中枢神経系の機能に障害を及ぼす。少量であれば悪影響なく摂取できる。人間は一般的に味の違いに気づかないが[ 80 ] 、灼熱感[ 81 ]や甘味[ 82 ]を感じることがある。毒性が現れるには、非常に大量の重水を摂取する必要がある。しかし、ネズミは重水の匂いでそれを避けることができ、多くの動物にとって重水は有毒である[ 83 ] 。
軽水とは、重水素含有量が標準の155 ppmレベル以下に低減された重水素減少水 (DDW) を指します。
発生
水は地球上で最も豊富な物質であり、また宇宙では水素に次いで3番目に豊富な分子である。2およびCO。[ 23 ]地球の質量の0.23 ppmは水であり、地球上の水量1.38 × 10の97.39%は水です。9 km 3は海洋中に存在します。 [ 84 ]
水は、太陽系の外縁部、つまり霜線と呼ばれる地点よりも外側の領域ではるかに多く存在し、その領域では太陽からの放射が弱すぎて、固体および液体の水(およびメタンやアンモニアなど、比較的融点の低い他の元素や化合物)を蒸発させることができない。太陽系の内側の惑星、小惑星、衛星は、ほぼ完全に金属とケイ酸塩でできている。その後、水は、まだ知られていないメカニズムによって太陽系の内側に運ばれてきたが、そのメカニズムは、はるかに多くの水の氷を含む外縁部から水を運んできた小惑星や彗星の衝突ではないかと考えられている。[ 85 ]霜線の内側と外側にある惑星の違いは顕著である。地球の質量の0.000023%は水であるが、土星の衛星テティスは、ほぼ完全に水でできている。[ 86 ]
反応
酸塩基反応
水は両性である。化学反応において酸としても塩基としても作用する能力がある。[ 87 ]ブレンステッド・ローリーの定義によれば、酸は陽子(H+)供与体であり、塩基はプロトン受容体である。[ 88 ]より強い酸と反応すると水は塩基として作用し、より強い塩基と反応すると酸として作用する。[ 88 ]例えば、水はH+塩酸が形成されるときにHClからイオンが生成します。
アンモニアとの反応では、NH3水はHを供給します+イオンとなり、酸として作用します。
水中の酸素原子は2つの孤立電子対を持っているため、水はルイス酸との反応においてしばしばルイス塩基、すなわち電子対供与体として作用します。また、ルイス塩基とも反応し、電子対供与体と水の水素原子との間に水素結合を形成します。HSAB理論では、水は弱硬酸と弱硬塩基の両方として説明され、他の硬種と優先的に反応することを意味します。
弱酸または弱塩基の塩を水に溶かすと、水によって塩が部分的に加水分解され、対応する塩基または酸が生成され、石鹸と重曹の水溶液のpH が塩基性になります。
配位子化学

水はルイス塩基の性質を持つため、遷移金属錯体ではよく使われる配位子であり、その例としてはFe (H2O)2+ 6過レニウム酸は、レニウム中心に配位した2つの水分子を含む。固体水和物では、水は配位子となるか、単に骨格内に留まるか、あるいはその両方となる。したがって、FeSO4·7時間2Oは[Fe(H 2 O) 6 ] 2+中心と1つの「格子水」から構成されています。水は典型的には単座配位子であり、中心原子と1つの結合のみを形成します。 [ 89 ]
有機化学
水は硬い塩基であるため、有機カルボカチオンと容易に反応する。例えば、水和反応では、ヒドロキシル基(OH−)と酸性プロトンが、炭素-炭素二重結合で結合した2つの炭素原子に付加され、アルコールが生成されます。有機分子に水が加わることで分子が2つに切断される反応を加水分解といいます。加水分解の代表的な例としては、脂肪の鹸化、タンパク質および多糖類の消化が挙げられます。水は、 S N 2置換反応やE2脱離反応においても脱離基となる可能性があり、後者は脱水反応と呼ばれます。
酸化還元反応における水
水には酸化状態+1の水素と酸化状態-2の酸素が含まれています。[ 90 ]水は水素化物、アルカリ金属、一部のアルカリ土類金属などの化学物質を酸化します。[ 91 ] [ 92 ]アルカリ金属が水と反応する例は次のとおりです。[ 93 ]
アルミニウムやベリリウムなどの他の反応性金属も水によって酸化されますが、その酸化物は金属に付着して受動的な保護層を形成します。[ 94 ]鉄の錆びは鉄と水の間の反応ではなく、水に溶解した鉄と酸素の間の反応であることに注意してください。 [ 95 ]
水は酸化されて酸素ガスを放出するが、たとえ還元電位がOの電位よりも高かったとしても、水と反応する酸化剤はほとんどない。2/H2O . このような反応のほとんどすべてには触媒が必要です。[ 96 ]水の酸化の例は次のとおりです。
電解
水は電流を流すことで、その構成要素である水素と酸素に分解することができます。[ 97 ]このプロセスは電気分解と呼ばれます。陰極の半反応は次のようになります。
陽極の半反応は次のようになります。
生成されたガスは泡となって表面に浮上し、そこで回収するか、あるいは水面上で炎を上げて点火することもできます。純水の電気分解に必要な電位は、25℃で1.23Vです。[ 97 ]実際の電気分解では、作動電位は1.48V以上です。
歴史
ヘンリー・キャベンディッシュは1781年に水が酸素と水素で構成されていることを証明しました。 [ 98 ]電気分解による水の水素と酸素への最初の分解は、 1800年にイギリスの化学者ウィリアム・ニコルソンとアンソニー・カーライルによって行われました。[ 98 ] [ 99 ] 1805年にジョゼフ・ルイ・ゲイ=リュサックとアレクサンダー・フォン・フンボルトは水が水素2つと酸素1つで構成されていることを証明しました。[ 100 ]
ギルバート・ニュートン・ルイスは1933年に純粋な重水の最初のサンプルを単離した。[ 101 ]
水の性質は、歴史的に様々な温度尺度を定義するために用いられてきました。特に、ケルビン、摂氏、ランキン、華氏といった温度尺度は、水の凝固点と沸点によって定義されてきました。また、あまり一般的ではないデリスル、ニュートン、レオミュール、レーマーといった温度尺度も同様に定義されていました。水の三重点は、今日ではより一般的に用いられている標準温度です。
命名法
水のIUPACでの正式な名称はオキシダンまたは単に水[ 102 ]、あるいは他の言語での同義語であるが、この分子を記述するために使用できる他の体系的な名称も存在する。オキシダンは、置換基命名法によって水の誘導体を命名する際に使用される単核親水素化物の名前としてのみ使用されることを意図している。[ 103 ]これらの誘導体には、一般的に他の推奨名がある。例えば、-OH基にはオキシダニルよりもヒドロキシルという名称が推奨される。オキサンという名称は、テトラヒドロピランとしても知られる環状エーテルの名称であるため、この目的には不適切であるとIUPACによって明示的に言及されている。[ 3 ] [ 104 ]
水の最も単純な体系名は「酸化水素」です。これは、過酸化水素、硫化水素、重水などの関連化合物に類似しています。I型イオン性二元化合物の化学命名法を用いると、水は「一酸化水素」という名称になりますが、[ 105 ]これは国際純正応用化学連合(IUPAC)が発行する名称には含まれていません。[ 102 ]別名として「二酸化水素」がありますが、これは水の名称としてはあまり使われておらず、主に「二酸化水素」のパロディで使用されています。
水のその他の体系的な名称には、酸と塩基の名前を用いたヒドロキシ酸、ヒドロキシル酸、水酸化水素などがある。[ j ]これらの珍しい名称はどれも広くは使われていない。水分子の分極形態であるH+おお−は、 IUPAC命名法ではハイドロオキシドとも呼ばれます。 [ 106 ]
水物質は、物質の相(液体の水、水蒸気、何らかの形の氷、または混合物の成分)を特定したくない場合にH 2 Oに対して使用されるまれな用語ですが、水という用語はこの一般的な意味でも使用されます。
二水素化酸素は水を表す別の言い方ですが、現代の用法では「水素化物」という用語はイオン化合物(水ではない)に限定されることがよくあります。
参照
脚注
- ^有機化学で主に水のpKa 値としてよく引用される15.7という値は誤りである。 [ 12 ] [ 13 ]
- ^ a b較正に使用されるウィーン標準平均海洋水(VSMOW)は、273.150089(10)K(0.000089(10)°C)で融解し、373.1339 K(99.9839°C)で沸騰します。他の同位体組成は、わずかに異なる温度で融解または沸騰します。
- ^ H+Hを表す3お+(H2O)nそしてより複雑なイオンが形成されます。
- ^負の熱膨張は溶融シリカでも観測される。 [ 34 ]また、かなり純粋なシリコンは、約18ケルビンから120ケルビンの間の温度で負の熱膨張係数を示す。 [ 35 ]
- ^凍結すると膨張する他の物質としては、シリコン(融点1,687 K(1,414 °C; 2,577 °F))、ガリウム(融点303 K(30 °C; 86 °F)、ゲルマニウム(融点1,211 K(938 °C; 1,720 °F))、ビスマス(融点545 K(272 °C; 521 °F))
- ^ (1-0.95865/1.00000) × 100% = 4.135%
- ^理想気体の法則から生じる断熱冷却。
- ^出典では0.0072°C/atmとされている。しかし、著者は1気圧を1,000,000 dynes/cm 2(1気圧)と定義している。標準的な気圧の定義である1,013,250 dynes/cm 2を用いると、0.0073°C/atmとなる。
- ^ 0.5/0.0073 = 68.5 という事実を使用します。
- ^水は両性(酸としてもアルカリとしても反応できる)であるため、酸と塩基の両方の名前が存在します。
参考文献
注記
- ^ De Leon, N. 「分子化合物の命名」 . Chemistry 101 Class Notes . Indiana University Northwest. 2018年9月24日時点のオリジナルよりアーカイブ。 2018年10月1日閲覧。
これらの化合物には、一般名(例:H 2 Oは「水」)が付けられている場合もあれば、体系名(例:H 2 O、一酸化二水素)が付けられている場合もあります。
- ^ "hydrol" . Merriam-Webster . 2017年8月13日時点のオリジナルよりアーカイブ。 2019年4月21日閲覧。
- ^ a b Leigh、Favre、Metanomski 1998、p.99。
- ^ a b c Braun, Charles L.; Smirnov, Sergei N. (1993-08-01). 「なぜ水は青いのか?」(PDF) . Journal of Chemical Education . 70 (8): 612. Bibcode : 1993JChEd..70..612B . doi : 10.1021/ed070p612 . ISSN 0021-9584 . 2019年12月1日時点のオリジナルよりアーカイブ(PDF) . 2018年8月9日閲覧.
- ^ a b c田中正治; ジラード・G; デイビス・R; プウト・A; ビグネル・N. (2001年8月). 「最近の実験報告に基づく0℃~40℃における水の密度に関する推奨表」. Metrologia . 38 (4): 301– 309. Bibcode : 2001Metro..38..301T . doi : 10.1088/0026-1394/38/4/3 .
- ^ Lemmon, Eric W.; Bell, Ian H.; Huber, Marcia L.; McLinden, Mark O. (1997). 「流体システムの熱物理的特性」. Linstrom, PJ; Mallard, WG (編). NIST Chemistry WebBook, NIST Standard Reference Database Number 69.米国国立標準技術研究所. doi : 10.18434/T4D303 . 2023年10月23日時点のオリジナルよりアーカイブ。 2023年10月17日閲覧。
- ^ Lide 2003、「氷と過冷却水の性質」第6節。
- ^ a b c Anatolievich, Kiper Ruslan. 「物質の性質:水」 . 2014年6月2日時点のオリジナルよりアーカイブ。 2014年6月1日閲覧。
- ^ Lide 2003、「0~370℃における水の蒸気圧」第6節。
- ^ Lide 2003、第8章:無機酸と塩基の解離定数。
- ^ワインガートナーら。 2016、p. 13.
- ^ 「水のpKaとは?」カリフォルニア大学デービス校2015年8月9日. 2016年2月14日時点のオリジナルよりアーカイブ。 2016年4月9日閲覧。
- ^ Silverstein, Todd P.; Heller, Stephen T. (2017年4月17日). 「学部課程におけるpKa値:水の真のpKaとは?」. Journal of Chemical Education . 94 (6): 690– 695. Bibcode : 2017JChEd..94..690S . doi : 10.1021/acs.jchemed.6b00623 .
- ^ラミレス、マリア LV;デ・カストロ、カルロス・A・ニエト、長坂、祐知。長島章アッサエル、マーク J.ウィリアム A. ウェイクハム (1995-05-01)。 「水の熱伝導率の標準参考データ」。物理化学参照データのジャーナル。24 (3): 1377–1381 . Bibcode : 1995JPCRD..24.1377R。土井: 10.1063/1.555963。ISSN 0047-2689。
- ^ Lide 2003、8—水溶液の濃縮特性:密度、屈折率、凝固点降下、粘度。
- ^ Lide 2003、6.186。
- ^ a b c d水in Linstrom, Peter J.; Mallard, William G. (eds.); NIST Chemistry WebBook、NIST 標準参照データベース番号 69、国立標準技術研究所、ゲイザースバーグ (MD)
- ^ Lide 2003、9—双極子モーメント。
- ^ GHS: PubChem 962 2023年7月28日アーカイブ、Wayback Machineにて
- ^グリーンウッド&アーンショー 1997年、620ページ。
- ^ 「水、万能溶媒」(ウェブサイト)。アメリカ合衆国:米国地質調査所。2019年10月22日。2021年12月1日時点のオリジナルよりアーカイブ。2020年12月15日閲覧。
- ^ Reece et al. 2013、48頁。
- ^ a b cワインガートナーら。 2016、p. 2.
- ^リース他 2013年、44頁。
- ^ 「自己プロトリシス定数」 . IUPAC化学用語集. IUPAC. 2009. doi : 10.1351/goldbook.A00532 . ISBN 978-0-9678550-9-7. 2019年4月29日時点のオリジナルよりアーカイブ。2018年8月9日閲覧。
- ^キャンベル、ウィリアムソン、ヘイデン、2006 年。
- ^ Smith, Jared D.; Christopher D. Cappa; Kevin R. Wilson; Ronald C. Cohen; Phillip L. Geissler; Richard J. Saykally (2005). 「液体水中における温度依存的な水素結合再配置の統一的記述」 . Proc. Natl. Acad. Sci. USA . 102 (40): 14171– 14174. Bibcode : 2005PNAS..10214171S . doi : 10.1073 / pnas.0506899102 . PMC 1242322. PMID 16179387 .
- ^出口 茂; 辻井 薫 (2007-06-19). 「超臨界水:ソフトマターにとって魅力的な媒体」.ソフトマター. 3 (7): 797– 803. Bibcode : 2007SMat....3..797D . doi : 10.1039/b611584e . ISSN 1744-6848 . PMID 32900070 .
- ^ Rhein, M. ; Rintoul, SR (2013). 「3:観測:海洋」(PDF) . IPCC WGI AR5(報告書). p. 257. 2020年10月16日時点のオリジナルよりアーカイブ(PDF) . 2017年12月22日閲覧。
海洋温暖化は地球全体のエネルギー変化インベントリの大部分を占めている。1971年から2010年までの地球のエネルギーインベントリの増加のうち、海洋温暖化は約93%を占め(高い確信度)、表層(0~700 m)の海洋温暖化は全体の約64%を占めている。残りのエネルギー変化は、氷(北極海の海氷、氷床、氷河を含む)の融解と大陸および大気の温暖化によるものである。
- ^ Lide 2003、第6章「氷と過冷却水の性質」。
- ^ Lide 2003、6 .温度と圧力の関数としての水と蒸気の特性。
- ^ "度量衡に関する法令" . 1795 年 4 月 7 日。2013年 2 月 25 日のオリジナルからアーカイブ。2016 年8 月 3 日に取得。
グラム
、絶対量の純粋な安全性、パーティーデュメートル、ガラスフォンダンテの温度。
- ^ a b cグリーンウッド&アーンショー 1997年、625ページ。
- ^ Shell, Scott M.; Debenedetti, Pablo G.; Panagiotopoulos, Athanassios Z. (2002). 「液体シリカにおける分子構造秩序と異常性」(PDF) . Phys. Rev. E. 66 ( 1) 011202. arXiv : cond-mat/0203383 . Bibcode : 2002PhRvE..66a1202S . doi : 10.1103/PhysRevE.66.011202 . PMID 12241346. S2CID 6109212. 2016年6月4日時点のオリジナル(PDF)からアーカイブ。 2009年7月7日閲覧。
- ^ Bullis, W. Murray (1990). 「第6章」 . O'Mara, William C.、Herring, Robert B.、Hunt, Lee P. (編). 『半導体シリコン技術ハンドブック』 . Park Ridge, New Jersey: Noyes Publications. p. 431. ISBN 0-8155-1237-6. 2024年2月4日時点のオリジナルよりアーカイブ。2010年7月11日閲覧。
- ^ a b c d eパールマン、ハワード. 「水の密度」 . USGS水科学スクール. 2016年6月25日時点のオリジナルよりアーカイブ。 2016年6月3日閲覧。
- ^ a bハウスクロフト, キャサリン・E.; シャープ, アラン・G. (2005).無機化学(第2版). ピアソン・プレンティス・ホール. pp. 162– 163. ISBN 0130-39913-2。
- ^ Loerting, Thomas ; Salzmann, Christoph ; Kohl, Ingrid ; Mayer, Erwin ; Hallbrucker, Andreas (2001-01-01). 「77 K、1 barにおける高密度アモルファス氷の第二の明確な構造「状態」」. Physical Chemistry Chemical Physics . 3 (24): 5355– 5357. Bibcode : 2001PCCP....3.5355L . doi : 10.1039/b108676f . ISSN 1463-9084 .
- ^グリーンウッド&アーンショー 1997年、624ページ。
- ^ Zumdahl & Zumdahl 2013、493ページ。
- ^ a b c「海は凍るのか?」国立海洋局。アメリカ海洋大気庁。2020年7月6日時点のオリジナルよりアーカイブ。 2016年6月9日閲覧。
- ^ Fine, RA; Millero, FJ (1973). 「温度と圧力の関数としての水の圧縮率」. Journal of Chemical Physics . 59 (10): 5529. Bibcode : 1973JChPh..59.5529F . doi : 10.1063/1.1679903 .
- ^ Neumeier, JJ (2018). 「温度範囲50 K-273 KにおけるH 2 O氷I hの弾性定数、体積弾性率、および圧縮率」 . Journal of Physical and Chemical Reference Data . 47 (3) 033101. Bibcode : 2018JPCRD..47c3101N . doi : 10.1063/1.5030640 . S2CID 105357042 . 2021年11月28日時点のオリジナルよりアーカイブ。 2021年8月3日閲覧。
- ^ 「基本単位の定義:ケルビン」。NIST 。米国国立標準技術研究所。2018年5月14日。2018年8月20日時点のオリジナルよりアーカイブ。 2018年8月9日閲覧。
- ^ a bワインガートナーら。 2016、p. 5.
- ^第106回会議議事録(PDF) .国際度量衡委員会. セーヴル . 2017年10月16~20日 . 2018年1月27日時点のオリジナルよりアーカイブ(PDF) . 2018年11月19日閲覧。
- ^ Schlüter, Oliver (2003-07-28).高圧低温プロセスが食品関連細胞材料に与える影響(PDF) (論文). Technische Universität Berlin . 2008-03-09時点のオリジナル(PDF)からアーカイブ。
- ^タマン、グスタフ・HJA(1925年)『集合状態』コンスタブル・アンド・カンパニー。
- ^ルイス&ライス 1922年。
- ^ Murphy, DM (2005). 「大気応用における氷と過冷却水の蒸気圧のレビュー」 . Quarterly Journal of the Royal Meteorological Society . 131 (608): 1539– 1565. Bibcode : 2005QJRMS.131.1539M . doi : 10.1256/qj.04.94 . S2CID 122365938. 2020年8月18日時点のオリジナルよりアーカイブ。2020年8月31日閲覧。
- ^ Debenedetti, PG; Stanley, HE (2003). 「過冷却水とガラス状水」(PDF) . Physics Today . 56 (6): 40– 46. Bibcode : 2003PhT....56f..40D . doi : 10.1063/1.1595053 . 2018年11月1日時点のオリジナルよりアーカイブ(PDF) . 2011年11月22日閲覧.
- ^シャープ 1988年、27ページ。
- ^ 「普通の水物質の融解・昇華曲線に沿った圧力に関する改訂版リリース」(PDF)IAPWS 2011年9月。2014年3月2日時点のオリジナルからアーカイブ(PDF) 。 2013年2月19日閲覧。
- ^ CS Fuller「半導体における欠陥相互作用」第5章、192-221ページ、『半導体』NB Hannay Ed. Reinhold、ニューヨーク、1959年
- ^ a bライト, トゥルーマン S.; リヒト, スチュアート; ベヴィラクア, アンソニー C.; モラッシュ, ケネス R. (2005-01-01). 「水の基礎導電率と抵抗率」.電気化学および固体レターズ. 8 (1): E16– E19. doi : 10.1149/1.1836121 . ISSN 1099-0062 .
- ^ Crofts, A. (1996). 「講義12:プロトン伝導、化学量論」イリノイ大学アーバナ・シャンペーン校. 2009年5月10日時点のオリジナルよりアーカイブ。 2009年12月6日閲覧。
- ^ Hoy, AR; Bunker, PR (1979). 「三原子分子の回転曲げシュレーディンガー方程式の精密解と水分子への応用」. Journal of Molecular Spectroscopy . 74 (1): 1– 8. Bibcode : 1979JMoSp..74....1H . doi : 10.1016/0022-2852(79)90019-5 .
- ^ Zumdahl & Zumdahl 2013、393ページ。
- ^キャンベル&ファレル 2007年、37~38頁。
- ^キャンベル&リース 2009、47ページ。
- ^ Chiavazzo, Eliodoro; Fasano, Matteo; Asinari, Pietro; Decuzzi, Paolo (2014). 「ナノ閉じ込め構造における水輸送のスケーリング挙動」 . Nature Communications . 5 3565: 4565. Bibcode : 2014NatCo...5.4565C . doi : 10.1038/ncomms4565 . PMC 3988813. PMID 24699509 .
- ^ 「生体分子を組織化する物理的力」(PDF) .生物物理学会. 2007年8月7日時点のオリジナルよりアーカイブ。
- ^ Lide 2003、「一般的な液体の表面張力」。
- ^ a b c Reece et al. 2013、p.46。
- ^ズムダール&ズムダール 2013、458–459頁。
- ^グリーンウッド&アーンショー 1997年、627ページ。
- ^ Zumdahl & Zumdahl 2013、518ページ。
- ^ Pugliano, N. (1992-11-01). 「小さな水クラスターにおける振動・回転・トンネルダイナミクス」 . UNTデジタルライブラリ. ローレンス・バークレー研究所、カリフォルニア州(米国): 6. doi : 10.2172/6642535 . OSTI 6642535. 2020年8月1日時点のオリジナルよりアーカイブ。2019年7月5日閲覧。
- ^ Richardson, Jeremy O.; Pérez, Cristóbal; Lobsiger, Simon; Reid, Adam A.; Temelso, Berhane; Shields, George C.; Kisiel, Zbigniew; Wales, David J.; Pate, Brooks H.; Althorpe, Stuart C. (2016-03-18). 「水ヘキサマープリズムにおける量子トンネル効果による協調水素結合破壊」 . Science . 351 (6279): 1310– 1313. Bibcode : 2016Sci...351.1310R . doi : 10.1126/science.aae0012 . ISSN 0036-8075 . PMID 26989250 .
- ^ Kolesnikov, Alexander I. (2016-04-22). 「緑柱石中の水の量子トンネル効果:水分子の新たな状態」 . Physical Review Letters . 116 (16) 167802. Bibcode : 2016PhRvL.116p7802K . doi : 10.1103/PhysRevLett.116.167802 . PMID 27152824. 2020年11月18日時点のオリジナルよりアーカイブ。2019年9月8日閲覧。
- ^ Pope; Fry (1996). 「純水の吸収スペクトル(380-700nm). II. 積分共振器測定」.応用光学. 36 (33): 8710–23 . Bibcode : 1997ApOpt..36.8710P . doi : 10.1364/ ao.36.008710 . PMID 18264420. S2CID 11061625 .
- ^ボール、フィリップ (2008). 「水—永続的な謎」 . Nature . 452 (7185): 291– 292. Bibcode : 2008Natur.452..291B . doi : 10.1038/452291a . PMID 18354466. S2CID 4365814 .
- ^ラリー・ゴニック、クレイグ・クリドル (2005年5月3日). 「第3章 共に生きる」.漫画でわかる化学入門(第1版). HarperResource. 59ページ . ISBN 978-0-06-093677-8
水(H
2
O)も同様です。水には何も結合していない電子対が2つあります。これらも考慮に入れる必要があります。NH
3
やH
2 Oのような分子は
「曲がった」分子
と呼ばれます
。
- ^ Theodore L. Brown他 (2015). 「9.2 Vseprモデル」 . 『化学:中心科学』(第13版). ピアソン. p. 351. ISBN 978-0-321-91041-7.オリジナルから2024年2月4日にアーカイブ。 2019年4月21日に取得。
非結合電子対の数が増えるにつれて結合角が減少することに注目してください。結合電子対は結合原子の両方の核に引き付けられますが、非結合電子対は主に一方の核にのみ引き付けられます。非結合電子対は核引力が弱いため、その電子領域は結合電子対の電子領域よりも空間的に広がっています(図9.7)。したがって、非結合電子対は結合電子対よりも多くの空間を占めます。本質的には、図9.5のアナロジーで言えば、大きく太い風船のように機能します。その結果、非結合電子対の電子領域は隣接する電子領域に大きな反発力を及ぼし、結合角を圧縮する傾向があります。
- ^ボイド 2000、105ページ。
- ^ボイド 2000、106ページ。
- ^ 「水の基礎物理定数および基本定数の使用に関するガイドライン」(PDF)IAPWS 2001年。2017年1月28日時点のオリジナルよりアーカイブ(PDF) 。 2008年3月21日閲覧。
- ^ Hardy, Edme H.; Zygar, Astrid; Zeidler, Manfred D.; Holz, Manfred; Sacher, Frank D. (2001). 「液体の水とアンモニアの並進運動と回転運動に対する同位体効果」. J. Chem. Phys . 114 (7): 3174– 3181. Bibcode : 2001JChPh.114.3174H . doi : 10.1063/1.1340584 .
- ^ Urey, Harold C.; et al. (1935年3月15日). 「重水の味について」. Science . 第81巻、第2098号. ニューヨーク: The Science Press. p. 273. Bibcode : 1935Sci....81..273U . doi : 10.1126/science.81.2098.273-a .
- ^ 「実験者が1クォート5,000ドルの『重水』を飲む」『ポピュラーサイエンス・マンスリー』第126巻第4号。ニューヨーク:ポピュラーサイエンス出版。1935年4月。17ページ。 2011年1月7日閲覧。
- ^ミュラー、グローバー・C. (1937年6月). 「『重水』は若返りの泉か?」 . 『ポピュラーサイエンス・マンスリー』第130巻第6号. ニューヨーク: ポピュラーサイエンス出版. pp. 22– 23. 2011年1月7日閲覧。
- ^ミラー、イングリス・J・ジュニア; ムーサー、グレゴリー (1979年7月). 「重水素酸化物に対する味覚反応」.生理学と行動. 23 (1): 69– 74. doi : 10.1016/0031-9384(79)90124-0 . PMID 515218. S2CID 39474797 .
- ^ワインガートナーら。 2016、p. 29.
- ^ Prockter, Louise M. (2005). 「太陽系の氷」(PDF) . Johns Hopkins APL Technical Digest . 26 (2): 175– 188. 2023年4月11日時点のオリジナルよりアーカイブ(PDF) . 2023年4月11日閲覧– Applied Physics Laboratory経由.
- ^ “惑星探査とフェルネルクンドゥン” . www.geo.fu-berlin.de (ドイツ語)。 2006年2月28日。2023-04-11 のオリジナルからアーカイブされました。2023 年 4 月 11 日に取得。
- ^ Zumdahl & Zumdahl 2013、659ページ。
- ^ a b Zumdahl & Zumdahl 2013、654ページ。
- ^ Zumdahl & Zumdahl 2013、984ページ。
- ^ Zumdahl & Zumdahl 2013、171ページ。
- ^ "Hydrides" . Chemwiki . UC Davis . 2013年10月2日. 2016年6月22日時点のオリジナルよりアーカイブ。 2016年6月25日閲覧。
- ^ズムダール&ズムダール 2013、932、936頁。
- ^ Zumdahl & Zumdahl 2013、338ページ。
- ^ Zumdahl & Zumdahl 2013、862ページ。
- ^ Zumdahl & Zumdahl 2013、981ページ。
- ^ Charlot 2007、275ページ。
- ^ a b Zumdahl & Zumdahl 2013、p.866。
- ^ a bグリーンウッド&アーンショー 1997年、601ページ。
- ^ 「企業と電気分解…」王立化学協会2003年8月. 2016年3月3日時点のオリジナルよりアーカイブ。 2016年6月24日閲覧。
- ^ 「ジョセフ・ルイ・ゲイ=リュサック、フランスの化学者(1778–1850)」。1902年百科事典。脚注122-1。2023年5月29日時点のオリジナルよりアーカイブ。 2016年5月26日閲覧。
- ^ Lewis, GN; MacDonald, RT (1933). 「H2同位体の濃度」. The Journal of Chemical Physics . 1 (6): 341. Bibcode : 1933JChPh...1..341L . doi : 10.1063/1.1749300 .
- ^ a b Leigh、Favre、Metanomski 1998、34ページ。
- ^ IUPAC 2005、85ページ。
- ^ 「テトラヒドロピラン」 . Pubchem .国立衛生研究所. 2016年8月16日時点のオリジナルよりアーカイブ。2016年7月31日閲覧。
- ^リー、ファーヴル、メタノムスキー 1998、27~28頁。
- ^ 「CID 22247451の化合物概要」 . Pubchem化合物データベース. 国立生物工学情報センター. 2014年8月27日時点のオリジナルよりアーカイブ。 2017年9月8日閲覧。
参考文献
- ボイド、クロード・E. (2000). 「pH、二酸化炭素、アルカリ度」.水質. ボストン、マサチューセッツ州: シュプリンガー. pp. 105– 122. doi : 10.1007/978-1-4615-4485-2_7 . ISBN 978-1-4615-4485-2。
- キャンベル, メアリー・K.; ファレル, ショーン・O. (2007).生化学(第6版). Cengage Learning. ISBN 978-0-495-39041-1。
- キャンベル, ニール A.; リース, ジェーン B. (2009).生物学(第8版). ピアソン. ISBN 978-0-8053-6844-4。
- キャンベル, ニール・A.; ウィリアムソン, ブラッド; ヘイデン, ロビン・J. (2006). 『生物学:生命の探究』 ボストン: ピアソン・プレンティス・ホール. ISBN 978-0-13-250882-7. 2014年11月2日時点のオリジナルよりアーカイブ。2008年11月19日閲覧。
- Charlot, G. (2007).無機定性分析. 書籍を読む. ISBN 978-1-4067-4789-8。
- グリーンウッド、ノーマン・N. ; アーンショウ、アラン (1997). 『元素化学』(第2版).バターワース・ハイネマン. ISBN 978-0-08-037941-8。
- 国際純正応用化学連合(2005).無機化学命名法:IUPAC勧告2005 (PDF) . 王立化学協会. ISBN 978-0-85404-438-2. 2019年12月12日にオリジナルからアーカイブ(PDF)されました。 2016年7月31日閲覧。
- Leigh, GJ; Favre, H. A; Metanomski, WV (1998).化学命名法の原則:IUPAC勧告へのガイド(PDF) . オックスフォード: Blackwell Science. ISBN 978-0-86542-685-6. OCLC 37341352 . 2011年7月26日時点のオリジナル(PDF)からアーカイブ。
- ルイス、ウィリアム・CM; ライス、ジェームズ (1922). 『物理化学の体系』 ロングマンズ、グリーン社
- ライド、デイビッド・R. (2003). CRC 化学・物理ハンドブック. CRC ハンドブック(第84版). CRC プレス. ISBN 978-0-8493-0484-2. 2024年2月4日時点のオリジナルよりアーカイブ。2016年5月29日閲覧。
- リース, ジェーン・B.; ウリー, リサ・A.; ケイン, マイケル・L.; ワッサーマン, スティーブン・A.; ミノルスキー, ピーター・V.; ジャクソン, ロバート・B. (2013).キャンベル生物学(第10版). ボストン, マサチューセッツ州: ピアソン. ISBN 978-0-321-77565-8。
- リディック、ジョン(1970)『有機溶媒の物理的性質と精製法』Techniques of Chemistry. Wiley-Interscience. ISBN 978-0-471-92726-6。
- シャープ、ロバート・フィリップ(1988年)『生きている氷:氷河と氷河作用を理解する』ケンブリッジ大学出版局、 27ページ、ISBN 978-0-521-33009-1。
- ワインガートナー、ヘルマン。ティーアマン、イルカ。ボルヒャース、ウルリッヒ。バルサ、ピーター。ルッツェ、ホルガー V.シュミット、トルステン C.フランク、エルンスト・ウルリッヒ。ウィガンド、ガブリエレ。ダーメン、ニコラウス。シュヴェット、ゲオルク。フリメル、フリッツ H.ゴルダラ、ビルギット C. (2016)。 「水、1. 性質、分析、水循環」。ウルマンの工業化学百科事典。 Wiley-VCH Verlag GmbH & Co. KGaA。土井: 10.1002/14356007.a28_001.pub3。ISBN 978-3-527-30673-2。
- ズムダール, スティーブン・S.; ズムダール, スーザン・A. (2013).化学(第9版). Cengage Learning . ISBN 978-1-13-361109-7。
さらに読む
- Ben-Naim, A. (2011)、水と水溶液の分子理論、World Scientific
外部リンク
- 「水の特性と測定」 .米国地質調査所. 2016年5月2日. 2016年8月31日閲覧.
- 一般および科学研究用途の一般水物質の熱力学的性質に関するIAPWS 1995年定式化に関するリリース(より簡略化された定式化)
- 2008年9月のIAPWS補足リリース「0.1 MPaにおける液体の水の特性」を使用したオンライン計算機
- チャップリン、マーティン (2019). 「様々な状態における水の構造と性質」 .水百科事典. Wiley Online Library 2019. pp. 1– 19. doi : 10.1002/9781119300762.wsts0002 . ISBN 978-1-119-30075-5. S2CID 213738895 .
- 水の蒸気圧、液体の密度、液体の動粘性、表面張力の計算
- 水の密度計算機
- 飲み物に氷が浮くのはなぜですか?NASA





![{\displaystyle K_{\rm {w}}=[{\rm {H_{3}O^{+}}}][{\rm {OH^{-}}}]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/86dca39006c4f875cacc14395c7ff6e38a09d990)

![{\displaystyle K_{\rm {eq}}\approx K_{\rm {w}}=[{\rm {H_{3}O^{+}}}][{\rm {OH^{-}}}]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/8c479a6b2710d07dd3952fcc072550c0e8537e70)

