磁気共鳴画像法
| 磁気共鳴画像法 | |
|---|---|
| 同義語 | 核磁気共鳴画像法(NMRI)、磁気共鳴断層撮影法(MRT) |
| ICD-9-CM | 88.91 |
| メッシュ | D008279 |
| メドラインプラス | 003335 |
磁気共鳴画像法(MRI)は、放射線医学において体内の解剖学的構造や生理学的プロセスの画像を生成するために使用される医療用画像技術である。MRIスキャナは、強力な磁場、磁場勾配、および電波を使用して体内の臓器の画像を形成する。MRIはX線や電離放射線を使用しないため、コンピュータ断層撮影(CT)や陽電子放出断層撮影(PET)スキャンと区別される。MRIは核磁気共鳴(NMR)の医療用途であり、 NMR分光法などの他のNMR用途の画像化にも使用することができる。[ 1 ]
MRIは、病院や診療所において、病気の診断、病期分類、経過観察のために広く利用されています。CTと比較して、MRIは脳や腹部などの軟部組織の画像において優れたコントラストを提供します。しかし、被験者を長くて狭いチューブの中に入れたまま測定を行うため、通常は測定時間が長く、音も大きいため、患者にとって不快感を与える可能性があります。ただし、「オープン型」MRIの設計により、この不快感は概ね軽減されています。さらに、体内にインプラントやその他の取り外し不可能な金属が埋め込まれている場合、リスクが生じる可能性があり、一部の患者はMRI検査を安全に受けられない場合があります。
MRIは元々NMRI(核磁気共鳴画像法)と呼ばれていましたが、否定的なイメージを避けるために「核」が省略されました。[ 2 ]特定の原子核は、外部磁場に置かれると無線周波数(RF)エネルギーを吸収します。その結果生じるスピン偏極は、無線周波数コイルにRF信号を誘導し、検出することができます。[ 3 ]言い換えれば、水素原子核内の陽子の核磁気スピンはRF入射波と共鳴し、コンパクトな方向、エネルギー(周波数)、位相を持つコヒーレントな放射線を放射します。このコヒーレントな増幅された放射線は、検査対象に近いRFアンテナによって検出されます。これはメーザーに似たプロセスです。臨床および研究用MRIでは、アンテナによって検出されるマクロ的な偏光放射線を生成するために、水素原子が最もよく使用されます。 [ 3 ]水素原子は、ヒトやその他の生物、特に水と脂肪に自然に豊富に存在します。このため、ほとんどのMRIスキャンは、基本的に体内の水分と脂肪の位置をマッピングするものです。電波パルスは核スピンエネルギー遷移を励起し、磁場勾配は分極を空間的に局所化します。パルスシーケンスのパラメータを変化させることで、組織内の水素原子の 緩和特性に基づいて、組織間で異なるコントラストを生成することができます。
1970年代から1980年代にかけて開発されて以来、MRIは多用途の画像診断技術であることが証明されてきました。MRIは診断医学や生物医学研究において最も広く利用されていますが、ミイラなどの無生物の画像形成にも用いられます。拡散MRIと機能的MRIは、MRIの有用性を拡張し、神経系における神経索と血流をそれぞれ捉えるだけでなく、詳細な空間画像も取得します。医療システムにおけるMRIの需要の持続的な増加は、費用対効果と過剰診断への懸念につながっています。[ 4 ] [ 5 ]
機構
建設と物理学

MRIスキャナーの主要構成要素は、サンプルを分極させる主磁石、主磁場の均一性のずれを補正するシムコイル、スキャン領域を特定するための勾配システム、そしてサンプルを励起し、その結果生じるNMR信号を検出するRFシステムです。システム全体は1台または複数台のコンピューターによって制御されます。
ほとんどの医療用途では、組織内の水素原子核(陽子のみで構成)が信号を発生させ、その信号が処理されて、特定領域におけるそれらの原子核の密度という観点から人体の画像が形成されます。陽子は結合している他の原子からの磁場の影響を受けるため、特定の化合物中の水素からの反応を区別することが可能です。検査を行うには、MRI スキャナ内に人を置き、画像化する領域の周囲に強力な磁場を形成します。まず、適切な共鳴周波数で振動磁場のエネルギーを一時的に患者に照射します。X 軸および Y 軸の傾斜磁場コイルでスキャンすることで、患者の選択した領域に、エネルギーが吸収されるのに必要な正確な磁場をかけます。原子はRFパルスによって励起され、結果として生じる信号は 1 つ以上の受信コイルで測定されます。傾斜磁場コイルを使用して局所磁場を変化させることで生じる RF レベルと位相の変化を調べることで、RF 信号を処理して位置情報を推測することができます。これらのコイルは、励起と応答の間に高速に切り替えられ、動くラインスキャンを実行します。そのため、磁気ひずみによって巻線がわずかに動くため、MRIスキャン特有の繰り返しノイズが発生します。異なる組織間のコントラストは、励起された原子が平衡状態に戻る速度によって決まります。画像をより鮮明にするために、外因性造影剤が投与されることもあります。 [ 6 ]

MRI では、スキャンボリューム全体にわたって数 ppm の強力かつ均一な磁場が必要です。磁石の磁場強度はテスラで測定され、ほとんどのシステムは 1.5 T で動作しますが、市販のシステムは 0.2 T から 7 T の間で利用できます。3T MRI システム (3 テスラ MRI とも呼ばれます) は、1.5 システムよりも強力な磁石を備えており、臓器や軟部組織の画像に適していると考えられています。[ 7 ]研究用途の全身 MRI システムは、たとえば 9.4 T、[ 8 ] [ 9 ] 10.5 T、[ 10 ] 11.7 T で動作します。[ 11 ]たとえば 14 T 以上のさらに高い磁場の全身 MRI システムは、概念提案[ 12 ]またはエンジニアリング設計の段階にあります。[ 13 ]ほとんどの臨床用磁石は超伝導磁石であり、低温に保つために液体ヘリウムが必要です。より低い磁場強度は永久磁石で実現でき、閉所恐怖症の患者向けの「オープン」MRIスキャナーでよく使用されています。[ 14 ]より低い磁場強度は、2020年にFDAによって承認されたポータブルMRIスキャナーでも使用されています。 [ 15 ]最近では、MRIはマイクロテスラからミリテスラの範囲の超低磁場でも実証されており、プリポーラライゼーション(10~100 mT程度)と、高感度超伝導量子干渉素子(SQUID )を使用して約100マイクロテスラでラーモア歳差磁場を測定することで、十分な信号品質が可能になります。[ 16 ] [ 17 ] [ 18 ]
T1とT2



各組織は、励起後、T 1(スピン格子、つまり静磁場と同じ方向の磁化)とT 2(スピンスピン、つまり静磁場に直交する方向の磁化)という独立した緩和過程によって平衡状態に戻ります。T 1強調画像を作成するには、繰り返し時間(TR)を変更することで、MR信号を測定する前に磁化を回復させます。この画像強調は、大脳皮質の評価、脂肪組織の同定、局所的な肝臓病変の特徴づけ、そして一般的に形態学的情報の取得、そして造影剤投与後の画像診断に役立ちます。 T2強調画像 を作成するには、エコー時間(TE)を変更することで、MR信号を測定する前に磁化を減衰させます。この画像強調は、浮腫や炎症の検出、白質病変の検出、前立腺や子宮の帯状構造の評価に有用です。
MRIスキャンから得られる情報は、振動磁場(サンプルを通過する高周波パルスの形態)による核スピンの摂動後の緩和速度の差に基づく画像コントラストの形で得られる。 [ 19 ]緩和速度は、信号が縦方向または横方向の平面から平衡状態に戻るまでにかかる時間の尺度である。
磁場 B 0の存在下では、磁化がz 軸に沿って増強され、サンプル内の磁気双極子は、平均して z 軸と一列になり、全体の磁化 M zを合計すると M zになります。この z に沿った磁化は平衡磁化として定義されます。磁化は、サンプル内のすべての磁気双極子の合計として定義されます。平衡磁化に続いて、 90° の無線周波数 (RF) パルスが xy 平面内の磁化ベクトルの方向を反転し、その後オフになります。ただし、初期の磁場 B 0 は引き続き適用されます。したがって、スピン磁化ベクトルは xy 平面から平衡状態へとゆっくりと戻ります。磁化ベクトルが平衡値 M zに戻るのにかかる時間は、縦緩和時間 T 1と呼ばれます。[ 20 ]その後、これが起こる速度は、単に緩和時間の逆数です。同様に、M xy がゼロに戻るのにかかる時間はT 2であり、速度はである。[ 21 ]時間の関数としての磁化はブロッホ方程式によって定義される。
T 1値とT 2値はサンプルの化学的環境に依存するため、MRIで有用です。軟部組織と筋組織はそれぞれ異なる速度で弛緩するため、典型的なスキャンでは画像コントラストが生じます。
MR 画像の標準的な表示は、白黒画像で流体の特性を表すことであり、さまざまな組織が次のように表示されます。
| 信号 | T1強調画像 | T2強調画像 |
|---|---|---|
| 高い | ||
| 中級 | ||
| 低い |
診断
臓器またはシステムによる使用

MRIは医療診断において幅広い用途があり、世界中で約5万台のスキャナーが使用されていると推定されています。[ 25 ] MRIは多くの専門分野の診断と治療に影響を与えていますが、健康状態の改善に対する効果については議論の余地があります。[ 26 ] [ 27 ]
MRIは、直腸癌や前立腺癌の術前病期分類において選択される検査法であり、他の腫瘍の診断、病期分類、経過観察にも役立っています。 [ 28 ]また、バイオバンキングにおける組織サンプル採取部位の決定にも用いられています。[ 29 ] [ 30 ]
神経画像

MRI は、脳幹と小脳を含む後頭蓋底をより鮮明に描出できるため、CT よりも神経癌の検査によく選択されるツールです。灰白質と白質のコントラストにより、MRI は脱髄疾患、認知症、脳血管疾患、感染症、アルツハイマー病、てんかんなど、中枢神経系の多くの症状の検査に最適です。[ 31 ] [ 32 ] [ 33 ]数ミリ秒間隔で複数の画像を撮影できるため、脳が異なる刺激にどのように反応するかを示すことができ、研究者は精神疾患における脳の機能的および構造的異常の両方を調べることができます。[ 34 ] MRI は、頭蓋内腫瘍、動静脈奇形、およびN ローカライザーと呼ばれる装置を使用したその他の外科治療可能な症状の治療のための誘導定位手術および放射線手術にも使用されます。[ 35 ] [ 36 ] [ 37 ]ヘルスケアに人工知能を導入する新しいツールは、ノイズ除去システムを適用することで、神経画像診断におけるより高い画質と形態計測分析を実証している。 [ 38 ]
死後脳全体の最高空間解像度記録は、マサチューセッツ総合病院によるもので、100ミクロンである。このデータは2019年10月にネイチャー誌に掲載された。 [ 39 ] [ 40 ]
MRIは精神障害の研究では広く使用されているが、患者中心成果研究所(PCORI)が委託した2024年の体系的な文献レビューとメタ分析によると、MRIスキャンを使用してADHDを診断した利用可能な研究では大きなばらつきが見られました。[ 41 ]著者らは、MRIはADHDの臨床診断を支援するために確実に使用することはできないと結論付けています。[ 41 ]
心血管系

心臓MRIは、心エコー検査、心臓CT、核医学検査などの他の画像診断技術を補完するものであり、心臓の構造と機能を評価するために使用することができます。[ 42 ]心臓MRIの応用分野には、心筋虚血および心筋生存率、心筋症、心筋炎、鉄過剰症、血管疾患、先天性心疾患の評価などがあります。[ 43 ]
筋骨格
筋骨格系への応用としては、脊椎の画像診断、関節疾患の評価、軟部組織腫瘍の評価などがある。[ 44 ] MRI技術は、遺伝性筋疾患を含む全身性筋疾患の画像診断にも使用できる 。[ 45 ] [ 46 ]
喉と食道の嚥下運動は、画像化された脊椎にモーションアーティファクトを引き起こす可能性があります。そのため、この領域に飽和パルスを適用することで、これらのアーティファクトを回避することができます。心臓の拍動によって生じるモーションアーティファクトは、MRIパルスのタイミングを心拍周期に合わせて調整することで低減できます。[ 47 ]血管血流アーティファクトは、関心領域の上下に飽和パルスを適用することで低減できます。[ 48 ]
肝臓と胃腸
肝胆道MRIは、肝臓、膵臓、胆管の病変の検出と特徴づけに用いられる。肝臓の局所性またはびまん性疾患は、拡散強調画像、対向位相画像、およびダイナミックコントラスト増強シーケンスを用いて評価することができる。細胞外造影剤は肝臓MRIで広く使用されており、新しい肝胆道造影剤は機能的胆道イメージングを行う機会も提供する。胆管の解剖学的画像は、磁気共鳴胆道膵管造影(MRCP)におけるT2強調シーケンスを用いることで得られる。膵臓の機能的画像は、セクレチン投与後に行われる。MR腸管造影は、炎症性腸疾患および小腸腫瘍の非侵襲的評価を提供する。MRコロノグラフィーは、大腸癌リスクの高い患者における大きなポリープの検出に役立つ可能性がある。[ 49 ] [ 50 ] [ 51 ] [ 52 ]
血管造影検査

磁気共鳴血管造影(MRA)は、動脈の画像を生成し、狭窄(異常な狭窄)や動脈瘤(破裂の危険性がある血管壁の拡張)の有無を評価します。MRAは、頸部や脳の動脈、胸部大動脈や腹部大動脈、腎動脈、そして脚(「ランオフ」と呼ばれる)の評価によく用いられます。画像生成には、常磁性造影剤(ガドリニウム)の投与や、「血流増強」(例えば、2Dおよび3D飛行時間シーケンス)など、様々な手法が用いられます。後者の場合、画像上の信号の大部分は、その平面に最近移動した血液によるものです(FLASH MRIも参照)。[ 53 ]
位相積算法(位相コントラスト血管造影として知られる)を用いると、血流速度マップを容易かつ正確に作成することができます。磁気共鳴静脈造影(MRV)は、静脈を画像化するために使用される同様の検査法です。この方法では、組織を下方から励起し、励起面のすぐ上方にある平面で信号を集めます。これにより、励起面から移動したばかりの静脈血を画像化することができます。[ 54 ]
造影剤
解剖学的構造や血流を画像化するMRIでは、組織や血液のさまざまな特性により自然なコントラストが得られるため、造影剤は不要です。ただし、より特殊なタイプの画像化では、外因性造影剤が静脈内、経口、または関節内に投与される場合があります。[ 6 ]ほとんどの造影剤は常磁性(ガドリニウム、マンガン、ユーロピウムなど)で、造影剤が蓄積する組織のT1を短縮するために使用されるか、超常磁性(SPION)で、健康な組織のT2およびT2*を短縮して信号強度を低下させるために使用されます(陰性造影剤)。最も一般的に使用される静脈造影剤は、高度に常磁性であるガドリニウムのキレート化合物をベースとしています。 [ 55 ]一般に、これらの造影剤は、X線撮影やCTで使用されるヨウ素化造影剤よりも安全であることが証明されています。アナフィラキシー様反応はまれで、約0.03~0.1%に発生します。[ 56 ]特に興味深いのは、通常の用量で投与した場合、ヨウ素化薬剤と比較して腎毒性の発生率が低いことです。これにより、造影CT検査を受けることができない腎機能障害患者にとって、造影MRI検査が選択肢となりました。[ 57 ]
ガドリニウム系造影剤は、典型的にはガドリニウム(III)の八座配位錯体である。この錯体は非常に安定(log K > 20)であるため、使用時には錯体を形成していないGd 3+イオンの濃度は毒性限度以下となるはずである。金属イオンの配位圏における9番目の位置は水分子によって占められており、この水分子は試薬分子の近傍の水分子と急速に交換され、磁気共鳴緩和時間に影響を与える。[ 58 ]
2017年12月、米国食品医薬品局(FDA)は医薬品安全性情報の中で、全てのガドリニウム造影剤(GBCA)に新たな警告を記載すると発表した。FDAはまた、患者教育の強化と、ガドリニウム造影剤の製造業者にこれらの造影剤の安全性を評価するための追加の動物試験および臨床試験の実施を義務付けることを求めている。[ 59 ]ガドリニウム造影剤は腎機能障害患者には有効であることが証明されているが、透析を必要とする重度の腎不全患者では、特定のガドリニウム含有造影剤の使用に関連している可能性のある、まれではあるが重篤な疾患である腎性全身性線維症のリスクがある。最も頻繁に関連付けられているのはガドジアミドだが、他の造影剤も関連付けられている。[ 60 ]因果関係は明確に証明されていないものの、米国の現在のガイドラインでは、透析患者は必要な場合にのみガドリニウム剤を投与されるべきであり、体内から薬剤を速やかに除去するために、スキャン後できるだけ早く透析を行うべきであるとされている。 [ 61 ] [ 62 ]
ガドリニウム含有造影剤がより多く入手可能なヨーロッパでは、潜在的なリスクに応じた造影剤の分類が発表されている。[ 63 ] [ 64 ] 2008年には、ガドキセテート(商品名:Eovist(米国)またはPrimovist(欧州))という新しい造影剤が診断用に承認された。これは、二重排泄経路という理論的利点がある。[ 65 ]
シーケンス
MRIシーケンスは、特定の無線周波数パルスと勾配の設定であり、特定の画像の外観をもたらします。[ 66 ] T1強調とT2強調もMRIシーケンスとして説明できます。
概要表
この表には、珍しいシーケンスや実験的なシーケンスは含まれていません。
| グループ | 順序 | 略語 | 物理 | 主な臨床的特徴 | 例 |
|---|---|---|---|---|---|
| スピンエコー | T1強調画像 | T1 | 短い繰り返し時間(TR) とエコー時間(TE) を使用してスピン-格子緩和を測定します。 |
他のシーケンスの標準的な基礎と比較 |  |
| T2強調画像 | T2 | 長いTR時間とTE時間を用いた スピン-スピン緩和の測定 |
他のシーケンスの標準的な基礎と比較 |  | |
| 陽子密度加重 | PD | TRを長くする(T1を短くする)とTEを短くする(T2を最小にする)。[ 70 ] | 関節疾患および関節損傷[ 71 ] |  | |
| 勾配エコー(GRE) | 定常自由歳差運動 | SSFP | 連続サイクルにわたって安定した残留横磁化を維持する。[ 73 ] | 心臓MRIビデオの作成(写真)。[ 73 ] |  |
| 有効T2または「T2スター」 | T2* | 長いエコー時間と小さなフリップ角を伴うスポイルドグラジエントリコールエコー(GRE)[ 74 ] | ヘモジデリン沈着(写真)と出血による低信号。[ 74 ] | 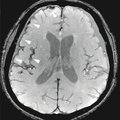 | |
| 感受性加重 | スイス | スポイルドグラディエントリコールエコー(GRE)、完全フロー補正、長いエコー時間、位相画像と振幅画像の組み合わせ[ 75 ] | 少量の出血(写真はびまん性軸索損傷)またはカルシウムの検出。[ 75 ] | _in_diffuse_axonal_injury.jpg/440px-Susceptibility_weighted_imaging_(SWI)_in_diffuse_axonal_injury.jpg) | |
| 反転回復 | 短いタウ反転回復 | かき混ぜる | 脂肪の信号がゼロになる反転時間を設定して脂肪を抑制する。 [ 76 ] | 浮腫がある場合、例えばより重度の疲労骨折の場合などに高信号となる。[ 77 ]写真はシンスプリント: | .jpg/440px-Shinsplint-mri_(crop).jpg) |
| 流体減衰反転回復 | フレア | 流体をゼロにする反転時間を設定して流体を抑制する | ラクナ梗塞、多発性硬化症(MS)プラーク、くも膜下出血、髄膜炎における高信号(写真)。[ 78 ] |  | |
| 二重反転回復 | ディレクター | 2回の反転による脳脊髄液と白質の同時抑制。 [ 79 ] | 多発性硬化症プラークの高信号(写真)。[ 79 ] |  | |
| 拡散強調画像(DWI) | 従来の | 飲酒運転 | 水分子のブラウン運動の測定。 [ 80 ] | 脳梗塞後数分以内に高信号となる(写真)。[ 81 ] |  |
| 見かけの拡散係数 | ADC | 従来のDWI画像を異なるDWI重み付けで複数回撮影することでT2重み付けが減少し、その変化は拡散に対応する。[ 82 ] | 脳梗塞後数分で信号が低下(写真)。[ 83 ] |  | |
| 拡散テンソル | DTI | 主に神経線維の方向への水分子の全体的なより大きなブラウン運動によるトラクトグラフィー(写真参照)。 [ 84 ] |  | ||
| 灌流強調画像(PWI) | 動的磁化率コントラスト | DSC | ガドリニウム造影剤注入による磁化率誘導信号損失の経時的変化を測定します。[ 86 ] |  | |
| 動脈スピンラベリング | アメリカ手話 | イメージングスラブの下の動脈血を磁気標識し、その後関心領域に入る。[ 88 ]ガドリニウム造影剤を必要としない。[ 89 ] | |||
| ダイナミックコントラスト強化 | DCE | ガドリニウム造影剤ボーラスによって誘発されるスピン格子緩和(T1)の短縮の時間的変化を測定する。[ 90 ] | Gd造影剤の取り込みが速いことは他の特徴と相まって悪性腫瘍を示唆する(写真)。[ 91 ] |  | |
| 機能的MRI(fMRI) | 血中酸素濃度依存画像 | 大胆な | ヘモグロビンの酸素飽和度依存性磁性の変化は組織の活動を反映する。[ 92 ] | 手術前に割り当てられたタスク(話す、指を動かすなど)を実行することで脳活動を局在化させる。認知研究にも使用される。[ 93 ] |  |
| 磁気共鳴血管造影(MRA)と静脈造影 | 飛行時間 | TOF | 撮像領域に入る血液はまだ磁気飽和していないため、短いエコー時間と流量補正を使用すると、はるかに高い信号が得られます。 | 動脈瘤、狭窄、解離の検出[ 94 ] |  |
| 位相コントラスト磁気共鳴画像法 | PC-MRA | 同じ大きさで反対方向の2つの勾配は、スピンの速度に比例する位相シフトをエンコードするために使用されます。[ 95 ] | 動脈瘤、狭窄、解離の検出(写真)。[ 94 ] | _Phase_Contrast_(PC)_sequence_MRI_of_arterial_dissections.jpg/440px-Vastly_undersampled_Isotropic_Projection_Reconstruction_(VIPR)_Phase_Contrast_(PC)_sequence_MRI_of_arterial_dissections.jpg) (VIPR) (VIPR) |
特殊な構成
磁気共鳴分光法
磁気共鳴分光法(MRS)は、体組織中の様々な代謝物のレベルを測定するために用いられ、様々な単一ボクセル法や画像化技術を用いて測定することができます。 [ 96 ] MR信号は、「励起」される同位体の異なる分子配列に対応する共鳴スペクトルを生成します。このシグネチャーは、特定の代謝疾患、特に脳に影響を与える疾患の診断に用いられます。 [ 97 ]また、腫瘍の代謝に関する情報の提供にも用いられます。[ 98 ]
磁気共鳴分光イメージング(MRSI)は、分光法とイメージング法の両方を組み合わせて、サンプルまたは患者の内部から空間的に局在したスペクトルを生成します。空間分解能ははるかに低い(利用可能なSNRによって制限される)が、各ボクセルのスペクトルには多くの代謝物に関する情報が含まれています。利用可能な信号は空間情報とスペクトル情報をエンコードするために使用されるため、MRSIでは、より高い磁場強度(3T以上)でのみ達成可能な高いSNRが必要です。[ 99 ]非常に高い磁場強度のMRIの調達と維持のコストが高いため[ 100 ] 、その人気を妨げています。しかし、最近の圧縮センシングベースのソフトウェアアルゴリズム(例:SAMV [ 101 ] )は、それほど高い磁場強度を必要とせずに 超解像を実現することが提案されています。
リアルタイム
リアルタイム磁気共鳴画像法(RT-MRI)は、動く物体をリアルタイムで連続的に監視する技術です。従来、リアルタイムMRIは画質や時間分解能が低いという欠点がありました。しかし、反復再構成アルゴリズムによってその限界が解消されました。ラジアルFLASH MRI(リアルタイム)は、面内分解能1.5~2.0 mmの画像に対して、時間分解能20~30ミリ秒を実現します。[ 103 ]リアルタイムMRIでは、関節や心臓の疾患に関する情報も得られます。多くの場合、MRI検査は患者にとってより簡単で快適になり、特に呼吸を落ち着かせることができない患者[ 104 ]や不整脈のある患者にとっては効果的です。
バランス定常自由歳差運動(bSSFP)画像は、 FLASH MRIよりも血液プールと心筋との間の画像コントラストが優れているが、B0不均一性が強い場合には重度のバンドアーティファクトが発生するという欠点がある。[ 104 ]
介入MRI
MRIは患者と検査技師に悪影響を与えないため、MRIスキャナーで撮影した画像を用いて低侵襲性処置を行う介入放射線学に適しています。このような処置では、強磁性器具は使用されません。[ 105 ]
介入MRIの専門分野として成長著しいのが、手術中にMRIを用いる術中MRIです。一部の特殊なMRIシステムでは、手術と同時撮影が可能です。より一般的には、手術を一時的に中断し、MRIで手術の成功度を評価したり、その後の手術の指針を得たりします。[ 106 ]
磁気共鳴誘導集束超音波
誘導療法では、高強度焦点式超音波(HIFU)ビームを組織に集束させ、MR熱画像法を用いて制御します。集束部における高エネルギーにより、温度は65 ℃(150℉)以上に上昇し、組織を完全に破壊します。この技術により、病変組織の精密なアブレーションが可能になります。MR画像は対象組織の3次元画像を提供し、超音波エネルギーを正確に集束させることができます。MR画像は、治療部位の定量的かつリアルタイムの熱画像を提供します。これにより、医師は超音波エネルギーの各サイクルで生成される温度が目的の組織内で熱アブレーションを引き起こすのに十分であることを確認でき、不十分な場合は、効果的な治療を確実に行うためにパラメータを調整することができます。[ 107 ]
多核イメージング
水素は、生物組織に大量に存在し、高い磁気回転比によって強い信号が得られるため、MRI で最も頻繁に画像化される原子核です。ただし、正味の核スピンを持つ原子核であれば、どのような原子核でもMRI で画像化できる可能性があります。このような原子核には、重水素、ヘリウム 3、リチウム 7、炭素 13、フッ素19 、酸素 17、ナトリウム23 、リン31 、キセノン 129などがあります。2 H、23 Na、31 P は体内に自然に豊富に存在するため、直接画像化できます。自然に豊富に存在する重水素は、濃度が 15 mM 前後で画像化できますが、ガンマ線感度と四極子緩和 (NMR)が低いという欠点があります。ただし、重水素画像化では化学シフト スペクトルがまばらであるため、代謝物選択画像化用にカスタマイズされたマルチバンド選択 RF パルスを開発することができます。このように、炭素13を用いた代謝イメージングと同様の代謝イメージングが、重水素代謝イメージング(DMI)によって可能となり、生体内代謝プロセスの解明に役立ちます。また、重水素のT2値が短いため、信号の平均化が速く、その物理的欠点の一部を補うことができます。3 Heや129 Xeなどの気体同位体は、核密度が低すぎて通常の条件下では有用な信号が得られないため、過分極させてから吸入する必要があります。17 Oや19 Fは、十分な量を液体(例えば、17 O-水)で投与できるため、過分極は必要ありません。[ 108 ]ヘリウムやキセノンを使用すると、これらの元素は通常、生体組織には存在しないため、背景ノイズが低減し、画像自体のコントラストが向上するという利点があります。[ 109 ]
さらに、正味の核スピンを持ち、水素原子と結合しているあらゆる原子の核は、水素原子と結合している低磁気回転比の核ではなく、高磁気回転比の水素原子核を画像化する異核磁化移動MRIによって画像化できる可能性がある。[ 110 ]原理的には、異核磁化移動MRIは特定の化学結合の有無を検出するために使用できる。[ 111 ] [ 112 ]
多核イメージングは、現在、主に研究技術として用いられています。しかし、潜在的な応用としては、機能イメージングや1 H MRIでよく見えない臓器(肺や骨など)のイメージング、あるいは代替造影剤としての応用が考えられます。吸入された過分極3 Heは、肺内の気腔の分布を画像化するために使用できます。13 Cを含む注射液や、過分極129 Xeの安定化バブルは、血管造影や灌流イメージングの造影剤として研究されています。31 Pは、骨密度や骨構造に関する情報に加え、脳の機能イメージングにも役立つ可能性があります。多核イメージングは、双極性障害などの疾患を持つ患者にとって重要な薬剤として使用されているリチウムのヒト脳内分布を可視化する可能性を秘めています。[ 113 ]
MRIによる分子イメージング
MRIは空間分解能が非常に高いという利点があり、形態学的画像と機能的画像に非常に適しています。しかし、MRIにはいくつかの欠点もあります。まず、MRIの感度は約10-3 ~ 10-5モル/ Lであり、他の種類の画像と比較すると非常に制限的になる可能性があります。この問題は、室温での核スピン状態間の個体差が非常に小さいことに起因します。例えば、臨床MRIの典型的な磁場強度である1.5テスラでは、高エネルギー状態と低エネルギー状態の差は200万個あたり約9分子です。MR感度を向上させるための改善には、磁場強度の増加や、光ポンピングまたは動的核分極による過分極化などがあります。また、感度を向上させる化学交換に基づくさまざまな信号増幅方式もあります。[ 114 ]
MRIを用いた疾患バイオマーカーの分子イメージングには、特異性が高く緩和能(感度)の高い標的MRI造影剤が必要である。これまで、MRIによる分子イメージングを実現するための標的MRI造影剤の開発に多くの研究が行われてきた。一般的に、ペプチド、抗体、または小さなリガンド、およびHER-2アフィボディなどの小さなタンパク質ドメインが標的化を達成するために適用されてきた。造影剤の感度を高めるために、これらの標的化部分は通常、高ペイロードMRI造影剤または緩和能の高いMRI造影剤に結合されている。[ 115 ]ユニークなmRNAおよび遺伝子転写因子タンパク質の遺伝子作用を示すために、新しいクラスの遺伝子標的MR造影剤が導入されている。[ 116 ] [ 117 ]これらの新しい造影剤は、ユニークなmRNA、マイクロRNA、およびウイルスを持つ細胞や、生きた脳の炎症に対する組織反応を追跡できる。[ 118 ] MRは、TaqMan分析、光学顕微鏡および電子顕微鏡と正の相関関係にある遺伝子発現の変化を報告[ 119 ]
パラレルMRI
磁場勾配を順次適用して MRI データを収集するには時間がかかります。最も合理化されたMRI シーケンスでも、勾配の切り替え速度には物理的および生理学的な限界があります。並列 MRI は、従来の順次方式ではなく、データの一部を同時に収集することでこれらの限界を回避します。これは、それぞれが体の異なる「ビュー」を持つ無線周波数 (RF) 検出コイルのアレイを使用して実現されます。削減された一連の勾配ステップが適用され、残りの空間情報は、既知の空間感度パターンに基づいてさまざまなコイルからの信号を組み合わせることで埋められます。結果として生じる加速度は、コイルの数と信号対雑音比 (加速度が増加すると低下する) によって制限されますが、適切なコイルアレイ構成を使用すると、一般的に 2 ~ 4 倍の加速度が達成され、特殊なコイルアレイを使用すると大幅に高い加速度が実証されています。並列 MRI は、ほとんどのMRI シーケンスで使用できます。
検出器アレイを使用してイメージングを加速する初期の提案が数多くあったが、MRI分野ではほとんど注目されなかったが、1996~1997年に空間高調波同時取得(SMASH)技術が導入されて以来、パラレルイメージングが広く開発および応用されるようになった。[ 120 ]感度エンコード(SENSE)[ 121 ]および一般化自動較正部分的パラレル取得(GRAPPA)[ 122 ]技術は、今日最も一般的に使用されているパラレルイメージング法である。パラレルMRIの登場により、画像再構成およびRFコイル設計の広範な研究開発が行われ、市販のMRシステムで使用できる受信チャンネル数が急速に増加した。パラレルMRIは現在、さまざまな身体部位のMRI検査や臨床または研究用途で日常的に使用されている。
定量的MRI
ほとんどのMRIは、特定のパラメータによって「重み付け」された信号強度の相対的な変化の空間マップを取得することにより、MRデータの定性的な解釈に重点を置いています。[ 123 ]定量的な方法では、正確な組織緩和測定パラメータ値または磁場の空間マップを決定したり、特定の空間的特徴のサイズを測定したりします。
定量的 MRI 法の例は次のとおりです。
- T1マッピング(特に心臓磁気共鳴画像法で使用される[ 124 ])
- T2マッピング[ 125 ]
- 定量的感受性マッピング(QSM)
- 定量的体液流MRI(一部の脳脊髄液流MRI [ 126 ])
- 磁気共鳴エラストグラフィー(MRE)[ 127 ]
- 磁気共鳴指紋法(MRF)[ 128 ]
定量的MRIはMR画像と解釈の再現性を高めることを目的としていますが、歴史的にはより長いスキャン時間を必要とします。[ 123 ]
定量的MRI(またはqMRI)は、より具体的には、1回の撮影セッションで複数の組織緩和測定パラメータをマッピングするマルチパラメータ定量的MRIを指すこともあります。[ 129 ]マルチパラメータ定量的MRIをより高速化する取り組みにより、各パラメータごとに別々のエンコード方法をシーケンスに組み込むか、 [ 130 ] MR信号の進化をマルチパラメータモデルに適合させることにより、複数のパラメータを同時にマッピングするシーケンスが作成されました。 [ 131 ] [ 128 ]
超偏極ガスMRI
従来のMRIでは、磁場によって励起される陽子を含む水分子が少ないため、肺組織の画像品質が低下します。超分極ガスを用いたMRI検査では、肺の換気障害を特定できます。検査前に、患者はヘリウムまたは窒素の緩衝ガスと混合した超分極キセノンを吸入します。その結果得られる肺画像は、従来のMRIよりもはるかに高品質です。
安全性
MRIは一般的に安全な技術ですが、安全手順の不備や人為的ミスにより傷害が起こる可能性があります。[ 132 ] MRIの禁忌には、ほとんどの人工内耳と心臓ペースメーカー、破片、眼内の金属異物などがあります。妊娠中の磁気共鳴画像法は、少なくとも第2および第3トリメスターでは造影剤なしで行えば安全と思われます。[ 133 ] MRIは電離放射線を使用しないため、CTとMRIのどちらでも同じ情報が得られる場合は、一般的にMRIがCTよりも好まれます。 [ 134 ]患者によっては閉所恐怖症を経験し、鎮静またはMRIプロトコルの短縮が必要になる場合があります。[ 135 ] [ 136 ]画像取得中の傾斜磁場コイルの振幅と急速な切り替えは、末梢神経刺激を引き起こす可能性があります。[ 137 ]
| 外部ビデオ | |
|---|---|
 MRIの磁石に投げつけられた磁性体 MRIの磁石に投げつけられた磁性体 |
MRIは強力な磁石を使用するため、磁性体が高速で移動し、飛散の危険があり、致命的な事故を引き起こす可能性があります。[ 138 ]しかし、毎年世界中で何百万件ものMRI検査が行われているため、[ 139 ]死亡事故は非常にまれです。[ 140 ]
MRI装置は最大120dB (A)の大きな騒音を発生することがあります。[ 141 ]これにより難聴、耳鳴り、聴覚過敏を引き起こす可能性があるため、検査中はMRIスキャナー室内にいるすべての人が適切な聴覚保護具を着用することが不可欠です。
過剰使用
医学会は、医師が患者にMRI検査を行うべき時期に関するガイドラインを発行し、過剰な使用を推奨していません。MRIは健康上の問題を検出したり診断を確定したりすることができますが、医学会は患者の訴えに対する診断や治療計画を立てる際に、MRIを最初の検査として用いるべきではないと推奨することがよくあります。よくある例としては、腰痛の原因究明にMRIを用いる場合が挙げられます。例えば、米国内科学会は、MRIを含む画像診断は患者にとって良い結果をもたらす可能性が低いため、MRI検査を推奨していません。[ 26 ] [ 27 ]
遺物

MRIアーティファクトとは、視覚的なアーティファクト、すなわち画像表示における異常現象のことです。磁気共鳴画像(MRI)検査では様々なアーティファクトが発生する可能性があり、診断の質に影響を与えるものもあれば、病理と混同されるものもあります。アーティファクトは、患者関連、信号処理依存、ハードウェア(装置)関連に分類できます。[ 142 ]
非医療用
MRIは、主に化学物質の日常的な分析に産業的に利用されています。核磁気共鳴技術は、例えば食品中の水分と脂肪の比率の測定、配管内の腐食性流体の流れのモニタリング、触媒などの分子構造の研究などにも利用されています。[ 1 ]
MRIは非侵襲性かつ非損傷性であるため、植物の解剖学的構造、水分輸送プロセス、水分収支を研究するために使用できます。[ 143 ]また、獣医学の放射線診断にも応用されています。これ以外では、動物学ではコストが高いため利用が限られていますが、多くの種に使用できます。[ 144 ]
古生物学では化石の構造を調べるために使用されます。[ 145 ]
法医学的画像診断は、手作業による剖検では得られない、剖検のグラフィックな記録を提供します。CTスキャンは骨格や実質の変化を全身で迅速に画像化しますが、MR画像診断は軟部組織の病変をより正確に再現します。[ 146 ]とはいえ、MRIはより高価で、利用に時間がかかります。[ 146 ]さらに、MR画像診断の品質は10℃以下では低下します。[ 147 ]
歴史
1971年、ストーニーブルック大学でポール・ラウターバーは、3次元すべてにおける磁場勾配と逆投影法を用いてNMR画像を作成しました。彼は1973年にNature誌に2本の水管の画像を発表しました。[ 148 ]続いて生きた動物であるハマグリの画像、そして1974年にはマウスの胸腔の画像を発表しました。ラウターバーはこの画像化手法をゼウグマトグラフィーと呼びましたが、この用語は後に(N)MR画像化に置き換えられました。[ 1 ] 1970年代後半、ノッティンガム大学の物理学者ピーター・マンスフィールドとラウターバーは、エコープラナー画像化(EPI)法などのMRI関連技術を開発しました。[ 149 ]
レイモンド・ダマディアンの核磁気共鳴(NMR)に関する研究はMRIに組み込まれ、最初のスキャナーの1つが作られました。[ 150 ]
膨大な計算能力を必要とする実用的なMRIの開発には、半導体技術の進歩が不可欠でした。これは、単一の集積回路チップ上に集積されるトランジスタ数の急速な増加によって可能になりました。[ 151 ]マンスフィールドとラウターバーは、「磁気共鳴画像法に関する発見」により、2003年のノーベル生理学・医学賞を受賞しました。[ 152 ]
参照
参考文献
- ^ a b c Rinck, Peter A. (2024).磁気共鳴医学:批評的入門(第14版(電子書籍)). TRTF – The Round Table Foundation: TwinTree Media.「医療における磁気共鳴」www.magnetic-resonance.org
- ^ McRobbie DW, Moore EA, Graves MJ, Prince MR (2007). MRI from Picture to Proton . Cambridge University Press. p. 1. ISBN 978-1-139-45719-4。
- ^ a b Hoult DI, Bahkar B (1998). 「NMR信号受信:仮想光子とコヒーレント自発放出」.磁気共鳴の概念. 9 (5): 277– 297. doi : 10.1002/(SICI)1099-0534(1997)9:5<277::AID-CMR1>3.0.CO;2-W .
- ^ Smith-Bindman R, Miglioretti DL , Johnson E, Lee C, Feigelson HS, Flynn M, et al. (2012年6月). 「大規模統合医療システムに登録された患者における診断画像検査の利用と関連する放射線被曝(1996~2010年)」. JAMA . 307 ( 22): 2400–9 . Bibcode : 2012JAMA..307.5960S . doi : 10.1001/jama.2012.5960 . PMC 3859870. PMID 22692172 .
- ^健康に関する一目でわかる2009年OECD指標. 2009. doi : 10.1787/health_glance-2009-en . ISBN 978-92-64-07555-9。
- ^ a b McRobbie DW (2007). MRI from picture to proton . Cambridge, UK; New York: Cambridge University Press. ISBN 978-0-521-68384-5。
- ^ 「国立がん研究所」Cancer.gov . 2024年9月16日閲覧。
- ^ 「Tesla Engineering Ltd - Magnet Division - MRI Supercon」 . www.tesla.co.uk . 2022年8月16日閲覧。
- ^ Qiuliang, Wang (2022年1月). 「IEE CASにおける9.4T/800mm全身MRI用超伝導磁石の開発成功」(PDF) . snf.ieeecsc.org . 2023年3月22日時点のオリジナルよりアーカイブ(PDF) .
- ^ Nowogrodzki, Anna (2018-10-31). 「世界最強のMRI装置が人間の画像診断を新たな限界へ押し上げる」 . Nature . 563 (7729): 24– 26. Bibcode : 2018Natur.563...24N . doi : 10.1038/ d41586-018-07182-7 . PMID 30382222. S2CID 53153608 .
- ^ CEA (2021年10月7日). 「世界で最も強力なMRIスキャナーが最初の画像を配信!」 CEA /英語ポータル. 2022年8月16日閲覧。
- ^ Budinger, Thomas F.; Bird, Mark D. (2018-03-01). 「14Tから20Tの磁場におけるヒト脳のMRIおよびMRS:技術的実現可能性、安全性、そして神経科学の展望」 . NeuroImage .超高磁場MRIによる神経画像化:現状と未来. 168 : 509–531 . doi : 10.1016/j.neuroimage.2017.01.067 . ISSN 1053-8119 . PMID 28179167. S2CID 4054160 .
- ^ Li, Yi; Roell, Stefan (2021-12-01). 「14 T全身MRI用ショートボア・クライオジェンフリー高温超伝導磁石システムの主要設計」 .超伝導科学技術. 34 (12): 125005. Bibcode : 2021SuScT..34l5005L . doi : 10.1088/1361-6668/ac2ec8 . ISSN 0953-2048 . S2CID 242194782 .
- ^佐々木正史、江原真司、中里哲也、玉川裕也、久保谷裕也、杉沢正人、佐藤哲也 (1990年4月)。 「0.2T永久磁石ユニットを搭載した肩のMR」。AJR。アメリカのレントゲン学ジャーナル。154 (4): 777– 8.土井: 10.2214/ajr.154.4.2107675。PMID 2107675。
- ^ 「ギルフォードの会社がベッドサイドMRIのFDA承認を取得」。ニューヘブン・レジスター。2020年2月12日。 2020年4月3日時点のオリジナルよりアーカイブ。 2020年4月15日閲覧。
- ^ McDermott R, Lee S, ten Haken B, Trabesinger AH, Pines A, Clarke J (2004年5月). 「超伝導量子干渉装置を用いたマイクロテスラMRI」 . Proceedings of the National Academy of Sciences of the United States of America . 101 (21): 7857–61 . Bibcode : 2004PNAS..101.7857M . doi : 10.1073/pnas.0402382101 . PMC 419521. PMID 15141077 .
- ^ Zotev VS, Matlashov AN, Volegov PL, Urbaitis AV, Espy MA, Kraus RH (2007). 「超低磁場MRIのためのSQUIDベースの計測装置」.超伝導科学技術. 20 (11): S367–73. arXiv : 0705.0661 . Bibcode : 2007SuScT..20S.367Z . doi : 10.1088/0953-2048/20/11/S13 . S2CID 119160258 .
- ^ Vesanen PT, Nieminen JO, Zevenhoven KC, Dabek J, Parkkonen LT, Zhdanov AV, 他 (2013年6月). 「市販の全頭型神経磁力計に基づくハイブリッド超低磁場MRIおよび磁気脳波計測システム」 . Magnetic Resonance in Medicine . 69 (6): 1795– 804. doi : 10.1002 / mrm.24413 . PMID 22807201. S2CID 40026232 .
- ^ De Leon -Rodriguez, LM (2015). 「基本的なMR緩和メカニズムと造影剤設計」 . Journal of Magnetic Resonance Imaging . 42 (3): 545– 565. doi : 10.1002/jmri.24787 . PMC 4537356. PMID 25975847 .
- ^ 「T1緩和実験」(PDF)。
- ^ McHale, J. (2017).分子分光法. CRC Press/Taylor and Francis Group. pp. 73– 80.
- ^ a b c d e f g「磁気共鳴画像法」ウィスコンシン大学。2017年5月10日時点のオリジナルよりアーカイブ。 2016年3月14日閲覧。
- ^ a b c d e f g h i j k l m n Johnson KA. 「基本的なプロトンMRイメージング。組織信号特性」。
- ^ a b Patil T (2013-01-18). 「MRIシーケンス」 . 2016年3月14日閲覧。
- ^ 「磁気共鳴:査読付き批評入門」欧州磁気共鳴フォーラム。 2014年11月17日閲覧。
- ^ a b Consumer Reports ; American College of Physicians . 「医師と患者が問うべき5つのこと」(PDF)。Choosing Wisely . ABIM Foundation提供。 2012年6月24日時点のオリジナル(PDF)からアーカイブ。 2012年8月14日閲覧。
- ^ a b Consumer Reports ; American College of Physicians (2012年4月). 「腰痛の画像検査:おそらく必要のない理由」(PDF) . High Value Care . 2013年1月15日時点のオリジナル(PDF)からアーカイブ。 2012年8月14日閲覧。
- ^ Husband J (2008).がん治療における断層画像診断の推奨事項:コンピュータ断層撮影(CT)、磁気共鳴画像(MRI)、陽電子放出断層撮影(PET-CT)(PDF) . 英国放射線専門医協会. ISBN 978-1-905034-13-0. 2012年9月7日にオリジナル(PDF)からアーカイブ。 2014年5月29日閲覧。
- ^ Heavey S, Costa H, Pye H, Burt EC, Jenkinson S, Lewis GR, et al. (2019年5月). 「PEOPLE: PatiEnt prostate samples for rEsearch:磁気共鳴画像データを用いて、新鮮な前立腺摘出術標本中の腫瘍組織と良性組織を標的とする組織収集経路」 . The Prostate . 79 (7): 768– 777. doi : 10.1002/pros.23782 . PMC 6618051. PMID 30807665 .
- ^ Heavey S, Haider A, Sridhar A, Pye H, Shaw G, Freeman A, Whitaker H (2019年10月). 「磁気共鳴画像法と生検データを用いた前立腺がんバイオバンキングにおけるサンプリング手順のガイド」 . Journal of Visualized Experiments (152). doi : 10.3791/60216 . PMID 31657791 .
- ^アメリカ神経放射線学会 (2013). 「脳の磁気共鳴画像法(MRI)の実施と解釈に関するACR-ASNR実践ガイドライン」(PDF) . 2017年7月12日時点のオリジナル(PDF)からアーカイブ。 2013年11月10日閲覧。
- ^ Rowayda AS (2012年5月). 「萎縮評価のための改良MRIセグメンテーション」. International Journal of Computer Science Issues . 9 (3).
- ^ Rowayda AS (2013年2月). 「アルツハイマー病の早期発見のためのMRIによる局所萎縮解析」.国際信号処理・画像処理・パターン認識ジャーナル. 6 (1): 49– 53.
- ^ Nolen-Hoeksema S (2014). 『異常心理学』(第6版). ニューヨーク: McGraw-Hill Education. p. 67.
- ^ Brown RA, Nelson JA (2016年6月). 「定位脳神経外科手術におけるNローカライザーの発明と初期の歴史」 . Cureus . 8 ( 6) e642. doi : 10.7759/cureus.642 . PMC 4959822. PMID 27462476 .
- ^ Leksell L, Leksell D, Schwebel J (1985年1月). 「定位固定と核磁気共鳴」 . Journal of Neurology, Neurosurgery, and Psychiatry . 48 (1): 14–8 . doi : 10.1136/jnnp.48.1.14 . PMC 1028176. PMID 3882889 .
- ^ Heilbrun MP, Sunderland PM, McDonald PR, Wells TH, Cosman E, Ganz E (1987). 「Brown-Roberts-Wells定位フレームの修正による3平面での磁気共鳴画像誘導の実現」.応用神経生理学. 50 ( 1–6 ): 143–52 . doi : 10.1159/000100700 . PMID 3329837 .
- ^金丸典子; 孝尾秀正; 雨宮詩織; 阿部修 (2021年12月2日). 「スキャン後処理ノイズ除去システムの画質と形態計測解析への影響」 . Journal of Neuroradiology . 49 (2): 205– 212. doi : 10.1016/j.neurad.2021.11.007 . PMID 34863809. S2CID 244907903 .
- ^ 「100時間にわたる人間の脳のMRI撮影で、これまでで最も詳細な3D画像が生成」 2019年7月10日。
- ^ 「チームが最高解像度の脳MRIスキャンを発表」。
- ^ a bピーターソン、ブラッドリー S.トランプ、ジョーイ。マグリオネ、マーガレット。ボルシャコワ、マリア。ブラウン、モラ。ロゼル、メアリー。モタラ、アネサ。柳生、幸。マイルズ、ジェレミー。パクダマン、シーラ。ガステラム、マリオ。グエン、ビッチ・トゥイ(ベッキー)。徳富、エリン。リー、エスター。ビレイ、エルサレムZ。シェーファー、コールマン。コフリン、ベンジャミン。セロス、カリン。モラカラパリ、スレヤ。ショー、ブリタニー。サズミン、タンジナ;オニエクウルジェ、アン N.トレンティーノ、ダニカ。ヘンペル、スザンヌ (2024)。「小児および青少年におけるADHDの診断と治療」。効果的なヘルスケア.ahrq.gov。doi : 10.23970/ahrqepccer267 . PMID 38657097 . 2024年6月19日閲覧。
- ^ Petersen SE, Aung N, Sanghvi MM, Zemrak F, Fung K, Paiva JM, 他 (2017年2月). 「英国バイオバンク集団コホートにおける白人の心臓構造と機能に関する心血管磁気共鳴(CMR)を用いた基準範囲」 . Journal of Cardiovascular Magnetic Resonance . 19 (1) 18. Springer Science and Business Media LLC. doi : 10.1186/s12968-017-0327-9 . PMC 5304550. PMID 28178995 .
- ^米国放射線学会、心血管コンピュータ断層撮影学会、心血管磁気共鳴学会、米国核医学心臓学会、北米心臓画像学会、心血管血管造影介入学会、インターベンショナルラジオロジー学会(2006年10月)。「ACCF/ACR/SCCT/SCMR/ASNC/NASCI/SCAI/SIR 2006 心臓コンピュータ断層撮影および心臓磁気共鳴画像法の適切性基準。米国心臓病学会財団品質戦略方針委員会適切性基準ワーキンググループ報告書」米国放射線学会誌3 ( 10): 751–71 . doi : 10.1016/j.jacr.2006.08.008 . PMID 17412166 .
- ^ Helms C (2008).筋骨格MRI . Saunders. ISBN 978-1-4160-5534-1。
- ^ Aivazoglou、LU;ギマランイス州、JB;リンク、TM;コスタ、MAF;カルドーソ、フロリダ州。デ・マットス・ロンバルディ・バディア、B;ファリアス、IB。デ・レゼンデ・ピント、WBV。デ・ソウザ、PVS。オリベイラ、ASB。デ・シケイラ・カルヴァーリョ、AA;相原、AY; da Rocha Corrêa Fernandes、A(2021年4月21日)。 「遺伝性ミオパチーの MR イメージング: イメージング アルゴリズムのレビューと提案」。ヨーロッパの放射線医学。31 (11): 8498–8512。土井: 10.1007/s00330-021-07931-9。PMID 33881569。S2CID 233314102。
- ^ Schmidt GP, Reiser MF, Baur-Melnyk A (2007年12月). 「筋骨格系の全身画像:MR画像の価値」 . Skeletal Radiology . 36 (12). Springer Nature: 1109–19 . doi : 10.1007/s00256-007-0323-5 . PMC 2042033. PMID 17554538 .
- ^ Havsteen I, Ohlhues A, Madsen KH, Nybing JD, Christensen H, Christensen A (2017). 「磁気共鳴画像法における動きアーティファクトは本当に問題なのか? - 物語的レビュー」 . Frontiers in Neurology . 8,232 . doi : 10.3389/fneur.2017.00232 . PMC 5447676. PMID 28611728 .
- ^ Taber, KH; Herrick, RC; Weathers, SW; Kumar, AJ; Schomer, DF; Hayman, LA (1998年11月). 「脊椎の臨床MR画像診断における落とし穴とアーティファクト」 . RadioGraphics . 18 (6): 1499– 1521. doi : 10.1148/radiographics.18.6.9821197 . ISSN 0271-5333 . PMID 9821197 .
- ^ Frydrychowicz A, Lubner MG, Brown JJ, Merkle EM, Nagle SK, Rofsky NM, Reeder SB (2012年3月). 「ガドリニウム造影剤を用いた肝胆道MR画像診断」 . Journal of Magnetic Resonance Imaging . 35 ( 3): 492– 511. doi : 10.1002/jmri.22833 . PMC 3281562. PMID 22334493 .
- ^ Sandrasegaran K, Lin C, Akisik FM, Tann M (2010年7月). 「最先端の膵臓MRI」. AJR. American Journal of Roentgenology . 195 (1): 42– 53. doi : 10.2214/ajr.195.3_supplement.0s42 . PMID 20566796 .
- ^ Masselli G, Gualdi G (2012年8月). 「小腸のMR画像」.放射線学. 264 (2): 333–48 . doi : 10.1148/radiol.12111658 . PMID 22821694 .
- ^ Zijta FM, Bipat S, Stoker J (2010年5月). 「大腸病変の検出における磁気共鳴(MR)コロノグラフィー:前向き研究の系統的レビュー」 .欧州放射線学. 20 (5): 1031–46 . doi : 10.1007/s00330-009-1663-4 . PMC 2850516. PMID 19936754 .
- ^ Wheaton AJ, 宮崎 M (2012年8月). 「非造影MR血管造影:物理的原理」 . Journal of Magnetic Resonance Imaging . 36 (2). Wiley: 286–304 . doi : 10.1002/jmri.23641 . PMID 22807222. S2CID 24048799 .
- ^ Haacke EM, Brown RF, Thompson M, Venkatesan R (1999).磁気共鳴イメージング:物理的原理とシーケンス設計. ニューヨーク: J. Wiley & Sons. ISBN 978-0-471-35128-3。
- ^ Rinck PA (2014). 「第13章 造影剤」 .磁気共鳴医学.
- ^マーフィー KJ、ブランバーグ JA、コーハン RH (1996 年 10 月)。「ガドリニウム造影剤に対する副作用: 36 例のレビュー」。AJR。アメリカのレントゲン学ジャーナル。167 (4): 847–9 .土井: 10.2214/ajr.167.4.8819369。PMID 8819369。
- ^ 「ACRガイドライン」 . guideline.gov . 2005年. 2006年9月29日時点のオリジナルよりアーカイブ。2006年11月22日閲覧。
- ^シュガエフ, セルゲイ; キャラバン, ピーター (2021). 「バイオイメージング技術における金属イオン:概要」 . アストリッド・シーゲル; エヴァ・フライジンガー; ローランド・シーゲル KO (編). 『バイオイメージング技術における金属イオン』 . ベルリン: ウォルター・デ・グリュイター. pp. 1– 37. doi : 10.1515/9783110685701-007 . ISBN 978-3-11-068570-1。
- ^ 「FDA医薬品安全性情報:FDAはガドリニウム造影剤(GBCA)が体内に残留することを警告、新たなクラス警告を要求」米国FDA 、 2018年5月16日。
- ^ Thomsen HS, Morcos SK, Dawson P (2006年11月). 「ガドリニウム造影剤の投与と腎性全身性線維症(NSF)の発症との間に因果関係はあるか?」Clinical Radiology . 61 (11): 905–6 . doi : 10.1016/j.crad.2006.09.003 . PMID 17018301 .
- ^ 「FDA医薬品安全性情報:腎機能障害患者におけるガドリニウム系造影剤の使用に関する新たな警告」。ガドリニウム系造影剤に関する情報。米国食品医薬品局。2010年12月23日。 2010年9月11日時点のオリジナルよりアーカイブ。 2011年3月12日閲覧。
- ^ 「FDA公衆衛生勧告:磁気共鳴画像法におけるガドリニウム含有造影剤」fda.gov。 2006年9月28日時点のオリジナルよりアーカイブ。
- ^ 「ガドリニウム含有造影剤:腎性全身性線維症のリスクを最小限に抑えるための新たなアドバイス」『医薬品安全性アップデート』3 (6):3.2010年1月。
- ^ 「MRIに関する質問と回答」(PDF) . カリフォルニア州コンコード:国際磁気共鳴医学会. 2010年8月2日閲覧。
- ^ Kanal, Emanuel; Broome, Dale R.; Martin, Diego R.; Thomsen, Henrik S. (2007-09-12). 「FDAの2007年5月23日付腎性全身性線維症アップデート1への対応 — 放射線学」 .放射線学. 246 (1). 北米放射線学会誌: 11–14 . doi : 10.1148/radiol.2461071267 . PMID 17855656. 2012年7月19日時点のオリジナルよりアーカイブ。 2010年8月2日閲覧。
- ^ Jones J, Gaillard F (2015年6月4日). 「MRIシーケンス(概要)」 . Radiopaedia . 2017年10月15日閲覧。
- ^ a b c d「磁気共鳴画像法」ウィスコンシン大学。2017年5月10日時点のオリジナルよりアーカイブ。2016年3月14日閲覧。
- ^ a b c d Johnson KA. 「基本的なプロトンMRイメージング。組織信号特性」ハーバード大学医学大学院。 2016年3月5日時点のオリジナルよりアーカイブ。 2016年3月14日閲覧。
- ^ Henkelman, RM; Hardy, PA; Bishop, JE; Poon, CS; Plewes, DB (1992年9月). 「RARE法および高速スピンエコー法で脂肪が明るく見える理由」. Journal of magnetic resonance imaging : JMRI . 2 (5): 533–40 . doi : 10.1002/jmri.1880020511 . PMID 1392246 .
- ^ Graham D, Cloke P, Vosper M (2011-05-31).放射線物理学の原理と応用 電子書籍(第6版). Elsevier Health Sciences. p. 292. ISBN 978-0-7020-4614-8。}
- ^ du Plessis V, Jones J. 「MRIシーケンス(概要)」Radiopaedia . 2017年1月13日閲覧。
- ^ Lefevre N, Naouri JF, Herman S, Gerometta A, Klouche S, Bohu Y (2016). 「メニスカス画像の最新レビュー:その放射線学的分析のための有用なツールの提案」 . Radiology Research and Practice . 2016 8329296. doi : 10.1155 /2016/8329296 . PMC 4766355. PMID 27057352 .
- ^ a b Luijkx T、Weerakody Y. 「定常状態自由歳差運動 MRI」。ラジオペディア。2017年10月13日に取得。
- ^ a b Chavhan GB, Babyn PS, Thomas B, Shroff MM, Haacke EM (2009). 「T2*ベースMRイメージングの原理、技術、応用、およびその特殊応用」 . Radiographics . 29 ( 5): 1433–49 . doi : 10.1148/rg.295095034 . PMC 2799958. PMID 19755604 .
- ^ a b Di Muzio B, Gaillard F. 「磁化率重み付けイメージング」2017年10月15日閲覧。
- ^ Sharma R, Taghi Niknejad M. 「Short tau inversion recovery」 Radiopaedia . 2017年10月13日閲覧。
- ^ Berger F, de Jonge M, Smithuis R, Maas M. 「ストレス骨折」放射線科助手オランダ放射線学会2017年10月13日閲覧。
- ^ Hacking C, Taghi Niknejad M, et al. "Fluid attenuation inversion recoveryg" . radiopaedia.org . 2015年12月3日閲覧。
- ^ a b Di Muzio B, Abd Rabou A. 「Double inversion recovery sequence」 Radiopaedia . 2017年10月13日閲覧。
- ^ Lee M、Bashir U. 「拡散強調イメージング」。ラジオペディア。2017年10月13日に取得。
- ^ウィーラッコディ Y、ゲイラード F. 「虚血性脳卒中」。ラジオペディア。2017 年 10 月 15 日に取得。
- ^ Hammer M. 「MRI物理学:拡散強調画像」 XRayPhysics . 2017年10月15日閲覧。
- ^ An H, Ford AL, Vo K, Powers WJ, Lee JM, Lin W (2011年5月). 「急性虚血性脳卒中における見かけの拡散係数病変の信号変化と梗塞リスクは、時間と灌流の両方に依存する」 . Stroke . 42 (5): 1276–81 . doi : 10.1161/STROKEAHA.110.610501 . PMC 3384724. PMID 21454821 .
- ^ a b Smith D, Bashir U. 「拡散テンソル画像法」 Radiopaedia . 2017年10月13日閲覧。
- ^ Chua TC, Wen W, Slavin MJ, Sachdev PS (2008年2月). 「軽度認知障害およびアルツハイマー病における拡散テンソルイメージング:レビュー」Current Opinion in Neurology . 21 (1): 83– 92. doi : 10.1097/WCO.0b013e3282f4594b . PMID 18180656 . S2CID 24731783 .
- ^ Gaillard F. 「動的磁化率コントラスト(DSC)MR灌流」 Radiopaedia . 2017年10月14日閲覧。
- ^ Chen F, Ni YC (2012年3月). 「急性虚血性脳卒中における磁気共鳴拡散灌流ミスマッチ:最新情報」 . World Journal of Radiology . 4 (3): 63– 74. doi : 10.4329 / wjr.v4.i3.63 . PMC 3314930. PMID 22468186 .
- ^ 「動脈スピンラベリング」ミシガン大学。 2017年10月27日閲覧。
- ^ Gaillard F. 「動脈スピンラベリング(ASL)MR灌流」 Radiopaedia . 2017年10月15日閲覧。
- ^ Gaillard F. 「ダイナミックコントラスト強調(DCE)MR灌流」 Radiopaedia . 2017年10月15日閲覧。
- ^ Turnbull LW (2009年1月). 「乳がんの診断と管理におけるダイナミック造影MRI」. NMR in Biomedicine . 22 (1): 28– 39. doi : 10.1002/nbm.1273 . PMID 18654999. S2CID 5305422 .
- ^ Chou Ih. 「Milestone 19: (1990) Functional MRI」 Nature 2013年8月9日閲覧。
- ^ Luijkx T、Gaillard F. 「機能的 MRI」。ラジオペディア。2017年10月16日に取得。
- ^ a b「磁気共鳴血管造影(MRA)」ジョンズ・ホプキンス病院。 2017年10月15日閲覧。
- ^ Keshavamurthy J, Ballinger R et al. 「位相コントラストイメージング」 Radiopaedia . 2017年10月15日閲覧。
- ^ Landheer K, Schulte RF, Treacy MS, Swanberg KM, Juchem C (2020年4月). 「現代の1 H in vivo 磁気共鳴分光パルスシーケンスの理論的記述」. Journal of Magnetic Resonance Imaging . 51 (4): 1008– 1029. doi : 10.1002 / jmri.26846 . PMID 31273880. S2CID 195806833 .
- ^ Rosen Y, Lenkinski RE (2007年7月). 「磁気共鳴神経分光法の最近の進歩」 . Neurotherapeutics . 4 (3): 330–45 . doi : 10.1016/j.nurt.2007.04.009 . PMC 7479727. PMID 17599700 .
- ^ Golder W (2004年6月). 「臨床腫瘍学における磁気共鳴分光法」. Onkologie . 27 (3): 304–9 . doi : 10.1159/000077983 . PMID 15249722. S2CID 20644834 .
- ^ Chakeres DW, Abduljalil AM, Novak P, Novak V (2002). 「ラクナ梗塞における1.5テスラと8テスラの高解像度磁気共鳴画像法の比較」Journal of Computer Assisted Tomography . 26 (4): 628–32 . doi : 10.1097/00004728-200207000-00027 . PMID 12218832 . S2CID 32536398 .
- ^ “MRI-scanner van 7 miljoen in gebruik” [700万ユーロのMRIスキャナーが使用中] (オランダ語)。メディッシュコンタクト。 2007 年 12 月 5 日。
- ^ Abeida H, Zhang Q, Li J, Merabtine N (2013). 「反復スパース漸近最小分散に基づくアレイ処理アプローチ」. IEEE Transactions on Signal Processing . 61 (4): 933–44 . arXiv : 1802.03070 . Bibcode : 2013ITSP...61..933A . doi : 10.1109/tsp.2012.2231676 . S2CID 16276001 .
- ^ S Zhang, M Uecker, D Voit, KD Merboldt, J Frahm (2010a) 高時間分解能リアルタイム心血管磁気共鳴:非線形逆再構成による放射状FLASH法 J Cardiovasc Magn Reson 12, 39, [1] doi : 10.1186/1532-429X-12-39
- ^ M Uecker, S Zhang, D Voit, A Karaus, KD Merboldt, J Frahm (2010a) 20ms解像度でのリアルタイムMRI NMR Biomed 23: 986-994, [2] doi : 10.1002/nbm.1585
- ^ a b Uyanik I, Lindner P, Tsiamyrtzis P, Shah D, Tsekos NV, Pavlidis IT (2013). 「自由呼吸および非心電図同期心臓MRIにおける生理的運動の解析のためのレベルセット法の適用」.心臓の機能イメージングとモデリング. コンピュータサイエンス講義ノート. 第7945巻. pp. 466– 473. doi : 10.1007/978-3-642-38899-6_55 . ISBN 978-3-642-38898-9. ISSN 0302-9743 . S2CID 16840737 .
- ^ Lewin JS (1999年5月). 「インターベンショナルMRイメージング:神経放射線学における概念、システム、および応用」 . AJNR. American Journal of Neuroradiology . 20 (5): 735–48 . PMC 7056143. PMID 10369339 .
- ^ Sisk JE (2013). The Gale Encyclopedia of Nursing and Allied Health (第3版). Farmington, MI: Gale. ISBN 978-1-4144-9888-1– Credo Referenceより。
- ^ Cline HE, Schenck JF, Hynynen K, Watkins RD, Souza SP, Jolesz FA (1992). 「MR誘導集束超音波手術」. Journal of Computer Assisted Tomography . 16 (6): 956– 65. doi : 10.1097/00004728-199211000-00024 . PMID 1430448. S2CID 11944489 .
- ^ Gore JC, Yankeelov TE, Peterson TE, Avison MJ (2009年6月). 「放射性医薬品を使用しない分子イメージング?」 . Journal of Nuclear Medicine . 50 ( 6 ). Society of Nuclear Medicine: 999–1007 . doi : 10.2967 / jnumed.108.059576 . PMC 2719757. PMID 19443583 .
- ^ 「超分極希ガスMRI実験室:脳の超分極キセノンMRI画像」ハーバード大学医学部。2018年9月20日時点のオリジナルよりアーカイブ。 2017年7月26日閲覧。
- ^ Hurd RE, John BK (1991). 「勾配増強プロトン検出異核多重量子コヒーレンス分光法」. Journal of Magnetic Resonance . 91 (3): 648–53 . Bibcode : 1991JMagR..91..648H . doi : 10.1016/0022-2364(91)90395-a .
- ^ Brown RA, Venters RA, Tang PP, Spicer LD (1995). 「勾配増強プロトン検出HMQC分光法を用いた異核間のスケーラー結合の検査」. Journal of Magnetic Resonance, Series A. 113 ( 1): 117–19 . Bibcode : 1995JMagR.113..117B . doi : 10.1006/jmra.1995.1064 .
- ^ Miller AF, Egan LA, Townsend CA (1997年3月). 「抗生物質ペプチド中の異なる位置における結合同位体濃縮度のNMRによる測定」 . Journal of Magnetic Resonance . 125 (1): 120–31 . Bibcode : 1997JMagR.125..120M . doi : 10.1006 / jmre.1997.1107 . PMID 9245367. S2CID 14022996 .
- ^ Necus J, Sinha N, Smith FE, Thelwall PE, Flowers CJ, Taylor PN, 他 (2019年6月). 「双極性障害における白質微細構造特性と脳内リチウムの空間分布との関係」 . Journal of Affective Disorders . 253 : 224– 231. doi : 10.1016/j.jad.2019.04.075 . PMC 6609924. PMID 31054448 .
- ^ Gallagher FA (2010年7月). 「MRIによる機能的・分子イメージング入門」.臨床放射線学. 65 (7): 557–66 . doi : 10.1016/j.crad.2010.04.006 . PMID 20541655 .
- ^ Xue S, Qiao J, Pu F, Cameron M, Yang JJ (2013). 「がんバイオマーカーの分子イメージングのための、新規タンパク質ベース磁気共鳴画像造影剤の設計」 . Wiley Interdisciplinary Reviews. ナノメディシン・アンド・ナノバイオテクノロジー. 5 (2): 163– 79. doi : 10.1002/wnan.1205 . PMC 4011496. PMID 23335551 .
- ^ Liu CH, Kim YR, Ren JQ, Eichler F, Rosen BR, Liu PK (2007年1月). 「生きた動物における脳遺伝子転写の画像化」 . The Journal of Neuroscience . 27 (3): 713–22 . doi : 10.1523/JNEUROSCI.4660-06.2007 . PMC 2647966. PMID 17234603 .
- ^ Liu CH, Ren J, Liu CM, Liu PK (2014年1月). 「DNAアプタマーを用いたin vivoでの細胞内遺伝子転写因子タンパク質誘導MRI」 . FASEB Journal . 28 (1): 464– 73. doi : 10.1096/fj.13-234229 . PMC 3868842. PMID 24115049 .
- ^ Liu CH, You Z, Liu CM, Kim YR, Whalen MJ, Rosen BR, Liu PK (2009年3月). 「生きた動物脳におけるマトリックスメタロプロテアーゼ-9活性の遺伝子ノックダウンによる拡散強調磁気共鳴画像法の反転」 . The Journal of Neuroscience . 29 (11): 3508–17 . doi : 10.1523/JNEUROSCI.5332-08.2009 . PMC 2726707. PMID 19295156 .
- ^ Liu CH, Yang J, Ren JQ, Liu CM, You Z, Liu PK (2013年2月). 「MRIは、生体内でのアンフェタミン曝露による神経膠細胞への異なる影響を明らかにする」 . FASEB Journal . 27 (2): 712–24 . doi : 10.1096/fj.12-220061 . PMC 3545538. PMID 23150521 .
- ^ Sodickson DK, Manning WJ (1997年10月). 「空間高調波同時取得(SMASH):無線周波数コイルアレイによる高速イメージング」. Magnetic Resonance in Medicine . 38 (4): 591– 603. doi : 10.1002/mrm.1910380414 . PMID 9324327. S2CID 17505246 .
- ^ Pruessmann KP, Weiger M, Scheidegger MB, Boesiger P (1999年11月). 「SENSE: 高速MRIのための感度エンコーディング」 . Magnetic Resonance in Medicine . 42 (5): 952–62 . doi : 10.1002/(SICI)1522-2594(199911)42:5<952::AID-MRM16>3.0.CO;2- S . PMID 10542355. S2CID 16046989 .
- ^ Griswold MA, Jakob PM, Heidemann RM, Nittka M, Jellus V, Wang J, Kiefer B, Haase A (2002年6月). 「一般化自動キャリブレーション部分並列取得(GRAPPA)」 . Magnetic Resonance in Medicine . 47 (6): 1202–10 . doi : 10.1002/ mrm.10171 . PMID 12111967. S2CID 14724155 .
- ^ a b Gulani, Vikas & Nicole, Sieberlich (2020). 「定量的MRI:その根拠と課題」.定量的磁気共鳴画像法. 学術出版. p. xxxvii-li. doi : 10.1016/B978-0-12-817057-1.00001-9 . ISBN 978-0-12-817057-1. S2CID 234995365 .
- ^ Captur, G; Manisty, C; Moon, JC (2016). 「心筋疾患の心臓MRI評価」Heart . 102 (18): 1429–35 . doi : 10.1136/heartjnl-2015-309077 . PMID 27354273 . S2CID 23647168 .
- ^ Cobianchi Bellisari, F; De Marino, L; Arrigoni, F; Mariani, S; Bruno, F; Palumbo, P; et al. (2021). 「関節内多血小板血漿(PRP)注入を受けた患者における膝蓋大腿軟骨のT2マッピングMRI評価」 Radiol Med . 126 (8 ) : 1085– 1094. doi : 10.1007/s11547-021-01372-6 . PMC 8292236. PMID 34008045 .
- ^ Gaillard, Frank; Knipe, Henry (2021年10月13日). 「髄液流速研究 | 放射線学参考文献」 . Radiopaedia . doi : 10.53347/rID-37401 . 2021年11月24日閲覧。
- ^セバスチャン・ハーシュ;ブラウン、ユルゲン。サック、インゴルフ (2016)。磁気共鳴エラストグラフィー |ワイリーオンラインブックス。土井: 10.1002/9783527696017。ISBN 978-3-527-69601-7. 2022年3月5日時点のオリジナルよりアーカイブ。2022年3月6日閲覧。
- ^ a b Ma D, Gulani V, Seiberlich N, Liu K, Sunshine JL, Duerk JL, et al. (2013). 「磁気共鳴フィンガープリンティング」 . Nature . 495 (7440): 187–92 . Bibcode : 2013Natur.495..187M . doi : 10.1038 / nature11971 . PMC 3602925. PMID 23486058 .
- ^ Seiler A, Nöth U, Hok P, Reiländer A , Maiworm M, Baudrexel S, et al. (2021). 「神経疾患におけるマルチパラメトリック定量MRI」 . Front Neurol . 12 640239. doi : 10.3389/fneur.2021.640239 . PMC 7982527. PMID 33763021 .
- ^ Warntjes JB, Leinhard OD, West J, Lundberg P (2008). 「脳における迅速な磁気共鳴定量:臨床応用のための最適化」 . Magn Reson Med . 60 (2): 320–9 . doi : 10.1002/mrm.21635 . PMID 18666127. S2CID 11617224 .
- ^ Ehses P, Seiberlich N, Ma D, Breuer FA, Jakob PM, Griswold MA, et al. (2013). 「黄金比ベースのラジアル読み出しを備えたIR TrueFISP:T1、T2、およびプロトン密度の高速定量化」 . Magn Reson Med . 69 (1): 71– 81. doi : 10.1002 / mrm.24225 . PMID 22378141. S2CID 24244167 .
- ^ Watson RE (2015). 「MRI安全イベントから学んだ教訓」Current Radiology Reports . 3 (10) 37. doi : 10.1007/s40134-015-0122-z . S2CID 57880401 .
- ^ Mervak BM, Altun E, McGinty KA, Hyslop WB, Semelka RC, Burke LM (2019年3月). 「妊娠中のMRI:適応と実際的な検討事項」. Journal of Magnetic Resonance Imaging . 49 (3): 621– 631. doi : 10.1002 / jmri.26317 . PMID 30701610. S2CID 73412175 .
- ^ "iRefer" . 英国放射線科医会. 2014年2月3日時点のオリジナルよりアーカイブ。2013年11月10日閲覧。
- ^ Murphy KJ, Brunberg JA (1997). 「MRIにおける成人の閉所恐怖症、不安、鎮静」.磁気共鳴画像法. 15 (1). Elsevier BV: 51–4 . doi : 10.1016/s0730-725x(96)00351-7 . PMID 9084025 .
- ^ Shahrouki, Puja; Nguyen, Kim-Lien; Moriarty, John M.; Plotnik, Adam N.; Yoshida, Takegawa; Finn, J. Paul (2021-09-01). 「閉所恐怖症患者の手術台滞在時間短縮のための集束フェルモキシトール造影MR血管造影(f-FEMRA)を用いた実現可能性研究」. The British Journal of Radiology . 94 (1125) 20210430. doi : 10.1259/bjr.20210430 . ISSN 0007-1285 . PMC 9327752. PMID 34415199 .
- ^ Klein V, Davids M, Schad LR, Wald LL, Guérin B (2021年2月). 「ヒトおよびイヌの人体モデルにおける電磁気学的および電気生理学的シミュレーションを用いたMRI傾斜磁場コイルの心臓刺激限界の調査」 . Magnetic Resonance in Medicine . 85 (2): 1047– 1061. doi : 10.1002/mrm.28472 . PMC 7722025. PMID 32812280 .
- ^フランス通信社(2018年1月30日)「インドの病院でMRIスキャナーに吸い込まれ男性が死亡」ガーディアン紙。
- ^ 「人口1,000人あたりの磁気共鳴画像(MRI)検査数、2014年」 OECD 、 2016年。
- ^ Mansouri M, Aran S, Harvey HB, Shaqdan KW, Abujudeh HH (2016年4月). 「大規模大学医療センターにおけるMRI検査における安全インシデント報告率」 . Journal of Magnetic Resonance Imaging . 43 (4). John Wiley and Sons : 998–1007 . doi : 10.1002/jmri.25055 . PMID 26483127. S2CID 25245904 .
- ^ Price, DL; De Wilde, JP; Papadaki, AM; Curran, JS; Kitney, RI (2001年2月). 「0.2 Tから3 TまでのMRIスキャナ15台における音響ノイズの調査」 . Journal of Magnetic Resonance Imaging . 13 (2): 288– 293. doi : 10.1002/1522-2586(200102)13:2<288::aid-jmri1041>3.0.co;2- p . ISSN 1053-1807 . PMID 11169836. S2CID 20684100 .
- ^ a bエラスムス LJ、ハーター D、ナウデ M、クリツィンガー HG、アチョ S (2004)。「MRI アーティファクトの概要」。南アフリカ放射線学ジャーナル。8 (2): 13.土井: 10.4102/sajr.v8i2.127。
- ^ Van As H (2006-11-30). 「細胞内の水分移動、膜透過性、細胞間および長距離水輸送の研究のための無傷植物MRI」 . Journal of Experimental Botany . 58 (4). Oxford University Press (OUP): 743–56 . doi : 10.1093/jxb/erl157 . PMID 17175554 .
- ^ Ziegler A, Kunth M, Mueller S, Bock C, Pohmann R, Schröder L, Faber C, Giribet G (2011-10-13). 「磁気共鳴画像の動物学への応用」.動物形態学. 130 (4). Springer Science and Business Media LLC: 227– 254. doi : 10.1007/s00435-011-0138-8 . hdl : 11858/00-001M-0000-0013-B8B0-B . ISSN 0720-213X . S2CID 43555012 .
- ^ Giovannetti G, Guerrini A, Salvadori PA (2016年7月). 「化石研究のための磁気共鳴分光法とイメージング」.磁気共鳴イメージング. 34 (6). Elsevier BV: 730– 742. doi : 10.1016/j.mri.2016.03.010 . PMID 26979538 .
- ^ a b Filograna L, Pugliese L, Muto M, Tatulli D, Guglielmi G, Thali MJ, Floris R (2019年2月). 「バーチャル剖検の実践ガイド:なぜ、いつ、どのように」.超音波、CT、MRセミナー. 40 (1): 56– 66. doi : 10.1053/j.sult.2018.10.011 . PMID 30686369. S2CID 59304740 .
- ^ Ruder TD, Thali MJ, Hatch GM (2014年4月). 「成人における法医学的死後MRI検査のエッセンス」 . The British Journal of Radiology . 87 (1036) 20130567. doi : 10.1259/bjr.20130567 . PMC 4067017. PMID 24191122 .
- ^ LAUTERBUR, PC (1973). 「誘起局所相互作用による画像形成:核磁気共鳴を用いた例」. Nature . 242 ( 5394 ). Springer Science and Business Media LLC: 190–191 . Bibcode : 1973Natur.242..190L . doi : 10.1038/242190a0 . ISSN 0028-0836 . S2CID 4176060 .
- ^マンスフィールド P、グランネル PK (1975)。 」「NMRによる固体および液体の「回折」と顕微鏡観察」。Physical Review B. 12 ( 9): 3618–34 . Bibcode : 1975PhRvB..12.3618M . doi : 10.1103/physrevb.12.3618 .
- ^サンドミール、リチャード(2022年8月17日)「世界初のMRIスキャナーの開発者、レイモンド・ダマディアン氏が86歳で死去」ニューヨーク・タイムズ(NYTimes.com経由)。
- ^ Rosenblum B, Kuttner F (2011). 『量子の謎:物理学と意識の遭遇』オックスフォード大学出版局. p. 127. ISBN 978-0-19-979295-5。
- ^ 「2003年ノーベル生理学・医学賞」ノーベル財団。2007年7月18日時点のオリジナルよりアーカイブ。 2007年7月28日閲覧。
さらに読む
- Blümer P (1998). Blümler P, Blümich B, Botto RE, Fukushima E (編).空間分解磁気共鳴:手法、材料、医学、生物学、レオロジー、地質学、生態学、ハードウェア. Wiley-VCH. ISBN 978-3-527-29637-8。
- Blümich B, Kuhn W (1992).磁気共鳴顕微鏡法:材料科学、農業、生物医学における方法と応用. Wiley. ISBN 978-3-527-28403-0。
- Blümich B (2000). NMRによる材料のイメージング. Clarendon Press. ISBN 978-0-19-850683-6。
- Eustace SJ, Nelson E (2004年6月). 「全身磁気共鳴画像法」 . BMJ . 328 (7453): 1387–8 . doi : 10.1136/bmj.328.7453.1387 . PMC 421763. PMID 15191954 .
- Farhat IA, Belton P, Webb GA (2007).食品科学における磁気共鳴:分子から人間へ. 英国王立化学協会. ISBN 978-0-85404-340-8。
- 福島 栄一 (1989).バイオメディシンにおけるNMR:物理的基礎. Springer Science & Business Media. ISBN 978-0-88318-609-1。
- Haacke EM, Brown RF, Thompson M, Venkatesan R (1999).磁気共鳴イメージング:物理的原理とシーケンス設計. ニューヨーク: J. Wiley & Sons. ISBN 978-0-471-35128-3。
- Jin (1998).磁気共鳴イメージングにおける電磁気解析と設計. CRC Press. ISBN 978-0-8493-9693-9。
- Kuperman V (2000).磁気共鳴イメージング:物理的原理と応用. アカデミックプレス. ISBN 978-0-08-053570-8。
- Lee SC, Kim K, Kim J, Lee S, Han Yi J, Kim SW, 他 (2001年6月). 「1マイクロメートル分解能のNMR顕微鏡法」. Journal of Magnetic Resonance . 150 ( 2): 207–13 . Bibcode : 2001JMagR.150..207L . doi : 10.1006/jmre.2001.2319 . PMID 11384182 .
- Liang ZP, Lauterbur PC (1999).磁気共鳴イメージングの原理:信号処理の観点. Wiley. ISBN 978-0-7803-4723-6。
- マンスフィールドP (1982).バイオメディシンにおけるNMRイメージング:補足2 磁気共鳴の進歩. エルゼビア. ISBN 978-0-323-15406-2。
- Pykett IL (1982年5月). 「医療におけるNMRイメージング」. Scientific American . 246 (5): 78–88 . Bibcode : 1982SciAm.246e..78P . doi : 10.1038/scientificamerican0582-78 . PMID 7079720 .
- リンク PA (編)。「MRIの歴史」。TRTF/EMRF。
- Sakr, HM; Fahmy, N; Elsayed, NS; Abdulhady, H; El-Sobky, TA; Saadawy, AM; Beroud, C; Udd, B (2021年7月1日). 「LAMA2関連先天性筋ジストロフィー児の全身筋MRI特性:新たなパターン」. Neuromuscular Disorders . 31 (9): 814– 823. doi : 10.1016/j.nmd.2021.06.012 . PMID 34481707. S2CID 235691786 .
- Schmitt F, Stehling MK, Turner R (1998).エコープラナーイメージング:理論、技術、応用. Springer Berlin Heidelberg. ISBN 978-3-540-63194-1。
- Simon M, Mattson JS (1996).医療におけるNMRと磁気共鳴の先駆者たち:MRIの歴史. ラマト・ガン, イスラエル: Bar-Ilan University Press. ISBN 978-0-9619243-1-7。
- Sprawls P (2000).磁気共鳴画像法:原理、方法、および技術. Medical Physics Publishing. ISBN 978-0-944838-97-6。
外部リンク
- Rinck PA(編). 「MRI:査読付き批評的入門」 .欧州磁気共鳴フォーラム(EMRF)/ラウンドテーブル財団(TRTF) .
- MRIガイドツアー:一般の方のための入門国立高磁場研究所
- MRIの基礎。基礎となる物理学と技術的側面。
- ビデオ:磁気共鳴安全教育研究研究所 (IMRSER) によるMRI 検査中に何が起こるか
- 英国王立研究所講演会 – MRI:人体を見る窓
- ヨーロッパの観点から見た磁気共鳴画像法の短い歴史
- MRIの仕組みを図解でわかりやすく解説
- リアルタイム MRI ビデオ: Biomedizinische NMR Forschungs GmbH。
- ポール・C・ラウターバー著『MRI(磁気共鳴画像)ノートブックの起源』1971年9月(全ページは、 Science History Institute Digital Collections(digital.sciencehistory.org)からさまざまな形式で無料でダウンロードできます)



