卵胞形成
- このプロセスは多くの動物で同様ですが、この記事では人間の卵胞形成についてのみ扱います。

生物学において、卵胞形成とは、未熟な卵母細胞を含む体細胞の密集した殻である卵巣卵胞の成熟を指します。卵胞形成とは、月経周期中に部分的に起こる、多数の小さな原始卵胞が大きな排卵前卵胞へと発達することを指します。
男性の精子形成は無期限に続くこともありますが、卵胞形成は、卵巣に残っている卵胞が、以前に一部の卵胞を成熟へと導いたホルモンのシグナルに反応できなくなった時点で終了します。この卵胞供給の枯渇は、閉経の始まりを告げるものです。1つの卵胞における卵胞形成の各周期は約2ヶ月半続きます。
概要
卵胞の主な役割は卵母細胞のサポートです。女性が生まれながらに持つ卵胞全体のうち、排卵に至るのはわずか0.1%で、残りの99.9%は(卵胞閉鎖と呼ばれる過程で)消滅します。人間の女性の卵巣には、生まれたときから多くの未熟な原始卵胞が含まれています。これらの卵胞にはそれぞれ、同様に未熟な一次卵母細胞が含まれています。思春期になると、卵胞の小集団が卵胞形成を開始し、排卵(卵母細胞が卵胞から離脱する過程)または閉鎖(卵胞の顆粒膜細胞の死)に至る成長パターンに入ります。
卵胞発育の過程で、原始卵胞は組織学的にもホルモン学的にも一連の重要な形質変化を経験する。まず一次卵胞へと変化し、その後二次卵胞へと変化する。その後、卵胞は三次卵胞、すなわち胞状卵胞へと移行する。この段階では、卵胞はホルモン、特にFSHに依存するようになり、成長速度が大幅に上昇する。三次卵胞後期、すなわち排卵前卵胞は破裂し、二次卵母細胞となった卵母細胞を排出することで、卵胞形成は終了する。
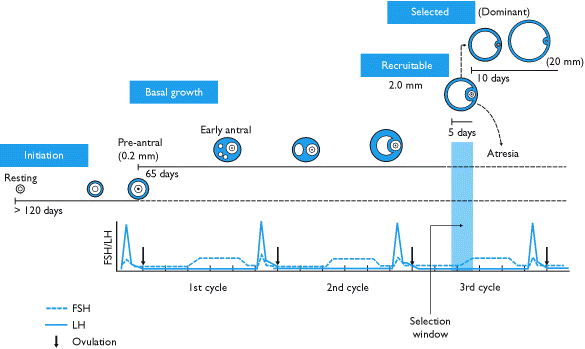
卵胞の「選択」とは、選抜されたコホートまたはウェーブから、優先的に成長するために単一の「優勢」卵胞が選ばれるプロセスです。これは通常、月経周期の卵胞期初期から中期に一度起こり、排卵につながることが記録されています。[ 1 ]
開発の段階
卵胞形成は継続的であり、卵巣には常に様々な発育段階にある卵胞が存在することを意味します。ほとんどの卵胞は死滅し、発育を完了することはありません。少数の卵胞は完全に発育し、二次卵母細胞を形成します。二次卵母細胞は、排卵と呼ばれる過程において卵胞の破裂によって放出されます。
成長する卵胞は、特定の構造的特徴によって定義される以下の明確な段階を経ます。
より大きな視点で見ると、原始卵胞から排卵前卵胞までの卵胞形成全体は、卵形成の卵母細胞形成の段階に属します。
| ステージ | 説明 | サイズ |
|---|---|---|
| 原始的 | 休眠状態、小型、扁平顆粒膜細胞の1層のみ | 原始卵胞の直径は約0.03~0.05 mmです。 |
| 主要な | 有糸分裂細胞、立方顆粒膜細胞 | 直径約0.1mm |
| 二次 | 莢膜細胞、複数層の顆粒膜細胞の存在 | 卵胞の直径は0.2mmになりました |
| 第三紀前期 | 初期第三卵胞は任意に5つのクラスに分類されます。クラス1の卵胞の直径は0.2mm、クラス2は約0.4mm、クラス3は約0.9mm、クラス4は約2mm、クラス5は約5mmです。 | |
| 第三紀後期 | 幽門が完全に形成され、それ以上の細胞分化はなく、新たな進行はない | クラス6の卵胞の直径は約10mm、クラス7は約16mm、クラス8は約20mmです。非優位卵胞がクラス5を超えて成長することはよくありますが、クラス8の卵胞が複数あることは稀です。 |
| 排卵前 | エストロゲン濃度が上昇し、他の卵胞は退縮または死滅する |
さらに、幽門卵胞を形成した卵胞は、幽門卵胞またはグラーフ卵胞と呼ばれます。この移行が上記の段階におけるどこで起こるかについては定義が異なり、第二期に入る際に起こるとする説もあれば、[ 2 ]第三期に入る際に起こるとする説もあります。[ 3 ]
排卵前期までは、卵胞内には減数分裂Iの前期で停止した一次卵母細胞が含まれています。排卵前期後期には、卵母細胞は減数分裂を継続し、二次卵母細胞となり、中期IIで停止します。

原始的
受精後18~22週目には、女性の卵巣皮質(胎児期の女性卵巣)に含まれる卵胞の数がピークに達します(平均で約400万~500万個ですが、個々のピーク時には600万~700万個に及びます)。[ 4 ]これらの原始卵胞には、基底膜によって卵母細胞周囲の環境から隔離された扁平な顆粒膜細胞(支持細胞)に囲まれた未熟な卵母細胞が含まれています。卵母細胞は静止状態にあり、生物学的活動はほとんど、あるいは全く示しません。ヒトでは原始卵胞は最大50年間休眠状態にあるため、卵巣周期の長さにはこの期間は含まれません。
卵胞の数は出生前にわずかに減少し、平均的なケースでは思春期までに50万個にまで減少します(思春期の卵胞数は2万5000個から150万個の範囲です)。[ 4 ]卵胞形成の「非効率性」のため(後述)、これらの卵胞のうち排卵前期に達するのはわずか400~500個です。閉経時には、卵胞数はわずか1000個しか残っていません。出生時の卵胞数が少ない女性は早期閉経、出生時の卵胞数が多い女性は遅期閉経となる可能性が高いと考えられますが、これに関する臨床的証拠はまだありません。[ 4 ]
原始細胞が「目覚める」プロセスは、初期リクルートメントとして知られています。研究によると、初期リクルートメントは、様々な刺激性ホルモンと抑制性ホルモン、そして局所的に産生される成長因子のバランスによって媒介されることが示されています。[ 5 ]
主要な
卵胞活性化の過程では、原始卵胞の顆粒膜細胞が扁平から立方体構造へと変化し、一次卵胞の形成が始まります。卵母細胞ゲノムが活性化され、遺伝子転写が始まります。卵胞と卵母細胞間の情報伝達に不可欠な、基本的な傍分泌シグナル伝達経路が形成されます。卵母細胞と卵胞はともに劇的に成長し、直径はほぼ0.1mmにまで大きくなります。
一次卵胞はこの時点で卵胞刺激ホルモン(FSH)受容体を発達させますが、胞状卵胞期まではゴナドトロピン非依存性です。しかし、研究により、FSHの存在は体外受精において卵胞の成長を促進することが示されています。
透明帯と呼ばれる糖タンパク質ポリマーカプセルが卵母細胞の周りに形成され、周囲の顆粒膜細胞から卵母細胞を隔離します。排卵後も卵母細胞に残る透明帯には、精子の侵入を触媒する酵素が含まれています。
二次
間質様の莢膜細胞は、卵母細胞から分泌されるシグナルによって動員される。これらの細胞は卵胞の最外層である基底膜を取り囲み、細胞分化を経て外莢膜と内莢膜となる。これら二つの莢膜層の間には毛細血管の複雑なネットワークが形成され、卵胞への血液循環と卵胞からの血液循環が開始する。
後期二次卵胞は、組織学的および構造的に、透明帯、約9層の顆粒層細胞、基底膜、内莢膜、毛細血管網、外莢膜に囲まれた成熟卵母細胞によって特徴づけられます。また、二次卵胞期には、幽門洞の発達も始まります。
幽門形成
卵母細胞に隣接して、卵胞腔と呼ばれる液体で満たされた空洞が形成されると、その卵胞は「胞状卵胞」と呼ばれます。これは、まだ胞状卵胞腔を持たない「前胞状卵胞」とは対照的です。胞状卵胞はグラーフ卵胞とも呼ばれます。
この変化がどの段階で起こるかについては定義が異なり、第2期の卵胞を胞状卵胞と呼ぶ人もいれば、[ 2 ]前胞状卵胞と呼ぶ人もいます。[ 3 ]
第三紀前期
第三期卵胞では、成熟卵胞の基本構造が形成されており、新たな細胞は検出されません。顆粒層細胞と莢膜細胞は有糸分裂を継続し、同時に幽門容積が増加します。第三期卵胞は、FSHの供給によってのみ、非常に大きなサイズに成長することができます。そして、FSHへの依存度が、この成長を阻害するのです。
卵母細胞から分泌される形態形成勾配の作用下で、第三期卵胞の顆粒膜細胞は4つの異なるサブタイプへと分化します。透明帯を取り囲む放線冠、基底膜の内側にある膜状細胞、そして幽門と卵丘に隣接する卵丘周囲細胞(膜状細胞と放線冠顆粒膜細胞を繋ぐ)です。それぞれの細胞タイプは、FSHに対する反応において異なる挙動を示します。
莢膜内細胞は黄体形成ホルモン( LH )受容体を発現しています。LHは莢膜細胞によるアンドロゲン、特にアンドロステンジオン(アンドロゲン受容体)の産生を誘導します。アンドロゲンは顆粒膜細胞によって芳香化され、主にエストラジオール(エストロゲン)を産生します。その結果、エストロゲン濃度が上昇し始めます。
第三期後期および排卵前期(月経周期の卵胞期)
この時点で、成長を開始した卵胞群の大部分は死滅しています。この卵胞死の過程は閉鎖症と呼ばれ、構成細胞と卵母細胞すべてにおける根治的アポトーシスを特徴とします。閉鎖症の原因は不明ですが、高濃度のFSHが閉鎖症を予防することが示されています。
月経周期の終わりに黄体が崩壊することで下垂体中のFSHが上昇し、次の周期に参加する5~7個のクラス5卵胞が刺激されます。これらの卵胞は前の月経周期の終わりに卵胞期に入り、次の月経周期の卵胞期に移行します。選ばれた卵胞は胞状卵胞と呼ばれ、成長を促すFSHを求めて互いに競合します。
5~7個の胞状卵胞群の出現パターンについては議論が続いています。胞状卵胞が継続的に補充されるという説、黄体期末期に一度だけ補充されるという説、そして最近では、月経周期中に2~3回の卵胞補充と発育の波(実際にはそのうち1回だけが排卵波である)を特徴とする補充モデルを裏付ける証拠が示されています。[ 6 ]
FSHの上昇に反応して、胞状卵胞はエストロゲンとインヒビンを分泌し始め、これらはFSHに負のフィードバック効果をもたらします。[ 7 ] FSH受容体の数が少ない卵胞はそれ以上発育できず、成長速度が低下し、閉鎖状態になります。最終的には、生存可能な卵胞は1つだけになります。残った卵胞は主席卵胞と呼ばれ、直径20mmまで急速に成長し、排卵前卵胞となります。
月経周期における卵胞期とは、第三期卵胞が選択されてから排卵前卵胞へと成長するまでの期間を指します。卵胞の発育にかかる実際の時間は様々です。
卵胞期における優勢卵胞の成長は、自然周期および経口避妊薬(POL)を服用しながら発育する優勢卵胞のいずれの場合も、1日あたり約1.5mm(±0.1mm)である。[ 8 ]制御性卵巣過剰刺激を行うと、より多くの卵胞が集まり、1日あたり約1.6mmの速度で成長する。[ 8 ]
排卵と黄体
月経周期13日目の卵胞期(または増殖期)の終わりまでに、排卵前卵胞の卵丘層に開口部(柱頭)が形成され、排卵と呼ばれる過程において卵母細胞と卵丘細胞が排泄されます。自然周期では、少なくとも14mmの卵胞で排卵が起こる可能性があります。[ 9 ]
卵母細胞は、技術的にはまだ二次卵母細胞であり、減数分裂第二中期に留まっています。受精によって卵母細胞(卵管)へと発達し、その後急速に卵子へと成長します(減数分裂第二期の完了)。卵母細胞は卵管を下り、受精しなかった場合、または子宮に着床しなかった(既に受精していた場合)場合は、最終的には月経によって排出されます。
エストラジオールが増加し、LH(およびFSH)の排卵ピークを引き起こします。このピークは(AMPcを介して)炎症誘発遺伝子を活性化し、卵胞壁の破裂を引き起こし、卵母細胞が排出されます。破裂した卵胞は劇的な変化を遂げ、黄体へと変化します。黄体はステロイド産生細胞群であり、大量のプロゲステロンと微量のエストロゲンを分泌することで子宮内膜を維持します。
これら2つのステップは卵胞形成の一部ではありませんが、網羅性を保つためにここに記載しています。それぞれの論文でその全容が論じられており、月経周期に関する論文ではその全体像が概観されています。これら3つのトピックを改めて確認することをお勧めします。
ホルモン機能
生殖器系に関連するほとんどのものと同様に、卵胞形成は内分泌系によって制御されています。卵胞形成を制御するために、5つのホルモンが正と負のフィードバックという複雑なプロセスに関与しています。それらは以下のとおりです。
- 視床下部から分泌されるゴナドトロピン放出ホルモン(GnRH)
- 2つのゴナドトロピン:
- エストロゲン
- プロゲステロン
GnRHは下垂体前葉からのFSHとLHの放出を刺激し、後に卵胞の成長を刺激します(ただし、FSHとLHに依存するのは胞状卵胞のみであるため、すぐには効果が現れません)。三次卵胞に莢膜細胞が形成されると、エストロゲンの量が急激に増加します(莢膜由来のアンドロゲンは顆粒膜細胞によってエストロゲンに芳香族化されます)。
低濃度のエストロゲンはゴナドトロピンの分泌を抑制しますが、高濃度のエストロゲンはゴナドトロピンを刺激します。さらに、エストロゲンの分泌量が増えると、卵胞膜細胞でLH受容体がさらに多く産生され、卵胞膜細胞はアンドロゲンの産生を促し、これが下流のエストロゲンとなります。この正のフィードバックループによりLHが急上昇し、この急上昇が排卵を引き起こします。
排卵後、LHは黄体形成を刺激します。排卵後、エストロゲンは陰性刺激レベルまで低下するため、FSHとLHの濃度を維持する役割を果たします。同じく黄体から分泌されるインヒビンは、FSHの抑制に寄与します。黄体から分泌されるプロゲステロンは、卵胞の成長を抑制し、妊娠を維持します。
内分泌系は月経周期と一致し、正常な卵胞形成過程において13周期(したがって13回のLHスパイク)を経ます。しかし、酵素シグナル伝達の協調とホルモン受容体の時間特異的な発現により、これらの早期スパイク発生中に卵胞の成長が乱れることはありません。
卵胞の数

最近、2つの論文が、出生時に限られた数の卵胞が形成されるという考えに異議を唱えました。[ 11 ] [ 12 ]マウスの出生後卵巣において、骨髄および末梢血由来の生殖系列幹細胞から卵胞が再生することが報告されました。これらの結果を再現しようとする研究が進行中ですが、325個のヒト卵巣集団を対象とした研究では、卵胞の再生を裏付ける証拠は得られませんでした。[ 4 ]
2010年、エディンバラ大学の研究者らは、女性が30歳になるまでに、成長していない卵胞(NGF)はわずか10%しか残っていないことを突き止めました。[ 4 ]女性は生まれたときに卵胞形成に必要な卵胞をすべて持っていますが、閉経まで着実に減少していきます。
卵巣予備能の枯渇
女性(およびマウス)は加齢に伴い、原始卵胞予備能に二本鎖切断が蓄積していきます。これらの卵胞には、減数分裂の最初の細胞分裂の前期で停止した一次卵母細胞が含まれています。二本鎖切断は、減数分裂中に一致する鎖を探索し、それを基に構築することで正確に修復されます(「相同組換え修復」と呼ばれます)。Titusら[ 13 ](2013)は、ヒト(およびマウス)が加齢するにつれて、相同組換え修復に必要な4つの主要なDNA修復遺伝子の発現が卵母細胞で低下することを発見しました。彼らは、DNA二本鎖切断修復は卵母細胞予備能の維持に不可欠であり、加齢に伴う修復効率の低下が卵巣予備能の枯渇(卵巣老化)に重要な役割を果たしているという仮説を立てました。
参照
追加画像
- 卵巣の断面。(#5から#9は卵胞形成の段階を表す)
- 移行性一次卵胞。
参考文献
- ^ Baerwald, Angela R.; Adams, Gregg P.; Pierson, Roger A. (2012). 「ヒトの月経周期における卵巣胞状卵胞形成:レビュー」 . Human Reproduction Update . 18 (1): 73– 91. doi : 10.1093/humupd/dmr039 . ISSN 1460-2369 . PMID 22068695 .
- ^ a b 769ページ、「幽門形成」の項:Sherwood, Lauralee. (2010). Human physiology: from cells to system . Australia; United States: Brooks/Cole. ISBN 978-0-495-39184-5。
- ^ a b 76ページ in: Vandenhurk, R.; Bevers, M.; Beckers, J. (1997). 「in vivoおよびin vitroにおける前胞状卵胞の発達」Theriogenology . 47 : 73– 82. doi : 10.1016/S0093-691X(96)00341-X .
- ^ a b c d e Wallace, WHB; Kelsey, TW (2010). 「受胎から閉経までのヒト卵巣予備能」 . PLOS ONE . 5 (1) e8772. arXiv : 1106.1382 . Bibcode : 2010PLoSO...5.8772W . doi : 10.1371/journal.pone.0008772 . PMC 2811725. PMID 20111701 .
- ^ Fortune J, Cushman R, Wahl C, Kito S (2000). 「原始卵胞から一次卵胞への移行」 . Mol Cell Endocrinol . 163 ( 1– 2): 53– 60. doi : 10.1016/S0303-7207(99)00240-3 . PMID 10963874. S2CID 8746207 .
- ^ 「ヒトの月経周期における卵巣胞状卵胞形成:レビュー」 ResearchGate . 2019年1月23日閲覧。
- ^ de Ziegler D (2007)、「卵胞期におけるFSHとLHの役割:自然周期IVFへの洞察」、RBMオンライン第15巻第5号、508ページ
- ^ a b Baerwald, Angela R.; Walker, Randy A.; Pierson, Roger A. (2009). 「自然月経周期、経口避妊周期、および卵巣刺激周期における卵胞の成長率」 . Fertility and Sterility . 91 (2): 440– 449. doi : 10.1016/j.fertnstert.2007.11.054 . ISSN 0015-0282 . PMID 18249401 .
- ^ Michael K. Skinner (2018). Encyclopedia of Reproduction (2 ed.). Academic Press. ISBN 34ページ 978-0-12-815145-7。
- ^ Wallace, W. Hamish B.; Thomas W. Kelsey (2010-01-27). 「受胎から閉経までのヒト卵巣予備能」 . PLOS ONE . 5 (1) e8772. arXiv : 1106.1382 . Bibcode : 2010PLoSO...5.8772W . doi : 10.1371 /journal.pone.0008772 . PMC 2811725. PMID 20111701 .
- ^ Johnson J, Bagley J, Skaznik-Wikiel M, Lee H, Adams G, Niikura Y, Tschudy K, Tilly J, Cortes M, Forkert R, Spitzer T, Iacomini J, Scadden D, Tilly J (2005). 「成体哺乳類の卵巣における骨髄および末梢血中の推定生殖細胞による卵母細胞生成」. Cell . 122 ( 2): 303–15 . doi : 10.1016 / j.cell.2005.06.031 . PMC 11771209. PMID 16051153. S2CID 19006732 .
- ^ Johnson J, Canning J, Kaneko T, Pru J, Tilly J (2004). 「哺乳類の出生後卵巣における生殖系列幹細胞と卵胞再生」. Nature . 428 ( 6979): 145–50 . Bibcode : 2004Natur.428..145J . doi : 10.1038/nature02316 . PMID 15014492. S2CID 1124530 .
- ^ Titus, S; Li, F; Stobezki, R; Akula, K; Unsal, E; Jeong, K; Dickler, M; Robson, M; Moy, F; Goswami, S; Oktay, K (2013). 「BRCA1関連DNA二本鎖切断修復の障害はマウスおよびヒトの卵巣老化につながる」 . Sci Transl Med . 5 (172): 172. doi : 10.1126/scitranslmed.3004925 . PMC 5130338. PMID 23408054 .
- Caglar G, Asimakopoulos B, Nikolettos N, Diedrich K, Al-Hasani S (2005). 「卵巣刺激における組換えLH」 . Reprod Biomed Online . 10 (6): 774– 85. doi : 10.1016/S1472-6483(10)61123-6 . PMID 15970010 .
- Fortune, JE; Yang, MY; Muruvi, W (2010). Lucy, MC; Pate, JL; Smith, MF; Spencer, TE (編). 「卵胞発育の初期段階:卵胞形成と活性化」 . Soc Reprod Fertil Suppl . 67 : 203–16 . doi : 10.7313/upo9781907284991.018 (2025年7月12日現在休止). ISBN 978-1-907284-99-1. PMC 5316466 . PMID 21755674 .
{{cite journal}}: CS1 maint: DOIは2025年7月時点で非アクティブです(リンク) - Gougeon A (1996). 「霊長類における卵胞発育の制御:事実と仮説」 . Endocr Rev. 17 ( 2): 121–55 . doi : 10.1210/edrv-17-2-121 . PMID 8706629 .
- Gougeon A (1986). 「ヒトにおける卵胞成長のダイナミクス:予備的結果に基づくモデル」Hum Reprod . 1 (2): 81–7 . doi : 10.1093/oxfordjournals.humrep.a136365 . PMID 3558758 .
- van den Hurk R, Zhao J (2005). 「哺乳類卵母細胞の形成と卵胞内での成長、分化、成熟」 . Theriogenology . 63 (6): 1717–51 . doi : 10.1016/j.theriogenology.2004.08.005 . PMID 15763114 .
- Uzumcu, Mehmet; Zachow, Rob (2007). 「発達期における環境内分泌攪乱化学物質への曝露:卵巣および女性の生殖機能への影響」.生殖毒性学. 23 (3): 337– 352. Bibcode : 2007RepTx..23..337U . doi : 10.1016/j.reprotox.2006.10.006 . PMC 1950429. PMID 17140764 .

.jpg/440px-Primary_follicle_(transition).jpg)