| |||
| |||
| 名前 | |||
|---|---|---|---|
| 発音 | / ˈ ɛ θ ə n ɒ l / | ||
| 推奨IUPAC名
エタノール[ 1 ] | |||
その他の名前
| |||
| 識別子 | |||
| |||
3Dモデル(JSmol)
|
|||
| 1718733 | |||
| チェビ |
| ||
| チェムブル |
| ||
| ケムスパイダー |
| ||
| ドラッグバンク |
| ||
| ECHA 情報カード | 100.000.526 | ||
| 787 | |||
| ケッグ | |||
PubChem CID
|
|||
| ユニイ |
| ||
| 国連番号 | 国連1170 | ||
CompToxダッシュボード (EPA)
|
|||
| |||
| |||
| プロパティ | |||
| C 2 H 6 O | |||
| モル質量 | 46.069 グラム/モル | ||
| 外観 | 無色の液体 | ||
| 臭い | ワインのような、刺激的な[ 2 ] | ||
| 密度 | 0.78945 g/cm 3(20℃)[ 3 ] | ||
| 融点 | −114.14 ± 0.03 [ 3 ] °C (−173.45 ± 0.05 °F; 159.01 ± 0.03 K) | ||
| 沸点 | 78.23 ± 0.09 [ 3 ] °C (172.81 ± 0.16 °F; 351.38 ± 0.09 K) | ||
| 混和性 | |||
| ログP | −0.31 | ||
| 蒸気圧 | 5.95 kPa(20℃) | ||
| 酸性度( p Ka ) | 15.9 (H2O )、29.8 (DMSO) [ 4 ] [ 5 ] | ||
磁化率(χ)
|
−33.60·10 −6 cm 3 /モル | ||
屈折率(nD )
|
1.3611 [ 3 ] | ||
| 粘度 | 1.2 mPa·s(20℃)、1.074 mPa·s(25℃)[ 6 ] | ||
| 1.69 D [ 7 ] | |||
| 危険 | |||
| GHSラベル: | |||
 
| |||
| 危険 | |||
| H225、H319、H360D | |||
| P210、P233、P240、P241、P242、P305+P351+P338 | |||
| NFPA 704(ファイアダイヤモンド) | |||
| 引火点 | 14℃(絶対)[ 9 ] | ||
| 致死量または濃度(LD、LC): | |||
LD 50(中間投与量)
|
| ||
| NIOSH(米国健康曝露限界): | |||
PEL(許可)
|
TWA 1000 ppm (1900 mg/m 3 ) [ 10 ] | ||
REL(推奨)
|
TWA 1000 ppm (1900 mg/m 3 ) [ 10 ] | ||
IDLH(差し迫った危険)
|
3300 ppm [ 10 ] | ||
| 安全データシート(SDS) | [ 8 ] | ||
| 関連化合物 | |||
関連化合物
|
|||
| 補足データページ | |||
| エタノール(データページ) | |||
特に記載がない限り、データは標準状態(25 °C [77 °F]、100 kPa)における材料のものです。
| |||
エタノール(エチルアルコール、穀物アルコール、飲用アルコール、あるいは単にアルコールとも呼ばれる)は、化学式CH 3 CH 2 OHで表される有機化合物である。エタノールはアルコールの一種であり、化学式はC 2 H 5 OH、C 2 H 6 O、あるいはEtOHとも表記される(Etはエチルの擬似元素記号)。エタノールは揮発性、可燃性、無色の液体で、刺激臭がある。[ 11 ] [ 12 ]精神抑制剤として、アルコール飲料の有効成分であり、カフェインに次いで世界で2番目に消費されている薬物である。[ 13 ]
エタノールは、酵母による糖の発酵プロセス、またはエチレン水和などの石油化学プロセスによって自然に生成されます。歴史的には全身麻酔薬として使用されており、現代医療では防腐剤、殺菌剤、一部の医薬品の溶媒、メタノール中毒およびエチレングリコール中毒の解毒剤として使用されています。[ 14 ] [ 15 ]化学溶媒として、また有機化合物の合成、ランプ、ストーブ、内燃機関の燃料源として使用されます。エタノールは脱水して重要な化学原料であるエチレンを生成することもできます。2023年時点で、エタノール燃料の世界生産量は112.0ギガリットル(2.96 × 10 10米ガロン)で、その大部分は米国(51%)とブラジル(26%)によるものでした。[ 16 ]
「エタノール」という用語は、1834年に造られたエチル基に由来し、1892年に正式に採用されましたが、「アルコール」は現在では同様の化合物を広く指していますが、もともと粉末状の化粧品を指し、後にエタノールのみを指すようになりました。[ 17 ]エタノールは、熟しすぎた果物やヤシの花などの環境で酵母代謝 の副産物として自然に発生し、嫌気性条件下での植物の発芽時、星間空間、人間の呼吸の中にも存在し、まれに自動醸造症候群によって体内で生成されることもあります。
エタノールは古代から麻薬として使用されてきました。発酵と蒸留による生産は、様々な文化圏で何世紀にもわたって発展してきました。化学的同定と合成生産は19世紀に始まりました。
名前
[編集]エタノールは、国際純正応用化学連合によって定義された体系名 であり、 2つの炭素原子(接頭辞「eth-」)を持つアルキル基と、それらの間に単結合(接尾辞「-an-」)を持ち、さらに付加された-OH官能基(接尾辞「-ol」)からなる化合物である。[ 18 ]
「エチルアルコール」の接頭辞「eth-」と修飾語「ethyl」は、もともと1834年にC群に割り当てられた「ethyl」という名称に由来する。
2H
5−ユストゥス・リービッヒ。彼は化合物Cのドイツ語名エーテルからこの言葉を造った。
2H
5−O− C
2H
5(英語では一般に「エーテル」、より具体的には「ジエチルエーテル」と呼ばれる)。[ 19 ]オックスフォード英語辞典によると、エチルは古代ギリシャ語のαἰθήρ(aithḗr、「上空の」)とギリシャ語のὕλη(hýlē、「木材、原材料」、したがって「物質、実体」)の短縮形である。[ 20 ] エタノールは、1892年4月にスイスのジュネーブで開催された国際化学命名法会議で採択されたアルコールとフェノールの命名に関する決議の結果として造られた。[ 21 ]
アルコールという用語は、現在では化学用語ではより広範な物質群を指すようになりましたが、日常会話ではエタノールという名称が使われています。これは中世にアラビア語の 「al-kuḥl 」 (古代から化粧品として用いられてきたアンチモンの粉末鉱石)から借用されたもので、中期ラテン語でもその意味を保持していました。[ 22 ]エタノール(完全形は「ワインのアルコール」)を指す「アルコール」の使用は1753年に初めて記録されました。18世紀後半以前は、アルコールという用語は一般的に昇華した物質を指していました。[ 23 ]
用途
[編集]娯楽用薬物
[編集]エタノールは中枢神経 抑制剤として、最も一般的に消費される向精神薬の一つです。[ 24 ]アルコールには精神活性作用、中毒性、発がん性があるにもかかわらず、[ 25 ]多くの国では容易に入手でき、合法的に販売されています。アルコール飲料の販売、輸出入、課税、製造、消費、所持を規制する法律があります。最も一般的な規制は、物品税と未成年者への販売禁止です。
哺乳類では、エタノールは主に肝臓と胃でADH酵素によって代謝されます。[ 26 ]これらの酵素はエタノールをアセトアルデヒド(エタナール)に酸化する触媒作用をします。 [ 27 ]
- CH 3 CH 2 OH + NAD + → CH 3 CHO + NADH + H +
ヒトにおいて、エタノールが高濃度で存在する場合、このエタノール代謝はシトクロムP450酵素CYP2E1によってさらに促進され、微量であればカタラーゼによっても代謝される。[ 28 ]生成される中間体であるアセトアルデヒドは発がん性物質として知られており、ヒトに対してエタノール自体よりも著しく強い毒性を示す。アルコール中毒に典型的に伴って現れる症状の多く、そして長期にわたるエタノール摂取に典型的に伴って現れる健康被害の多くは、ヒトにおけるアセトアルデヒドの毒性に起因すると考えられる。[ 29 ]
アセトアルデヒドから酢酸への酸化は、アルデヒド脱水素酵素(ALDH)によって行われます。この酵素の不活性型または機能不全型をコードするALDH2遺伝子の変異は、東アジア人の約50%に影響を及ぼし、一時的な皮膚の発赤や、アセトアルデヒド中毒に関連する、しばしば不快な症状を引き起こす特徴的なアルコールフラッシュ反応の一因となっています。 [ 30 ]この変異は、東アジア人の約80%において、エタノールをアセトアルデヒドに変換する触媒効率を向上させるADH酵素ADH1Bの別の変異を伴うのが一般的です。[ 30 ]
医学
[編集]エタノールは最も古い鎮静剤として知られており、古代メソポタミアや中世の手術で経口全身麻酔薬として使用されていました。[ 14 ] [ 15 ]血中アルコール濃度が0.03 ~ 0.05%で軽度の中毒が始まり、 0.4%で麻酔性昏睡を引き起こします。 [ 31 ]この使用法は、致命的なアルコール中毒、肺への誤嚥、嘔吐のリスクが高く、古代ではアヘンや大麻などの代替品が使用され、後に1840年代からジエチルエーテルが使用されるようになりました。[ 32 ]
エタノールは、その殺菌・抗真菌作用から、医療用ワイプや手指消毒ジェルの消毒剤として使用されています。 [ 33 ]エタノールは、微生物の膜脂質二重層を溶解し、タンパク質を変性させることで微生物を死滅させ、ほとんどの細菌、真菌、ウイルスに効果があります。細菌の胞子には効果がありませんが、過酸化水素で処理できます。[ 34 ]
70%エタノール溶液は、純粋なエタノールよりも効果的です。これは、エタノールが最適な抗菌活性を発揮するために水分子に依存しているためです。無水エタノールは、アルコールが微生物の膜を完全に透過できないため、微生物を死滅させることなく不活性化する可能性があります。[ 35 ] [ 36 ]エタノールは、細胞膜の浸透圧バランスを崩すことで細胞の脱水を引き起こし、細胞から水分を排出させて細胞死に導くため、消毒剤や防腐剤としても使用できます。[ 37 ]
エタノールはエチレングリコール中毒[ 38 ]およびメタノール中毒[ 39 ]の解毒剤として投与されることがある。これはメタノールとエチレングリコールに対するアルコール脱水素酵素(ADH)の競合阻害剤として作用することによって行われる。[ 40 ]エタノールは副作用が多いものの、この役割においてフォメピゾールよりも安価で入手しやすい。 [ 41 ]
エタノールは、多くの水に溶けない薬剤や関連化合物を溶解するために使用されます。例えば、鎮痛剤、咳止め薬、風邪薬、洗口液などの液剤には、最大25%のエタノールが含まれている場合があります[ 42 ]。そのため、アルコール誘発性呼吸器反応など、エタノールに副作用のある人は使用を避ける必要があります[ 43 ]。エタノールは、アセトアミノフェン、鉄剤、ラニチジン、フロセミド、マンニトール、フェノバルビタール、トリメトプリム/スルファメトキサゾール、市販の 咳止め薬など、700種類以上の液剤に主に抗菌防腐剤として含まれています[ 44 ]。
エタノールの薬液の中にはチンキ剤とも呼ばれるものがあります。
エネルギー源
[編集]
エタノールの最大の用途は、エンジン燃料と燃料添加剤です。特にブラジルは、世界有数のエタノール生産国であることから、エンジン燃料としてのエタノールの使用に大きく依存しています。[ 45 ] [ 46 ] ブラジルで販売されているガソリンには、少なくとも25%の無水エタノールが含まれています。含水エタノール(約95%のエタノールと5%の水)は、ブラジルで販売されている新車のガソリン車の90%以上で燃料として使用できます。
米国をはじめとする多くの国では、主にE10(エタノール10%、ガソホールとも呼ばれる)とE85(エタノール85%)のエタノール/ガソリン混合燃料が使用されています。今後、年間約1500億米ガロン(5億7000万立方メートル)のガソリン市場の大部分が燃料用エタノールに置き換えられ始めると考えられています。[ 47 ]

オーストラリアの法律では、自動車におけるサトウキビ廃棄物由来の純粋エタノールの使用は10%までに制限されています。古い車(および燃焼速度の遅い燃料を使用するように設計されたヴィンテージカー)は、エンジンバルブのアップグレードまたは交換が必要です。[ 48 ]
業界擁護団体によると、燃料としてのエタノールは、一酸化炭素、粒子状物質、窒素酸化物、その他のオゾン形成汚染物質の有害な排気管からの排出を削減します。 [ 49 ]アルゴンヌ国立研究所は、多くの異なるエンジンと燃料の組み合わせの温室効果ガス排出量を分析し、純粋なガソリンと比較して、バイオディーゼル/石油ディーゼル混合物(B20)は8%の削減を示し、従来のE85エタノール混合物は17%の削減、セルロースエタノールは64%の削減を示しました。[ 50 ]エタノールはガソリンよりもはるかに高いリサーチオクタン価(RON)を持ち、これはつまり、プレイグニッションが起こりにくく、より良い点火進角を可能にし、炭素排出量の削減に加えてトルクと効率の向上につながります。[ 51 ]
内燃機関でエタノールを燃焼させると、ガソリンで生成される不完全燃焼生成物の多くと、かなり大量のホルムアルデヒドやアセトアルデヒドなどの関連物質が生成される。[ 52 ]これにより、光化学反応性が著しく高まり、地上オゾン層が増加する。[ 53 ]このデータは、燃料排出量の比較に関する「クリーン燃料レポート」にまとめられており[ 54 ]、エタノールの排気ガスはガソリンの排気ガスの2.14倍のオゾンを生成することが示されている。[ 55 ]これを「クリーン燃料レポート」のカスタム局所汚染指数に追加すると、エタノールの局所汚染(スモッグの原因となる汚染)は1.7と評価される。ガソリンは1.0で、数値が高いほど汚染が大きいことを意味する。[ 56 ]カリフォルニア大気資源局は、従来のNOxや反応性有機ガス(ROG)と同様に、ホルムアルデヒドの規制基準を排出ガス規制グループとして認めることで、2008年にこの問題を正式化した。[ 57 ]
ブラジルの自動車の20%以上は、エタノール100%を燃料として使用できます。これには、エタノール専用エンジンとフレックス燃料エンジンが含まれます。[ 58 ]ブラジルのフレックス燃料エンジンは、エタノール100%、ガソリン100%、またはその両方の混合で作動します。米国では、より高いエタノール混合はまだ許可されておらず、効率的でないため、フレックス燃料車は0%から85%のエタノール(ガソリン15%)で走行できます。ブラジルは、国内産のサトウキビからエタノールを生産する大規模な国家インフラによって、このエタノール燃料自動車の普及を支援しています。
エタノールは水と混和性が高いため、液体炭化水素のように現代のパイプラインで輸送するには適していません。 [ 59 ]整備士は小型エンジン(特にキャブレター)の損傷事例の増加を目の当たりにしており、燃料中のエタノールによる水分保持の増加が損傷の原因であると考えています。[ 60 ]
エタノールは初期の二液推進 ロケット(液体推進)の燃料として、液体酸素などの酸化剤と組み合わせて一般的に使用されていました。第二次世界大戦中のドイツのA-4弾道ロケット(プロパガンダ名V-2でよく知られています)[ 61 ]は、宇宙時代の幕開けとなったとされており、 B-ストッフの主成分としてエタノールを使用していました。このような命名法では、燃焼室の温度を下げるためにエタノールに25%の水を混合しました。[ 62 ] [ 63 ] V -2の設計チームは、第二次世界大戦後の米国のロケット開発に貢献し、その中には米国初の宇宙飛行士を弾道飛行に乗せたエタノール燃料のレッドストーンロケットも含まれています。[ 64 ] [ 65 ]よりエネルギー密度の高いロケット燃料が開発されるにつれて、アルコールは一般的に使用されなくなったが、[ 63 ]エタノールは最近の実験的な軽量ロケット推進レース航空機で使用された。[ 66 ]
商用燃料電池は、改質天然ガス、水素、またはメタノールを燃料として動作します。エタノールは、入手しやすく、低コスト、高純度、低毒性であることから、魅力的な代替燃料です。直接エタノール燃料電池、自己熱改質システム、熱統合システムなど、幅広い燃料電池コンセプトが試験段階にあります。エタノール燃料電池の商業化に着手した組織は数多くありますが、研究段階にある研究が大部分を占めています。[ 67 ]
エタノール暖炉は、家庭暖房や装飾に使用できます。また、調理用のストーブ燃料としても使用できます。[ 68 ] [ 69 ]
| 燃料の種類 | MJ/L | MJ/kg | オクタン価 の研究 |
|---|---|---|---|
| 乾燥木材(水分20%) | 約19.5 | ||
| メタノール | 17.9 | 19.9 | 108.7 [ 70 ] |
| エタノール | 21.2 [ 71 ] | 26.8 [ 71 ] | 108.6 [ 70 ] |
| E85 (エタノール85%、ガソリン15%) |
25.2 | 33.2 | 105 |
| 液化天然ガス | 25.3 | 約55 | |
| オートガス( LPG ) (60%プロパン+ 40%ブタン) |
26.8 | 50 | |
| 航空ガソリン (ジェット燃料ではなく、高オクタン価ガソリン) |
33.5 | 46.8 | 100/130(リーン/リッチ) |
| ガソホール (ガソリン90% + エタノール10%) |
33.7 | 47.1 | 93/94 |
| レギュラーガソリン | 34.8 | 44.4 [ 72 ] | 最小91 |
| プレミアムガソリン | 最大104 | ||
| ディーゼル | 38.6 | 45.4 | 25 |
| 木炭、押し出し成形 | 50 | 23 |
その他の用途
[編集]エタノールは、ハロゲン化エチル、エチルエステル、ジエチルエーテル、酢酸、エチルアミンなどの他の有機化合物の前駆体として広く使用されている重要な工業原料です。エタノールは分子構造上、極性で親水性の化合物と非極性で疎水性の化合物の両方を溶解できるため、万能溶媒と考えられています。また、エタノールは沸点が低いため、他の化合物を溶解した溶液から簡単に除去でき、植物油の抽出剤として人気があります。大麻油の抽出方法では、エタノールは抽出溶媒としてよく使用され、[ 73 ]また、ウィンタリゼーションと呼ばれるプロセスで溶液から油、ワックス、クロロフィルを除去するための後処理溶媒としても使用されます。[ 74 ]
エタノールは、塗料、チンキ剤、マーカー、洗口液、香水、消臭剤などのパーソナルケア製品、湿潤標本の保存料などに使用されています。[ 75 ] 多糖類は アルコールの存在下では水溶液から沈殿するため、エタノール沈殿はDNAやRNAの精製に使用されています。[ 76 ]エタノールは凝固点が-114℃(-173℉)と低く、毒性も低いため、実験室ではドライアイスなどの冷却剤とともに冷却槽として使用され、容器を水の凝固点未満に保つことがあります。[ 77 ]同じ理由で、エタノールはアルコール温度計の活性流体としても使用されています。
化学
[編集]This section needs additional citations for verification. (November 2024) |
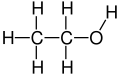
エタノールは2炭素アルコールです。分子式はCH 3 CH 2 OHです。エタノール分子の構造はCH 3 −CH 2 −OH(エチル基がヒドロキシル基に結合)で、メチル基(−CH 3)の炭素がメチレン基(−CH 2 − )の炭素に結合し、メチレン基はヒドロキシル基( −OH )の酸素に結合しています。エタノールはジメチルエーテルの構造異性体です。エチル基( −CH 2 CH 3 )をEtで表す一般的な有機化学表記法に倣い、エタノールはEtOHと略されることもあります。
物理的特性
[編集]
エタノールは揮発性で無色の液体で、わずかに臭いがあります。燃焼時に煙の出ない青い炎を発しますが、通常の光では必ずしも見えません。エタノールの物理的性質は、主に水酸基の存在と炭素鎖の短さに起因しています。エタノールの水酸基は水素結合を形成するため、プロパンなどの同分子量の極性の低い有機化合物よりも粘性が高く、揮発性が低くなります。[ 78 ]
エタノールの空気中での断熱炎温度は2082℃または3779℉である。[ 79 ]
エタノールは水よりもわずかに屈折率が高く、屈折率は1.36242(λ=589.3 nm、18.35 °Cまたは65.03 °F)です。[ 80 ]エタノールの三重点は150 ± 20 Kです。[ 81 ]
溶媒の性質
[編集]エタノールは多用途の溶媒であり、水や酢酸、アセトン、ベンゼン、四塩化炭素、クロロホルム、ジエチルエーテル、エチレングリコール、グリセロール、ニトロメタン、ピリジン、トルエンなどの多くの有機溶媒と混和します。溶媒としての主な用途は、ヨウ素チンキや咳止めシロップなどです。[ 80 ] [ 82 ]また、ペンタンやヘキサンなどの軽質脂肪族炭化水素、トリクロロエタンやテトラクロロエチレンなどの脂肪族塩化物とも混和します。[ 82 ]
エタノールと水の混和性は、長鎖アルコール(炭素原子5個以上)の水との混和性とは対照的である。長鎖アルコールの水との混和性は、炭素数の増加に伴い急激に低下する。[ 83 ]エタノールとアルカンの混和性は、ウンデカンまでのアルカンに限られる。ドデカンおよびそれ以上のアルカンとの混合物は、ある温度(ドデカンの場合は約13℃ [ 84 ] )以下で混和性ギャップを示す。この混和性ギャップは、アルカンが多くなるにつれて広がる傾向があり、完全に混和する温度は上昇する。
エタノールと水の混合物は、それぞれの成分の合計よりも体積が小さくなります。等量のエタノールと水を混合すると、混合物の体積はわずか1.92倍になります。[ 80 ] [ 85 ]エタノールと水の混合は発熱反応であり、298 Kで最大777 J/mol [ 86 ]の熱エネルギーが放出されます。

水素結合により、純粋なエタノールは空気中の水分を容易に吸収するほど吸湿性があります。水酸基の極性により、エタノールは多くのイオン性化合物、特に水酸化ナトリウム、水酸化カリウム、塩化マグネシウム、塩化カルシウム、塩化アンモニウム、臭化アンモニウム、臭化ナトリウムを溶解します。[ 82 ] 塩化ナトリウムと塩化カリウムはエタノールにわずかに溶けます。[ 82 ]エタノール分子は非極性末端も持つため、ほとんどの精油[ 87 ]や多くの香料、着色料、医薬品など の非極性物質も溶解します。
水に数パーセントのエタノールを加えるだけで、水の表面張力は急激に低下します。この性質は「ワインの涙」現象を部分的に説明しています。ワインをグラスの中で回すと、グラスの壁に薄い膜が張ったワインからエタノールが急速に蒸発します。ワインのエタノール含有量が減少するにつれて、表面張力が増加し、薄い膜は「玉状」になり、滑らかなシート状ではなく、溝状にグラスを流れ落ちます。
水との共沸混合物
[編集]大気圧下では、エタノールと水の混合物は、エタノールが約 89.4 モル%(質量で 95.6%のエタノール、[ 88 ]体積で97%のアルコール)の共沸混合物を形成し、沸点は 351.3 K(78.2 °C; 172.7 °F)です。[ 89 ]低圧下では、エタノールと水の共沸混合物の組成は、エタノールを多く含む混合物に変わります。[ 90 ]最小圧力共沸混合物は、エタノール分率が 100%[ 90 ]、沸点が 306 K(33 °C; 91 °F)で、[ 89 ]およそ 70 torr (9.333 kPa)の圧力に相当します 。[ 91 ]この圧力以下では共沸混合物は存在せず、エタノールと水の混合物から無水エタノールを蒸留することができます。[ 91 ]
可燃性
[編集]エタノール水溶液は、引火点と呼ばれる温度以上に加熱し、発火源を加えると発火します。[ 92 ]アルコール度数20%(体積比約25%)の場合には、約25℃(77℉)で発火します。純粋なエタノールの引火点は13℃(55℉)ですが、[ 93 ]圧力や湿度などの大気の組成によってわずかに影響を受けることがあります。エタノール混合物は、平均室温より低い温度でも発火する可能性があります。エタノールは、濃度が質量比2.35%(体積比3.0%、6プルーフ)を超えると、可燃性液体(クラス3危険物)とみなされます。[ 94 ] [ 95 ] [ 96 ]アルコールを燃焼させて効果を出す料理はフランベと呼ばれます。
| エタノール モル分率、% |
温度 | |
|---|---|---|
| °C | °F | |
| 1 | 84.5 | 184.1 [ 95 ] |
| 2 | 64 | 147 [ 95 ] |
| 2.35 | 60 | 140 [ 95 ] [ 94 ] |
| 3 | 51.5 | 124.7 [ 95 ] |
| 5 | 43 | 109 [ 97 ] |
| 6 | 39.5 | 103.1 [ 95 ] |
| 10 | 31 | 88 [ 97 ] |
| 20 | 25 | 77 [ 95 ] |
| 30 | 24 | 75 [ 97 ] |
| 50 | 20 | 68 [ 97 ] [ 95 ] |
| 70 | 16 | 61 [ 97 ] |
| 80 | 15.8 | 60.4 [ 95 ] |
| 90 | 14 | 57 [ 97 ] |
| 100 | 12.5 | 54.5 [ 97 ] [ 95 ] [ 93 ] |
自然発生
[編集]エタノールは酵母の代謝過程の副産物です。そのため、酵母の生息地には必ずエタノールが存在します。エタノールは、熟しすぎた果物によく見られます。[ 99 ]共生酵母によって生成されるエタノールは、ベタムヤシの花に含まれています。ペンテールツパイなどの一部の動物種はエタノールを求める行動を示しますが、ほとんどの動物種はエタノールを含む食物源に興味を示さず、回避もしません。[ 100 ]多くの植物の発芽時にも、自然な嫌気性反応の結果としてエタノールが生成されます。[ 101 ]
エタノールは宇宙空間でも検出されており、星間雲の塵の粒子の周りに氷の膜を形成しています。[ 102 ]健康なボランティアの呼気中に 微量(平均196ppb )の内因性エタノールとアセトアルデヒドが検出されました。 [ 103 ] 自己醸造症候群は腸管発酵症候群としても知られ、消化器系内での内因性 発酵によって中毒量のエタノールが生成されるまれな病状です。[ 104 ]
生産
[編集]
エタノールは、石油化学製品としてエチレンの水和によって生産されるほか、生物学的プロセスとして酵母で糖を発酵させることによっても生産されます。[ 105 ]どちらのプロセスがより経済的であるかは、石油と穀物の飼料原料 の実勢価格によって決まります。
出典
[編集]2006年の世界のエタノール生産量は51ギガリットル(1.3 × 10 10 米ガロン)で、世界の供給量の69%はブラジルと米国によるものでした。[ 16 ]ブラジルのエタノールはサトウキビから生産されており、他のエネルギー作物と比較して比較的収量が高く(生産に使用される化石燃料よりも830%多い燃料です) 、 [ 106 ]サトウキビはトウモロコシよりもショ糖の濃度が高いだけでなく(約30%)、抽出もはるかに簡単です。この過程で発生するバガスは廃棄されず、発電所で焼却され発電されます。バガスの燃焼はブラジルで生産される電力の約9%を占めています。[ 107 ]
1970年代、米国における工業用エタノールの大部分は石油化学製品として製造されていましたが、1980年代に米国はトウモロコシ由来のエタノールに対する補助金制度を導入しました。[ 108 ]再生可能燃料協会によると、2007年10月30日現在、米国には131の穀物エタノールバイオ精製所があり、年間70億米ガロン(2,600万立方メートル)のエタノール生産能力を有しています。さらに、米国で現在進行中の72の建設プロジェクトにより、今後18ヶ月で64億米ガロン(2,400万立方メートル)の新たな生産能力が追加される可能性があります。[ 47 ]
インドでは、エタノールはサトウキビから作られています。[ 109 ] スイートソルガムもエタノールの潜在的な供給源であり、乾燥地での栽培に適しています。国際半乾燥熱帯作物研究所は、アジアとアフリカの乾燥地域で燃料、食料、動物飼料の供給源としてソルガムを栽培する可能性を調査しています。[ 110 ]スイートソルガムは、同じ期間にサトウキビの3分の1の水を必要とします。また、トウモロコシよりも約22%少ない水を必要とします。世界初のスイートソルガムエタノール蒸留所は、2007年にインドのアーンドラ・プラデーシュ州で商業生産を開始しました。[ 111 ]
エタノールは、生物学的反応と電気化学的反応を介して二酸化炭素を変換することによって実験室で生産されています。[ 112 ] [ 113 ]
2O → CH
3CH
2O H + 副産物
水分補給
[編集]エタノールは石油化学原料から、主にエチレンの酸触媒水和反応によって 生産されます。合成エタノールと呼ばれることもあります。
- C 2 H 4 + H 2 O → C 2 H 5 OH
触媒として最も一般的に使用されるのはリン酸であり、[ 114 ] [ 115 ] シリカゲルや珪藻土などの多孔質担体に吸着されている。この触媒は1947年にシェル石油会社によって初めて大規模エタノール生産に使用された。[ 116 ]反応は300℃(572°F)の高圧蒸気存在下で行われ、エチレンと蒸気の比率は5:3に維持される。[ 117 ] [ 118 ]このプロセスはユニオンカーバイド社などによって工業規模で使用された。トウモロコシから生産される発酵エタノールの方が経済的であるため、米国ではもはやこのプロセスは行われていない。[ 119 ]
1930年にユニオンカーバイド社によって初めて工業規模で実施されたが、現在ではほとんど使われていない古い方法では、エチレンを濃硫酸と反応させてエチル硫酸を生成し、これを加水分解してエタノールを生成し、硫酸を再生していた。[ 121 ]
- C 2 H 4 + H 2 SO 4 → C 2 H 5 HSO 4
- C 2 H 5 HSO 4 + H 2 O → H 2 SO 4 + C 2 H 5 OH
発酵
[編集]This section needs additional citations for verification. (November 2024) |
アルコール飲料や燃料に含まれるエタノールは発酵によって生成されます。特定の酵母(例:サッカロミセス・セレビシエ)は糖(多糖類)を代謝し、エタノールと二酸化炭素を生成します。以下の化学式は、この変換をまとめたものです。
6H
12お
6→ 2CH
3CH
2OH + 2 CO 2
発酵とは、酵母を適切な温度条件下で培養し、アルコールを生成するプロセスです。このプロセスは約35~40℃(95~104℉)で行われます。エタノールは酵母に対して毒性があるため、醸造で得られるエタノール濃度には限界があります。そのため、より高い濃度を得るには、強化または蒸留が用いられます。最もエタノール耐性の高い酵母株は、約18%のエタノール濃度まで生存できます。
穀物などのデンプン質材料からエタノールを生産するには、まずデンプンを糖に変換する必要があります。ビール醸造では、伝統的に穀物を発芽させる、つまり麦芽を発酵させることでこの工程が行われてきました。麦芽はアミラーゼという酵素 を生成します。麦芽化した穀物をすりつぶすと、アミラーゼが残りのデンプンを糖に変換します。
エタノール発酵用の糖はセルロースから得ることができます。この技術の導入により、トウモロコシの芯、藁、おがくずなど、セルロースを含む多くの農業副産物を再生可能エネルギー資源に変換できる可能性があります。サトウキビのバガスなどの農業残渣や、スイッチグラスなどのエネルギー作物も発酵可能な糖源となる可能性があります。[ 122 ]
テスト
[編集]

醸造所やバイオ燃料工場では、エタノール濃度を測定するために2つの方法が採用されています。赤外線エタノールセンサーは、2900 cm −1のC−Hバンドを用いて溶解エタノールの振動周波数を測定します。この方法では、比較的安価な固体センサーを用いてC−Hバンドを参照バンドと比較することでエタノール含有量を計算します。この計算には、ランベルト・ベールの法則が用いられます。あるいは、比重計を用いて出発原料の密度と生成物の密度を測定し、発酵中の比重の変化からアルコール含有量を求める方法もあります。この安価で間接的な方法は、ビール醸造業界で長い歴史を持っています。
精製
[編集]エチレンの水和または醸造により、エタノールと水の混合物が生成される。ほとんどの工業用途および燃料用途では、エタノールを精製する必要がある。大気圧下での分留により、エタノールを重量比95.6%(モル比89.5%)まで濃縮することができる。この混合物は、沸点が78.1℃(華氏172.6度)の共沸混合物であり、蒸留によってさらに精製することはできない。ベンゼン、シクロヘキサン、ヘプタンなどの共沸剤を添加すると、エタノール、水、共沸剤からなる新たな三成分共沸混合物が形成される。この低沸点の三成分共沸混合物は優先的に除去され、無水エタノールが得られる。[ 115 ]
蒸留以外にも、エタノールは分子ふるい、セルロース、コーンミールなどの乾燥剤を添加することで乾燥させることができます。乾燥剤は乾燥させて再利用できます。[ 115 ]分子ふるいは、 95.6%のエタノール溶液から水分を選択的に吸収するために使用できます。[ 123 ]ゼオライトの一種である孔径3Åの分子ふるいは 、エタノール分子を遮断しながら水分子を効果的に隔離します。湿ったふるいを加熱すると水分が追い出され、乾燥能力が回復します。[ 124 ]
膜はエタノールと水の分離にも使用できます。膜を用いた分離は気液平衡に基づいていないため、水とエタノールの共沸混合物の制限を受けません。膜は、いわゆるハイブリッド膜蒸留プロセスでよく使用されます。このプロセスでは、最初の分離ステップとして前濃縮蒸留塔を使用します。その後、蒸気透過モードまたはパーベーパレーションモードで動作する膜によって、さらなる分離が行われます。蒸気透過モードでは蒸気膜フィードを使用し、パーベーパレーションモードでは液体膜フィードを使用します。
他にも以下のような様々な手法が議論されている。[ 115 ]
- 炭酸カリウムの不溶性を利用して塩析を行うと、エタノールと水との相分離が起こります。これにより、アルコールに微量の炭酸カリウム不純物が混入しますが、これは蒸留によって除去できます。エタノールは水と共沸混合物を形成するため、この方法は蒸留によるエタノール精製に非常に有用です。
- 炭素ナノスパイク膜上の銅ナノ粒子を触媒として用いて、常温で二酸化炭素をエタノールに直接電気化学的に還元する[ 125 ]
- 超臨界二酸化炭素による穀物マッシュからのエタノールの抽出。
- 浸透蒸発;
- 部分凍結は、伝統的に作られるアップルジャック(飲料)などの発酵アルコール溶液を濃縮するためにも使用されます。
- 圧力スイング吸着[ 126 ]
エタノールのグレード
[編集]純粋なエタノールとアルコール飲料は向精神薬として重税が課せられていますが、エタノールは消費以外の用途にも広く利用されています。これらの用途に対する税負担を軽減するため、ほとんどの管轄区域では、エタノールに飲用に適さない物質が添加されている場合、税が免除されています。これらの物質には、安息香酸デナトニウムなどの苦味料や、メタノール、ナフサ、ピリジンなどの毒性物質が含まれます。このような製品は変性アルコールと呼ばれます。[ 127 ] [ 128 ]
無水アルコールは、水分含有量の少ないエタノールを指します。最大水分含有量が1%から数ppmまで、様々なグレードがあります。共沸蒸留を使用して水を除去すると、微量の物質分離剤(例:ベンゼン)が含まれます。[ 129 ]無水アルコールは人間の消費を目的としたものではありません。無水エタノールは、水が他の化学物質と反応する実験室および工業用途の溶媒として、また燃料用アルコールとして使用されます。分光エタノールは、紫外線と可視光の吸収が低い無水エタノールであり、紫外可視分光法の溶媒としての使用に適しています。[ 130 ]純粋なエタノールは、米国では200プルーフに分類され、英国のシステムでは175度プルーフに相当します。 [ 131 ]蒸留酒は、96%エタノールと4%の水の共沸組成物であり、さまざまな目的で無水エタノールの代わりに使用されます。蒸留酒は約94%のエタノール(188プルーフ)を含みます。不純物は、実験室で製造される95%(190プルーフ)のエタノールとは異なります。[ 132 ]
反応
[編集]This section needs additional citations for verification. (November 2024) |
エタノールは第一級アルコールに分類されます。これは、エタノールのヒドロキシル基が結合している炭素に、少なくとも2つの水素原子が結合していることを意味します。多くのエタノール反応は、エタノールのヒドロキシル基で起こります。
エステル形成
[編集]酸触媒の存在下では、エタノールはカルボン酸と反応してエチルエステルと水を生成します。
- RCOOH + HOCH 2 CH 3 → RCOOH 2 CH 3 + H 2 O
この反応は工業的に大規模に行われており、生成した水を除去する必要があります。エステルは酸または塩基の存在下で反応し、アルコールと塩を生成します。この反応は石鹸の製造に用いられるため、鹸化として知られています。エタノールも無機酸とエステルを形成できます。硫酸ジエチルとリン酸トリエチルは、それぞれエタノールを三酸化硫黄と五酸化リンで処理することで得られます。硫酸ジエチルは有機合成において有用なエチル化剤です。亜硝酸エチルは、エタノールと亜硝酸ナトリウムおよび硫酸との反応で生成され、かつては利尿剤として使用されていました。
脱水
[編集]酸触媒の存在下では、アルコールはエタノールからエチレンのようなアルケンに変換されます。典型的には、アルミナなどの固体酸が用いられます。[ 133 ]
- CH 3 CH 2 OH → H 2 C=CH 2 + H 2 O
同じ分子から水が除去されるため、この反応は分子内脱水反応として知られています。アルコールの分子内脱水反応には、高温と硫酸などの酸性触媒の存在が必要です。[ 134 ]砂糖由来のエタノール(主にブラジル)から生産されるエチレンは、ナフサやエタンなどの石油化学原料から生産されるエチレンと競合しています。[要出典]分子内脱水反応よりも低い温度では、分子間アルコール脱水反応が起こり、対称的なエーテルが生成されることがあります。これは縮合反応です。次の例では、エタノールからジエチルエーテルが生成されます。
燃焼
[編集]エタノールの完全燃焼により二酸化炭素と水が生成されます。
- C 2 H 5 OH (l) + 3 O 2 (g) → 2 CO 2 (g) + 3 H 2 O (l); −Δ c H = 1371 kJ/mol [ 136 ] = 29.8 kJ/g = 327 kcal/mol = 7.1 kcal/g
- C 2 H 5 OH (l) + 3 O 2 (g) → 2 CO 2 (g) + 3 H 2 O (g); −Δ c H = 1236 kJ/mol = 26.8 kJ/g = 295.4 kcal/mol = 6.41 kcal/g [ 137 ]
比熱 = 2.44 kJ/(kg·K)
酸塩基化学
[編集]エタノールは中性分子であり、エタノール水溶液のpHはほぼ7.00です。エタノールは、ナトリウムなどのアルカリ金属との反応により、共役塩基であるエトキシドイオン(CH 3 CH 2 O − )に定量的に変換されます。[ 83 ]
- 2CH3CH2OH + 2Na → 2CH3CH2ONa + H2
または水素化ナトリウムのような非常に強い塩基:
- CH 3 CH 2 OH + NaH → CH 3 CH 2 ONa + H 2
水とエタノールの酸性度は、それぞれpKaが15.7と16であることからほぼ等しい。したがって、ナトリウムエトキシドと水酸化ナトリウムは、ほぼ釣り合った平衡状態にある。
- CH 3 CH 2 OH + NaOH ⇌ CH 3 CH 2 ONa + H 2 O
ハロゲン化
[編集]エタノールは工業的にはハロゲン化エチルの原料として用いられていませんが、その反応は例として挙げられます。エタノールはハロゲン化水素と反応し、 SN 2反応によって塩化エチルや臭化エチルなどのハロゲン化エチルを生成します。
- CH 3 CH 2 OH + HCl → CH 3 CH 2 Cl + H 2 O
HClは塩化亜鉛などの触媒を必要とする。[ 121 ] HBrは硫酸触媒による還流を必要とする。 [ 121 ]エチルハライドは、原理的には、エタノールを塩化チオニルや三臭化リンなどのより特殊なハロゲン化剤で処理することによっても生成できる。[ 83 ] [ 121 ]
- CH 3 CH 2 OH + SOCl 2 → CH 3 CH 2 Cl + SO 2 + HCl
エタノールを塩基存在下でハロゲンと反応させると、対応するハロホルム(CHX 3、X = Cl、Br、I)が得られる。この変換はハロホルム反応と呼ばれる。[ 138 ] 塩素との反応では中間体としてクロラールと呼ばれるアルデヒドが生成し、水と反応するとクロラール水和物を形成する。 [ 139 ]
- 4 Cl 2 + CH 3 CH 2 OH → CCl 3 CHO + 5 HCl
- CCl 3 CHO + H 2 O → CCl 3 C(OH) 2 H
酸化
[編集]エタノールは、試薬と条件に応じてアセトアルデヒドに酸化され、さらに酢酸に酸化される。 [ 121 ]この酸化は工業的には重要ではないが、人体では、これらの酸化反応は肝臓の酵素ADHによって触媒される。エタノールの酸化生成物である酢酸は、アセチルCoAの前駆体であり、人体にとって栄養素である。アセチルCoAのアセチル基はエネルギーとして消費されるか、生合成に利用される。
代謝
[編集]エタノールは、タンパク質、脂肪、炭水化物などの主要栄養素と同様に、カロリーを供給します。摂取され代謝されると、エタノール代謝を通じて1グラムあたり7キロカロリーを供給します。[ 140 ]
安全性
[編集]エタノールは非常に可燃性が高いため、裸火の近くでは使用しないでください。大気中の濃度が1000分の1を超えると、欧州連合の職業性暴露限度を超えます。[ 141 ]
純粋なエタノールは皮膚や目に刺激を与えます。[ 142 ]摂取すると吐き気、嘔吐、中毒症状が現れます。長期摂取は深刻な肝障害を引き起こす可能性があります。[ 141 ] 2021年には、世界中でエタノールが原因で180万人が死亡しました。[ 143 ]
歴史
[編集]糖をエタノールに発酵させる技術は、人類が利用した最も初期のバイオテクノロジーの一つです。エタノールは歴史的に、スピリット・オブ・ワイン(ワインの蒸留酒)や熱烈なスピリッツ(アルコール度の高い蒸留酒) [ 144 ]、アクア・ヴィタエ(ラテン語で「生命の水」)やアクア・ヴィータなど、様々な名称で呼ばれてきました。エタノールの摂取による酩酊作用は古代から知られていました。エタノールは先史時代から、アルコール飲料の酩酊成分として人類に利用されてきました。中国で発見された9,000年前の陶器に付着した乾燥した残留物は、新石器時代の人々がアルコール飲料を摂取していたことを示唆しています。[ 145 ]
ワインの呼気の可燃性は、アリストテレス(紀元前384年 - 322年)、テオプラストス(紀元前 371年頃- 287年)、大プリニウス(紀元後23/24年 - 79年)などの古代の自然哲学者たちにすでに知られていました。[ 146 ]しかし、2世紀と3世紀のローマ帝国エジプトでより高度な蒸留技術が開発されたにもかかわらず、これはすぐにはエタノールの単離にはつながりませんでした。[ 147 ]ジャービル・イブン・ハイヤン(紀元9世紀)の著作の1つに初めて見られる重要な認識は、沸騰しているワインに塩を加えるとワインの相対的な揮発性が高まり、結果として生じる蒸気の可燃性が高まる可能性があるというものでした。 [ 148 ]ワインの蒸留は、アル・キンディー(紀元 801年頃~873年)とアル・ファーラビー(紀元 872年~ 950年)に帰せられるアラビア語の著作、そしてアル・ザフラウィー(ラテン語:アブルカシス、936年~1013年)の『キターブ・アル・タスリーフ』 (後にラテン語で『リベル・セルバトリス』と翻訳された)の第28巻にも記録されている。[ 149 ] 12世紀には、ワインを塩で蒸留してアクア・アルデンス(「燃える水」、すなわちエタノール)を製造する方法が多くのラテン語の著作に登場し始め、13世紀末までに西ヨーロッパの化学者の間で広く知られる物質となった。[ 150 ]
タッデオ・アルデロッティ(1223–1296)の著作には、水冷式蒸留器で分留を繰り返すエタノール濃縮法が記されており、純度90%のエタノールが得られるとされている。[ 151 ]エタノールの薬効は、アルナルド・ディ・ヴィラノーヴァ(1240–1311 CE)とヨハネス・ディ・ルペシッサ( 1310年頃–1366年)によって研究され、後者はエタノールをあらゆる病気を予防できる生命維持物質(アクア・ヴィタエまたは「生命の水」、ヨハネスはこれをワインの真髄とも呼んだ)とみなした。[ 152 ]中国では、考古学的証拠から、アルコールの本格的な蒸留は金(1115–1234)または南宋(1127–1279)の時代に始まったことが示されている。[ 153 ]河北省青龍市の遺跡で12世紀の蒸留器が発見されている。[ 153 ]インドでは、アルコールの蒸留法は中東から伝わり、 14世紀にはデリー・スルタン朝で広く行われていた。[ 154 ]
1796年、ドイツ系ロシア人化学者ヨハン・トビアス・ロウィッツは、部分的に精製されたエタノール(アルコールと水の共沸混合物)を過剰の無水アルカリと混合し、その混合物を弱火で蒸留することで純粋なエタノールを得ました。[ 155 ]フランスの化学者アントワーヌ・ラボアジエは、エタノールを炭素、水素、酸素の化合物として記述し、1807年にニコラ・テオドール・ド・ソシュールはエタノールの化学式を決定しました。[ 156 ] [ 157 ] 50年後、アーチボルド・スコット・クーパーはエタノールの構造式を発表しました。これは、決定された最初の構造式の一つです。[ 158 ]
エタノールは1825年にマイケル・ファラデーによって初めて合成されました。彼は硫酸が大量の石炭ガスを吸収できることを発見しました。[ 159 ]彼は得られた溶液をイギリスの化学者ヘンリー・ヘネルに渡し、ヘネルは1826年にそこに「スルホビン酸」(硫酸水素エチル)が含まれていることを発見しました。[ 160 ] 1828年、ヘネルとフランスの化学者ジョルジュ・シモン・セルラスはそれぞれ独立して、スルホビン酸がエタノールに分解できることを発見しました。[ 161 ] [ 162 ]こうして1825年、ファラデーは意図せずして、エチレン(石炭ガスの成分)から酸触媒水和反応によってエタノールを生成できることを発見したのです。これは現在の工業的なエタノール合成法に類似したプロセスです。[ 163 ]
エタノールはアメリカ合衆国では1840年頃からランプの燃料として使われていましたが、南北戦争中に工業用アルコールに課された税金によって経済的に不利になりました。この税金は1906年に廃止されました。[ 164 ]自動車燃料としての使用は1908年に遡り、フォード・モデルTはガソリンまたはエタノールで走行できました。 [ 165 ]一部のアルコールランプの燃料としてエタノールが使用されています。
工業用エタノールは、多くの場合エチレンから製造されます。[ 166 ]エタノールは、香料、香味料、着色料、医薬品など、人体との接触や消費を目的とした物質の溶媒として広く使用されています。化学においては、溶媒であると同時に、他の物質の合成原料としても使用されます。熱や光のための燃料として長い歴史があり、近年では内燃機関の燃料としても利用されています。
参照
[編集]参考文献
[編集]- ^ 有機化学命名法:IUPAC勧告および推奨名称2013(ブルーブック) . ケンブリッジ、英国:王立化学協会. 2014. p. 30. doi : 10.1039/9781849733069-00001 . ISBN 978-0-85404-182-4。
- ^ 「エタノール」 . PubChem . 2022年12月29日閲覧。
- ^ a b c d Haynes, William M.編 (2011). CRC Handbook of Chemistry and Physics (92nd ed.). Boca Raton, Florida: CRC Press . p. 3.246. ISBN 1-4398-5511-0。
- ^ Ballinger P, Long FA (1960). 「アルコールの酸イオン化定数. II. いくつかの置換メタノールおよび関連化合物の酸性度1,2」. Journal of the American Chemical Society . 82 (4): 795– 798. Bibcode : 1960JAChS..82..795B . doi : 10.1021/ja01489a008 . ISSN 0002-7863 .
- ^ Arnett EM, Venkatasubramaniam KG (1983). 「3つの超塩基系における熱化学的酸性度」J. Org. Chem . 48 (10): 1569– 1578. doi : 10.1021/jo00158a001 .
- ^ Lide DR編 (2012). CRC Handbook of Chemistry and Physics (92 ed.). ボカラトン, フロリダ州: CRC Press/Taylor and Francis. pp. 6– 232.
- ^ Lide DR編 (2008). CRC Handbook of Chemistry and Physics (89 ed.). ボカラトン, フロリダ州: CRC Press. pp. 9– 55.
- ^ 「エタノールのMSDS」 。 2023年1月12日閲覧。
- ^ “エタノール” . webwiser.nlm.nih.gov . 2021年6月25日時点のオリジナルよりアーカイブ。 2021年6月25日閲覧。
- ^ a b c d 「エチルアルコール」。2018年11月2日。 2023年12月23日閲覧。
- ^ 「エタノール」 . PubChem. 国立医学図書館. 2021年9月28日閲覧。
- ^ 「エチルアルコール」(PDF) . 有害物質ファクトシート. ニュージャージー州保健局. 2021年9月28日閲覧。
- ^ ソング, フランク; ウォーカー, マシュー P. (2023年11月8日). 「金融トレーダーにおける睡眠、アルコール、カフェイン」 . PLOS ONE . 18 (11) e0291675. Bibcode : 2023PLoSO..1891675S . doi : 10.1371/journal.pone.0291675 . ISSN 1932-6203 . PMC 10631622. PMID 37939019 .
- ^ a b Powell MA (2004). 「9. 古代メソポタミアにおけるワインとブドウ:楔形文字による証拠」マクガバンPE、フレミングSJ、カッツSH(編).ワインの起源と古代史. 歴史と人類学における食物と栄養. 第11巻(第1版). アムステルダム:テイラー&フランシス. pp. 96– 124. ISBN 978-0-203-39283-6. ISSN 0275-5769 . 2010年9月15日閲覧。
- ^ a b Schnelle, Norbert (1965年8月). 「全身麻酔におけるアルコール静脈内投与」 . Surgical Clinics of North America . 45 (4): 1041– 1049. doi : 10.1016/S0039-6109(16)37650-2 . PMID 14312998. 2022年12月30日閲覧.
- ^ a b 「2008年世界の燃料用エタノール生産量」エリスビル、ミズーリ州:再生可能燃料協会。 2024年6月21日閲覧。
- ^ "alcohol". 『オックスフォード英語辞典:歴史的原理に基づく新しい英語辞典の序文、補足、参考文献を収録した訂正再版』第1巻AB. オックスフォード:クラレンドン・プレス. 1913年. 209ページ. 2025年9月19日閲覧–インターネットアーカイブ経由.
- ^ 「エタノール – 化合物概要」 . PubChemプロジェクト. メリーランド州ベセスダ:国立生物工学情報センター.
- ^ リービッヒ J (1834)。「Ueber die Construction des Aethers und seiner Verbindungen」 [エーテルとその化合物の構成について]。Annalen der Pharmacy (ドイツ語)。9 (22): 1–39。Bibcode : 1834AnP...107..337L。土井: 10.1002/andp.18341072202。
18 ページより: 「
Bezeichnen wir die Kohlenwasserstoffverbindung 4C + 10H als das Radikal des Aethers mit E
2
und nennen es Ethyl , ...」 (炭化水素化合物 4C + 10H を E
2
を持つエーテルのラジカルとして指定し
、エチルと名付けましょう...)。
- ^ ハーパー、ダグラス。「エチル」。オンライン語源辞典。
- ^ 1892年の国際化学命名法会議の報告書については、以下を参照。
- アームストロングH (1892). 「化学命名法に関する国際会議」 . Nature . 46 (1177): 56– 59. Bibcode : 1892Natur..46...56A . doi : 10.1038/046056c0 .
- アームストロングの報告書は、決議文とともに英語で再録されている:Armstrong H (1892). "The International Conference on Chemical Nomenclature" . The Journal of Analytical and Applied Chemistry . 6 (1177): 390–400 (398). Bibcode : 1892Natur..46...56A . doi : 10.1038/046056c0 .
アルコールとフェノールは、由来する炭化水素の名称にちなんで命名され、接尾辞
ol
が付く(例:ペンタノール、ペンチノールなど)。
- ^ マルトハウフ, ロバート・P. (1966). 『化学の起源』 ロンドン: オールドボーン. ISBN 978-2-88124-594-7。p. 205; OED ; etymonline.com
- ^ マルセリン・ベルトロ;フーダス、オクターブ V. (1893)。ラ・シミ・オー・モヤン・アージュ。 Vol. I. パリ: 国家帝国。 p. 136.
- ^ 「アルコールの使用と安全な飲酒:MedlinePlus医療百科事典」medlineplus.gov . 2023年3月11日閲覧。
- ^ 「アルコール」 . www.who.int . 2025年5月23日閲覧。
- ^ ファレス J、モレノ A、クロサス B、ペラルバ JM、アッラーリ=ハッサーニ A、イェルムクヴィスト L、他。 (1994年9月)。「ヒト胃由来のクラス IV のアルコール脱水素酵素 (σσ-ADH)。cDNA 配列と構造/機能の関係」。欧州生化学ジャーナル。224 (2): 549–557 .土井: 10.1111/j.1432-1033.1994.00549.x。PMID 7925371。
- ^ Edenberg HJ, McClintick JN (2018年12月). 「アルコール脱水素酵素、アルデヒド脱水素酵素、およびアルコール使用障害:批判的レビュー」 .アルコール依存症:臨床および実験研究. 42 (12): 2281–2297 . doi : 10.1111/acer.13904 . PMC 6286250. PMID 30320893 .
- ^ Heit, C.; Dong, H.; Chen, Y.; Thompson, DC; Dietrich, RA; Vasiliou, VK (2013). 「中枢神経系におけるアルコール代謝と感受性におけるCYP2E1の役割」.シトクロムP450 2E1:疾患および薬物代謝におけるその役割. 細胞内生化学. 第67巻. pp. 235– 237. doi : 10.1007/978-94-007-5881-0_8 . ISBN 978-94-007-5880-3. PMC 4314297 . PMID 23400924 .
- ^ 「アルコール代謝:最新情報」NIAA出版物。国立衛生研究所。2021年2月28日時点のオリジナルよりアーカイブ。 2021年3月10日閲覧。
- ^ a b Eng MY, Luczak SE, Wall TL (2007). 「アジア人におけるALDH2、ADH1B、ADH1Cの遺伝子型:文献レビュー」 .アルコール研究と健康. 30 (1): 22– 27. PMC 3860439. PMID 17718397 .
- ^ カヴェ、アンソニー。「誰も語らない3つの天然の古代麻酔薬:アヘン、アルコール、マリファナ」。アンソニー・カヴェ医師(医学博士) 。 2022年12月30日閲覧。
- ^ Grattan, N.「子宮出血の治療」『 Provincial Medicine and Surgical Journal』第1巻第6号(1840年11月7日)、107ページ。
- ^ Pohorecky, Larissa A.; Brick, John (1988年1月). 「エタノールの薬理学」. Pharmacology & Therapeutics . 36 ( 2–3 ): 335–427 . doi : 10.1016/0163-7258(88)90109-X . PMID 3279433 .
- ^ McDonnell G, Russell AD (1999年1月). 「防腐剤と消毒剤:活性、作用、耐性」 . Clinical Microbiology Reviews . 12 (1): 147– 179. Bibcode : 1999CliMR..12..147M . doi : 10.1128/CMR.12.1.147 . PMC 88911. PMID 9880479 .
- ^ 「化学消毒剤|消毒・滅菌ガイドライン|ガイドラインライブラリ|感染管理|CDC」 www.cdc.gov . 2018年1月29日閲覧。
- ^ 「なぜ微生物学の作業エリアの拭き掃除に70%エタノールが使われるのか?」 ResearchGate . 2018年1月29日閲覧。
- ^ 「エタノール」 www.drugbank.ca 2019年1月28日閲覧。
- ^ Scalley R (2002年9月). 「エチレングリコール中毒の治療」 . American Family Physician . 66 (5): 807– 813. PMID 12322772. 2018年1月15日閲覧。
- ^ Beauchamp, GA; Valento, M (2016年9月). 「毒性アルコール摂取:救急部門における迅速な認識と管理」.救急医療実践. 18 (9): 1– 20. PMID 27538060 .
- ^ 佐々波、ミサ;山田太平;小原 隆文中尾篤典内藤弘道(2020)。「エチレングリコール中毒に対する経口エタノール治療」。クレウス。12 (12) e12268。土井:10.7759/cureus.12268。ISSN 2168-8184。PMC 7827791。PMID 33510981。
- ^ Anseeuw, Kurt; Sabbe, Marc B.; Legrand, Annemie (2008年4月). 「メタノール中毒:『速くて安い』と『遅くて高い』の二重性」. ".ヨーロッパ救急医学ジャーナル. 15 (2): 107– 109. doi : 10.1097/MEJ.0b013e3282f3c13b . ISSN 0969-9546 . PMID 18446077. S2CID 23861841 .
- ^ 「一般的な製剤中のアルコール含有量」(PDF)ニューヨーク州医師会。2021年4月29日時点のオリジナル(PDF)からアーカイブ。 2019年10月8日閲覧。
- ^ Adams KE, Rans TS (2013年12月). 「アルコールおよびアルコール飲料に対する有害反応」Annals of Allergy, Asthma & Immunology . 111 (6): 439– 445. doi : 10.1016/j.anai.2013.09.016 . PMID 24267355 .
- ^ Zuccotti GV, Fabiano V (2011年7月). 「小児用医薬品における賦形剤としてのエタノールの安全性に関する問題」.医薬品安全性に関する専門家意見. 10 (4): 499– 502. doi : 10.1517 /14740338.2011.565328 . PMID 21417862. S2CID 41876817 .
- ^ 「E85の供給源の入手可能性」クリーン・エア・トラスト。 2015年7月27日閲覧。
- ^ 「世界の燃料用エタノール生産量」 Statista . 2021年6月2日閲覧。
- ^ a b 「米国初の商業用セルロースエタノールバイオ精製所が発表」再生可能燃料協会、2006年11月20日。2007年1月24日時点のオリジナルよりアーカイブ。 2011年5月31日閲覧。
- ^ Green R. 「Model T Ford Club Australia (Inc.)」 。 2014年1月14日時点のオリジナルよりアーカイブ。2011年6月24日閲覧。
- ^ 「エタノール101」。アメリカエタノール連合。2020年11月14日時点のオリジナルよりアーカイブ。2011年3月26日閲覧。
- ^ Energy Future Coalition. 「バイオ燃料に関するFAQ」 .バイオ燃料ソースブック.国連財団. 2011年2月19日時点のオリジナルよりアーカイブ。
- ^ マラキアス、アウグスト・セザール・テイシェイラ;ネット、ニルトン・アントニオ・ディニス。フィーリョ、フェルナンド・アントニオ・ロドリゲス。ダ・コスタ、ロベルト・ベルリーニ・ロドリゲス。ランゲアニ、マルコス。バエタ、ホセ・ギリェルメ・コエーリョ(2019年11月18日)。「電気モーターによる内燃エンジンの完全な置き換えという誤解を招くものと、モビリティの持続可能な未来に対するブラジルのエタノールの重要性に関する研究: レビュー」。ブラジル機械科学工学協会のジャーナル。41 (12): 567.土井: 10.1007/s40430-019-2076-1。ISSN 1806-3691。
- ^ カリフォルニア州大気資源局(1989年10月)「健康安全法第39037.05条の規定に準拠した低排出ガス自動車の定義、第2版」。2018年2月18日時点のオリジナルよりアーカイブ。 2018年2月18日閲覧。
- ^ Lowi A, Carter WP (1990年3月).実車排出ガスによる大気オゾンへの影響を評価する方法. ペンシルベニア州ウォーレンデール: SAE技術論文.
- ^ Jones TT (2008). 「クリーン燃料レポート:モーター(エンジン)燃料、関連する汚染物質、技術の定量的比較」 researchandmarkets.com . 2012年9月9日時点のオリジナルよりアーカイブ。
- ^ Tao R (2010年8月16~20日).電気粘性流体と磁気粘性懸濁液. フィラデルフィア: World Scientific. ISBN 978-981-4340-22-9– 第12回国際会議の議事録より。
- ^ Biello D. 「大気汚染を減らしたい?必ずしもエタノールに頼ってはいけない」サイエンティフィック・アメリカン。 2017年7月11日閲覧。
- ^ 「複合木材製品からのホルムアルデヒド放出を削減するための空中毒性物質制御措置の導入」シカゴおよびワシントンD.C.:窓・ドア製造業者協会。2008年7月30日。2010年3月9日時点のオリジナルよりアーカイブ。
- ^ 「Tecnologia flex atrai estrangeiros」(ブラジルポルトガル語)。アジェンシア・エスタード。
- ^ Horn M, Krupp F (2009年3月16日). 『地球:続編:エネルギー改革と地球温暖化阻止への競争』 第62巻. pp. 63– 65. Bibcode : 2009PhT....62d..63K . doi : 10.1063/1.3120901 . ISBN 978-0-393-06810-8. S2CID 153892198 .
{{cite book}}:|journal=無視されました (ヘルプ) - ^ 「整備士、エタノールが小型エンジンに悪影響を与えると指摘」 2020年9月23日アーカイブ、 NBCニュース、2008年1月8日
- ^ クラーク、ジョン・D. (1972). 『点火!液体ロケット推進剤の非公式な歴史』 .アイザック・アシモフによる序文. ラトガース大学出版局. p. 9. ISBN 978-0-8135-0725-5。
- ^ Darling D. 「インターネット科学百科事典:V-2」 。 2024年7月27日閲覧。
- ^ a b 「宇宙飛行の基礎:ロケット推進剤」braeunig.us . 2023年3月11日閲覧。
- ^ 「ロケットの歴史」 NASA歴史アーカイブ。2006年8月5日時点のオリジナルよりアーカイブ。
- ^ Kuettner, Joachim P. ; Bertram, Emil (1963年10月). 「マーキュリー・レッドストーンロケットの開発と性能」(PDF) .マーキュリー計画概要(第4回有人軌道飛行の結果を含む:1963年5月15日および16日) . p. 70. NASA-SP-45 – NTRS経由.
- ^ Chow D (2010年4月26日). 「ロケット・レーシング・リーグ、新型空飛ぶホットロッドを発表」 . Space.com . 2014年3月8日時点のオリジナルよりアーカイブ。 2024年7月27日閲覧。
- ^ Badwal SP, Giddey S, Kulkarni A, Goel J, Basu S (2015年5月). 「輸送機関および定置用途向け直接エタノール燃料電池 – 包括的レビュー」 . Applied Energy . 145 : 80–103 . Bibcode : 2015ApEn..145...80B . doi : 10.1016/j.apenergy.2015.02.002 .
- ^ イマーグート、デブラ・ジョー(2015年12月3日)「エタノール暖炉は居心地が良いのか?」ウォール・ストリート・ジャーナル。 2016年3月2日閲覧。
- ^ Rajvanshi AK, Patil SM, Mendonca B (2007年3月). 「インドの農村地域における低濃度エタノールストーブ」 .持続可能な開発のためのエネルギー. 11 (1): 94– 99. Bibcode : 2007ESusD..11...94R . CiteSeerX 10.1.1.142.5846 . doi : 10.1016/S0973-0826(08)60568-2 .
- ^ a b Eyidogan M, Ozsezen AN, Canakci M, Turkcan A (2010). 「アルコールとガソリンの混合燃料がSIエンジンの性能と燃焼特性に与える影響」. Fuel . 89 (10): 2713– 2720. Bibcode : 2010Fuel...89.2713E . doi : 10.1016/j.fuel.2010.01.032 .
- ^ a b Thomas, George (2000). 「DOE水素貯蔵開発プログラムの概要」(PDF) . カリフォルニア州リバモア:サンディア国立研究所. 2007年2月21日時点のオリジナル(PDF)からアーカイブ。
- ^ Thomas G (2000). 「DOE水素貯蔵開発プログラムの概要」(PDF) . サンディア国立研究所. 2009年8月1日閲覧.
- ^ 「エタノール抽出ガイド」 . Cannabis Business Times . 2019年4月9日閲覧。
- ^ 「Extract Winterization | 背景と基本」 Aptia Engineering、2022年3月7日。 2025年11月23日閲覧。
- ^ 「エタノール|定義、式、用途、および事実|ブリタニカ」ブリタニカ百科事典。2025年9月7日時点のオリジナルよりアーカイブ。 2025年11月23日閲覧。
- ^ 小田 有紀; 貞兼 幸一郎; 吉川 裕子; 今中 忠之; 滝口 金吾; 林 正人; 監物 隆弘; 吉川 健一 (2016年2月16日). 「高濃度エタノール溶液:単一分子観察によるDNAの良溶媒」 . Chemphyschem: A European Journal of Chemical Physics and Physical Chemistry . 17 (4): 471– 473. doi : 10.1002 / cphc.201500988 . ISSN 1439-7641 . PMC 4770436. PMID 26891092 .
- ^ 「冷却浴」 . Chemistry LibreTexts . 2013年10月2日. 2025年11月23日閲覧。
- ^ 1=サイズ、L.;パドロ、JA; Guàrdia、E. 「液体エタノールにおける力学と水素結合」。分子物理学。土井:10.1080/00268979909482891 。2025 年12 月 31 日に取得。
{{cite journal}}: CS1 maint: numeric names: authors list (link) - ^ 「異なる燃料の炎温度分析とNOx排出量」ミシシッピ州化学工学部。
- ^ a b c Lide DR編 (2000). CRC化学物理ハンドブック第81版. CRCプレス. ISBN 978-0-8493-0481-1。
- ^ 「エタノール」 NIST Chemistry WebBook、SRD 69、2023年。 2023年12月23日閲覧。
- ^ a b c d Windholz M (1976). The Merck index: an encyclopedia of chemicals and drugs (9th ed.). Rahway, NJ: Merck. ISBN 978-0-911910-26-1。[ページが必要]
- ^ a b c Morrison RT, Boyd RN (1972).有機化学(第2版). Allyn and Bacon, inc. ISBN 978-0-205-08452-4。[ページが必要]
- ^ Dahlmann U, Schneider GM (1989). 「エタノール + ドデカンまたはテトラデカンまたはヘキサデカンまたは2,2,4,4,6,8,8-ヘプタメチルノナンの0.1 MPaから120.0 MPaまでの(液体+液体)相平衡および臨界曲線」. J Chem Thermodyn . 21 (9): 997– 1004. Bibcode : 1989JChTh..21..997D . doi : 10.1016/0021-9614(89)90160-2 .
- ^ ロッジスドン 1991、813ページ。
- ^ Costigan MJ, Hodges LJ, Marsh KN, Stokes RH, Tuxford CW (1980). 「等温置換熱量計:混合時の発熱エンタルピー測定のための設計変更」. Aust. J. Chem . 33 (10): 2103. Bibcode : 1982AuJCh..35.1971I . doi : 10.1071/CH9802103 .
- ^ Merck Index of Chemicals and Drugs、第9版、モノグラフ6575から6669
- ^ アメリカ国立標準技術研究所. 「標準参照物質1828:エタノール水溶液」(PDF) .
- ^ a b Pemberton RC, Mash CJ (1978). 「水性非電解質混合物の熱力学的性質 II. 303.15~363.15 Kにおける水+エタノールの蒸気圧および過剰ギブスエネルギーの正確な静的測定法による測定」J Chem Thermodyn . 10 (9): 867– 888. Bibcode : 1978JChTh..10..867P . doi : 10.1016/0021-9614(78)90160-X .
- ^ a b Beebe, AH; Coulter, KE; Lindsay, RA; Baker, EM (1942年12月). 「大気圧未満の圧力下におけるエタノール-水系の平衡」. Industrial & Engineering Chemistry . 34 (12): 1501– 1504. doi : 10.1021/ie50396a019 .
- ^ a b "6.4 圧力スイング蒸留 | Hyper-TVT: オンライン Thermische VerfahrensTechnik" .プロセス工学研究所 |チューリッヒ工科大学。 2003 年 11 月 10 日。2024 年10 月 12 日に取得。
- ^ 「Flash Point and Fire Point」 . Nttworldwide.com . 2010年12月14日時点のオリジナルよりアーカイブ。
- ^ a b NFPA 325: 可燃性液体、ガス、揮発性固体の火災危険特性に関するガイド マサチューセッツ州クインシー:全米防火協会(NFPA) 1994年1月1日
- ^ a b 「49 CFR § 173.120 – クラス3 – 定義」。法律情報研究所。
可燃性液体(クラス3)とは、引火点が60℃(140℉)以下の液体をいう。
- ^ a b c d e f g h i j k マルティネス、PJ;ラス、E。 Compaña、JM 「アルコール、ケトン、水の二成分混合物の引火点測定」。キミカ科学部、科学学部。 p. 3、表4。
- ^ 「49 CFR § 172.101 – 危険物質の目的と使用に関する表」。コーネル大学法律情報研究所。
危険物質の説明と正式輸送名:エタノール、エチルアルコール、エタノール溶液、エチルアルコール溶液。危険物分類:3。識別番号:UN1170。PG:II。ラベルコード:3。
- ^ a b c d e f g h Ha, Dong-Myeong; Park, Sang Hun; Lee, Sungjin (2015年4月). 「Setaフラッシュ密閉カップ試験器を用いた水-メタノール系および水-エタノール系の引火点測定」 .火災科学工学. 29 (2): 39– 43. doi : 10.7731/KIFSE.2015.29.2.039 .
4ページ、表3
- ^ 「エタノール系水溶液の引火点」 . Engineeringtoolbox.com . 2011年6月23日閲覧。
- ^ Dudley R (2004年8月). 「エタノール、果実の熟成、そして霊長類果食におけるヒトのアルコール依存症の歴史的起源」 .統合比較生物学. 44 (4): 315– 323. doi : 10.1093/icb/44.4.315 . PMID 21676715 .
- ^ Graber C (2008). 「事実かフィクションか?:動物は酔うのが好き」 . Scientific American . 2010年7月23日閲覧。
- ^ Leblová S, Sinecká E, Vaníčková V (1974). 「自然嫌気環境下における種子発芽時のピルビン酸代謝」. Biologia Plantarum . 16 (6): 406– 411. Bibcode : 1974BioPl..16..406L . doi : 10.1007/BF02922229 . S2CID 34605254 .
- ^ Schriver A, Schriver-Mazzuoli L, Ehrenfreund P, d'Hendecourt L (2007). 「星間物質におけるエタノールの起源の一つ:11 Kにおける混合CO 2 –C 2 H 6膜の光化学反応.FTIRによる研究」. Chemical Physics . 334 ( 1–3 ): 128– 137. Bibcode : 2007CP....334..128S . doi : 10.1016/j.chemphys.2007.02.018 .
- ^ Turner C, Spanel P, Smith D (2006). 「選択イオンフローチューブ質量分析法を用いた健常者呼気中のエタノールおよびアセトアルデヒドの縦断的研究」Rapid Communications in Mass Spectrometry . 20 (1): 61– 68. Bibcode : 2006RCMS...20...61T . doi : 10.1002/rcm.2275 . PMID 16312013 .
- ^ Doucleff M (2013年9月17日). 「オートビール症候群:どうやら腸内でビールが作れるらしい」 NPR.
- ^ Mills GA, Ecklund EE (1987). 「輸送燃料の成分としてのアルコール」 . Annual Review of Energy . 12 : 47–80 . doi : 10.1146/annurev.eg.12.110187.000403 .
- ^ Reel M (2006年8月19日). 「ブラジルのエネルギー自立への道」ワシントン・ポスト.
- ^ Rossi, Liane M.; Gallo, Jean Marcel R.; Mattoso, Luiz HC; Buckeridge, Marcos S.; Licence, Peter; Allen, David T. (2021年3月29日). 「サトウキビ由来エタノールとブラジルのバイオマスエネルギー・化学品セクター」 . ACS Sustainable Chemistry & Engineering . 9 (12): 4293– 4295. Bibcode : 2021ASCE....9.4293R . doi : 10.1021/acssuschemeng.1c01678 . ISSN 2168-0485 . S2CID 233676614 .
- ^ Wittcoff HA, Reuben BG, Plotkin JS (2004). 『工業用有機化学品』 John Wiley & Sons. pp. 136–. ISBN 978-0-471-44385-8。
- ^ スワミ、VN(2020)。 重要な意味を持つ言葉भारती परीक्षा मार्गदर्शक[ Vidyabharti District Co-operative Bank 採用試験ガイド (銀行員等級試験) ] (マラーティー語)。ラトゥール、マハーラーシュトラ州、インド: Vidyabharti Publication。 p. 119.
- ^ 「食料、飼料、燃料としてのスイートソルガム」(PDF)New Agriculturalist 、2008年1月。2015年9月4日時点のオリジナル(PDF)からアーカイブ。 2023年3月11日閲覧。
- ^ 「スイートソルガムエタノールバリューチェーンの開発」 Wayback Machineに2014年2月23日アーカイブ。ICRISAT、2013年
- ^ Liew F, Henstra AM, Köpke M, Winzer K, Simpson SD, Minton NP (2017年3月). 「選択的アルコール生産のためのClostridium autoethanogenumの代謝工学」 . Metabolic Engineering . 40 : 104–114 . Bibcode : 2017MbEng..40..104L . doi : 10.1016 / j.ymben.2017.01.007 . PMC 5367853. PMID 28111249 .
- ^ 「太陽光発電燃料システムでCO2をエタノールとエチレンにリサイクル」ニュースセンター、2017年9月18日。 2017年9月19日閲覧。
- ^ Roberts JD , Caserio MC (1977). 『有機化学の基礎原理』 WA Benjamin. ISBN 978-0-8053-8329-4。[ページが必要]
- ^ a b c d Kosaric N, Duvnjak Z, Farkas A, Sahm H, Bringer-Meyer S, Goebel O, Mayer D (2011). 「エタノール」. Ullmann's Encyclopedia of Industrial Chemistry . Weinheim: Wiley-VCH. pp. 1– 72. doi : 10.1002/14356007.a09_587.pub2 . ISBN 978-3-527-30673-2。(サブスクリプションが必要です)
- ^ 「エタノール」。化学技術百科事典第9巻、1991年、p.82。
- ^ 「エタノール」 Wayback Machineで2015年1月13日にアーカイブ。必須化学産業。
- ^ Harrison, Tim (2014年5月). 「大学進学前の学生向け触媒ウェブページ V1_0」(PDF) .ブリストル・ケムラボ、化学学部. ブリストル大学. 2021年3月5日時点のオリジナル(PDF)からアーカイブ。
- ^ Tullo, Alexander (2021年8月26日). 「米国最後の合成エタノール工場が閉鎖へ」 . cen.acs.org . 2022年11月22日閲覧。
- ^ ロッジスドン, ジョン E. (1991). 「エタノール」. ハウ=グラント, メアリー; カーク, レイモンド E.; オスマー, ドナルド F.; クロシュヴィッツ, ジャクリーン I. (編). 『化学技術百科事典』 第9巻 (第4版). ニューヨーク: ワイリー. 817頁. ISBN 978-0-471-52669-8。ロッジスドン、ジョン・E.著( 2000年12月4日)「エタノール」として再出版。ザイデル、アルザ編著『カーク・オスマー化学技術百科事典』(第5版)所収。Wiley. doi : 10.1002/0471238961.0520080112150719.a01。ISBN 978-0-471-48494-3。
- ^ a b c d e Streitwieser A , Heathcock CH (1976).有機化学入門. マクミラン. ISBN 978-0-02-418010-0。
- ^ Clines T (2006年7月). 「より良いエタノールの醸造」 . Popular Science Online. 2007年11月3日時点のオリジナルよりアーカイブ。
- ^ 化学者、アメリカ穀物協会 (1986).穀物科学技術の進歩. アメリカ穀物化学者協会. ISBN 978-0-913250-45-7。
- ^ デール・カラハム、分子ふるい情報
- ^ Song Y, Peng R, Hensley DK, Bonnesen PV, Liang L, Wu Z, Meyer HM, Chi M, Ma C, Sumpter BG, Rondinone AJ (2016). 「銅ナノ粒子/Nドープグラフェン電極を用いたCO2からエタノールへの高選択的電気化学変換」 . ChemistrySelect . 1 (プレプリント): 6055– 6061. doi : 10.1002/slct.201601169 .
- ^ Jeong JS, Jeon H, Ko Km, Chung B, Choi GW (2012). 「パイロットプラントにおける様々なPSA(圧力スイング吸着)プロセスを用いた無水エタノールの製造」.再生可能エネルギー. 42 : 41– 45. Bibcode : 2012REne...42...41J . doi : 10.1016/j.renene.2011.09.027 .
- ^ 「免税アルコール消費量削減のためのミシガン大学プログラム:変性アルコールはより安全で安価な代替品」(PDF)。ミシガン大学。2007年11月27日時点のオリジナル(PDF)からアーカイブ。 2007年9月29日閲覧。
- ^ イギリス (2005年).変性アルコール規制2005年版. Archived 9 December 2009 at the Wayback Machine . Statutory Instrument 2005 No. 1524.
- ^ Bansal RK, Bernthsen A (2003). 『有機化学の教科書』 . New Age International Limited. pp. 402–. ISBN 978-81-224-1459-2。
- ^ Christian GD (2004). 「分光分析用溶媒」 .分析化学. 第1巻(第6版). ホーボーケン、ニュージャージー州: John Wiley & Sons. p . 473. ISBN 978-0-471-21472-4。
- ^ Andrews S (2007年8月1日).食品・飲料管理教科書. Tata McGraw-Hill Education. pp. 268–. ISBN 978-0-07-065573-7。
- ^ Kunkee RE, Amerine MA (1968年7月). 「甘口ワインにおける酵母の糖およびアルコールによる安定化」 .応用微生物学. 16 (7): 1067–1075 . doi : 10.1128/AEM.16.7.1067-1075.1968 . PMC 547590. PMID 5664123 .
- ^ ツィマーマン、ハインツ;ローランド、ワルツ (2008)。 "エチレン"。ウルマンの工業化学百科事典。ワインハイム: ワイリー-VCH。土井: 10.1002/14356007.a10_045.pub3。ISBN 978-3-527-30673-2。
- ^ 「14.4: アルコールの脱水反応」 Chemistry LibreTexts、2016年2月9日。 2022年5月9日閲覧。
- ^ 「アルコールの脱水反応によるアルケン」 Chemistry LibreTexts、2013年10月2日。 2022年5月9日閲覧。
- ^ Rossini FD (1937). 「単純な有機分子の生成熱」. Ind. Eng. Chem . 29 (12): 1424– 1430. doi : 10.1021/ie50336a024 .
- ^ CRC Handbook of Chemistry and Physics、第49版、1968-1969年の生成熱から計算。
- ^ Chakrabartty SK (1978). Trahanovsky WS (編).有機化学における酸化. ニューヨーク: アカデミック・プレス. pp. 343– 370.
- ^ ラインハルト J、コップ E、マキュージック BC、ローデラー G、ボッシュ A、フライシュマン G (2007)。 「クロロアセトアルデヒド」。ウルマンの工業化学百科事典。ワインハイム: ワイリー-VCH。土井: 10.1002/14356007.a06_527.pub2。ISBN 978-3-527-30673-2。
- ^ Cederbaum, Arthur I (2012年11月16日). 「アルコール代謝」 . Clinics in Liver Disease . 16 (4): 667– 685. doi : 10.1016/j.cld.2012.08.002 . ISSN 1089-3261 . PMC 3484320. PMID 23101976 .
- ^ a b 「エチルアルコールの安全性データ」オックスフォード大学、2008年5月9日。2011年7月14日時点のオリジナルよりアーカイブ。2011年1月3日閲覧。
- ^ 会議議事録は2021年4月16日に Wayback Machineにアーカイブされています。危険化学物質データの分類と特性に関する技術委員会(2010年1月12~13日)。
- ^ https://ourworldindata.org/grapher/deaths-due-to-alcohol-use?tab=discrete-bar&time=2021
- ^ オットリー、ウィリアム・キャンベル (1826).化学およびそれに関連する鉱物学辞典. マレー.
- ^ Roach J (2005年7月18日). 「9,000年前のビール、中国のレシピから再現」ナショナルジオグラフィックニュース. 2005年7月22日時点のオリジナルよりアーカイブ。 2007年9月3日閲覧。
- ^ Berthelot & Houdas 1893、vol.私、p. 137.
- ^ Berthelot & Houdas 1893、vol. I、138–139ページ。
- ^ アル・ハッサン、アフマド・Y. (2009). 「8世紀のアラビア文献におけるアルコールとワインの蒸留」『アル・キムヤ研究:ラテン語とアラビア語の錬金術と化学における重要課題』ヒルデスハイム:ゲオルク・オルムス出版. pp. 283– 298.(同じ内容が著者のウェブサイト でも閲覧可能です。2015年12月29日アーカイブ、 Wayback Machine )。
- ^ al-Hassan 2009 (著者のウェブサイト でも同じ内容が閲覧可能Archived 29 December 2015 at the Wayback Machine);cf. Berthelot & Houdas 1893 , vol. I, pp. 141, 143。ワインには硫黄が加えられることもあった( Berthelot & Houdas 1893 , vol. I, p. 143を参照)。
- ^ マルトハウフ 1966年、204-206頁。
- ^ ホルムヤード、エリック・ジョン(1957). 『錬金術』 ハーモンズワース: ペンギンブックス. ISBN 978-0-486-26298-7。
{{cite book}}: ISBN / Date incompatibility (help)51~52ページ。 - ^ プリンシペ、ローレンス・M. (2013). 『錬金術の秘密』シカゴ:シカゴ大学出版局. ISBN 978-0-226-10379-2。69~71ページ。
- ^ a b Haw SG (2006). 「ワイン、女性、そして毒」 .マルコ・ポーロ・イン・チャイナ. ラウトレッジ. pp. 147– 148. ISBN 978-1-134-27542-72016年7月10日閲覧。
最も古い時代は後漢時代と思われる…中国で飲料用の蒸留酒が本格的に始まったのは、金と南宋の時代である可能性が高い。
- ^ ハビブ、イルファン(2011年)『中世インドの経済史 1200-1500』ピアソン・エデュケーション・インディア、55-56頁。ISBN 978-81-317-2791-1。
- ^ ローウィッツ T (1796). 「Anzeige eines, zur volkommen Entwasserung des Weingeistes nothwendig zu beobachtenden, Handgriffs」 [ワインスピリッツ[つまりアルコールと水の共沸混合物]を完全に脱水させるために実行しなければならない作業の報告)]。Chemische Annalen für die Freunde der Naturlehre、Aerznengelartheit、Haushaltungskunde und Manufakturen (ドイツ語)。1 : 195–204。197–198ページを参照: Lowitz は、
共沸混合物を 2:1 過剰の無水アルカリと混合し、混合物を弱火で蒸留することによって脱水しました。
- ^ ヒュー・チザム編 (1911). ブリタニカ百科事典第1巻 (第11版). ケンブリッジ大学出版局. pp. 525– 527.
- ^ ド・ソシュール T (1807)。「アルコールと硫黄の組成に関するメモワール」。Journal de Physique、de Chimie、d'Histoire Naturelle et des Arts。64 : 316–354 .ソシュールは 1807 年の論文でエタノールの組成を大まかにしか決定しませんでした。エタノールのより正確な分析は、彼の 1814 年の論文の 300 ページに記載されています: de Saussure, Théodore (1814)。「アルコールの組成と硫黄の組成に関するヌーベル観察」。アナール・ド・シミーとフィジーク。89 : 273–305 .
- ^ Couper AS (1858). 「新しい化学理論について」(オンライン版再版) . Philosophical Magazine . 16 ( 104–116 ) . 2007年9月3日閲覧。
- ^ ファラデー M (1825). 「炭素と水素の新しい化合物、および熱による石油の分解中に得られる他の特定の生成物について」 .ロンドン王立協会哲学紀要. 115 : 440–466 . doi : 10.1098/rstl.1825.0022 .448 ページの脚注で、ファラデーは石炭ガスと石炭ガス蒸留物に対する硫酸の作用について言及しています。具体的には、「[硫酸] は炭素と水素と直接結合します。そして、[結果として生じる化合物が] 塩基と結合すると、スルホビネート (つまり、エチル硫酸) にいくらか似ていますが、それでもそれらとは異なる、特異なクラスの塩が形成されることがわかりました。」
- ^ Hennell H (1826). 「硫酸とアルコールの相互作用について、ならびに生成化合物の組成と性質に関する考察」 .ロンドン王立協会哲学紀要. 116 : 240–249 . doi : 10.1098/rstl.1826.0021 . S2CID 98278290 . 248 ページで、ヘネルは、ファラデーが石炭ガスが溶けた硫酸を彼に渡し、彼 (ヘネル) がそれに「スルホビン酸」(硫酸水素エチル) が含まれていることを発見したと述べています。
- ^ Hennell H (1828). 「硫酸とアルコールの相互作用、およびエーテル生成過程の性質について」 .ロンドン王立協会哲学論文集. 118 : 365–371 . doi : 10.1098/rstl.1828.0021 . S2CID 98483646 . 368 ページで、ヘネルは「スルホビン酸」(硫酸水素エチル)からエタノールを製造しています。
- ^ セルリャス GS (1828)。 Guyton de Morveau LB、Gay-Lussac JL、Arago F、Michel Eugène Chevreul、Marcellin Berthelot、Éleuthère Élie Nicolas Mascart、Albin Haller (編)。「アルコール上の硫酸塩の作用、結果としての製品の製造」。アナール・ド・シミーとフィジーク。39 : 152–186 .158 ページで、セルリャスは「硫酸水素酸水素カルボネ」(硫酸炭化水素)からのアルコールの製造について言及しています。
- ^ 1855年、フランスの化学者マルセラン・ベルテロは、純粋なエチレンからエタノールを調製することによってファラデーの発見を確認した。ベルトロー M (1855)。アラゴ F、ゲイ=リュサック JL (編)。「Sur la formation de l'alcool au moyen du bicarbure d'hydrogène (エチレンによるアルコールの生成について)」。アナール・ド・シミーとフィジーク。43 : 385–405 .(注: ベルテロの論文の化学式が間違っているのは、当時の化学者が元素の原子量を間違って使用していたためです。たとえば、炭素 (12 ではなく 6)、酸素 (16 ではなく 8) などです。)
- ^ Siegel R (2007年2月15日). 「かつては無視されていたエタノールが、今や急成長中」 . NPR . 2007年9月22日閲覧。
- ^ DiPardo J. 「バイオマスエタノールの生産と需要の見通し」(PDF)。米国エネルギー省。2015年9月24日時点のオリジナル(PDF)からアーカイブ。 2007年9月22日閲覧。
- ^ マイヤーズRL、マイヤーズRL(2007年)『最も重要な化合物100選:リファレンスガイド』ウェストポート、コネチカット州:グリーンウッド・プレス、p.122。ISBN 978-0-313-33758-1。
さらに読む
[編集]- Boyce JM、Pittet D (2003). 「医療現場における手指衛生」アトランタ、ジョージア州:疾病予防管理センター
- Onuki S, Koziel JA, van Leeuwen J, Jenks WS, Grewell D, Cai L (2008年6月).エタノールの製造、精製、および分析技術:レビュー. 2008 ASABE Annual International Meeting. Providence, RI . 2013年2月16日閲覧.
- 「米国の変性アルコール指定の説明」 Sci -toys。
- ランゲ、ノーバート・アドルフ (1967). ジョン・オーリー・ディーン (編).ランゲ化学ハンドブック(第10版). マグロウヒル.
- シュミット、エッカート W. (2022)。 "エタノール"。アルコール。液体燃料の百科事典。デ・グルイテル。ページ 12–32。土井: 10.1515/9783110750287-001。ISBN 978-3-11-075028-7。
外部リンク
[編集]- 周期表のビデオにおけるアルコール(エタノール)(ノッティンガム大学)
- 国際労働機関のエタノール安全情報
- 国家汚染物質目録 – エタノールファクトシート
- CDC – NIOSH 化学物質の危険性に関するポケットガイド – エチルアルコール
- 米国国立標準技術研究所のエタノールに関する化学データ
- シカゴ商品取引所のエタノール先物に関するニュースと市場データ
- エタノールの蒸気圧、液体密度、動的液体粘度、表面張力の計算
- エタノールの歴史エタノールの歴史を振り返る
- ChemSub Online: エチルアルコール
- エチレンと硫酸を使用した工業用エタノール製造プロセスのフロー図