活動電位

活動電位(神経インパルス、あるいはニューロン内では「スパイク」とも呼ばれる)は、細胞膜を横切る一連の急激な電圧変化である。活動電位は、特定の細胞の膜電位が急激に上昇および下降するときに発生する。[ 1 ]この「脱分極」(物理的には膜の分極の反転)により、隣接する部位も同様に脱分極する。活動電位は、ニューロンや筋細胞などの動物細胞や一部の植物細胞など、いくつかの種類の興奮性細胞で発生する。膵臓β細胞などの特定の内分泌細胞や、下垂体前葉の特定の細胞も興奮性細胞である。[ 2 ]
ニューロンにおいて、活動電位は細胞間コミュニケーションにおいて中心的な役割を果たします。これは、ニューロンの軸索に沿って軸索の末端にあるシナプス小胞へと信号が伝播するのを補助する(跳躍伝導に関しては補助する)ことによります。これらの信号は、シナプスを介して他のニューロン、あるいは運動細胞や腺と結合します。他の種類の細胞においては、活動電位の主な機能は細胞内プロセスを活性化することです。例えば、筋細胞では、活動電位は収縮につながる一連の事象の最初のステップです。膵臓のβ細胞では、活動電位はインスリンの放出を引き起こします。[ a ]ニューロンによって生成される活動電位の時間的系列は、「スパイク列」と呼ばれます。活動電位、つまり神経インパルスを発するニューロンは、しばしば「発火する」と言われます。
活動電位は、細胞の細胞膜に埋め込まれた特殊な電位依存性イオンチャネルによって発生します。[ b ]これらのチャネルは、膜電位が細胞の(負の)静止電位に近いときには閉じていますが、膜電位が正確に定義された閾値電圧まで上昇すると急速に開き始め、膜を「脱分極」させます。 [ b ]チャネルが開くと、ナトリウムイオンが流入し、細胞内部がより正の電位になり、さらに(負の)膜電位が上昇します。これにより、さらに多くのチャネルが開き、細胞膜を流れる電流が増加し、これが繰り返されます。このプロセスは爆発的に進行し、利用可能なすべてのイオンチャネルが開き、膜電位が大幅に上昇します。ナトリウムイオンの急速な流入は、細胞膜の極性(つまり、膜を横切る電界の方向)を反転させ、イオンチャネルは急速に不活性化します。ナトリウムチャネルが閉じると、ナトリウムイオンはニューロン内に入ることができなくなり、能動的に細胞膜外へ輸送されます。次にカリウムチャネルが活性化され、カリウムイオンの外向きの電流が生じ、電気化学的勾配は静止状態に戻ります。電位を変化させるには通過するイオンの数が少ないため、この過程の間、両側のイオン濃度は比較的変化しません。活動電位が発生した後、後過分極と呼ばれる一時的な負のシフトが発生します。
動物細胞には、主に2種類の活動電位が存在する。1つは電位依存性ナトリウムチャネルによって生成され、もう1つは電位依存性カルシウムチャネルによって生成される。ナトリウムをベースとした活動電位は通常1ミリ秒未満で持続するが、カルシウムをベースとした活動電位は100ミリ秒以上持続することがある。[ c ]一部のニューロンでは、ゆっくりとしたカルシウムスパイクが、急速に放出されるナトリウムスパイクの長いバーストの原動力となる。一方、心筋細胞では、最初の速いナトリウムスパイクが「プライマー」となり、それが急速なカルシウムスパイクの発生を誘発し、それが筋収縮を引き起こす。 [ 3 ] [ c ]
概要

動物、植物、真菌のほぼすべての細胞膜は、細胞の外部と内部の間に膜電位と呼ばれる電位差を維持しています。動物細胞膜の典型的な電圧は -70 mV です。これは、細胞内部が外部に対して負の電圧を持っていることを意味します。ほとんどの種類の細胞では、膜電位は通常ほぼ一定に保たれます。しかし、一部の種類の細胞は、電圧が時間とともに変動するという意味において電気的に活性です。ニューロンや筋細胞など、電気的に活性な一部の種類の細胞では、電圧変動は急速な上向き(正)スパイクとそれに続く急速な下降の形をとることがよくあります。これらの上下のサイクルは活動電位として知られています。その持続時間は細胞の種類によって大きく異なります。哺乳類のニューロンでは、上下のサイクル全体にかかる時間はわずか数千分の1秒ですが[ 4 ] 、植物細胞では活動電位は数秒も続くことがあります[ 5 ] 。
細胞の電気的特性はその膜構造によって決まります。細胞膜は、脂質二重層という分子から構成されており、その中により大きなタンパク質分子が埋め込まれています。脂質二重層は電荷を帯びたイオンの移動に対して高い抵抗性を持つため、絶縁体として機能します。一方、膜に埋め込まれた大きなタンパク質は、イオンが膜を通過できるチャネルを提供します。活動電位は、細胞内外の電位差に応じて閉状態と開状態を切り替えるチャネルタンパク質によって駆動されます。これらの電圧感受性タンパク質は、電圧依存性イオンチャネルとして知られています。
典型的なニューロンにおけるプロセス

動物の体組織のすべての細胞は電気的に分極している。言い換えれば、細胞の細胞膜を挟んで膜電位と呼ばれる電位差を維持している。この電気的分極は、イオンポンプとイオンチャネルと呼ばれる膜に埋め込まれたタンパク質構造の複雑な相互作用によって生じる。ニューロンでは、膜内のイオンチャネルの種類は通常、細胞のさまざまな部分で異なり、樹状突起、軸索、細胞体に異なる電気的特性を与えている。その結果、ニューロンの膜には興奮性(活動電位を生成できる)の部分ができる一方、他の部分はできない。最近の研究では、ニューロンの最も興奮しやすい部分は軸索丘(軸索が細胞体を離れる点)の後の部分であり、軸索開始部と呼ばれていることがわかっているが、軸索と細胞体もほとんどの場合興奮性である。[ 6 ]
興奮性の膜パッチにはそれぞれ、膜電位の重要なレベルが 2 つあります。静止電位は、細胞が何も撹乱されない限り膜電位が維持する値で、それよりも高い値は閾値電位と呼ばれます。一般的なニューロンの軸索丘では、静止電位は約 -70 ミリボルト (mV) で、閾値電位は約 -55 mV です。ニューロンへのシナプス入力により、膜は脱分極または過分極します。つまり、膜電位が上昇または下降します。脱分極が蓄積して膜電位が閾値に達すると、活動電位が発生します。活動電位が誘発されると、膜電位は急激に上昇し、次に同様に急激に下降します。多くの場合、静止レベルを下回って終了し、しばらくそのレベルにとどまります。活動電位の形状は定型的です。つまり、特定の細胞のすべての活動電位の上昇と下降は、通常、ほぼ同じ振幅と時間経過になります。 (例外については後述します)ほとんどのニューロンでは、このプロセス全体は約1000分の1秒で行われます。多くの種類のニューロンは、1秒間に最大10~100回の速度で活動電位を絶えず放出します。しかし、一部のニューロンは非常に静かで、数分間、あるいはそれ以上活動電位を放出しないこともあります。
生物物理学的基礎
活動電位は、細胞膜に存在する特殊なタイプの電位依存性イオンチャネルによって生じます。[ 7 ]電位依存性イオンチャネルは、3つの重要な特性を持つ膜貫通タンパク質です。
- 複数のコンフォメーションをとることが可能です。
- 少なくとも 1 つの構造により、特定の種類のイオンが透過できる膜チャネルが作成されます。
- 構造間の遷移は膜電位の影響を受けます。
したがって、電位依存性イオンチャネルは、膜電位のある値では開き、他の値では閉じる傾向があります。しかし、ほとんどの場合、膜電位とチャネル状態の関係は確率的であり、時間遅延を伴います。イオンチャネルは予測不可能なタイミングで構造を切り替えます。膜電位は、遷移の速度と、各遷移の単位時間あたりの確率を決定します。

電位依存性イオンチャネルは、正のフィードバックループを生成できるため、活動電位を生成することができます。膜電位はイオンチャネルの状態を制御し、イオンチャネルの状態は膜電位を制御します。したがって、状況によっては、膜電位の上昇がイオンチャネルの開口を引き起こし、それによって膜電位がさらに上昇することがあります。活動電位は、この正のフィードバックサイクルが爆発的に進行したときに発生します。活動電位の時間的および振幅の軌跡は、それを生成する電位依存性イオンチャネルの生物物理学的特性によって決まります。活動電位を生成するために必要な正のフィードバックを生成できるチャネルは、いくつか種類存在します。電位依存性ナトリウムチャネルは、神経伝導に関与する高速活動電位を担っています。筋細胞や一部のニューロンにおける低速活動電位は、電位依存性カルシウムチャネルによって生成されます。これらの各種類には、異なる電圧感受性と時間的ダイナミクスを持つ複数のバリエーションがあります。
最も集中的に研究されている電圧依存性イオンチャネルは、速伝導に関与するナトリウムチャネルです。これらは、アラン・ホジキンとアンドリュー・ハクスリーがノーベル賞を受賞した活動電位の生物物理学に関する研究で初めて特徴づけたことから、ホジキン・ハクスリーナトリウムチャネルと呼ばれることもありますが、より便宜的にNaVチャネルと呼ばれることもあります(「V」は「電圧」の略です)。NaVチャネルには、不活性化、活性化、不活性化の3つの状態があります。活性化状態のチャネルは、ナトリウムイオンのみを透過します。膜電位が低い場合、チャネルはほとんどの時間を不活性化(閉)状態で過ごします。膜電位が一定レベルを超えると、チャネルは活性化(開)状態に移行する可能性が高まります。膜電位が高いほど、活性化の可能性が高くなります。チャネルが活性化されると、最終的には不活性化(閉)状態に移行します。その後、しばらく不活性化状態が続く傾向がありますが、膜電位が再び低下すると、チャネルは最終的に不活性化状態に戻ります。活動電位中、このタイプのチャネルのほとんどは、不活性化→活性化→不活性化→不活性化というサイクルを経ます。ただし、これは集団全体の平均的な挙動に過ぎず、個々のチャネルは原理的にはいつでも任意の遷移を起こす可能性があります。ただし、チャネルが不活性化状態から直接活性化状態へ遷移する可能性は非常に低いです。不活性化状態のチャネルは、不活性化状態に戻るまで不応性を示します。
これらすべての結果として、 NaVチャネルの動態は、その速度が複雑な形で電圧に依存する遷移行列によって支配されます。これらのチャネル自体が電圧の決定に大きな役割を果たすため、システム全体のダイナミクスを解明するのは非常に困難です。ホジキンとハクスリーは、イオンチャネルの状態を支配するパラメータに関する一連の微分方程式、いわゆるホジキン・ハクスリー方程式を開発することでこの問題に取り組みました。これらの方程式はその後の研究によって大幅に修正されましたが、活動電位の生物物理学に関するほとんどの理論的研究の出発点となっています。

膜電位が上昇すると、ナトリウム イオン チャネルが開き、ナトリウムイオンが細胞内に入ることができます。続いてカリウム イオン チャネルが開き、カリウムイオンが細胞から出ていきます。ナトリウム イオンの流入により、細胞内の正に帯電した陽イオンの濃度が増加し、脱分極が起こります。この脱分極では、細胞の電位が細胞の静止電位よりも高くなります。ナトリウム チャネルは活動電位のピークで閉じますが、カリウムは細胞から出続けます。カリウム イオンの流出により、膜電位が低下し、細胞が過分極します。静止状態からの小さな電圧上昇では、カリウム電流がナトリウム電流を上回り、電圧は通常の静止値、通常は -70 mV に戻ります。[ 8 ] [ 9 ] [ 10 ]しかし、電圧が臨界閾値、通常は静止値より 15 mV 高い値を超えて増加すると、ナトリウム電流が優位になります。この結果、ナトリウム電流からの正のフィードバックによってさらに多くのナトリウム チャネルが活性化される暴走状態が発生します。したがって、細胞は発火し、活動電位を生成します。[ 8 ] [ 11 ] [ 12 ] [注1 ]ニューロンが活動電位を誘発する頻度は、発火率または神経発火率と呼ばれることがよくあります。
活動電位の過程で電位依存性チャネルが開くことで生じる電流は、通常、最初の刺激電流よりもかなり大きくなります。したがって、活動電位の振幅、持続時間、形状は、刺激の振幅や持続時間ではなく、興奮性膜の特性によって大きく決まります。この「全か無か」という活動電位の特性は、刺激の強度に応じて変化する受容体電位、電気緊張電位、閾値下膜電位振動、シナプス電位などの段階的電位とは区別されます。電位依存性チャネル、リークチャネル、チャネル分布、イオン濃度、膜容量、温度、その他の要因によって決まるさまざまな活動電位タイプが、多くの細胞タイプと細胞区画に存在します。
活動電位に関与する主なイオンはナトリウム陽イオンとカリウム陽イオンです。ナトリウム イオンが細胞内に入ると、カリウム イオンが細胞外へ出て平衡を回復します。膜電圧が劇的に変化するには、比較的少数のイオンが膜を通過する必要があります。そのため、活動電位中に交換されるイオンは、内部と外部のイオン濃度にわずかな変化しか与えません。通過する少数のイオンは、ナトリウム-カリウム ポンプの継続的な動作によって再び送り出され、このポンプは他のイオン トランスポーターとともに、膜を挟んだイオン濃度の正常な比率を維持します。カルシウム陽イオンと塩化物陰イオンは、それぞれ心臓活動電位や単細胞藻類Acetabulariaの活動電位など、いくつかの種類の活動電位に関与しています。
活動電位は興奮性膜の領域で局所的に発生しますが、結果として生じる電流は隣接する膜領域の活動電位をトリガーし、ドミノ倒しのような伝播を引き起こします。電位の受動的な広がり ( 電気緊張性電位) とは対照的に、活動電位は興奮性膜領域に沿って新たに生成され、減衰することなく伝播します。[ 13 ]軸索の髄鞘形成部分は興奮性がなく、活動電位を生成せず、信号は電気緊張性電位として受動的に伝播します。ランヴィエの絞輪と呼ばれる一定間隔の非髄鞘形成領域は、活動電位を生成して信号を増幅します。跳躍伝導として知られるこのタイプの信号伝播では、信号速度と軸索直径の好ましいトレードオフが得られます。一般に、軸索終末の脱分極は、シナプス間隙への神経伝達物質の放出を引き起こします。さらに、大脳新皮質に広く分布する錐体ニューロンの樹状突起では、逆伝播する活動電位が記録されている。[ d ]これらは、スパイクタイミング依存性の可塑性において役割を果たしていると考えられている。
ホジキン・ハクスリーの膜容量モデルでは、活動電位の伝達速度は定義されておらず、放出されたイオンが隣接するチャネルと干渉することで隣接領域が脱分極すると仮定されていました。しかし、イオン拡散と半径の測定により、これは不可能であることが示されました。さらに、エントロピー変化と時間に関する矛盾した測定値は、容量モデルが単独で作用するという説に反論しています。一方、ギルバート・リングの吸着仮説は、生細胞の膜電位と活動電位は、細胞の吸着部位への可動イオンの吸着に起因すると仮定しています。[ 14 ]
活動電位の電気的特性の成熟
ニューロンの活動電位を生成・伝播する能力は発達の過程で変化する。電流インパルスによってニューロンの膜電位がどの程度変化するかは、膜入力抵抗の関数である。細胞が成長するにつれて膜にチャネルが追加され、入力抵抗は減少する。成熟したニューロンはシナプス電流に反応して膜電位の変化も短くなる。フェレットの外側膝状体ニューロンはP0の方がP30よりも時定数が長く、電圧偏向が大きい。 [ 15 ]活動電位持続時間が減少することの1つの結果として、高頻度刺激に対する信号の忠実度が維持される。未熟なニューロンは高頻度刺激を受けた後、シナプス増強よりもシナプス抑制を起こしやすい。[ 15 ]
多くの生物の初期発生においては、活動電位は実際には最初はナトリウム電流ではなくカルシウム電流によって運ばれます。発生中のカルシウムチャネルの開閉速度は、成熟ニューロンで活動電位を運ぶ電位依存性ナトリウムチャネルの開閉速度よりも遅いです。カルシウムチャネルの開口時間が長いと、活動電位が成熟ニューロンよりもかなり遅くなります。[ 15 ]アフリカツメガエルのニューロンの活動電位は最初は60~90ミリ秒かかります。発生中、この時間は1ミリ秒まで短縮します。この大幅な短縮には2つの理由があります。第1に、内向き電流が主にナトリウムチャネルによって運ばれるようになります。[ 16 ]第2に、遅延整流電流であるカリウムチャネル電流が、初期強度の3.5倍に増加します。[ 15 ]
カルシウム依存性活動電位からナトリウム依存性活動電位への遷移が進行するには、膜に新たなチャネルを追加する必要がある。アフリカツメガエルのニューロンをRNA合成阻害剤またはタンパク質合成阻害剤を含む環境で培養すると、この遷移は阻害される。[ 17 ]細胞自体の電気活動さえもチャネル発現に関与している可能性がある。アフリカツメガエルの心筋細胞における活動電位が阻害されると、ナトリウムおよびカリウムの電流密度の典型的な増加が阻害または遅延される。[ 18 ]
この電気的特性の成熟は種を超えて観察される。アフリカツメガエルでは、ニューロンが有糸分裂の最終段階を経ると、ナトリウム電流とカリウム電流が劇的に増加する。ラット皮質ニューロンのナトリウム電流密度は、生後2週間で600%増加する。[ 15 ]
神経伝達
ニューロンの解剖学
活動電位は、植物細胞、筋細胞、そして心臓の特殊細胞(心臓活動電位が発生する)など、いくつかの種類の細胞によって支えられています。しかし、最も興奮しやすい細胞はニューロンであり、ニューロンは活動電位の発生機構も最も単純化しています。
ニューロンは電気的に興奮性のある細胞であり、一般的に1つ以上の樹状突起、1つの細胞体、1つの軸索、および1つ以上の軸索終末から構成されます。樹状突起は細胞突起であり、その主な機能はシナプス信号を受信することです。樹状突起の突起は樹状突起スパインと呼ばれ、シナプス前ニューロンから放出された神経伝達物質を捕捉するように設計されています。樹状突起スパインには、リガンド依存性イオンチャネルが高濃度に存在します。これらのスパインは、球状の突起と樹状突起をつなぐ細い首を持っています。これにより、スパイン内部で起こる変化が隣接するスパインに影響を与える可能性が低くなります。樹状突起スパインは、まれな例外(LTPを参照)を除き、独立したユニットとして機能します。樹状突起は、核と多くの「通常の」真核生物細胞小器官を収容する細胞体から伸びています。スパインとは異なり、細胞体の表面には電圧活性化イオンチャネルが存在します。これらのチャネルは、樹状突起で生成された信号の伝達を助けます。細胞体から出てくるのが軸索丘です。この領域は、電圧活性化ナトリウムチャネルが非常に集中しているのが特徴です。一般的に、活動電位のスパイク開始領域、[ 19 ]すなわちトリガーゾーンであると考えられています。スパインで生成され、細胞体によって伝達される複数の信号はすべて、ここで収束します。軸索丘のすぐ後ろには軸索があります。これは、細胞体から離れる方向に伸びる細い管状の突起です。軸索はミエリン鞘によって絶縁されています。ミエリンは、シュワン細胞(末梢神経系)またはオリゴデンドロサイト(中枢神経系)のいずれかで構成されており、どちらもグリア細胞の一種です。グリア細胞は電気信号の伝達には関与していませんが、ニューロンと通信し、重要な生化学的サポートを提供します。[ 20 ]具体的には、ミエリンは軸索節を複数回巻き付け、厚い脂肪層を形成してイオンの軸索への出入りを防いでいます。この絶縁体は、信号の減衰を防ぎ、信号速度の高速化を確保します。しかし、この絶縁体には、軸索表面にチャネルが存在してはならないという制約があります。そのため、絶縁体のない膜のパッチが規則的に配置されています。これらのランヴィエ絞輪は「ミニ軸索丘陵」と考えることができます。その目的は、信号の減衰を防ぐために信号を増幅することです。最遠端では、軸索は絶縁体を失い、複数の軸索終末に分岐し始めます。これらのシナプス前終末、またはシナプスボタンは、シナプス前細胞の軸索内の特殊な領域であり、シナプス小胞と呼ばれる膜で囲まれた小さな球体に囲まれた神経伝達物質が含まれています。
入会
軸索に沿った活動電位の伝播とシナプス小突起における終結について考察する前に、軸索丘陵において活動電位がどのように開始されるかを検討することが有用である。基本的な要件は、丘陵における膜電位が発火閾値を超えることである。[ 8 ] [ 9 ] [ 21 ] [ 22 ]この脱分極はいくつかの方法で発生する。

ダイナミクス
活動電位は、シナプス前ニューロンからの興奮性シナプス後電位によって最も一般的に開始されます。 [ 23 ]通常、神経伝達物質分子はシナプス前ニューロンから放出されます。これらの神経伝達物質は、シナプス後細胞の受容体に結合します。この結合により、さまざまな種類のイオンチャネルが開きます。この開口には、細胞膜の局所的な透過性、ひいては膜電位を変化させるというさらなる効果があります。結合により電圧が上昇する(膜が脱分極する)場合、シナプスは興奮性です。一方、結合により電圧が減少する(膜が過分極する)場合、シナプスは抑制性です。電圧が上昇しても低下しても、変化は膜の近くの領域に受動的に伝播します(ケーブル方程式とその改良によって説明されるように)。通常、電圧刺激は、シナプスからの距離と神経伝達物質の結合からの時間とともに指数関数的に減少します。興奮性電圧の一部は軸索丘に到達し、(稀ではあるが)膜を脱分極させて新たな活動電位を誘発することがある。より一般的には、新たな活動電位を誘発するには、複数のシナプスからの興奮性電位がほぼ同時に作用する必要がある。しかしながら、それらの共同作用は、抑制性シナプス後電位の作用によって阻害される可能性がある。
神経伝達は電気シナプスを介しても起こります。[ 24 ]興奮性細胞間のギャップ結合による直接的な結合により、活動電位は1つの細胞から次の細胞へ、どちらの方向にも直接伝達されます。細胞間のイオンの自由な流れは、化学物質を介さない迅速な伝達を可能にします。整流チャネルは、活動電位が電気シナプスを介して一方向にのみ伝達することを保証します。電気シナプスは、人間の脳を含むすべての神経系に存在しますが、明らかに少数派です。[ 25 ]
「全か無か」の原則
活動電位の振幅は、それを生み出した電流量とは無関係であるとしばしば考えられています。言い換えれば、電流が大きくても活動電位は大きくならないということです。したがって、活動電位は「全か無か」の信号であると言われています。なぜなら、活動電位は完全に発生するか全く発生しないかのどちらかだからです。[ e ] [ f ] [ g ]これは、振幅が刺激の強度に依存する受容体電位とは対照的です。 [ 26 ]どちらの場合も、活動電位の頻度は刺激の強度と相関しています。
活動電位は定型的で均一な信号であるという古典的な見方が何十年にもわたって神経科学の分野を支配してきましたが、最近の証拠は活動電位がより複雑なイベントであり、振幅だけでなく持続時間や位相を通じても情報を伝達できることを示唆しており、時には当初は不可能だと考えられていた距離まで伝達することさえあります。[ 27 ] [ 28 ] [ 29 ] [ 30 ]
感覚ニューロン
感覚ニューロンでは、圧力、温度、光、音などの外部信号がイオンチャネルの開閉と連動して膜のイオン透過性や電圧が変化する。[ 31 ]これらの電圧変化は興奮性(脱分極)または抑制性(過分極)となることがあり、一部の感覚ニューロンでは、これらの複合効果により軸索丘が脱分極し、活動電位を誘発することがある。ヒトでの例としては、嗅覚受容ニューロンとマイスナー小体があり、それぞれ嗅覚と触覚に重要である。しかし、すべての感覚ニューロンが外部信号を活動電位に変換するわけではなく、軸索を持たないニューロンもある。[ 32 ]その代わり、信号を神経伝達物質の放出または連続的な段階的電位に変換することがあり、そのいずれもが後続のニューロンを刺激して活動電位を発火させる可能性がある。例えば、人間の耳では、有毛細胞が入ってきた音を機械的に制御されるイオンチャネルの開閉に変換し、神経伝達物質分子の放出を引き起こすことがあります。同様に、人間の網膜では、最初の光受容細胞と次の層(双極細胞と水平細胞を含む)の細胞は活動電位を生成しません。一部のアマクリン細胞と第3層である神経節細胞のみが活動電位を生成し、それが視神経を伝わります。
ペースメーカー電位

感覚ニューロンでは、活動電位は外部刺激によって生じます。しかし、興奮性細胞の中には、発火にそのような刺激を必要としないものもあります。そのような細胞は、自発的に軸索丘を脱分極し、体内時計のように一定の速度で活動電位を発火させます。[ 33 ]このような細胞の電圧トレースはペースメーカー電位として知られています。 [ 34 ]心臓の洞房結節にある心臓ペースメーカー細胞が良い例です。[ h ]このようなペースメーカー電位には自然なリズムがありますが、外部刺激によって調整できます。たとえば、心拍数は薬剤や交感神経と副交感神経からの信号によって変えることができます。[ 35 ]外部刺激は細胞の反復発火を引き起こすのではなく、タイミングを変えるだけです。[ 34 ]場合によっては、周波数の調節がより複雑になり、バーストなどの活動電位のパターンにつながることがあります。
フェーズ
活動電位の経過は、上昇期、ピーク期、下降期、アンダーシュート期、不応期の5つの部分に分けられます。上昇期には膜電位が脱分極(正電位に傾く)します。脱分極が止まる時点をピーク期と呼びます。この段階で膜電位は最大に達します。その後、下降期が続きます。この段階では膜電位は負電位に傾き、静止電位に戻ります。アンダーシュート期、または後過分極期は、膜電位が静止時(過分極時)よりも一時的に負に帯電する期間です。最後に、後続の活動電位の発生が不可能または困難な期間は不応期と呼ばれ、他の期と重なることがあります。[ 36 ]
活動電位の経路は、2つの相乗効果によって決定される。[ 37 ]まず、膜電圧V mの変化に応じて、電圧感受性イオンチャネルが開閉する。これにより、これらのイオンに対する膜の透過性が変化する。[ 38 ]次に、ゴールドマンの式によれば、この透過性の変化は平衡電位E mを変化させ、ひいては膜電圧V mを変化させる。[ i ]このように、膜電位は透過性に影響を与え、さらに膜電位に影響を与える。これにより、活動電位の上昇期の重要な部分である正のフィードバックが生じる可能性がある。 [ 8 ] [ 11 ]複雑な要因として、1つのイオンチャネルが、 V mの変化に対して逆の方法で、あるいは異なる速度で反応する複数の内部「ゲート」を持つ場合がある。[ 39 ] [ j ]例えば、V m を 上昇させると、電圧感受性ナトリウムチャネルのほとんどのゲートが開きますが、同時に、よりゆっくりではありますが、チャネルの「不活性化ゲート」も閉じます。 [ 40 ]そのため、V mが突然上昇すると、ナトリウムチャネルは最初は開きますが、その後、不活性化が遅いために閉じます。
活動電位の全位相における電圧と電流は、1952年にアラン・ロイド・ホジキンとアンドリュー・ハクスリーによって正確にモデル化され[ j ] 、この功績により1963年にノーベル生理学・医学賞を受賞しました[ β ]。しかし、彼らのモデルは2種類の電圧感受性イオンチャネルのみを考慮しており、それらの内部ゲートが互いに独立して開閉するなど、いくつかの仮定を置いています。実際には、イオンチャネルには多くの種類があり[ 41 ]、必ずしも独立して開閉するわけではありません[ k ] 。
刺激と上昇期
典型的な活動電位は、軸索丘陵[ 42 ]で十分に強い脱分極、例えばV mを上昇させる刺激によって始まります。この脱分極は、細胞内への過剰なナトリウム陽イオンの注入によって引き起こされることが多く、これらの陽イオンは、化学シナプス、感覚ニューロン、ペースメーカー電位など、様々な発生源から供給されます。
静止状態のニューロンでは、細胞外液のナトリウムイオンと塩化物イオンの濃度は細胞内液の濃度よりも高く、細胞内液のカリウムイオンの濃度は細胞外液の濃度よりも高くなっています。イオンが高濃度から低濃度に移動する濃度差と静電気効果(反対電荷同士の引き合い)が、ニューロン内外のイオンの移動の原因です。ニューロンの内部は、細胞外への K +の移動により、細胞外部に比べて負に帯電しています。ニューロン膜は K +に対して他のイオンよりも透過性が高いため、このイオンは濃度勾配に沿って選択的に細胞外へ移動します。この濃度勾配とニューロン膜に存在するカリウム漏出チャネルによってカリウムイオンの流出が起こり、静止電位はE K ≈ -75 mVに近くなります 。[ 43 ] Na +イオンは細胞外でより高濃度にあるため、Na +チャネルが開くと、濃度と電位差の両方によって Na + イオンが細胞内に押し出されます。脱分極により膜内のナトリウム チャネルとカリウム チャネルの両方が開き、イオンがそれぞれ軸索に出入りできるようになります。脱分極が小さい場合 (たとえば、V mが -70 mV から -60 mV に増加する場合)、外向きのカリウム電流が内向きのナトリウム電流を圧倒し、膜は再分極して約 -70 mV の通常の静止電位に戻ります。[ 8 ] [ 9 ] [ 10 ]しかし、脱分極が十分に大きい場合、内向きのナトリウム電流が外向きのカリウム電流よりも増加し、暴走状態 (正のフィードバック)が発生します。つまり、内向きの電流が多いほど、V mが増加し、それがさらに内向きの電流を増加させます。[ 8 ] [ 11ナトリウム透過性の増加により、V mはナトリウム平衡電圧E Na ≈ +55 mV に近づきます。電圧の上昇により、さらに多くのナトリウムチャネルが開き、V mはさらにE Naに近づきます。この正のフィードバックは、ナトリウムチャネルが完全に開き、VmがENaに近づくまで続きます。[ 8 ] [ 9 ] [ 21 ] [ 22 ] Vmとナトリウム透過性の急激な上昇は、活動電位の上昇期に対応しています。 [ 8 ] [ 9 ] [ 21 ] [ 22 ]
この暴走状態の臨界閾値電圧は通常約-45 mVですが、軸索の直近の活動によって異なります。活動電位を発火したばかりの細胞は、Na +チャネルが不活性化状態から回復していないため、すぐに次の活動電位を発火させることはできません。新しい活動電位を発火させることができない期間は、絶対不応期と呼ばれます。[ 44 ] [ 45 ] [ 46 ]より長い時間が経過し、イオンチャネルのすべてではなく一部が回復した後、軸索を刺激して別の活動電位を発生させることができますが、閾値が高くなり、たとえば-30 mVまでのはるかに強い脱分極が必要になります。活動電位を異常に誘発しにくい期間は、相対不応期と呼ばれます。[ 44 ] [ 45 ] [ 46 ]
ピーク期
上昇期の正のフィードバックは、ナトリウムイオンチャネルが最大限に開くと減速し、停止する。活動電位のピークでは、ナトリウム透過性が最大となり、膜電圧V mはナトリウム平衡電圧E Naとほぼ等しくなる。しかし、最初にナトリウムチャネルを開いた同じ上昇電圧が、同時にそれらの孔を閉じることでゆっくりと遮断もする。つまり、ナトリウムチャネルは不活性化される。[ 40 ]これにより、膜のナトリウム透過性はカリウム透過性に比べて低下し、膜電圧は静止値に戻る。同時に、上昇した電圧は電圧感受性カリウムチャネルを開く。膜のカリウム透過性の増加は、V mをE Kへと向かわせる。[ 40 ]これらのナトリウム透過性とカリウム透過性の変化が相まって、V m は急速に低下し、膜が再分極し、活動電位の「下降期」が生じる。[ 44 ] [ 47 ] [ 22 ] [ 48 ]
後過分極
脱分極電圧は追加の電圧依存性カリウムチャネルを開き、これらのいくつかは膜が通常の静止電圧に戻ってもすぐには閉じない。さらに、活動電位中にカルシウムイオンの流入に反応して、さらなるカリウムチャネルが開く。細胞内のカリウムイオン濃度は一時的に異常に低くなり、膜電圧V mはカリウム平衡電圧E Kにさらに近づく。膜電位は静止膜電位を下回る。したがって、後過分極と呼ばれるアンダーシュートまたは過分極が発生し、膜カリウム透過性が通常の値に戻り、膜電位が静止状態に戻るまで持続する。[ 49 ] [ 47 ]
不応期
各活動電位の後には不応期が続きます。不応期は、新たな活動電位を誘発できない絶対不応期と、通常よりも強い刺激が必要となる相対不応期に分けられます。 [ 44 ] [ 45 ] [ 46 ]これらの2つの不応期は、ナトリウムチャネル分子とカリウムチャネル分子の状態変化によって引き起こされます。活動電位後に閉じると、ナトリウムチャネルは「不活性化」状態に入り、膜電位に関わらず開通できなくなります。これが絶対不応期です。十分な数のナトリウムチャネルが休止状態に戻った後でも、カリウムチャネルの一部が開いたままになることがよくあります。これにより膜電位の脱分極が困難になり、相対不応期が発生します。カリウムチャネルの密度とサブタイプはニューロンの種類によって大きく異なるため、相対不応期の長さは大きく異なります。
絶対不応期は、軸索に沿った活動電位の一方向伝播に主に関与している。[ 50 ]任意の瞬間において、活発に発火している部分の後ろの軸索のパッチは不応性であるが、最近活性化されていない前方のパッチは、活動電位からの脱分極によって刺激を受けることができる。
伝搬
軸索丘で発生した活動電位は、波として軸索に沿って伝播する。[ 51 ]活動電位の発生中に軸索上の一点を流れる電流は、軸索に沿って広がり、隣接する膜部分を脱分極させる。この脱分極が十分に強い場合、隣接する膜部分で同様の活動電位が誘発される。この基本的なメカニズムは、 1937年にアラン・ロイド・ホジキンによって実証された。神経節を圧迫または冷却して活動電位を遮断した後、彼は、遮断された部分が十分に短ければ、遮断された部分の片側に到達した活動電位が反対側で別の活動電位を誘発できることを示した。[ l ]
膜パッチで活動電位が発生すると、膜パッチは再び発火できるようになるまでに回復する時間を必要とする。分子レベルでは、この絶対不応期は、電圧活性化ナトリウムチャネルが不活性化状態から回復する、すなわち閉状態に戻るのに必要な時間に対応する。[ 45 ]ニューロンには多くの種類の電圧活性化カリウムチャネルが存在する。その中には、速く不活性化するもの(A型電流)もあれば、遅く不活性化するもの、あるいは全く不活性化しないものもある。この多様性により、先行する脱分極によってカリウムチャネルの一部が不活性化された場合でも、再分極のための電流源が常に確保されることが保証される。一方、強い脱分極時には、すべてのニューロンの電圧活性化ナトリウムチャネルが数ミリ秒以内に不活性化されるため、相当数のナトリウムチャネルが閉状態に戻るまでは、次の脱分極は不可能となる。絶対不応期は発火頻度を制限するものの、[ 52 ]活動電位が軸索に沿って一方向にのみ移動することを保証する。[ 50 ]活動電位によって流入する電流は、軸索に沿って両方向に広がります。[ 53 ]しかし、軸索の未発火部分のみが活動電位で反応します。発火したばかりの部分は、活動電位が安全に範囲外になるまで反応せず、その部分を再刺激することはできません。通常の順行性伝導では、活動電位は軸索丘からシナプス突起(軸索末端)に向かって伝播します。逆方向への伝播(逆行性伝導)は非常にまれです。[ 54 ]しかし、実験室で軸索の中央を刺激すると、軸索の両半分は「新鮮」、つまり未発火の状態になります。そのため、2つの活動電位が発生し、1つは軸索丘に向かい、もう1つはシナプス突起に向かって伝播します。
ミエリンと跳躍伝導

神経系で電気信号をすばやく効率的に伝達するため、特定のニューロンの軸索はミエリン鞘で覆われています。ミエリンは多層膜で、ランヴィエの絞輪と呼ばれる間隔で区切られたセグメントに軸索を包んでいます。ミエリンは、末梢神経系ではシュワン細胞、中枢神経系ではオリゴデンドロサイトという特殊な細胞によって生成されます。ミエリン鞘は、絞輪間の間隔で膜容量を減らして膜抵抗を増やすことで、絞輪から絞輪への活動電位の高速な跳躍運動を可能にします。[ m ] [ n ] [ o ]髄鞘形成は主に脊椎動物に見られますが、一部のエビの種など、いくつかの無脊椎動物で類似のシステムが発見されています。[ p ]脊椎動物のニューロンすべてが髄鞘を形成しているわけではありません。たとえば、自律神経系を構成するニューロンの軸索は、一般に髄鞘を形成していません。
ミエリンは、髄鞘形成部に沿ってイオンが軸索に出入りするのを防ぎます。一般的に、髄鞘形成は活動電位の伝導速度を高め、エネルギー効率を高めます。跳躍性の有無にかかわらず、活動電位の平均伝導速度は1 メートル毎秒(m/s)から100 m/sを超える範囲で変化し、一般的に軸索の直径が大きくなるにつれて増加します。[ q ]
軸索の髄鞘形成部では、活動電位は膜を伝わることができません。しかし、電流は細胞質によって運ばれ、ランヴィエ結節の1つ目または2つ目を脱分極させるのに十分な電流です。その代わりに、ランヴィエ結節の1つの活動電位から生じたイオン電流が、次の結節で別の活動電位を引き起こします。この結節から結節への活動電位の見かけ上の「ホッピング」は、跳躍伝導として知られています。跳躍伝導のメカニズムは1925年にラルフ・リリーによって提唱されましたが[ r ] 、跳躍伝導の最初の実験的証拠は、田崎一二[ s ]と竹内泰治[ t ] [ 55 ]、そしてアンドリュー・ハクスリーとロバート・シュテンフリによって得られました[ u ] 。対照的に、無髄軸索では、活動電位はすぐ隣の膜で別の活動電位を引き起こし、波のように軸索を連続的に伝わります。

ミエリンには、伝導速度の速さとエネルギー効率という2つの重要な利点があります。最小直径(約1マイクロメートル)よりも大きい軸索の場合、髄鞘化によって活動電位の伝導速度が通常10倍向上します。 [ w ]逆に、同じ伝導速度の場合、髄鞘化された繊維は髄鞘のない繊維よりも小さくなります。例えば、活動電位は髄鞘化されたカエルの軸索と髄鞘のないイカの巨大軸索でほぼ同じ速度(25 m/s)で伝わりますが、カエルの軸索の直径は約30分の1、断面積は約1000分の1です。また、イオン電流はランヴィエ絞輪に限定されるため、膜を「透過」するイオンははるかに少なく、代謝エネルギーを節約できます。ヒトの神経系は体内の代謝エネルギーの約20%を使用するため、この節約は重要な選択的優位性となります。 [ w ]
跳躍伝導の成功には、軸索の髄鞘化部分の長さが重要である。伝導速度を最大化するために、髄鞘化部分は可能な限り長くする必要があるが、到達した信号が弱すぎて次のランヴィエ絞輪で活動電位を誘発できないほど長くてはならない。自然界では、髄鞘化部分は一般に、受動的に伝播する信号が少なくとも2つの絞輪を伝わり、かつ2番目または3番目の絞輪で活動電位を発火させるのに十分な振幅を維持できるほど長い。したがって、跳躍伝導の安全率は高く、損傷が発生した場合でも絞輪を迂回して伝導することができる。しかし、安全率が低い特定の場所では、無髄ニューロンであっても活動電位が途中で終了することがある。よくある例としては、軸索が2つの軸索に分岐する分岐点が挙げられる。[ 57 ]
いくつかの疾患ではミエリンが分解され、跳躍伝導が阻害され、活動電位の伝導速度が低下します。[ x ]これらの中で最もよく知られているのは多発性硬化症で、ミエリンの破壊によって協調運動が阻害されます。[ 58 ]
ケーブル理論

軸索内の電流の流れは、ケーブル理論[ 59 ]とその詳細化であるコンパートメントモデル[ 60 ]によって定量的に記述することができます。ケーブル理論は、1855年にケルビン卿によって大西洋横断電信ケーブルをモデル化するために開発され[ y ] 、 1946年にホジキンとラシュトンによってニューロンに関連することが示されました[ z ]。単純なケーブル理論では、ニューロンは電気的に受動的な、完全に円筒形の伝送ケーブルとして扱われ、偏微分方程式で記述することができます[ 59 ]
ここで、V ( x , t ) は、時刻t、ニューロンの長さ方向の位置xにおける膜両端の電圧であり、λ と τ は、刺激に対するこれらの電圧の減衰特性の長さと時間スケールである。右の回路図を参照すると、これらのスケールは単位長さあたりの抵抗と容量から決定できる。[ 61 ]
これらの時間と長さのスケールは、無髄線維におけるニューロンの直径に対する伝導速度の依存性を理解するために使用できます。例えば、時間スケールτは膜抵抗r mと容量c mの両方に伴って増加します。容量が増加すると、所定の膜間電圧(式Q = CV)を生成するために転送される電荷量が増加します。一方、抵抗が増加すると、単位時間あたりに転送される電荷量が減少し、平衡化が遅くなります。同様に、ある軸索の単位長さあたりの内部抵抗r iが他の軸索よりも低い場合(例えば、前者の軸索の半径が大きい場合)、空間減衰長λは長くなり、活動電位の伝導速度は増加するはずです。膜抵抗r mが増加すると、膜を横切る平均「漏れ」電流が低下し、同様にλが長くなり、伝導速度が増加します。
終了
化学シナプス
一般的に、シナプス突起に到達した活動電位は、神経伝達物質をシナプス間隙に放出する。[ aa ]神経伝達物質は、シナプス後細胞のイオンチャネルを開くことができる小さな分子であり、ほとんどの軸索は、そのすべての末端に同じ神経伝達物質を持っている。活動電位の到達により、シナプス前膜の電圧感受性カルシウムチャネルが開き、カルシウムの流入により神経伝達物質で満たされた小胞が細胞表面に移動し、その内容物をシナプス間隙に放出する。[ ab ]この複雑なプロセスは、破傷風とボツリヌス中毒の原因となる神経毒であるテタノスパスミンとボツリヌス毒素によって阻害される。[ ac ]
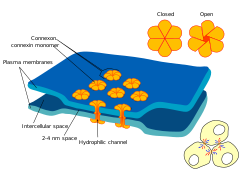
電気シナプス
シナプスの中には、神経伝達物質という「仲介者」を必要とせず、シナプス前細胞とシナプス後細胞を結びつけるものもあります。[広告]活動電位がそのようなシナプスに到達すると、シナプス前細胞に流入するイオン電流は2つの細胞膜の障壁を通過し、コネクソンと呼ばれる孔を通ってシナプス後細胞に入ります。[ ae ]このように、シナプス前活動電位のイオン電流はシナプス後細胞を直接刺激することができます。電気シナプスは、シナプス間隙を介した神経伝達物質のゆっくりとした拡散を必要としないため、より速い伝達を可能にします。そのため、逃避反射、脊椎動物の網膜、心臓など、素早い反応とタイミングの調整が重要な場面では常に電気シナプスが用いられます。
神経筋接合部
化学シナプスの特殊な例として神経筋接合部が挙げられ、ここでは運動ニューロンの軸索が筋線維で終結する。[ af ]このような場合、放出される神経伝達物質はアセチルコリンであり、これは筋線維の膜(筋鞘)内の膜貫通タンパク質であるアセチルコリン受容体に結合します。 [ ag ]しかし、アセチルコリンは結合したままにはなりません。むしろ解離し、シナプスにある酵素、アセチルコリンエステラーゼによって加水分解されます。この酵素は筋肉への刺激を急速に弱め、筋肉の収縮の程度とタイミングを微妙に調節することを可能にします。一部の毒物は、この制御を妨げるためにアセチルコリンエステラーゼを不活性化します。神経ガスのサリンとタブン、[ ah ]殺虫剤のダイアジノンとマラチオンなどです。[ ai ]
その他の細胞タイプ
心臓活動電位

心臓の活動電位は、ニューロンの活動電位とは異なり、拡張プラトーを有し、そこでは、膜が数百ミリ秒間高電圧に保持され、その後、通常通りカリウム電流によって再分極されます。[ aj ]このプラトーは、より遅いカルシウムチャネルが開き、ナトリウムチャネルが不活性化された後でも膜電圧を平衡電位近くに保つ 作用によるものです。
心臓の活動電位は、心臓の収縮を調整する上で重要な役割を果たしている。[ aj ]洞房結節の心臓細胞は、心臓を同期させるペースメーカー電位を提供する。これらの細胞の活動電位は、通常、心房と心室の間の唯一の伝導路である房室結節(AV結節)に伝播し、AV結節を通過します。AV結節からの活動電位はヒス束を通ってプルキンエ線維に伝わります。[注 2 ]逆に、先天性変異または損傷による心臓活動電位の異常は、人間の病理、特に不整脈につながる可能性があります。[ aj ]キニジン、リドカイン、β遮断薬、ベラパミルなど、いくつかの抗不整脈薬は心臓の活動電位に作用します。[ ak ]
筋活動電位
正常な骨格筋細胞の活動電位は、ニューロンの活動電位に類似している。[ 62 ]活動電位は、細胞膜(筋形質膜)の脱分極によって生じ、電圧感受性ナトリウムチャネルが開く。これらのチャネルは不活性化され、膜はカリウムイオンの外向き電流によって再分極する。活動電位前の静止電位は通常 -90mV で、一般的なニューロンよりもいくぶん負の値である。筋活動電位は約 2~4 ms 持続し、絶対不応期は約 1~3 ms、筋肉に沿った伝導速度は約 5 m/s である。活動電位によってカルシウムイオンが放出され、トロポミオシンが解放されて筋肉が収縮する。筋活動電位は、神経筋接合部におけるシナプス前ニューロン活動電位の到達によって引き起こされる。神経筋接合部は神経毒の一般的な標的である。[ ah ]
植物の活動電位
植物細胞と真菌細胞[ al ]も電気的に興奮性である。動物の活動電位との根本的な違いは、植物細胞における脱分極が正のナトリウムイオンの取り込みではなく、負の塩化物イオンの放出によって達成される点である。[ am ] [ an ] [ ao ] 1906年、JCボーズは植物における活動電位の最初の測定値を発表した。これは、バードン=サンダーソンとダーウィンによって既に発見されていた。[ 63 ]細胞質カルシウムイオンの増加が、細胞内への陰イオン放出の原因であると考えられる。このため、カルシウムは、大麦の葉に見られるように、負の塩化物イオンの流入や正のカリウムイオンの流出といったイオン移動の前駆物質となる。[ 64 ]
カルシウムイオンの最初の流入は、小さな細胞脱分極も引き起こし、電位依存性イオンチャネルが開き、塩化物イオンによって完全な脱分極が伝播できるようになります。
一部の植物(例えば、ハエトリグサ)は、ナトリウム依存性チャネルを用いて植物の動きを制御し、刺激イベントを「カウント」して動きの閾値に達したかどうかを判断します。ハエトリグサとしても知られるハエトリグサは、ノースカロライナ州とサウスカロライナ州の亜熱帯湿地帯に生息しています。 [ 65 ]土壌の栄養分が乏しい場合、ハエトリグサは昆虫や動物を餌とします。[ 66 ]この植物に関する研究は行われているものの、ハエトリグサ、そして一般的な食肉植物の分子基盤に関する理解は不足しています。[ 67 ]
しかし、活動電位とそれがハエトリグサ内の動きや仕組みにどのように影響するかについての研究は数多く行われてきました。まず、ハエトリグサの静止膜電位(−120 mV)は動物細胞(通常−90 mV~−40 mV)よりも低いです。[ 67 ] [ 68 ]静止電位が低いと、活動電位を活性化しやすくなります。そのため、昆虫が植物の罠に止まると、毛のような機械受容器が刺激されます。[ 67 ]次にこの受容器が約1.5ms持続する活動電位を活性化します。[ 69 ]これにより、細胞への正カルシウムイオンが増加し、わずかに脱分極します。ただし、ハエトリグサは1回の刺激では閉じません。その代わり、2本以上の毛の活性化が必要です。[ 66 ] [ 67 ] 1本の毛だけが刺激された場合、その活性化は偽陽性として無視されます。さらに、2本目の毛は、最初の活性化を認識するために、一定の時間間隔(0.75~40秒)内に活性化されなければならない。[ 67 ]こうして、最初の刺激の後、カルシウムの蓄積が始まり、その後ゆっくりと減少する。この時間間隔内に2本目の活動電位が発火すると、カルシウム閾値に達して細胞を脱分極させ、一瞬のうちに獲物への罠を閉じる。[ 67 ]
植物の活動電位は、それに続く陽カリウムイオンの放出とともに、浸透圧による塩分(KCl)の損失を伴います。一方、動物の活動電位は、同量のナトリウムの流入とカリウムの流出が浸透圧的に打ち消すため、浸透圧的に中性です。植物細胞における電気的関係と浸透圧関係の相互作用[ ap ]は、塩分濃度が変化する条件下での植物と動物の共通の単細胞祖先における電気的興奮性の浸透圧機能から生じたものと思われます。さらに、迅速なシグナル伝達という現在の機能は、より安定した浸透圧環境における後生動物細胞のより新しい成果とみなされています。 [ 70 ]一部の維管束植物(例:オジギソウ)における活動電位のよく知られたシグナル伝達機能は、後生動物の興奮性細胞の機能とは独立して生じたもの と思われます。
上昇期やピークとは異なり、下降期と後過分極は主にカルシウム以外の陽イオンに依存しているようです。再分極を開始するには、細胞は膜上の受動輸送によってカリウムを細胞外に移動させる必要があります。これはニューロンとは異なり、カリウムの移動は膜電位の低下を支配しません。植物細胞が完全に再分極するには、プロトンATPaseと呼ばれる輸送体を利用して細胞から水素を放出するためのATPの形でエネルギーが必要です。[ 71 ] [ 67 ]
分類上の分布と進化上の利点
活動電位は、植物、昆虫などの無脊椎動物、爬虫類や哺乳類などの脊椎動物を含む多細胞生物全体に見られます。[ aq ]海綿動物は活動電位を伝達しない多細胞真核生物の主な門であると思われますが、いくつかの研究では、これらの生物も何らかの形の電気信号を持っていると示唆されています。 [ ar ]静止電位、活動電位の大きさや持続時間は進化によってあまり変わっていませんが、伝導速度は軸索の直径や髄鞘形成によって劇的に変化します。
| 動物 | 細胞の種類 | 静止電位(mV) | AP増加(mV) | AP持続時間(ミリ秒) | 伝導速度(m/s) |
|---|---|---|---|---|---|
| イカ(ロリゴ) | 巨大な軸索 | −60 | 120 | 0.75 | 35 |
| ミミズ(Lumbricus) | 中央巨大線維 | −70 | 100 | 1.0 | 30 |
| ゴキブリ(ワモンゴキブリ亜科) | 巨大繊維 | −70 | 80~104 | 0.4 | 10 |
| カエル(ラナ) | 坐骨神経軸索 | −60から−80 | 110~130 | 1.0 | 7~30 |
| 猫(フェリス) | 脊髄運動ニューロン | −55から−80 | 80~110 | 1~1.5 | 30~120 |
進化を通じて保存されてきたことを考えると、活動電位は進化上の利点をもたらすと思われる。活動電位の 1 つの機能は、生物内での迅速で長距離の信号伝達である。伝導速度は 110 m/s を超えることがあり、これは音速の3 分の 1 である。比較すると、血流で運ばれるホルモン分子は、大きな動脈内を約 8 m/s で移動する。この機能の一部は、心臓の収縮などの機械的イベントの緊密な調整である。2 つ目の機能は、その生成に関連する計算である。活動電位は、伝送距離とともに減衰しない全か無かの信号であるため、デジタル エレクトロニクスに似た利点がある。軸索丘陵におけるさまざまな樹状突起信号の統合と、複雑な一連の活動電位を形成するための閾値処理は、もう 1 つの計算形式であり、生物学的に中枢パターン発生器を形成するために利用され、人工ニューラル ネットワークで模倣されている。
おそらく40億年前に生息していた原核生物と真核生物の共通の祖先は、電位依存性チャネルを有していたと考えられています。この機能は、後世のある時点で、コミュニケーション機構として利用されるようになったと考えられます。現代の単細胞細菌でさえ、活動電位を利用して同じバイオフィルム内の他の細菌とコミュニケーションをとることができます。[ 73 ]
実験方法

活動電位の研究には、新たな実験手法の開発が必要でした。1955年以前の初期の研究は、主にアラン・ロイド・ホジキンとアンドリュー・フィールディング・ハクスリーによって行われました。彼らはジョン・カルー・エクルズと共に、神経伝導のイオン的基盤の解明への貢献により、1963年のノーベル生理学・医学賞を受賞しました。この研究は、単一のニューロンまたは軸索からの信号を分離すること、高速で高感度な電子機器を開発すること、そして単一細胞内の電圧を記録できるほど 電極を小型化することという3つの目標に焦点を当てていました。
最初の問題は、イカ(当時はLoligo pealeiiに分類されていたLoligo forbesiiとDoryteuthis pealeii)のニューロンに見られる巨大な軸索を研究することで解決されました。 [ as ]これらの軸索は直径が非常に大きいため(およそ 1 mm、つまり一般的なニューロンの 100 倍)、肉眼で確認でき、抽出や操作が容易です。[ j ] [ at ]しかし、それらはすべての興奮性細胞を代表するものではなく、活動電位を持つ他の多数のシステムが研究されてきました。
2つ目の問題は、電圧クランプ[ au ]の重要な開発によって解決されました。これにより、実験者は活動電位の背後にあるイオン電流を単独で研究できるようになり、電子ノイズの重要な発生源である膜の静電容量Cに関連する電流I Cを排除できました。 [ 75 ]電流はCに膜間電圧V mの変化率を掛けたものに等しいため、解決策は膜を流れる電流に関係なくV m を一定(変化率ゼロ)に保つ回路を設計することでした。したがって、 V m を一定値に保つために必要な電流は、膜を流れる電流を直接反映しています。その他の電子的な進歩には、ファラデーケージや高入力インピーダンスの電子機器の使用があり、測定自体が測定対象の電圧に影響を与えないようにしました。[ 76 ]
3 つ目の問題、すなわち単一の軸索を乱すことなくその軸索内の電圧を記録できるほど小さい電極を得るという問題は、1949 年にガラス製マイクロピペット電極が発明されたことで解決され、[ av ] 、これはすぐに他の研究者にも採用されました。[ aw ] [ ax ]この方法の改良により、100 Å (10 nm )という極細の電極チップを作製できるようになり、高い入力インピーダンスも得られます。[ 77 ]活動電位は、ニューロンのすぐ隣に配置された小さな金属電極、EOSFETを含むニューロチップ、またはCa 2+や電圧に敏感な染料を使用して光学的に記録することもできます。[ ay ]

ガラスマイクロピペット電極は多数のイオンチャネルを通過する電流の合計を測定するのに対し、単一のイオンチャネルの電気的特性を研究することは、1970年代にエルヴィン・ネーアーとベルト・ザックマンによるパッチクランプの開発によって可能になりました。この発見により、彼らは1991年にノーベル生理学・医学賞を受賞しました。[ γ ]パッチクランプ法は、イオンチャネルが開、閉、不活性化といった個別の伝導状態を持つことを実証しました。
近年、活動電位を測定するための光学イメージング技術が開発され、多点同時記録や超空間分解能記録などが可能となっている。電位感受性色素を用いることで、心筋細胞膜の微小な部分から活動電位を光学的に記録することができる。[ az ]
神経毒

いくつかの神経毒(天然および合成)は、活動電位を阻害することで作用します。フグ由来のテトロドトキシンとゴニオウラックス( 「赤潮」の原因となる渦鞭毛藻類)由来のサキシトキシンは、電圧感受性ナトリウムチャネルを阻害することで活動電位を阻害します。[ ba ]同様に、ブラックマンバ由来のデンドロトキシンは、電圧感受性カリウムチャネルを阻害します。このようなイオンチャネル阻害剤は、特定のチャネルを意図的に「オフ」にすることで他のチャネルの寄与を分離できるため、重要な研究目的に利用されています。また、アフィニティークロマトグラフィーによるイオンチャネルの精製や濃度測定にも有用です。しかし、このような阻害剤は強力な神経毒にもなり、化学兵器としての使用が検討されてきました。昆虫のイオンチャネルを標的とした神経毒は、効果的な殺虫剤としても利用されてきました。その一例が合成ペルメトリンで、活動電位に関与するナトリウムチャネルの活性化を持続させます。昆虫のイオンチャネルは人間のものとは十分に異なるため、人間への副作用はほとんどありません。
歴史

動物の神経系における電気の役割は、1791年から1797年にかけて研究したルイージ・ガルヴァーニによって解剖されたカエルで初めて観察されました。 [ bb ]ガルヴァーニの研究結果は、アレッサンドロ・ボルタにインスピレーションを与え、ボルタ電池(最も初期の電池として知られている)を開発させました。ボルタ電池を使って、彼は動物の電気(電気ウナギなど)と、加えられた直流電圧に対する生理学的反応を研究しました。[ bc ]
19 世紀、科学者たちは神経全体(ニューロンの束) の電気信号の伝播を研究し、神経組織は相互につながった管のネットワーク (細網)ではなく、細胞で構成されていることを実証しました。[ 78 ]カルロ・マッテウチはガルヴァーニの研究を進め、カエルの損傷した神経と筋肉が直流電流を生成できることを実証しました。マッテウチの研究はドイツの生理学者エミール・デュ・ボア=レーモンに刺激を与え、彼は 1843 年にこれらの筋肉と神経の準備を刺激すると、静止電流が著しく減少することを発見し、活動電位の電気的性質を特定した最初の研究者となりました。[ 79 ]活動電位の伝導速度はその後、1850 年にデュ・ボア=レーモンの友人ヘルマン・フォン・ヘルムホルツによって測定されました。[ 80 ]その後、化学理論と実験的実施の限界により電気生理学の進歩は停滞しました。神経組織が個々の細胞から構成されていることを証明するため、スペインの医師サンティアゴ・ラモン・イ・カハールとその弟子たちは、カミロ・ゴルジが開発した染色法を用いて、ニューロンの無数の形状を丹念に描写した。この発見により、ゴルジとラモン・イ・カハールは1906年のノーベル生理学賞を受賞した。[ δ ]彼らの研究は、19世紀の神経解剖学における長年の論争に終止符を打った。ゴルジ自身も神経系のネットワークモデルを提唱していた。

20 世紀には電気生理学で大きな進歩がありました。1902 年と 1912 年に、ジュリアス バーンスタインは、活動電位は軸索膜のイオン透過性の変化から生じるという仮説を提唱しました。 [ bd ] [ 81 ]バーンスタインの仮説は、活動電位中に膜コンダクタンスが増加することを示したケン コールとハワード カーティスによって確認されました。 [ be ] 1907 年、ルイ ラピックは、活動電位は閾値を越えたときに発生すると示唆し、[ bf ]これは後にイオンコンダクタンスの動的システムの産物であることが示されました。1949 年、アラン ホジキンとバーナード カッツは、軸索膜が異なるイオンに対して異なる透過性を持つ可能性があると考えてバーンスタインの仮説を改良し、特に、活動電位に対するナトリウム透過性の重要な役割を実証しました。[ bg ]彼らは、活動電位を媒介する神経膜を介した電気的変化を初めて実際に記録した。[ ε ]この一連の研究は、1952年にホジキン、カッツ、アンドリュー・ハクスリーが発表した5本の論文で最高潮に達した。彼らは電圧クランプ法を用いて、ナトリウムイオンとカリウムイオンに対する軸索膜の透過性の電圧と時間への依存性を明らかにし、そこから活動電位を定量的に再構築することに成功した。[ j ]ホジキンとハクスリーは、彼らの数学モデルの特性を、「開」、「閉」、「不活性化」など、いくつかの異なる状態を取り得る個別のイオンチャネルと相関させた。彼らの仮説は、1970年代半ばから1980年代にかけて、個々のイオンチャネルの伝導状態を調べるためのパッチクランプ法を開発したエルウィン・ネーハーとバート・ザックマンによって確認された。 [ bh ] 21世紀には、研究者らは、原子分解能の結晶構造、[ bj ]蛍光距離測定[ bk ]およびクライオ電子顕微鏡研究を通じて、これらの伝導状態の構造的基礎とイオン種に対するチャネルの選択性を理解し始めています。[ bi ][ bl ]
ジュリアス・バーンスタインは、膜を越えた静止電位に対するネルンストの式を初めて導入した人物でもありました。これは、 1943 年にデイビッド・E・ゴールドマンによって一般化され、同名のゴールドマン式となりました。 [ i ]ナトリウム–カリウムポンプは1957 年に[ bm ] [ ζ ]特定され、その特性は徐々に解明され、[ bn ] [ bo ] [ bp ]最終的に、 X 線結晶構造解析によって原子分解能の構造が決定されました。[ bq ]関連するイオンポンプの結晶構造も解明され、これらの分子機械がどのように機能するかについてのより広い視点が得られました。[ br ]
定量モデル

数学的モデルと計算モデルは活動電位の理解に不可欠であり、実験データに対して検証可能な予測を提供し、理論の厳格な検証を可能にします。初期の神経モデルの中で最も重要かつ正確なのはホジキン・ハクスリーモデルです。これは、4つの常微分方程式(ODE)の結合によって活動電位を記述するものです。[ j ]ホジキン・ハクスリーモデルは、自然界に存在する現実的な神経膜と比較すると制限の少ない単純化である可能性がありますが[ 82 ] 、その複雑さから、モリス・レカーモデル[ bt ]やフィッツヒュー・ナグモモデル[ bu ]など、さらに単純化されたモデルがいくつか生まれました[ 83 ] [ bs ] 。これらのモデルはどちらも、結合したODEが2つしかありません。ホジキン・ハクスリー・モデルやフィッツヒュー・ナグモ・モデル、およびそれらの関連モデルであるボンヘッファー・ファン・デル・ポール・モデル[ bv ]の特性は、数学、 [ 84 ] [ bw ]計算[ 85 ]および電子工学[ bx ]の分野で十分に研究されてきました。しかし、発生器電位と活動電位の単純なモデルでは、特にパチニ小体のような機械受容器の閾値付近の神経スパイク率とスパイク形状を正確に再現することができません。[ 86 ]より現代的な研究では、より大規模で統合されたシステムに焦点を当てています。活動電位モデルを神経系の他の部分 (樹状突起やシナプスなど) のモデルと結合することにより、研究者は神経計算[ 87 ]や逃避反射などの単純な反射、中枢パターン発生器によって制御される反射を研究することができます。[ 88 ] [ by ]
参照
注記
参考文献
脚注
- ^ Hodgkin AL, Huxley AF (1952年8月). 「膜電流の定量的記述と神経伝導および興奮への応用」 . The Journal of Physiology . 117 (4): 500–44 . doi : 10.1113/jphysiol.1952.sp004764 . PMC 1392413. PMID 12991237 .
- ^ Williams JA (1981年2月). 「内分泌細胞と外分泌細胞における分泌の電気的相関」. Fed Proc . 40 (2): 128–34 . PMID 6257554 .
- ^ 「心筋収縮」 。 2021年5月28日閲覧。
- ^ Purves et al. 2008、26ページ。
- ^ Pickard B (1973年6月). 「高等植物における活動電位」(PDF) . The Botanical Review . 39 (2): 172– 201. Bibcode : 1973BotRv..39..172P . doi : 10.1007/BF02859299 . S2CID 5026557. 2021年8月27日時点のオリジナル(PDF)からアーカイブ。 2020年4月14日閲覧。
- ^ Leterrier C (2018年2月). 「軸索開始部:最新の視点」 . The Journal of Neuroscience . 38 (9): 2135– 2145. doi : 10.1523/JNEUROSCI.1922-17.2018 . PMC 6596274. PMID 29378864 .
- ^ Purves D, Augustine GJ, Fitzpatrick D, et al., eds. (2001). 「電圧依存性イオンチャネル」 Neuroscience (第2版). Sunderland, MA: Sinauer Associates. 2018年6月5日時点のオリジナルよりアーカイブ。 2017年8月29日閲覧。
- ^ a b c d e f g hブロック、オーカンド、グリンネル、1977 年、150–151 ページ。
- ^ a b c d e Junge 1981、89–90 ページ。
- ^ a bシュミット・ニールセン 1997、484ページ。
- ^ a b cパーブスら。 2008、48–49 ページ。ブロック、オーカンド、グリンネル、1977 年、p. 141;シュミット・ニールセン、1997 年、p. 483;ユンゲ 1981 年、p. 89.
- ^スティーブンス 1966年、127ページ。
- ^シュミット・ニールセン、484ページ。
- ^玉川 浩、船谷 正之、池田 憲治 (2016年1月). 「生体系と非生体系の両方で観察される膜電位発生機構としてのLingの吸着理論」 .膜. 6 ( 1): 11. doi : 10.3390/membranes6010011 . PMC 4812417. PMID 26821050 .
- ^ a b c d e Sanes DH, Reh TA (2012年1月1日).神経系の発達(第3版). エルゼビア・アカデミック・プレス. pp. 211– 214. ISBN 9780080923208. OCLC 762720374 .
- ^ Partridge D (1991).カルシウムチャネル:その特性、機能、調節、そして臨床的意義. CRC Press. pp. 138– 142. ISBN 9780849388071。
- ^ Black I (1984).神経発達の細胞・分子生物学 | Ira Black | Springer . Springer. p. 103. ISBN 978-1-4613-2717-2. 2017年7月17日時点のオリジナルよりアーカイブ。
- ^ Pedersen R (1998). Current Topics in Developmental Biology, Volume 39. Elsevier Academic Press. ISBN 9780080584621。
- ^ブロック、オーカンド、グリンネル、1977 年、p. 11.
- ^シルバーソーン 2010、253ページ。
- ^ a b cパーブスら。 2008、49–50 ページ。ブロック、オーカンド、グリンネル、1977 年、140 ~ 141 ページ。シュミット・ニールセン、1997 年、480 ~ 481 ページ。
- ^ a b c dシュミット・ニールセン 1997年、483-484頁。
- ^ブロック、オーカンド、グリンネル、1977 年、177–240 ページ。シュミット・ニールセン、1997 年、490 ~ 499 ページ。スティーブンス 1966 年、p. 47-68。
- ^ブロック、オーカンド、グリンネル、1977 年、178–180 ページ。シュミット・ニールセン、1997 年、490 ~ 491 ページ。
- ^パーヴェスら 2001 .
- ^パーヴェス他 2008年、26~28頁。
- ^ 「髄鞘形成はシナプス伝達のアナログ変調の空間範囲を拡大する:モデル化研究」細胞神経科学の最前線。
- ^ Zbili, M .; Debanne, D. (2019). 「シナプス伝達におけるアナログ-デジタル変調の過去と未来」 . Frontiers in Cellular Neuroscience . 13 160. doi : 10.3389/fncel.2019.00160 . PMC 6492051. PMID 31105529 .
- ^ Clark, Beverley; Häusser, Michael (2006年8月8日). 「神経コーディング:軸索におけるアナログシグナル伝達」 . Current Biology . 16 (15): R585– R588. doi : 10.1016/j.cub.2006.07.007 . PMID 16890514. S2CID 8295969 .
- ^ Liu, Wenke; Liu, Qing; Crozier, Robert A.; Davis, Robin L. (2021). 「らせん神経節軸索における活動電位微細構造のアナログ伝達」 . Journal of Neurophysiology . 126 (3): 888– 905. doi : 10.1152/jn.00237.2021 . PMC 8461829. PMID 34346782 .
- ^シュミット・ニールセン、1997 年、535–580 ページ。ブロック、オーカンド、グリンネル、1977 年、49 ~ 56、76 ~ 93、247 ~ 255。スティーブンス、1966 年、69 ~ 79 ページ。
- ^ブロック、オーカンド、グリンネル、1977 年、53 ページ。ブロック、オーカンド、グリンネル、1977 年、122 ~ 124 ページ。
- ^ Junge 1981、115–132ページ。
- ^ a bブロック、オーカンド、グリンネル、1977 年、152–153 ページ。
- ^ブロック、オーカンド、グリンネル、1977 年、444–445 ページ。
- ^ Purves et al. 2008、38ページ。
- ^スティーブンス 1966年、127~128頁。
- ^パーヴェスら 2008年、61~65頁。
- ^パーブスら。 2008、64–74 ページ。ブロック、オーカンド、グリンネル、1977 年、149 ~ 150 ページ。ユンゲ 1981 年、84 ~ 85 ページ。スティーブンス、1966 年、152 ~ 158 ページ。
- ^ a b cパーブスら。 2008 年、p. 47;パーブスら。 2008 年、p. 65;ブロック、オーカンド、グリンネル、1977 年、147 ~ 148 ページ。スティーブンス 1966 年、p. 128.
- ^ Goldin, AL、 Waxman 2007、「神経チャネルと受容体」、pp. 43–58。
- ^スティーブンス 1966、49ページ。
- ^パーブスら。 2008 年、p. 34;ブロック、オーカンド、グリンネル、1977 年、p. 134;シュミット・ニールセン、1997 年、478 ~ 480 ページ。
- ^ a b c dパーヴェス他 2008年、49頁。
- ^ a b c dスティーブンス 1966年、19~20頁。
- ^ a b cブロック、オーカンド、グリンネル、1977 年、p. 151;ユンゲ、1981 年、4 ~ 5 ページ。
- ^ a bブロック、オーカンド、グリンネル、1977 年、p. 152.
- ^ブロック、オーカンド、グリンネル、1977 年、147–149 ページ。スティーブンス、1966 年、126 ~ 127 ページ。
- ^ Purves et al. 2008、37ページ。
- ^ a b Purves et al. 2008、p.56。
- ^ブロック、オーカンド、グリンネル、1977 年、160–164 ページ。
- ^スティーブンス 1966年、21~23頁。
- ^ブロック、オーカンド、グリンネル、1977 年、161–164 ページ。
- ^ブロック、オーカンド、グリンネル、1977 年、p. 509.
- ^田崎一郎、フィールド 1959、75–121ページ
- ^シュミット-ニールセン、1997 年、図 12.13。
- ^ブロック、オーカンド、グリンネル、1977 年、p. 163.
- ^ Waxman, SG、 Waxman 2007、「神経変性疾患としての多発性硬化症」、pp. 333–346。
- ^ a b Rall, W、Koch & Segev 1989、「樹状ニューロンのケーブル理論」、pp. 9–62。
- ^ Segev I, Fleshman JW, Burke RE (1989). 「複雑ニューロンのコンパートメントモデル」Koch C , Segev I (編). 『ニューロンモデリングの方法:シナプスからネットワークへ』 マサチューセッツ州ケンブリッジ: MIT出版. pp. 63– 96. ISBN 978-0-262-11133-1. LCCN 88008279 . OCLC 18384545 .
- ^パーヴェスら 2008年、52~53頁。
- ^ガノン 1991、59~60頁。
- ^ Tandon, Prakash N (2019年7月1日). 「ジャグディーシュ・チャンドラ・ボースと植物神経生物学:パートI」(PDF) . Indian Journal of History of Science . 54 (2). doi : 10.16943/ijhs/2019/v54i2/49660 . ISSN 0019-5235 .
- ^ Felle HH, Zimmermann MR (2007年6月). 「大麦における活動電位を介した全身シグナル伝達」. Planta . 226 ( 1) 203: 203–14 . Bibcode : 2007Plant.226..203F . doi : 10.1007/s00425-006-0458-y . PMID 17226028. S2CID 5059716 .
- ^ Luken JO (2005年12月). 「カロライナ湾に生息するモウズイカ科ハエトリグサ(Dionaea muscipula)の生息地」. Southeastern Naturalist . 4 (4): 573– 584. doi : 10.1656/1528-7092(2005)004[0573:HODMVF]2.0.CO;2 . ISSN 1528-7092 . S2CID 9246114 .
- ^ a b Böhm J, Scherzer S, Krol E, Kreuzer I, von Meyer K, Lorey C, 他 (2016年2月). 「ハエトリグサDionaea muscipulaは捕食者誘発性の活動電位を計測し、ナトリウム吸収を誘導する」 . Current Biology . 26 (3): 286–95 . Bibcode : 2016CBio...26..286B . doi : 10.1016/j.cub.2015.11.057 . PMC 4751343. PMID 26804557 .
- ^ a b c d e f g Hedrich R, Neher E (2018年3月). 「ハエトリグサ:興奮しやすい食虫植物の働き」. Trends in Plant Science . 23 (3): 220– 234. Bibcode : 2018TPS....23..220H . doi : 10.1016/j.tplants.2017.12.004 . PMID 29336976 .
- ^ Purves D, Augustine GJ, Fitzpatrick D, 他編. Neuroscience. 第2版. Sunderland (MA): Sinauer Associates; 2001. 神経細胞膜の電位. 入手先: [1]
- ^ Volkov AG, Adesina T, Jovanov E (2007年5月). 「運動細胞への電気刺激によるハエトリグサの閉鎖」 . Plant Signaling & Behavior . 2 (3): 139– 45. Bibcode : 2007PlSiB...2..139V . doi : 10.4161/psb.2.3.4217 . PMC 2634039. PMID 19516982 .
- ^ Gradmann, D; Mummert, H、 Spanswick、Lucas & Dainty 1980、「植物の活動電位」、pp. 333–344。
- ^ Opritov, VA, et al. 「高等植物(ペポカボチャ)細胞における活動電位発生と電気発生ポンプの作動との直接的な結合」ロシア植物生理学誌、第49巻、第1号、2002年、142~147頁。
- ^ブロック&ホリッジ 1965 .
- ^ Kristan WB (2016年10月). 「ニューロンの初期進化」 . Current Biology . 26 (20): R949– R954. Bibcode : 2016CBio...26.R949K . doi : 10.1016/j.cub.2016.05.030 . PMID 27780067 .
- ^ Hellier JL (2014).脳、神経系、そしてその疾患ABC-Clio. p. 532. ISBN 9781610693387。
- ^ Junge 1981、63-82ページ。
- ^ケッテンマン&グランティン 1992 .
- ^ Snell, FM、 Lavallée、Schanne、Hébert 1969、「先端の細いピペット微小電極の電気的特性」。
- ^火鉢 1961 ;マクヘンリー&ギャリソン 1969 ;ウォーデン、スウェイジー、アデルマン 1975 年。
- ^フィンケルスタイン・GW (2013).エミール・デュ・ボワ=レイモンド:19世紀ドイツにおける神経科学、自己、そして社会. マサチューセッツ州ケンブリッジ. ISBN 9781461950325. OCLC 864592470 .
{{cite book}}: CS1 メンテナンス: 場所の発行元が見つかりません (リンク) - ^オレスコ、キャサリン・M、フレデリック・L・ホームズ共著「実験、定量化、そして発見:ヘルムホルツの初期生理学的研究、1843-50年」デイヴィッド・カーン編『ヘルマン・フォン・ヘルムホルツと19世紀科学の基礎』 50-108頁。カリフォルニア大学バークレー校、ロサンゼルス校、ロンドン校、1994年。
- ^バーンスタイン 1912年。
- ^ Baranauskas G, Martina M (2006年1月). 「哺乳類の中枢ニューロンにおいて、ナトリウム電流はホジキン・ハクスリー型の遅延なしに活性化する」 . The Journal of Neuroscience . 26 (2): 671– 84. doi : 10.1523 /jneurosci.2283-05.2006 . PMC 6674426. PMID 16407565 .
- ^ホッペンステッド 1986 .
- ^ Sato, S; Fukai, H; Nomura, T; Doi, S. Reeke et al. 2005 , Bifurcation Analysis of the Hodgkin-Huxley Equations , pp. 459–478.* FitzHugh, R. Schwann 1969 , Mathematical models of axcitation and propagation in neurons , pp. 12–16.* Guckenheimer & Holmes 1986 , pp. 12–16
- ^ Nelson, ME; Rinzel, J in Bower & Beeman 1995 , The Hodgkin-Huxley Model、pp. 29–49。* Rinzel, J & Ermentrout, GB; in Koch & Segev 1989 , Analysis of Neural Excitability and Oscillations、pp. 135–169。
- ^ Biswas A, Manivannan M, Srinivasan MA (2015). 「振動触覚感度閾値:パチニ小体の非線形確率的メカノトランスダクションモデル」 . IEEE Transactions on Haptics . 8 (1): 102– 13. Bibcode : 2015ITHap...8..102B . doi : 10.1109/TOH.2014.2369422 . PMID 25398183. S2CID 15326972 .
- ^ McCulloch 1988、pp.19–39, 46–66, 72–141; Anderson & Rosenfeld 1988、pp.15–41。
- ^ Getting, PA、 Koch & Segev 1989、「小規模ニューラルネットワークの再構築」、pp. 171–194。
ジャーナル記事
- ^ MacDonald PE, Rorsman P (2006年2月). 「膵β細胞における振動、細胞間結合、そしてインスリン分泌」 . PLOS Biology . 4 (2): e49. doi : 10.1371/journal.pbio.0040049 . PMC 1363709. PMID 16464129 .

- ^ a b Barnett MW, Larkman PM (2007年6月). 「活動電位」 . Practical Neurology . 7 (3): 192–7 . PMID 17515599. 2011年7月8日時点のオリジナルよりアーカイブ。
- ^ a b Varró, András; et al. (2021年7月1日). 「心臓膜貫通イオンチャネルと活動電位:細胞生理学と不整脈誘発性行動」 .生理学レビュー. 101 (3): 1083–1176 . doi : 10.1152/physrev.00024.2019 . ISSN 0031-9333 . PMID 33118864 .
- ^ Golding NL, Kath WL, Spruston N (2001年12月). 「CA1錐体ニューロン樹状突起における活動電位逆伝播の二分法」. Journal of Neurophysiology . 86 (6): 2998– 3010. doi : 10.1152/jn.2001.86.6.2998 . PMID 11731556. S2CID 2915815 .
- ^佐々木 哲也、松木 直也、池ヶ谷 裕也 2011 軸索伝導中の活動電位調節 Science 331 (6017)、pp. 599–601
- ^ Aur D, Connolly CI, Jog MS (2005年11月). 「四極管を用いたスパイク指向性の計算」. Journal of Neuroscience Methods . 149 (1): 57– 63. doi : 10.1016/j.jneumeth.2005.05.006 . PMID 15978667. S2CID 34131910 .
- ^ Aur D., Jog, MS., 2010 神経電気力学:脳の言語を理解する、IOS Press、2010年。doi: 10.3233 / 978-1-60750-473-3-i
- ^ Noble D (1960年11月). 「ホジキン・ハクスリー方程式に基づく心臓の活動とペースメーカーの電位」. Nature . 188 ( 4749): 495–7 . Bibcode : 1960Natur.188..495N . doi : 10.1038/188495b0 . PMID 13729365. S2CID 4147174 .
- ^ a b Goldman DE (1943年9月). 「膜における電位、インピーダンス、整流作用」 .一般生理学ジャーナル. 27 (1): 37– 60. doi : 10.1085/jgp.27.1.37 . PMC 2142582. PMID 19873371 .
- ^ a b c d e Hodgkin AL , Huxley AF, Katz B (1952年4月). 「ロリゴ巨大軸索の膜における電流-電圧関係の測定」 . The Journal of Physiology . 116 (4): 424–48 . doi : 10.1113/jphysiol.1952.sp004716 . PMC 1392219. PMID 14946712 . * Hodgkin AL , Huxley AF (1952年4月). 「ロリゴ巨大軸索の膜を通過するナトリウムイオンとカリウムイオンの電流」 . The Journal of Physiology . 116 (4): 449–72 . doi : 10.1113/jphysiol.1952.sp004717 . PMC 1392213. PMID 14946713 . * Hodgkin AL , Huxley AF (1952年4月). 「ロリゴ巨大軸索における膜コンダクタンスの構成要素」 . The Journal of Physiology . 116 (4): 473–96 . doi : 10.1113/jphysiol.1952.sp004718 . PMC 1392209. PMID 14946714 . * Hodgkin AL , Huxley AF (1952年4月). 「ロリゴ巨大軸索におけるナトリウムコンダクタンスに対する膜電位の二重効果」 . The Journal of Physiology . 116 (4): 497– 506. doi : 10.1113/jphysiol.1952.sp004719 . PMC 1392212. PMID 14946715 . * Hodgkin AL , Huxley AF (1952年8月). 「膜電流の定量的記述と神経伝導および興奮への応用」 . The Journal of Physiology . 117 (4): 500–44 . doi : 10.1113/jphysiol.1952.sp004764 . PMC 1392413. PMID 12991237 .
- ^ Naundorf B, Wolf F, Volgushev M (2006年4月). 「皮質ニューロンにおける活動電位開始のユニークな特徴」 ( PDF) . Nature . 440 (7087): 1060–3 . Bibcode : 2006Natur.440.1060N . doi : 10.1038/nature04610 . PMID 16625198. S2CID 1328840. 2018年12月20日時点のオリジナル(PDF)からアーカイブ。 2019年9月24日閲覧。
- ^ Hodgkin AL (1937年7月). 「神経における電気伝達の証拠:パートI」 . The Journal of Physiology . 90 (2): 183– 210. doi : 10.1113/jphysiol.1937.sp003507 . PMC 1395060. PMID 16994885 . * Hodgkin AL (1937年7月). 「神経における電気伝達の証拠:第2部」 . The Journal of Physiology . 90 (2): 211–32 . doi : 10.1113/jphysiol.1937.sp003508 . PMC 1395062. PMID 16994886 .
- ^ Zalc B (2006). 「ミエリンの獲得:成功物語」.ニューロン–グリア相互作用におけるプリン作動性シグナル伝達. ノバルティス財団シンポジウム. 第276巻. pp. 15–21 , discussion 21–5, 54–7 , 275–81 . doi : 10.1002/9780470032244.ch3 . ISBN 978-0-470-03224-4. PMID 16805421 .
{{cite book}}:|journal=無視されました (ヘルプ) - ^ Poliak S, Peles E (2003年12月). 「ランヴィエ絞輪における髄鞘形成軸索の局所的分化」. Nature Reviews. Neuroscience . 4 (12): 968–80 . doi : 10.1038/nrn1253 . PMID 14682359. S2CID 14720760 .
- ^ Simons M, Trotter J (2007年10月). 「まとめ:髄鞘形成の細胞生物学」Current Opinion in Neurobiology . 17 (5): 533–40 . doi : 10.1016/j.conb.2007.08.003 . PMID 17923405 . S2CID 45470194 .
- ^ Xu K, Terakawa S (1999年8月). 「窓形成節と広い髄鞘下空間が、エビの髄鞘形成軸索の異常に速いインパルス伝導の基盤を形成する」 . The Journal of Experimental Biology . 202 (Pt 15): 1979–89 . Bibcode : 1999JExpB.202.1979X . doi : 10.1242/jeb.202.15.1979 . PMID 10395528 .
- ^ a b Hursh JB (1939). 「神経線維の伝導速度と直径」. American Journal of Physiology . 127 : 131–39 . doi : 10.1152/ajplegacy.1939.127.1.131 .
- ^ Lillie RS (1925年3月). 「受動鉄神経モデルにおける伝達と回復に影響を与える因子」 .一般生理学ジャーナル. 7 (4): 473– 507. doi : 10.1085/jgp.7.4.473 . PMC 2140733. PMID 19872151 . ケインズ&エイドリー(1991)、p.78も参照。
- ^ Tasaki I (1939). 「神経インパルスの電気跳躍伝達と麻酔による神経線維への影響」Am. J. Physiol . 127 : 211–27 . doi : 10.1152/ajplegacy.1939.127.2.211 .
- ^田崎一、竹内徹 (1941). 「Der am Ranvierschen Knoten entstehende Aktionsstrom und seine Bedeutung für die Erregungsleitung」。Pflügers は生理学的アーカイブを保存します。244 (6): 696–711 .土井: 10.1007/BF01755414。S2CID 8628858。 *田崎 I、竹内 徹 (1942)。 「Weitere Studien über den Aktionsstrom der markhaltigen Nervenfaser und über die elektrosaltatorische Übertragung des nervenimpulses」。Pflügers は生理学的アーカイブを保存します。245 (5): 764–82 .土井: 10.1007/BF01755237。S2CID 44315437。
- ^ Huxley AF , Stämpfli R (1949年5月). 「末梢有髄神経線維における跳躍伝導の証拠」 . The Journal of Physiology . 108 (3): 315–39 . doi : 10.1113/jphysiol.1949.sp004335 . PMC 1392492. PMID 16991863 . * Huxley AF , Stampfli R (1951年2月). 「単一髄鞘神経線維における膜静止電位と活動電位の直接測定」 . The Journal of Physiology . 112 ( 3–4 ): 476–95 . doi : 10.1113/jphysiol.1951.sp004545 . PMC 1393015. PMID 14825228 .
- ^ Rushton WA (1951年9月). 「髄質神経における線維サイズの影響に関する理論」 . The Journal of Physiology . 115 (1): 101–22 . doi : 10.1113/jphysiol.1951.sp004655 . PMC 1392008. PMID 14889433 .
- ^ a b Hartline DK, Colman DR (2007年1月). 「急速伝導と巨大軸索および髄鞘線維の進化」 . Current Biology . 17 (1): R29-35. Bibcode : 2007CBio...17R..29H . doi : 10.1016/j.cub.2006.11.042 . PMID 17208176. S2CID 10033356 .
- ^ Miller RH, Mi S (2007年11月). 「脱髄の解剖」. Nature Neuroscience . 10 (11): 1351–4 . doi : 10.1038/nn1995 . PMID 17965654. S2CID 12441377 .
- ^ケルビンWT (1855). 「電信理論について」.王立協会紀要. 7 : 382–99 . doi : 10.1098/rspl.1854.0093 . S2CID 178547827 .
- ^ Hodgkin AL , Rushton WA (1946年12月). 「甲殻類神経線維の電気定数」 . Proceedings of the Royal Society of Medicine . 134 (873): 444–79 . Bibcode : 1946RSPSB.133..444H . doi : 10.1098/rspb.1946.0024 . PMID 20281590 .
- ^ Süudhof TC (2008). 「神経伝達物質放出」.神経伝達物質放出の薬理学. 実験薬理学ハンドブック. 第184巻. pp. 1– 21. doi : 10.1007/978-3-540-74805-2_1 . ISBN 978-3-540-74804-5. PMID 18064409 .
- ^ Rusakov DA (2006年8月). 「中枢シナプスにおけるシナプス前制御のCa2+依存性メカニズム」 . The Neuroscientist . 12 (4): 317–26 . doi : 10.1177/1073858405284672 . PMC 2684670. PMID 16840708 .
- ^ Humeau Y, Doussau F, Grant NJ, Poulain B (2000年5月). 「ボツリヌス菌と破傷風菌の神経毒素が神経伝達物質の放出を阻害する仕組み」. Biochimie . 82 (5): 427–46 . doi : 10.1016/S0300-9084(00)00216-9 . PMID 10865130 .
- ^ Zoidl G, Dermietzel R (2002年11月). 「電気シナプスの探索:未来への一瞥」. Cell and Tissue Research . 310 (2): 137–42 . doi : 10.1007/s00441-002-0632-x . PMID 12397368. S2CID 22414506 .
- ^ Brink PR, Cronin K, Ramanan SV (1996年8月). 「興奮性細胞におけるギャップ結合」. Journal of Bioenergetics and Biomembranes . 28 (4): 351–8 . doi : 10.1007/BF02110111 . PMID 8844332. S2CID 46371790 .
- ^ Hirsch NP (2007年7月). 「健康と疾患における神経筋接合部」 . British Journal of Anaesthesia . 99 (1): 132–8 . doi : 10.1093/bja/aem144 . PMID 17573397 .
- ^ Hughes BW, Kusner LL, Kaminski HJ (2006年4月). 「神経筋接合部の分子構造」. Muscle & Nerve . 33 (4): 445–61 . doi : 10.1002/mus.20440 . PMID 16228970 . S2CID 1888352 .
- ^ a b Newmark J (2007年1月). 「神経剤」. The Neurologist . 13 (1): 20– 32. doi : 10.1097/01.nrl.0000252923.04894.53 . PMID 17215724. S2CID 211234081 .
- ^ Costa LG (2006年4月). 「有機リン系毒性学の最新課題」Clinica Chimica Acta; International Journal of Clinical Chemistry . 366 ( 1–2 ): 1–13 . doi : 10.1016/j.cca.2005.10.008 . PMID 16337171 .
- ^ a b c Kléber AG, Rudy Y (2004年4月). 「心臓の拍動伝播とそれに伴う不整脈の基本メカニズム」.生理学レビュー. 84 (2): 431–88 . doi : 10.1152/physrev.00025.2003 . PMID 15044680. S2CID 21823003 .
- ^ Tamargo J, Caballero R, Delpón E (2004年1月). 「心房細動治療における薬理学的アプローチ」Current Medicinal Chemistry . 11 (1): 13– 28. doi : 10.2174/0929867043456241 . PMID 14754423 .
- ^スレイマン CL、ロング WS、グラッドマン D (1976 年 4 月)。 」菌糸菌Neurospora crassaにおける「活動電位」。Biochimica et Biophysica Acta (BBA) - Biomembranes . 426 (4): 732– 44. doi : 10.1016/0005-2736(76)90138-3 . PMID 130926 .
- ^ Mummert H, Gradmann D (1991年12月). 「寛骨臼における活動電位:電位依存性フラックスの測定とシミュレーション」. The Journal of Membrane Biology . 124 (3): 265–73 . doi : 10.1007/BF01994359 . PMID 1664861. S2CID 22063907 .
- ^ Gradmann D (2001). 「植物の振動モデル」. Aust. J. Plant Physiol . 28 (7): 577– 590. Bibcode : 2001FunPB..28..577G . doi : 10.1071/pp01017 .
- ^ Beilby MJ (2007).車軸藻における活動電位. 国際細胞学レビュー. 第257巻. pp. 43– 82. doi : 10.1016/S0074-7696(07)57002-6 . ISBN 978-0-12-373701-4. PMID 17280895 .
- ^ Gradmann D, Hoffstadt J (1998年11月). 「植物におけるイオントランスポーターの電気結合:細胞内イオン濃度との相互作用」. The Journal of Membrane Biology . 166 (1): 51–9 . doi : 10.1007/s002329900446 . PMID 9784585. S2CID 24190001 .
- ^ Fromm J, Lautner S (2007年3月). 「植物における電気シグナルとその生理学的意義」 . Plant, Cell & Environment . 30 (3): 249– 257. Bibcode : 2007PCEnv..30..249F . doi : 10.1111/j.1365-3040.2006.01614.x . PMID 17263772 .
- ^ Leys SP, Mackie GO, Meech RW (1999年5月). 「スポンジにおけるインパルス伝導」 . The Journal of Experimental Biology . 202 (Pt 9) (9): 1139–50 . Bibcode : 1999JExpB.202.1139L . doi : 10.1242/jeb.202.9.1139 . PMID 10101111 .
- ^ Keynes RD (1989). 「神経インパルス研究における巨大軸索の役割」BioEssays . 10 ( 2–3 ): 90–3 . doi : 10.1002/bies.950100213 . PMID 2541698 .
- ^ Meunier C, Segev I (2002年11月). 「悪魔の代弁者を演じること:ホジキン=ハクスリーモデルは有用か?」Trends in Neurosciences 25 ( 11): 558–63 . doi : 10.1016/S0166-2236(02)02278-6 . PMID 12392930. S2CID 1355280 .
- ^ Cole KS (1949). 「イカの軸索膜の動的電気特性」. Arch. Sci. Physiol . 3 : 253–8 .
- ^ Ling G, Gerard RW (1949年12月). 「カエル縫工筋線維の正常膜電位」. Journal of Cellular and Comparative Physiology . 34 (3): 383–96 . doi : 10.1002/jcp.1030340304 . PMID 15410483 .
- ^ Nastuk WL, Hodgkin A (1950). 「単一筋線維の電気的活動」. Journal of Cellular and Comparative Physiology . 35 : 39–73 . doi : 10.1002/jcp.1030350105 .
- ^ Brock LG, Coombs JS, Eccles JC (1952年8月). 「細胞内電極を用いた運動ニューロンの電位記録」 . The Journal of Physiology . 117 (4): 431–60 . doi : 10.1113/jphysiol.1952.sp004759 . PMC 1392415. PMID 12991232 .
- ^ Ross WN, Salzberg BM, Cohen LB, Davila HV (1974年12月). 「活動電位における色素吸収の大きな変化」 . Biophysical Journal . 14 (12): 983–6 . Bibcode : 1974BpJ....14..983R . doi : 10.1016/ S0006-3495 (74)85963-1 . PMC 1334592. PMID 4429774 . * Grynkiewicz G, Poenie M, Tsien RY (1985年3月). 「蛍光特性が大幅に向上した新世代Ca2+指示薬」 . The Journal of Biological Chemistry . 260 (6): 3440–50 . doi : 10.1016/S0021-9258(19)83641-4 . PMID 3838314 .
- ^ Bu G, Adams H, Berbari EJ, Rubart M (2009年3月). 「in situ心室心筋細胞の筋形質膜における均一な活動電位再分極」 . Biophysical Journal . 96 (6): 2532–46 . Bibcode : 2009BpJ....96.2532B . doi : 10.1016/j.bpj.2008.12.3896 . PMC 2907679. PMID 19289075 .
- ^ Milligan JV, Edwards C (1965年7月). 「カエル横紋筋におけるカリウム拘縮後の拘縮能力回復の経時変化に影響を与えるいくつかの要因」 . The Journal of General Physiology . 48 (6): 975–83 . doi : 10.1085/jgp.48.6.975 . PMC 2195447. PMID 5855511 . * Ritchie JM, Rogart RB (1977). 「サキシトキシンおよびテトロドトキシンの興奮性組織への結合」Reviews of Physiology, Biochemistry and Pharmacology, 第79巻. pp. 1– 50. doi : 10.1007/BFb0037088 . ISBN 0-387-08326-X. PMID 335473 .* Keynes RD, Ritchie JM (1984年8月). 「標識サキシトキシンのイカ巨大軸索への結合について」.ロンドン王立協会紀要. シリーズB, 生物科学. 222 (1227): 147–53 . Bibcode : 1984RSPSB.222..147K . doi : 10.1098 / rspb.1984.0055 . PMID 6148754. S2CID 11465181 .
- ^ Piccolino M (1997年10月). 「ルイージ・ガルヴァーニと動物の電気:電気生理学の創始から2世紀後」. Trends in Neurosciences 20 (10): 443–8 . doi : 10.1016 / S0166-2236(97)01101-6 . PMID 9347609. S2CID 23394494 .
- ^ Piccolino M (2000年4月). 「ボルタ電池200周年(1800-2000年):人工電気器官」Trends in Neurosciences 23 ( 4): 147–51 . doi : 10.1016/S0166-2236(99) 01544-1 . PMID 10717671. S2CID 393323 .
- ^バーンスタイン J (1902). 「生命エネルギーの熱力学的研究」。Pflügers は生理学的アーカイブを保存します。92 ( 10–12 ): 521–562 .土井: 10.1007/BF01790181。S2CID 33229139。
- ^ Cole KS , Curtis HJ (1939年5月). 「活動中のイカ巨大軸索の電気インピーダンス」 .一般生理学ジャーナル. 22 (5): 649–70 . doi : 10.1085/jgp.22.5.649 . PMC 2142006. PMID 19873125 .
- ^ラピック L (1907)。 「分極に関する興奮電気の量的研究」。J.Physiol.パソル。将軍9 : 620–635 .
- ^ Hodgkin AL , Katz B (1949年3月). 「ナトリウムイオンがイカの巨大軸索の電気的活動に及ぼす影響」 . The Journal of Physiology . 108 (1): 37– 77. Bibcode : 1949JPhsg.108...37H . doi : 10.1113/jphysiol.1949.sp004310 . PMC 1392331. PMID 18128147 .
- ^ Neher E , Sakmann B (1976年4月). 「脱神経カエル筋線維の膜から記録された単一チャネル電流」. Nature . 260 ( 5554): 799– 802. Bibcode : 1976Natur.260..799N . doi : 10.1038/260799a0 . PMID 1083489. S2CID 4204985 . * Hamill OP, Marty A, Neher E, Sakmann B, Sigworth FJ (1981年8月). 「細胞および無細胞膜パッチからの高解像度電流記録のための改良パッチクランプ法」. Pflügers Archiv . 391 (2): 85– 100. doi : 10.1007/BF00656997 . PMID 6270629. S2CID 12014433 . * Neher E , Sakmann B (1992年3月). 「パッチクランプ法」. Scientific American . 266 (3): 44– 51. Bibcode : 1992SciAm.266c..44N . doi : 10.1038/scientificamerican0392-44 . PMID 1374932 .
- ^ Yellen G (2002年9月). 「電位依存性カリウムチャネルとその関連分子」. Nature . 419 (6902): 35– 42. Bibcode : 2002Natur.419...35Y . doi : 10.1038/nature00978 . PMID 12214225. S2CID 4420877 .
- ^ Doyle DA, Morais Cabral J, Pfuetzner RA, Kuo A, Gulbis JM, Cohen SL, et al. (1998年4月). 「カリウムチャネルの構造:K+伝導と選択性の分子基盤」. Science . 280 (5360): 69– 77. Bibcode : 1998Sci...280...69D . doi : 10.1126/science.280.5360.69 . PMID 9525859 . * Zhou Y, Morais-Cabral JH, Kaufman A, MacKinnon R (2001年11月). 「K+チャネル-Fab複合体による2.0Å分解能でのイオン配位および水和の化学」. Nature . 414 (6859): 43–8 . Bibcode : 2001Natur.414...43Z . doi : 10.1038 / 35102009 . PMID 11689936. S2CID 205022645 . * Jiang Y, Lee A, Chen J, Ruta V, Cadene M, Chait BT, MacKinnon R (2003年5月). 「電位依存性K+チャネルのX線構造」. Nature . 423 (6935): 33– 41. Bibcode : 2003Natur.423...33J . doi : 10.1038/ nature01580 . PMID 12721618. S2CID 4347957 .
- ^ Cha A, Snyder GE, Selvin PR , Bezanilla F (1999年12月). 「分光法によるカリウムチャネルの電圧感受性領域の原子スケールの動き」 . Nature . 402 ( 6763): 809–13 . Bibcode : 1999Natur.402..809C . doi : 10.1038/45552 . PMID 10617201. S2CID 4353978 . * Glauner KS, Mannuzzu LM, Gandhi CS, Isacoff EY (1999年12月). 「Shakerカリウムチャネルにおける電位センサー運動の分光マッピング」. Nature . 402 ( 6763): 813–7 . Bibcode : 1999Natur.402..813G . doi : 10.1038/45561 . PMID 10617202. S2CID 4417476 . * Bezanilla F (2000年4月). 「電圧依存性イオンチャネルにおける電圧センサー」.生理学レビュー. 80 (2): 555–92 . doi : 10.1152/physrev.2000.80.2.555 . PMID 10747201. S2CID 18629998 .
- ^ Catterall WA (2001年2月). 「ナトリウムチャネルの3Dビュー」 . Nature . 409 (6823): 988–9 , 991. Bibcode : 2001Natur.409..988C . doi : 10.1038/35059188 . PMID 11234048. S2CID 4371677 . * Sato C, Ueno Y, Asai K, Takahashi K, Sato M, Engel A, Fujiyoshi Y (2001年2月). 「電圧感受性ナトリウムチャネルは複数の空洞を持つベル型分子である」. Nature . 409 (6823): 1047–51 . Bibcode : 2001Natur.409.1047S . doi : 10.1038/35059098 . PMID 11234014 . S2CID 4430165 .
- ^ Skou JC (1957年2月). 「末梢神経由来のアデノシントリホスファターゼに対するいくつかの陽イオンの影響」. Biochimica et Biophysica Acta . 23 (2): 394– 401. doi : 10.1016 / 0006-3002(57)90343-8 . PMID 13412736. S2CID 32516710 .
- ^ Hodgkin AL , Keynes RD (1955年4月). 「SepiaとLoligoの巨大軸索における陽イオンの能動輸送」 . The Journal of Physiology . 128 (1): 28– 60. doi : 10.1113/jphysiol.1955.sp005290 . PMC 1365754. PMID 14368574 .
- ^ Caldwell PC, Hodgkin AL, Keynes RD, Shaw TL (1960年7月). 「『エネルギーに富む』リン酸化合物の注入がロリゴの巨大軸索におけるイオンの能動輸送に及ぼす影響」 . The Journal of Physiology . 152 (3): 561–90 . doi : 10.1113/jphysiol.1960.sp006509 . PMC 1363339. PMID 13806926 .
- ^ Caldwell PC, Keynes RD (1957年6月). 「巨大軸索からのナトリウム排出におけるリン酸結合エネルギーの利用」. The Journal of Physiology . 137 (1): 12–3P. doi : 10.1113/jphysiol.1957.sp005830 . PMID 13439598. S2CID 222188054 .
- ^ Morth JP、Pedersen BP、Toustrup-Jensen MS、Sørensen TL、Petersen J、Andersen JP、他。 (2007 年 12 月)。 「ナトリウム・カリウムポンプの結晶構造」。自然。450 (7172): 1043– 9. Bibcode : 2007Natur.450.1043M。土井:10.1038/nature06419。PMID 18075585。S2CID 4344526。
- ^ Lee AG, East JM (2001年6月). 「カルシウムポンプの構造からそのメカニズムがわかること」 . The Biochemical Journal . 356 (Pt 3): 665– 83. doi : 10.1042/0264-6021:3560665 . PMC 1221895. PMID 11389676 .
- ^ * Fitzhugh R (1960年5月). 「ホジキン・ハクスリー神経方程式における閾値とプラトー」 .一般生理学ジャーナル. 43 (5): 867–96 . doi : 10.1085/jgp.43.5.867 . PMC 2195039. PMID 13823315 . * Kepler TB, Abbott LF, Marder E (1992). 「コンダクタンスベースニューロンモデルの縮約」.生物サイバネティクス. 66 (5): 381–7 . doi : 10.1007/BF00197717 . PMID 1562643. S2CID 6789007 .
- ^ Morris C, Lecar H (1981年7月). 「フジツボ巨大筋繊維における電圧振動」 . Biophysical Journal . 35 (1): 193– 213. Bibcode : 1981BpJ....35..193M . doi : 10.1016/ S0006-3495 (81)84782-0 . PMC 1327511. PMID 7260316 .
- ^ Fitzhugh R (1961年7月). 「神経膜の理論モデルにおけるインパルスと生理学的状態」 .生物物理学ジャーナル. 1 (6): 445–66 . Bibcode : 1961BpJ.....1..445F . doi : 10.1016 / S0006-3495(61)86902-6 . PMC 1366333. PMID 19431309 . *南雲 純、有本 誠、吉澤 誠 (1962). 「神経軸索を模擬した能動パルス伝送線路」IRE紀要. 50 (10): 2061–2070 . Bibcode : 1962PIRE...50.2061N . doi : 10.1109/JRPROC.1962.288235 . S2CID 51648050 .
- ^ Bonhoeffer KF (1948年9月). 「神経興奮のモデルとしての受動鉄の活性化」 .一般生理学ジャーナル. 32 (1): 69– 91. doi : 10.1085/jgp.32.1.69 . PMC 2213747. PMID 18885679 . *ボンヘッファー KF (1953)。 「モデル・デア・ネルヴェナーレグン」。ナトゥールヴィッセンシャフテン。40 (11): 301–311。ビブコード: 1953NW....40....301B。土井:10.1007/BF00632438。S2CID 19149460。 *ファン・デル・ポルB (1926). 「緩和振動について」.哲学雑誌. 2 : 977–992 .* Van der Pol B , Van der Mark J (1928). 「弛緩振動として考える心拍と心臓の電気的モデル」. Philosophical Magazine . 6 : 763–775 . doi : 10.1080/14786441108564652 .* Van der Pol B , van der Mark J (1929). 「弛緩振動として考える心拍と心臓の電気的モデル」Arch. Neerl. Physiol . 14 : 418– 443.
- ^ Evans JW (1972). 「神経軸索方程式. I. 線形近似」 .インディアナ大学数学ジャーナル. 21 ( 9): 877– 885. doi : 10.1512/iumj.1972.21.21071 .* Evans JW, Feroe J (1977). 「神経インパルスの局所安定性理論」. Math. Biosci . 37 : 23–50 . doi : 10.1016/0025-5564(77)90076-1 .
- ^ Keener JP (1983). 「Van der Pol方程式とFitzHugh-Nagumo方程式のためのアナログ回路」. IEEE Transactions on Systems, Man, and Cybernetics . 13 (5): 1010– 1014. Bibcode : 1983ITSMC..13.1010K . doi : 10.1109/TSMC.1983.6313098 . S2CID 20077648 .
- ^ Hooper SL (2000年3月). 「中枢パターン発生器」. Current Biology . 10 (5): R176– R179. Bibcode : 2000CBio...10.R176H . CiteSeerX 10.1.1.133.3378 . doi : 10.1016/S0960-9822(00)00367-5 . PMID 10713861. S2CID 11388348 .
本
- アンダーソンJA、ローゼンフェルドE編(1988年)『ニューロコンピューティング:研究の基礎』、マサチューセッツ州ケンブリッジ:MIT出版。ISBN 978-0-262-01097-9. LCCN 87003022 . OCLC 15860311 .
- バーンスタイン J (1912)。Elektrobiologie, die Lehre von den elektrischen Vorgängen im Organismus auf moderner Grundlage dargestellt [電気生物学、現代の基準で表現された生体内の電気的プロセスの研究]。ブラウンシュヴァイク: Vieweg und Sohn。LCCN 12027986。OCLC 11358569。
- Bower JM、Beeman D (1995). 『GENESISの書:GENERALニューラルシミュレーションシステムによる現実的なニューラルモデルの探究』サンタクララ、カリフォルニア州:TELOS. ISBN 978-0-387-94019-9. LCCN 94017624 . OCLC 30518469 .
- Brazier MA (1961). 『脳の電気的活動の歴史』ロンドン: Pitman. LCCN 62001407. OCLC 556863 .
- Bullock TH , Horridge GA (1965).無脊椎動物の神経系の構造と機能.生物学シリーズ. サンフランシスコ: WH Freeman. LCCN 65007965. OCLC 558128 .
- Bullock TH、Orkand R、Grinnell A (1977).神経系入門. 生物学シリーズ. サンフランシスコ: WH Freeman. ISBN 978-0-7167-0030-2. LCCN 76003735 . OCLC 2048177 .
- Field J編 (1959). 『生理学ハンドブック:生理学的知識と概念の批判的かつ包括的な提示:第1部:神経生理学』第1巻. ワシントンD.C.:アメリカ生理学会. LCCN 60004587. OCLC 830755894 .
- ガノン, WF (1991). 『Review of Medical Physiology』(第15版). コネチカット州ノーウォーク: Appleton and Lange. ISBN 978-0-8385-8418-7。ISSN 0892-1253。LCCN 87642343。OCLC 23761261。
{{cite book}}:|journal=無視されました (ヘルプ) - Guckenheimer J, Holmes P編 (1986).非線形振動、動的システム、ベクトル場の分岐. 応用数学科学 第42巻(第2版). ニューヨーク: Springer Verlag. ISBN 978-0-387-90819-9. OCLC 751129941 .
- ホッペンステッドFC (1986). 『ニューロンの数学入門』 ケンブリッジ数理生物学研究 第6巻. ケンブリッジ: ケンブリッジ大学出版局. ISBN 978-0-521-31574-6. LCCN 85011013 . OCLC 12052275 .
- Junge D (1981).神経と筋の興奮(第2版). サンダーランド, マサチューセッツ州: Sinauer Associates. ISBN 978-0-87893-410-2. LCCN 80018158 . OCLC 6486925 .
- Kettenmann H, Grantyn R編 (1992). 『実用的な電気生理学的手法:脊椎動物神経生物学におけるin vitro研究のためのガイド』ニューヨーク: Wiley. ISBN 978-0-471-56200-9. LCCN 92000179 . OCLC 25204689 .
- Keynes RD , Aidley DJ (1991). 『神経と筋肉』(第2版). Cambridge: Cambridge University Press. ISBN 978-0-521-41042-7. LCCN 90015167 . OCLC 25204483 .
- Koch C , Segev I編 (1989). 『ニューロンモデリングの方法:シナプスからネットワークへ』 マサチューセッツ州ケンブリッジ: MIT出版. ISBN 978-0-262-11133-1. LCCN 88008279 . OCLC 18384545 .
- Lavalée M、Schanne OF、Hébert NC、編。 (1969年)。ガラス微小電極。ニューヨーク: ワイリー。ISBN 978-0-471-51885-3. LCCN 68009252 . OCLC 686 .
- マカロックWS (1988). 『心の体現』 ケンブリッジ、マサチューセッツ州: MIT出版. ISBN 978-0-262-63114-3. LCCN 88002987 . OCLC 237280 .
- McHenry LC, Garrison FH (1969). Garrison's History of Neurology . Springfield, Ill.: Charles C. Thomas. OCLC 429733931 .
- Silverthorn DU (2010). 『人間生理学:統合的アプローチ』(第5版). サンフランシスコ: ピアソン. ISBN 978-0-321-55980-7. LCCN 2008050369 . OCLC 268788623 .
- Spanswick RM、Lucas WJ、Dainty J編 (1980).植物膜輸送:現在の概念的課題. 植物生物学の発展. 第4巻. アムステルダム: Elsevier Biomedical Press. ISBN 978-0-444-80192-0. LCCN 79025719 . OCLC 5799924 .
- Purves D, Augustine GJ, Fitzpatrick D, Hall WC, Lamantia AS, McNamara JO, Williams SM (2001). 「シナプス小胞からの伝達物質の放出」 . Neuroscience (第2版). サンダーランド, マサチューセッツ州: Sinauer Associates. ISBN 978-0-87893-742-4. LCCN 00059496 . OCLC 806472664 .
- Purves D, Augustine GJ, Fitzpatrick D, Hall WC, Lamantia AS, McNamara JO, White LE (2008). Neuroscience (第4版). Sunderland, MA: Sinauer Associates. ISBN 978-0-87893-697-7. LCCN 2007024950 . OCLC 144771764 .
- Reeke GN、Poznanski RR、Sporns O、Rosenberg JR、Lindsay KA編 (2005). 『神経科学におけるモデリング:生物システムから神経模倣ロボティクスへ』 フロリダ州ボカラトン:Taylor & Francis. ISBN 978-0-415-32868-5. LCCN 2005298022 . OCLC 489024131 .
- Schmidt-Nielsen K (1997). 『動物生理学:適応と環境』(第5版). ケンブリッジ: ケンブリッジ大学出版局. ISBN 978-0-521-57098-5. LCCN 96039295 . OCLC 35744403 .
- Schwann HP編 (1969).生物工学. 大学間エレクトロニクスシリーズ 第9巻. ニューヨーク: McGraw-Hill. ISBN 978-0-07-055734-5. LCCN 68027513 . OCLC 51993 .
- スティーブンスCF (1966).神経生理学入門. ニューヨーク: ジョン・ワイリー・アンド・サンズ. ISBN 9780471824367. LCCN 66015872 . OCLC 1175605 .
- Waxman SG編 (2007). 『分子神経学』 エルゼビア・アカデミック・プレス(マサチューセッツ州バーリントン)ISBN 978-0-12-369509-3. LCCN 2008357317 . OCLC 154760295 .
- Worden FG、Swazey JP、Adelman G編 (1975). 『神経科学、発見の道』 マサチューセッツ州ケンブリッジ: MIT出版. ISBN 978-0-262-23072-8. LCCN 75016379 . OCLC 1500233 .
ウェブページ
- ^ Fitzhugh R, Izhikevich E (2006). 「FitzHugh-Nagumoモデル」 . Scholarpedia . 1 (9): 1349. Bibcode : 2006SchpJ...1.1349I . doi : 10.4249/scholarpedia.1349 .
- ^ 「1963年のノーベル生理学・医学賞」(プレスリリース)。スウェーデン王立科学アカデミー。1963年。2007年7月16日時点のオリジナルよりアーカイブ。 2010年2月21日閲覧。
- ^ 「1991年ノーベル生理学・医学賞」(プレスリリース)スウェーデン王立科学アカデミー。1991年。2010年3月24日時点のオリジナルよりアーカイブ。 2010年2月21日閲覧。
- ^ 「1906年のノーベル生理学・医学賞」(プレスリリース)。スウェーデン王立科学アカデミー。1906年。2008年12月4日時点のオリジナルよりアーカイブ。2010年2月21日閲覧。
- ^ Warlow C (2007年6月). 「マメ科における共生イオンチャネルの最近の進化はイオン伝導性を変化させ、カルシウムシグナル伝達機能を改善した」 . Practical Neurology . 7 (3). BMJ Publishing Group: 192–197 . 2012年3月14日時点のオリジナルよりアーカイブ。 2013年3月23日閲覧。
- ^ 「1997年ノーベル化学賞」(プレスリリース)スウェーデン王立科学アカデミー。1997年。2009年10月23日時点のオリジナルよりアーカイブ。2010年2月21日閲覧。
さらに読む
- Aidley DJ, Stanfield PR (1996). 『イオンチャネル:分子の働き』ケンブリッジ: ケンブリッジ大学出版局. ISBN 978-0-521-49882-1。
- ベア・MF、コナーズ・BW、パラディソ・MA (2001). 『神経科学:脳の探究』 ボルチモア:リッピンコット. ISBN 0-7817-3944-6。
- Clay JR (2005年5月). 「軸索興奮性の再考」 .生物物理学と分子生物学の進歩. 88 (1): 59– 90. doi : 10.1016/j.pbiomolbio.2003.12.004 . PMID 15561301 .
- ドイチュ S、ミケリ・ツァナコウ E (1987)。神経電気システム。ニューヨーク: ニューヨーク大学出版局。ISBN 0-8147-1782-9。
- Hille B (2001).興奮性膜のイオンチャネル(第3版). サンダーランド, マサチューセッツ州: Sinauer Associates. ISBN 978-0-87893-321-1。
- ジョンストン・D、ウー・SM(1995)『細胞神経生理学の基礎』ケンブリッジ、マサチューセッツ州:ブラッドフォードブック、MIT出版。ISBN 0-262-10053-3。
- カンデル ER、シュワルツ JH、ジェッセル TM (2000)。神経科学の原理(第 4 版)。ニューヨーク:マグロウヒル。ISBN 0-8385-7701-6。
- ミラーC (1987). 「イオンチャネルタンパク質の働き」. カツマレクLK、レビタンIB編.ニューロモジュレーション:神経興奮性の生化学的制御. ニューヨーク:オックスフォード大学出版局. pp. 39– 63. ISBN 978-0-19-504097-5。
- ネルソンDL、コックスMM(2008年)『レーニンガー生化学原理』(第5版)ニューヨーク:WHフリーマンISBN 978-0-7167-7108-1。
外部リンク
- ブラックウェル出版の活動電位におけるイオンの流れ
- ブラックウェル出版の有髄軸索と無髄軸索における活動電位の伝播
- 心臓細胞におけるAPの生成と神経細胞におけるAPの生成
- 静止膜電位、WK Purves、D Sadava、GH Orians、HC Heller著『Life: The Science of Biology』第8版、ニューヨーク:WH Freeman、ISBN 978-0-7167-7671-0。
- アリゾナ大学におけるイオン運動と任意のイオン濃度に対するゴールドマン電圧
- 活動電位を示す漫画
- 活動電位の伝播
- 活動電位の発生:電圧および電流クランプシミュレーション
- SourceForge.netで神経細胞と心臓の活動電位をシミュレートするオープンソース ソフトウェア
- 活動電位入門、Neuroscience Online(UTヒューストン医学部による電子神経科学教科書)
- カーンアカデミー:電気緊張と活動電位 2014年7月2日アーカイブウェイバックマシン






