バイオバンク
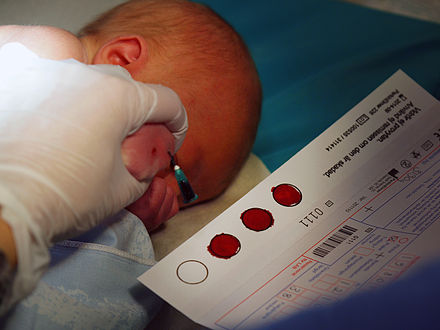
バイオバンクは、研究に使用するための生物学的サンプル(通常はヒト)を保管するバイオリポジトリの一種です。バイオバンクは医学研究において重要なリソースとなり、ゲノミクスや個別化医療といった様々な現代研究を支えています。
バイオバンクは、研究者に多数の人々のデータへのアクセスを提供します。バイオバンクのサンプルとそこから得られたデータは、多くの場合、複数の研究者が目的を異にする研究に利用されます。例えば、多くの疾患は一塩基多型と関連しています。数万から数十万の個人のデータを用いたゲノムワイド関連研究では、これらの遺伝的関連性を潜在的な疾患バイオマーカーとして特定することができます。バイオバンクが登場する以前は、多くの研究者が十分なサンプルの入手に苦労していました。
バイオバンクは、プライバシー、研究倫理、そして医療倫理に関する疑問を提起してきました。適切なバイオバンク倫理とは何かという点については、見解が分かれています。しかしながら、慎重に検討された運営原則と方針を確立せずにバイオバンクを運営することは、バイオバンク・プログラムに参加するコミュニティに悪影響を及ぼす可能性があるという点で、コンセンサスが得られています。
背景
「バイオバンク」という用語は1990年代後半に初めて登場し、近年では幅広い意味を持つ用語として発展してきました。[ 1 ] [ 2 ]一つの定義は「1つ以上の研究目的のために保管されている、ヒトの生物学的材料と関連情報の組織化されたコレクション」です。[ 3 ] [ 4 ] 植物、動物、微生物、その他のヒト以外の材料のコレクションもバイオバンクと呼ばれることがありますが[ 5 ] [ 6 ]、一部の議論ではこの用語はヒト標本のみに使用されています。[ 3 ]
バイオバンクは通常、サンプルを極低温で保管する施設を備えています。 [ 7 ]バイオ バンクの規模は、個別の冷蔵庫から倉庫まで様々で、病院、大学、非営利団体、製薬会社などの機関によって維持されています。[ 7 ]
バイオバンクは、目的または設計によって分類することができます。疾患指向型バイオバンクは通常、病院と提携しており、様々な疾患を代表するサンプルを収集します。これは、疾患に関連するバイオマーカーを探すためかもしれません。 [ 8 ] [ 9 ]集団ベースのバイオバンクは、一般集団における疾患感受性のバイオマーカーを探すためなど、あらゆる人々から多数のサンプルを採取するため、特定の病院との提携を必要としません。[ 10 ]
- バーチャルバイオバンクは疫学的コホートを共通のプールに統合します。[ 11 ]バーチャルバイオバンクは国の規制を満たすサンプル収集を可能にします。[ 12 ]
- 組織バンクは、移植や研究のためにヒト組織を採取・保管する機関です。バイオバンクの確立が進むにつれて、組織バンクとバイオバンクの統合が進むことが期待されています。[ 12 ]
- 人口バンクは、生体材料だけでなく、ライフスタイル、臨床、環境データなどの関連する特性も保存します。[ 12 ]
2008年、米国の研究者はバイオバンクに2億7000万検体を保管し、新規サンプルの収集率は年間2000万件でした。[ 13 ]これらの数字は、そのような数のサンプルが使用できなかった時代と、研究者がそれらを要求し始めた時代の間で、研究の性質が世界中で根本的に変化したことを表しています。[ 13 ]研究者は総じて、単一センターの研究センターから、質的に異なる次世代の研究インフラへと進歩し始めました。[ 14 ]バイオバンクの出現によってもたらされた課題には、その存在に関連する倫理的、法的、社会的問題があり、脆弱な集団から寄付を集める公平性、寄付者へのインフォームドコンセントの提供、参加者へのデータ開示のロジスティクス、知的財産の所有権、参加する寄付者のプライバシーとセキュリティなどが含まれます。[ 13 ]これらの新しい問題のため、研究者と政策立案者は、研究ガバナンスの新しいシステムを必要とし始めました。[ 14
多くの研究者は、創薬と医薬品開発を促進するためのインフラ整備の重要な分野としてバイオバンキングを挙げている。[ 3 ]
種類と用途
ヒト遺伝学研究
1990年代後半までに、科学者たちは、多くの疾患が少なくとも部分的には遺伝的要素によって引き起こされるものの、単一の欠陥遺伝子に起因する疾患は少なく、ほとんどの遺伝性疾患は複数の遺伝子における複数の遺伝因子によって引き起こされることに気づきました。[ 15 ]単一の遺伝子のみを調べる戦略は多くの疾患の遺伝的要素を見つけるのに効果的ではなく、新しい技術によって単一の遺伝子を調べるコストとゲノム全体のスキャンを行うコストがほぼ同じになったため、科学者たちは、遺伝情報を収集する場合でも、はるかに大量の遺伝情報を収集するようになりました。[ 15 ]同時に、技術の進歩によって情報の広範な共有も可能になったため、遺伝学研究を行う多くの科学者は、データが収集されると、ある目的で収集されたゲノム全体のスキャンデータへのアクセスが、実際には他の多くの種類の遺伝学研究にも役立つことに気づきました。[ 15 ]以前はデータは通常1つの研究室に保管されていましたが、現在では科学者はコミュニティでの使用と共有のために、大量の遺伝データを1か所に保存し始めています。[ 15 ]
ゲノムワイドなスキャンを実施し、データを共有することによる直接的な結果として、多くの一塩基多型が発見され、初期の成功としては、単一遺伝子スキャンとバイオバンク以前に特定された約 10,000 件から、ゲノムワイドなスキャン実施が数年にわたって実施された後の 2007 年までに 500,000 件までの改善が挙げられます。[ 15 ]問題が 1 つ残りました。この変化する実施方法によって遺伝子型データの収集が可能になりましたが、関連する表現型データを収集するためのシステムが同時に用意されていませんでした。[ 15 ]遺伝子型データは血液サンプルなどの生物学的標本から取得されますが、表現型データは、面接、身体評価、病歴の確認、またはその他の手配が難しいプロセスで標本提供者を調査することによって取得する必要があります。[ 15 ]このデータが利用可能であったとしても、それを遺伝子型データに接続することによって患者の権利をどの程度、どのように保護できるかについては倫理的な不確実性がありました。[ 15 ]バイオバンクの制度は、遺伝子型データを保存し、それを表現型データと関連付け、それを必要とする研究者が広く利用できるようにするために開発され始めました。[ 15 ]
遺伝子検査サンプルを含むバイオバンクは、歴史的にヨーロッパ系の人々のサンプルが大部分を占めてきました。[ 16 ]バイオバンクサンプルの多様化が必要であり、研究者は過小評価されている集団に影響を与える要因を考慮する必要があります。[ 17 ] [ 18 ]
保全、生態系の回復、地球工学
![[アイコン]](http://upload.wikimedia.org/wikipedia/commons/thumb/1/1c/Wiki_letter_w_cropped.svg/20px-Wiki_letter_w_cropped.svg.png) | このセクションは拡張が必要です。不足している情報を追加していただければ幸いです。 (2020年12月) |
2020年11月、科学者たちはグレートバリアリーフの絶滅危惧サンゴの生きた断片、組織、DNAサンプルの収集を開始した。これは、将来の修復・再生活動のための予防的バイオバンクとなる。[ 19 ]数か月前には、別のオーストラリアの研究チームが、そのようなサンゴをより耐熱性のあるものに進化させたと報告している。[ 20 ]
生物標本
バイオバンクに保管され、研究者に提供される検体は、サンプリングによって採取されます。検体の種類には、血液、尿、皮膚細胞、臓器組織、その他の材料が含まれます。組織検体の採取方法はますます標的を絞ったものになりつつあり、 MRIを用いて組織のどの部分を採取すべきかを特定する場合もあります。[ 21 ] [ 22 ]バイオバンクは、研究者が検査、実験、または分析を行うためにこれらの検体を必要とするまで、これらの検体を良好な状態で保管します。
ストレージ
バイオバンクは、他のDNAデータベースと同様に、サンプルとドナー情報へのアクセスを慎重に保管し、文書化する必要があります。[ 23 ]サンプルは、経時的な劣化を最小限に抑えて確実に維持する必要があり、偶発的および意図的な物理的損傷から保護する必要があります。システムに入出力される各サンプルの登録は、通常、頻繁にバックアップできるコンピューターベースのシステムに集中的に保管されます。[ 23 ]各サンプルの物理的な場所は、標本の迅速な所在確認を可能にするために記録されます。アーカイブシステムでは、サンプルの個人を特定できないようにすることで、ドナーのプライバシーを尊重し、研究者が分析を詳細に知ることができるようにする。[ 23 ]臨床データを含むデータベースは、臨床情報と組織サンプルをリンクする安全な方法で個別に保管されます。[ 23 ]サンプルの室温での保管が使用される場合もありますが、これは、コストや冷凍庫の故障の可能性など、低温保管の欠点として認識されていたことを受けて開発されたものです。[ 23 ] 現在のシステムは小型で、-80℃(-112℉)の冷凍庫に必要なスペースの約10分の1に約4万個のサンプルを保管することができます。複製サンプルや分割サンプルは、セキュリティ上の理由から別の場所に保管されることがよくあります。[ 23 ]
所有
遺伝物質の大規模データベースをめぐる論争の一つは、サンプルの所有権の問題である。2007年時点で、アイスランドには物理的なサンプルとそれに含まれる情報の所有権に関する3つの異なる法律があった。[ 24 ]アイスランドの法律では、物理的なサンプル自体の保管権はアイスランド政府にあり、所有権は提供者が保持するとされている。[ 24 ]一方、トンガとエストニアはバイオバンクのサンプルの所有権を政府に与えているものの、提供者の権利を強く保護する法律が含まれている。[ 24 ]
倫理
バイオバンキングにおいて重要な出来事は、研究者が研究のためにヒト検体を収集しようとする時です。この場合、研究参加者のプライバシー権、検体とその派生データの所有権、研究結果の返却における提供者の権利範囲、そして提供者が研究への参加にどの程度同意できるかといった問題が生じます。[ 25 ]
同意に関して、主な問題は、バイオバンクが通常、複数の将来の研究目的のためにサンプルとデータを収集しており、将来の可能性のあるすべての研究について特定の同意を得ることは現実的ではないということです。一回限りの同意や、様々な研究目的のための広範な同意では、倫理的および法的要件を満たせない可能性があるという議論があります。[ 26 ] [ 27 ]動的同意は、研究者とサンプル/データ提供者との間の継続的な関与とコミュニケーションを可能にするため、バイオバンキングに適した同意のアプローチである可能性があります。
ガバナンス
バイオバンクを対象とした、国際的に認められたガバナンスガイドラインは存在しません。バイオバンクは通常、ヒトを対象とする研究に関して国際的に認められているより広範な推奨事項に適応しようと努め、ガイドラインが更新されるにつれて変更します。多くの種類の研究、特に医学研究では、機関審査委員会による監督が地域レベルで行われます。機関審査委員会は通常、自国の政府が定めた基準を執行します。各国で採用されている法律は、程度の差はあれ、国際的に提案されているバイオバンクのガバナンス推奨事項をモデルにしていることがよくあります。
主要組織
バイオバンキングに関する文書化されたガイドラインの作成に参加した組織の例としては、以下のものがある。[ 2 ]世界医師会、国際医学機関評議会、欧州評議会、ヒトゲノム機構、世界保健機関、ユネスコ。国際生物環境リポジトリ学会(ISBER)は、ネットワーキング、教育、イノベーションの機会を創出し、生物環境リポジトリにおける進化する課題へのアプローチを調和させる、世界的なバイオバンキング組織である。ISBERはベストプラクティスを通じて世界中のリポジトリを結びつける。ISBERベストプラクティス第4版は2018年1月31日に発表され、2019年5月初旬にLN2補遺が発表された。[ 28 ]
歴史
1998年、アイスランド議会は保健分野データベース法を可決した。この法律により、同国に国立バイオバンクを設立することが可能となった。1999年、米国国立生命倫理諮問委員会は、ヒト生物学的標本の取り扱いに関する政策提言を含む報告書を発表した。[ 13 ] 2005年、米国国立がん研究所は、バイオサンプルコレクションを保有するパートナー組織向けに共通データベースと標準操作手順を確立する部門を設けるため、バイオリポジトリおよびバイオサンプル研究局を設立した。 [ 13 ] 2006年、欧州連合理事会は、バイオバンク特有の問題を議論する上で斬新なヒト生物学的標本に関する政策を採択した。[ 13 ]
経済
研究者たちは、バイオバンク、特に国家が支援するバイオバンクの経済的側面について、より批判的な検証を求めている。[ 29 ]国立バイオバンクは、多くの場合、官民パートナーシップによって資金提供を受けており、資金は国立研究評議会、医療慈善団体、製薬会社の投資、バイオテクノロジーベンチャーキャピタルなどから提供されている。[ 30 ]このように、国立バイオバンクは、国家、国民、そして商業団体の間で仲介された経済関係を可能にしている。組織材料の体系的な収集には、強い商業的インセンティブが根底にあることが示されている。これは特に、集団規模の研究が基礎的な病因研究よりも診断技術に向いているゲノム研究の分野で顕著である。[ 31 ]研究者のロバート・ミッチェルとキャサリン・ウォルドビー[ 29 ]は、大きな利益が見込めることを考慮して、バイオバンクは国民の大部分を生産的な参加者として登録し、彼らの身体と将来の病歴から商業的可能性のある資源を作り出すため、彼らの貢献は「臨床労働」の一形態とみなされるべきであり、したがって参加者も経済的利益を得るべきだと主張している。
訴訟
保管されている人体標本の所有権をめぐって争い、裁判に持ち込まれた事例があります。例としては、以下のようなものがあります。
参照
参考文献
- ^ Hewitt R, Watson P (2013年10月). 「バイオバンクの定義」.バイオプリザベーション・アンド・バイオバンキング. 11 (5): 309–15 . doi : 10.1089/bio.2013.0042 . PMID 24835262 .
- ^ a b Cambon-Thomsen A, Rial-Sebbag E, Knoppers BM (2007年8月). 「ヒトバイオバンクの利用に関する倫理的・法的枠組みの動向」 .欧州呼吸器学会誌. 30 ( 2): 373–82 . doi : 10.1183/09031936.00165006 . PMID 17666560. S2CID 15217640 .
- ^ a b c Hewitt RE (2011年1月). 「バイオバンキング:個別化医療の基盤」Current Opinion in Oncology . 23 (1): 112–9 . doi : 10.1097/CCO.0b013e32834161b8 . PMID 21076300 . S2CID 205547716 .
- ^ Kauffmann F, Cambon-Thomsen A (2008年5月). 「生物学的コレクションの追跡:書籍と臨床試験の間」. JAMA . 299 (19): 2316–8 . doi : 10.1001/jama.299.19.2316 . PMID 18492973 .
- ^ ISO 20387:「バイオテクノロジー - バイオバンキング - バイオバンキングに関する一般要求事項」(2018)
- ^ ISO/TR 22758:「バイオテクノロジー - バイオバンキング - ISO 20387の実装ガイド」(2020)
- ^ a bシルバーマンS (2010年6月). 「The Flesh Files」. Wired . 第18巻第6号. pp. 157–161 , 182, 184, 188, 190.
- ^ Bevilacqua G, Bosman F, Dassesse T, Höfler H, Janin A, Langer R, 他 (2010年4月). 「組織バンキングにおける病理学者の役割:欧州コンセンサス専門家グループ報告書」 . Virchows Archiv . 456 (4): 449– 54. doi : 10.1007/s00428-010-0887-7 . PMC 2852521. PMID 20157825 .
- ^ Paskal W, Paskal AM, Dębski T, Gryziak M, Jaworowski J (2018年10月). 「現代のバイオバンク活動の側面 - 包括的レビュー」 .病理学と腫瘍学研究. 24 (4): 771– 785. doi : 10.1007/s12253-018-0418-4 . PMC 6132819. PMID 2972 8978 .
- ^ Riegman PH, Morente MM, Betsou F, de Blasio P, Geary P, 他 (Marble Arch International Working Group on Biomedical Research) (2008年10月). 「より良い医療のためのバイオバンキング」 . Molecular Oncology . 2 (3): 213–22 . doi : 10.1016/j.molonc.2008.07.004 . PMC 5527804. PMID 19383342 .
- ^ Gottweis H、Petersen AR (2008 年 6 月 20 日)。バイオバンク: 比較の観点から見たガバナンス。テイラーとフランシス。 p. 92.ISBN 978-0-415-42737-1. 2012年2月1日閲覧。
- ^ a b c Labant MA (2012年1月15日). 「バイオバンクの多様性が医薬品および診断薬開発を促進する」 . Genetic Engineering & Biotechnology News . 32 (2): 42,44. doi : 10.1089/gen.32.2.21 . ISSN 1935-472X . 2012年2月1日閲覧。
- ^ a b c d e f Haga S, Beskow L (2008). 「遺伝学研究におけるバイオバンクの倫理的、法的、社会的影響」.複雑形質の遺伝学的解析. 遺伝学の進歩. 第60巻. pp. 505– 544. doi : 10.1016/S0065-2660(07)00418-X . ISBN 978-0-12-373883-7. PMID 18358331 .
- ^ a b Fullerton SM, Anderson NR, Guzauskas G, Freeman D, Fryer-Edwards K (2010年1月). 「次世代バイオレポジトリ研究におけるガバナンス課題への対応」 . Science Translational Medicine . 2 (15): 15cm3. doi : 10.1126/scitranslmed.3000361 . PMC 3038212. PMID 20371468 .
- ^ a b c d e f g h i Greely HT (2007). 「大規模ゲノムバイオバンクの不安定な倫理的・法的基盤」 . Annual Review of Genomics and Human Genetics . 8 : 343–64 . doi : 10.1146/annurev.genom.7.080505.115721 . PMID 17550341 .
- ^ Fisher ER, Pratt R, Esch R, Kocher M, Wilson K, Lee W, Zierhut HA (2020年2月). 「米国における遺伝学研究および精密医療研究への参加と見解における人種と民族の役割:定性的および定量的研究の系統的レビュー」 . Molecular Genetics & Genomic Medicine . 8 (2) e1099. doi : 10.1002/mgg3.1099 . PMC 7005620. PMID 31867882 .
- ^ Ewing AT, Turner AD, Sakyi KS, Elmi A, Towson M, Slade JL, 他 (2020年9月). 「声を増幅させる:高齢で多様なコホートにおけるがんバイオバンキング研究のアドバイス、ガイダンス、そして認識された価値」 . Journal of Cancer Education . 37 (3): 683– 693. doi : 10.1007/ s13187-020-01869-0 . PMC 10286728. PMID 32975747. S2CID 221917485 .
- ^ Ewing AT, Kalu N, Cain G, Erby LH, Ricks-Santi LJ, Tetteyfio-Kidd Telemaque E, Scott DM (2019年10月). 「アフリカ系アメリカ人癌サバイバーにおける遺伝学研究のための生体試料提供意欲に関連する要因」 . Journal of Community Genetics . 10 (4): 471– 480. doi : 10.1007/ s12687-019-00411-0 . PMC 6754482. PMID 30877487 .
- ^ Lu D. 「バイオバンクに800種のサンゴを収容、将来的にサンゴ礁を復元可能に」ニューサイエンティスト誌。 2020年12月9日閲覧。
- ^ 「科学者ら、白化現象に対抗する『耐熱性』サンゴの開発に成功」 phys.org 2020年12月29日閲覧。
- ^ Heavey S, Haider A, Sridhar A, Pye H, Shaw G, Freeman A, Whitaker H (2019年10月). 「磁気共鳴画像法と生検データを用いた前立腺がんバイオバンキングにおけるサンプリング手順のガイド」 . Journal of Visualized Experiments (152). doi : 10.3791/60216 . PMID 31657791 .
- ^ Heavey S, Costa H, Pye H, Burt EC, Jenkinson S, Lewis GR, et al. (2019年5月). 「PEOPLE: PatiEnt prostate samples for rEsearch:磁気共鳴画像データを用いて、新鮮な前立腺摘出術標本中の腫瘍組織と良性組織を標的とする組織収集経路」 . The Prostate . 79 (7): 768– 777. doi : 10.1002/pros.23782 . PMC 6618051. PMID 30807665 .
- ^ a b c d e f Macleod AK, Liewald DC, McGilchrist MM, Morris AD, Kerr SM, Porteous DJ (2009年2月). 「遺伝子バイオバンキング研究の原則と実践」 .欧州呼吸器学会誌. 33 ( 2): 419–25 . doi : 10.1183/09031936.00043508 . PMID 19181915. S2CID 6669308 .
- ^ a b c Nwabueze RN (2007-09-30).バイオテクノロジーと財産権の課題:死体における財産権. アルダーショット、イギリス: アッシュゲート・プレス. pp. 169–170 . ISBN 978-0-7546-7168-8。
- ^ホーキンス AK、オドハティ KC (2011 年 10 月)。」「あなたのうんちの持ち主は誰?」:ヒトマイクロバイオーム研究とバイオバンキングおよび関連研究のELSI側面との接点に関する考察。BMCメディカルゲノミクス。4 : 72。doi : 10.1186 /1755-8794-4-72。PMC 3199231。PMID 21982589。
- ^ Hoeyer K (2012). 「冷血取引か?」『バイオバンキングへの信頼』pp. 21– 41.
- ^ Ewing AT, Erby LA, Bollinger J, Tetteyfio E, Ricks-Santi LJ, Kaufman D (2015年4月). 「バイオバンク研究における広範同意と狭義同意の提供意思に関する人口統計学的差異」 . Biopreservation and Biobanking . 13 (2): 98– 106. doi : 10.1089/bio.2014.0032 . PMC 4574731. PMID 25825819 .
- ^ 「ISBERリポジトリのベストプラクティス - ISBER」www.isber.org . 2020年2月11日閲覧。
- ^ a b Mitchell R, Waldby C (2010年5月). 「国立バイオバンク:臨床労働、リスク生産、そしてバイオバリューの創造」 .科学技術と人間の価値. 35 ( 3): 330– 355. doi : 10.1177/0162243909340267 . PMC 2879701. PMID 20526462 .
- ^ Lewis G (2004). 「組織収集と製薬業界:企業バイオバンクの調査」. Tutton R, Corrigan O (編).遺伝子データベース:DNAの収集と利用における社会倫理的問題. ロンドンおよびニューヨーク: Routledge. pp. 181– 201.
- ^ Rajan KS (2006). 『バイオキャピタル:ポストゲノム生命の構成』デューク大学出版局.
さらに読む
- Kaye J, Stranger M (2009). 『バイオバンク・ガバナンスの原則と実践』 Ashgate Publishing, Ltd. ISBN 978-0-7546-7825-0。。
- ソルバック JH (2009)。研究バイオバンキングの倫理。スプリンガー。ISBN 978-0-387-93871-4。。
- 欧州委員会共同研究センター将来技術研究所(2010年)「欧州のバイオバンク:調和とネットワーク化の展望」年次報告書/Tuar、出版局、doi : 10.2791 /41701、ISBN 978-92-79-15783-7、ISSN 1018-5593
{{citation}}: CS1 maint: ISBNによる作業パラメータ(リンク) - バイオバンキング・フォー・メディシン:テクノロジーと市場 2012-2022、Visiongain、2011年12月13日、2016年3月20日時点のオリジナルよりアーカイブ、2012年2月2日閲覧
- 中国バイオバンク:情報とリソースの共有、中国国立遺伝子銀行(深圳)、2011年1月31日
- ISO 20387:2018「バイオテクノロジー - バイオバンキング - バイオバンキングの一般要求事項」。
- ISO/TR 22758:2020「バイオテクノロジー - バイオバンキング - ISO 20387 実装ガイド」。
- ISO 21899:2020「バイオテクノロジー - バイオバンキング - バイオバンク内の生物学的材料の処理方法の検証および検証に関する一般要求事項」
外部リンク
- Specimen Centralバイオリポジトリリスト、世界中で活動中のバイオバンクとバイオリポジトリのリスト
- 摘出された臓器が医療に革命を起こす- 2007年PBS / Wired Scienceレポート
- Genetic Allianceが作成した8分間のバイオバンクビデオ
- 国際生物環境保存協会(ISBER) 2018年5月10日アーカイブ- Wayback Machine
