光学顕微鏡

光学顕微鏡は、光学顕微鏡とも呼ばれ、一般的に可視光とレンズシステムを使用して小さな物体の拡大画像を生成する顕微鏡の一種です。光学顕微鏡は顕微鏡の中で最も古い設計であり、現在の複合形態は17世紀に発明されたと考えられています。基本的な光学顕微鏡は非常にシンプルなものもありますが、多くの複雑な設計は解像度と試料のコントラストを向上させることを目的としています
対象物はステージ上に置かれ、顕微鏡の1つまたは2つの接眼レンズを通して直接観察されます。高倍率顕微鏡では通常、両方の接眼レンズに同じ像が映りますが、実体顕微鏡では、わずかに異なる像を用いることで3D効果を生み出します。画像(顕微鏡写真)の撮影には、通常カメラが使用されます。
サンプルは様々な方法で照明できます。透明体は下から照明し、固体は対物レンズを通過する光(明視野)または対物レンズの周囲から光(暗視野)を照射します。偏光は金属物体の結晶方位を決定するために使用できます。位相差イメージングは、屈折率の異なる微細な部分を強調することで、画像コントラストを高めるために使用できます。
通常、倍率の異なる複数の対物レンズがターレットに取り付けられており、回転させて所定の位置に配置することでズームインが可能です。光学顕微鏡の最大倍率は、可視光の分解能の限界により、通常1000倍程度に制限されています。これよりも高い倍率も可能ですが、対象物の詳細な部分は解像されません。
可視光を使用しない光学顕微鏡の代替手段としては、走査型電子顕微鏡、透過型電子顕微鏡、走査型プローブ顕微鏡などがあり、その結果、はるかに高い倍率を実現できます。
種類

光学顕微鏡には、単眼顕微鏡と複合顕微鏡の2つの基本的な種類があります。単眼顕微鏡は、単レンズまたはレンズ群の光学的なパワーを利用して拡大します。複合顕微鏡は、複数のレンズ群(一方のレンズ群がもう一方のレンズ群で生成された像を拡大する)を用いて、対象物をより高倍率で観察します。現代の研究用顕微鏡の大部分は複合顕微鏡ですが、一部の安価な市販デジタル顕微鏡は単眼顕微鏡です。複合顕微鏡はさらに様々な種類の顕微鏡に分類され、光学構成、価格、用途が異なります。
簡易顕微鏡
簡易顕微鏡は、レンズまたはレンズ群を用いて、角度倍率のみで物体を拡大し、観察者に正立した拡大された虚像を与えます。[ 1 ] [ 2 ]単一の凸レンズまたはレンズ群は、虫眼鏡、ルーペ、望遠鏡や顕微鏡の 接眼レンズなどの簡易な拡大装置に使用されています
複合顕微鏡

複合顕微鏡は、観察対象物に近いレンズ(対物レンズと呼ばれる)を使用して光を集め、顕微鏡内で対象物の実像を結像させます。その像は、2つ目のレンズまたはレンズ群(接眼レンズと呼ばれる)によって拡大され、観察者に対象物の拡大された倒立虚像を与えます。[ 3 ]
複合対物レンズと接眼レンズの組み合わせを使用することで、はるかに高い角倍率が可能になります。高さ の物体の場合、焦点が合った状態では、最大で の拡大されていない角度サイズを占めることができます。これは、目の近点距離(約11 cm)に物体を置いたときに達成されます。複合顕微鏡によって形成される虚像は の角度サイズを実現します 。ここで は、隣接する対物レンズと接眼レンズの焦点間の距離です。これは の角倍率です。
一般的な複合顕微鏡は、多くの場合、交換可能な対物レンズを備えており、ユーザーは倍率を素早く調整することができます。[ 3 ]複合顕微鏡では、位相差などのより高度な照明設定も可能になります。
その他の顕微鏡のバリエーション
複合光学顕微鏡の設計には、特殊な目的のために多くのバリエーションがあります。これらのいくつかは、特定の目的への特化を可能にする物理的な設計の違いです
- 実体顕微鏡は、サンプルの立体的な画像を提供する低倍率の顕微鏡で、解剖によく使用されます。
- 比較顕微鏡には 2 つの独立した光路があり、各目で 1 つの画像を介して 2 つのサンプルを直接比較できます。
- 倒立顕微鏡。下からサンプルを研究するためのもので、液体中の細胞培養や金属組織学に役立ちます。
- 光ファイバコネクタ検査顕微鏡。コネクタ端面検査用に設計されています。
- 高解像度のサンプルを研究するための移動型顕微鏡。
その他の顕微鏡のバリエーションは、異なる照明技術に合わせて設計されています。
- 岩石顕微鏡。その設計には通常、偏光フィルター、回転ステージ、石膏板が含まれており、方向によって光学特性が変化する鉱物やその他の結晶性物質の研究に役立ちます。
- 偏光顕微鏡。岩石顕微鏡に似ています。
- 位相差照明法を応用した位相差顕微鏡。
- 落射蛍光顕微鏡。蛍光体を含むサンプルの分析用に設計されています。
- 共焦点顕微鏡は、走査レーザーを使用してサンプルを照射し蛍光を観察する落射蛍光照明の広く使用されている変種です。
- 2 光子顕微鏡は、散乱媒体のより深部の蛍光を画像化し、特に生体サンプルにおける光退色を低減するために使用されます。
- 学生用顕微鏡 - 学校での使用や子供向けの入門用機器として設計された、簡略化された操作部と低品質の光学系を備えた低倍率の顕微鏡です。[ 4 ]
- 超顕微鏡は、光の散乱を利用して、可視光の波長(約500ナノメートル)以下またはそれに近い直径の微粒子を観察できるように改造された光学顕微鏡です。電子顕微鏡の出現以来、ほとんど使われていません。
- チップ増強ラマン顕微鏡は、従来の波長ベースの解像度の制限のない、チップ増強ラマン分光法に基づく光学顕微鏡の変種です。 [ 5 ] [ 6 ]この顕微鏡は主に、すべての光学ツールを使用して走査プローブ顕微鏡プラットフォーム上で実現されます。
デジタル顕微鏡

デジタル顕微鏡とは、デジタルカメラを搭載した顕微鏡で、コンピュータを介してサンプルを観察できるものです。顕微鏡は、様々なレベルの自動化により、部分的または完全にコンピュータ制御される場合もあります。デジタル顕微鏡は、顕微鏡画像のより高度な分析、例えば距離や面積の測定、蛍光染色や組織学的染色の定量化などを可能にします。
低出力のデジタル顕微鏡、USB顕微鏡も市販されています。これらは基本的に高出力マクロレンズを搭載したウェブカメラで、一般的に透過照明は使用しません。カメラをコンピューターのUSBポートに直接接続し、画像をモニターに直接表示します。接眼レンズを必要とせず、非常に低価格で、中程度の倍率(最大約200倍)を実現しています。高出力照明は通常、カメラレンズに隣接する LED光源によって提供されます。
敏感な生物試料への損傷を避けるために、非常に低い光量でデジタル顕微鏡観察を行うには、高感度の光子計数型デジタルカメラを用いる必要がある。エンタングルした光子対を提供する光源を用いることで、最も光に敏感な試料への損傷リスクを最小限に抑えられることが実証されている。ゴーストイメージングを光子スパース顕微鏡に応用したこの手法では、試料に赤外線光子を照射する。各光子は可視帯域のエンタングルした光子と空間的に相関しており、光子計数型カメラによる効率的な画像化が可能となる。[ 7 ]
歴史
発明
最も初期の顕微鏡は、倍率が限られた単レンズの拡大鏡であり、少なくとも13世紀に眼鏡のレンズが広く使用されていた頃にまで遡ります。 [ 8 ]
複合顕微鏡は1620年頃にヨーロッパで初めて登場しました[ 9 ] [ 10 ]。その中には、コルネリス・ドレベルがロンドンで実演したもの(1621年頃)や、ローマで展示されたものなどがあります[ 11 ] [ 10 ]。
複合顕微鏡の実際の発明者は不明であるが、長年にわたって多くの主張がなされてきた。その中には、オランダの眼鏡職人ヨハネス・ザカリアッセンが、彼の父であるザカリアス・ヤンセンが1590年には既に複合顕微鏡および/または望遠鏡を発明していたという、発表から35年後[ 12 ]の主張が含まれる。ヨハネスの証言は疑わしいと主張する者もいるが[ 13 ] [ 14 ] [ 15 ]、発明の日付がザカリアスが当時子供だった頃まで遡ることになり、ヨハネスの主張が真実であるためには、複合顕微鏡はヨハネスの祖父であるハンス・マルテンスによって発明されたはずだという推測につながる。[ 14 ]別の主張では、ヤンセンの競争相手であるハンス・リッペルスハイ(1608年に最初の望遠鏡の特許を申請)も複合顕微鏡を発明したという。[ 16 ]他の歴史家は、1621年に複合顕微鏡を発明したオランダの発明家コルネリス・ドレベルを指摘している。[ 11 ] [ 10 ]
ガリレオ・ガリレイは複合顕微鏡の発明者としてしばしば挙げられる。1610年以降、彼は望遠鏡の焦点を近づけてハエなどの小さな物体を間近で見ることができることを発見した[ 17 ]また、逆側から覗いて小さな物体を拡大することもできる。[ 18 ]唯一の欠点は、近くの物体を観察するには、彼の2フィートの望遠鏡を6フィートまで延長しなければならなかったことである。[ 19 ]ドレベルが製作した複合顕微鏡が1624年にローマで展示されたのを見た後、ガリレオは独自の改良型を製作した。[ 11 ] [ 10 ] 1625年、ジョヴァンニ・ファーベルは、ガリレオが1624年にアカデミア・デイ・リンチェイに提出した複合顕微鏡に顕微鏡という名称をつけた[ 20 ](ガリレオはそれを「オッキオリーノ」または「小さな目」と呼んでいた)。ファーバーはギリシャ語の「小さい」を意味するμικρόν(ミクロン)と「見る」を意味するσκοπεῖν (スコペイン)からこの名前を作った。これはリンシア人が作った別の言葉「望遠鏡」に類似した名前である。[ 21 ]
同じくオランダ人のクリスティアーン・ホイヘンスは、17世紀後半に色消しされたシンプルな2レンズ接眼レンズシステムを開発し、顕微鏡開発における大きな進歩となりました。ホイヘンスの接眼レンズは現在も生産されていますが、視野が狭いなどの小さな欠点があります。
普及

アントニー・ファン・レーウェンフック(1632-1724)は、16世紀にすでに簡単な拡大レンズが作られていたにもかかわらず、生物学者たちの注目を集めた人物として知られています。ファン・レーウェンフックの自家製顕微鏡は、非常に小さいながらも強力なレンズが1つ付いた簡単な顕微鏡でした。使いにくいものでしたが、レーウェンフックは詳細な画像を観察することができました。複数のレンズを構成することが困難だったため、複合顕微鏡がファン・レーウェンフックの簡単な顕微鏡と同じ品質の画像を提供できるようになるまでには、約150年の光学開発が必要でした。1850年代には、チューレーン大学の化学教授ジョン・レナード・リデルが、アメリカで最も初期かつ最も広範囲なコレラの顕微鏡調査の一つを行っている最中に、最初の実用的な双眼顕微鏡を発明しました。[ 23 ] [ 24 ]
照明技術
顕微鏡の基本的な技術と光学系は400年以上前から存在していましたが、今日見られるような高品質の画像を生成するための試料照明技術が開発されたのはごく最近のことです
1893年8月、アウグスト・ケーラーはケーラー照明法を開発しました。この試料照明法は、極めて均一な照明を実現し、従来の試料照明法の多くの限界を克服しました。ケーラー照明が開発される以前は、例えば電球のフィラメントなどの光源の像が試料像に常に写っていました。
1953年、オランダの物理学者フリッツ・ツェルニケは、透明試料の画像化を可能にする位相差照明の開発により、ノーベル物理学賞を受賞しました。光の吸収ではなく干渉を利用することで、生きた哺乳類細胞などの極めて透明な試料を、染色技術を用いることなく画像化することが可能になりました。そのわずか2年後の1955年、ジョルジュ・ノマルスキーは、干渉に基づくもう一つの画像化技術である微分干渉コントラスト顕微鏡の理論を発表しました。
蛍光顕微鏡
現代の生物顕微鏡法は、細胞内の特定の構造を蛍光プローブで検出する技術の開発に大きく依存しています。通常の透過光顕微鏡法とは異なり、蛍光顕微鏡法では、対物レンズを通して限られた波長の光が試料に照射されます。この光は試料中の蛍光体と相互作用し、より長波長の光を発します。この発光によって画像が構成されます。
20世紀半ば以降、DNAに結合するDAPIなどの化学蛍光染色剤は、細胞内の特定の構造を標識するために使用されてきました。近年の開発としては、蛍光標識抗体を用いてサンプル中の特定のタンパク質を認識する免疫蛍光法や、生細胞が蛍光を発するGFPなどの蛍光タンパク質が挙げられます。
構成要素

透過光で試料を観察するように設計された現代の光学顕微鏡はすべて、光路の基本構成要素を共有しています。さらに、ほとんどの顕微鏡は同じ「構造」構成要素を備えています[ 25 ](右図に基づいて以下に番号が付けられています)。
- 接眼レンズ(1)
- 対物レンズターレット、リボルバー、または回転ノーズピース(複数の対物レンズを保持するため)(2)
- 対物レンズ(3)
- フォーカスノブ(ステージを動かすため)
- 粗調整(4)
- 微調整(5)
- ステージ(試料を載せる)(6)
- 光源(光または鏡)(7)
- ダイヤフラムとコンデンサー(8)
- メカニカルステージ(9)
接眼レンズ
接眼レンズは、2枚以上のレンズが入った円筒状のもので、その機能は像を目に焦点を合わせることです。接眼レンズは鏡筒の上端に挿入されます。接眼レンズは交換可能で、倍率の異なる様々な接眼レンズを取り付けることができます。接眼レンズの一般的な倍率は、5倍、10倍(最も一般的)、15倍、20倍です。一部の高性能顕微鏡では、対物レンズと接眼レンズの光学構成が、可能な限り最高の光学性能が得られるように調整されています。これは、アポクロマート対物レンズ で最も一般的に行われます
対物砲塔(リボルバーまたは回転ノーズピース)
対物ターレット、リボルバー、または回転式ノーズピースは、対物レンズセットを保持する部品です。これにより、ユーザーは対物レンズを切り替えることができます。
対物レンズ
一般的な複合光学顕微鏡の下端には、サンプルからの光を集める 1 つ以上の対物レンズがあります。対物レンズは通常、ガラス製の単一要素または複数要素の複合レンズを収めた円筒形のハウジングに収められています。通常、約 3 個の対物レンズが円形のノーズピースにねじ込まれており、これを回転させて必要な対物レンズを選択できます。これらの配置は共焦点になるように設計されており、顕微鏡で 1 つのレンズから別のレンズに変更しても、サンプルの焦点が合ったままになります。顕微鏡の対物レンズは、倍率と開口数という 2 つのパラメータによって特徴付けられます。前者は通常 5 倍から 100 倍の範囲であり、後者は 0.14 から 0.7 の範囲で、それぞれ約 40 mm から 2 mm の焦点距離に相当します。通常、倍率の高い対物レンズほど開口数が高く、結果として得られる画像の被写界深度は浅くなります。一部の高性能対物レンズでは、最高の光学性能を得るために、対応する接眼レンズが必要になる場合があります。
油浸対物レンズ

一部の顕微鏡では、高倍率でより高い解像度を得るために、油浸対物レンズまたは水浸対物レンズを使用しています。これらは、対物レンズとサンプルの間に、浸漬油や水などの屈折率整合材と、整合したカバーガラスを挟んで使用されます。屈折率整合材の屈折率は空気よりも高いため、対物レンズの開口数を大きく(1より大きく)することができ、光は最小限の屈折で標本から対物レンズの外面に透過します。開口数は最大1.6まで達成可能です。[ 26 ]開口数が大きいほど、より多くの光を集めることができ、より小さな細部の詳細な観察が可能になります。油浸レンズの倍率は通常40~100倍です。
フォーカスノブ
調整ノブはステージを上下に動かし、粗動と微動のフォーカスを別々に調整できます。同じ操作で、顕微鏡をさまざまな厚さの標本に合わせて調整できます。古い設計の顕微鏡では、フォーカス調整ホイールがスタンドに対して顕微鏡の鏡筒を上下に動かし、ステージは固定されていました
フレーム
光学アセンブリ全体は、従来、剛性の高いアームに取り付けられており、さらにそのアームは頑丈なU字型の脚に取り付けられ、必要な剛性を確保しています。アームの角度は調整可能で、視野角を調整できます
フレームには、顕微鏡の様々な操作部を取り付けるための取り付け部があります。通常、これには焦点合わせ用の操作部が含まれており、粗調整用の大きなローレットホイールと微調整用の小さなローレットホイールが組み合わされています。その他の機能としては、ランプの調整部やコンデンサーの調整部などがあります。
ステージ
ステージは対物レンズの下にある台で、観察する標本を支えます。ステージの中央には、標本を照らす光が通る穴があります。ステージには通常、スライド(標本を載せる、典型的な寸法が25×75 mmの長方形のガラス板)を 保持するためのアームが付いています
100倍を超える倍率では、スライドを手で動かすのは現実的ではありません。中価格帯以上の顕微鏡に搭載されているメカニカルステージでは、ノブを操作してスライドを微調整し、サンプル/スライドを希望の位置に移動させることができます。顕微鏡に元々メカニカルステージが搭載されていない場合は、追加で搭載することも可能です。
すべてのステージは上下に動き、焦点を合わせます。機械式ステージでは、スライドが2つの水平軸に沿って移動し、標本を位置決めして細部を観察できます。
ユーザーが試料をステージの中央に配置するため、まず低倍率からピント合わせを開始します。高倍率に移行するには、高倍率で再度ピントを合わせるためにステージを垂直方向に高く移動させる必要があり、場合によっては試料の水平位置をわずかに調整する必要もあります。この水平方向の試料位置調整こそが、メカニカルステージの目的です。
標本を準備してスライドに載せるのは難しいため、子供の場合は、使用する焦点レベルに関係なく、中央に配置され、簡単に焦点を合わせることができる準備済みのスライドから始めるのが最適です。
光源
様々な光源を使用できます。最も単純な方法は、鏡を通して日光を照射する方法です。しかし、ほとんどの顕微鏡には、調整・制御可能な独自の光源が備わっています。多くの場合、ハロゲンランプが使用されていますが、 LEDやレーザーを使用した照明も一般的になりつつあります。高価な機器では、 ケーラー照明が備えられていることがよくあります
コンデンサー
コンデンサーは、照明光源からの光を試料に集光するために設計されたレンズです。コンデンサーには、照明の品質と強度を調整するために、絞りやフィルターなどの他の機能も含まれる場合があります。暗視野顕微鏡、位相差顕微鏡、微分干渉顕微鏡などの照明技術では、追加の光学部品を光路内に正確に配置する必要があります
倍率
複合光学顕微鏡の実際の倍率は、接眼レンズと対物レンズの倍率の積です。例えば、接眼レンズの倍率が10倍で対物レンズの倍率が100倍の場合、合計倍率は1,000倍になります。オイルや紫外線の使用など、環境を調整することで解像度を高め、1,000倍を超える倍率でも細部を観察できます。
オペレーション

照明技術
光路を変更してサンプルからコントラストを向上させた画像を生成する技術は数多くあります。サンプルからコントラストを高める主な技術には、交差偏光、暗視野、位相差、微分干渉コントラスト照明などがあります。最近の技術(Sarfus)は、交差偏光と特定のコントラスト強化スライドを組み合わせて、ナノメートルサイズのサンプルを可視化します
- ティッシュペーパーのサンプルにコントラストを生成するために使用される透過照明技術の 4 つの例。1.559 μm/ピクセル。
- 明視野照明では、サンプルのコントラストはサンプル内の光の吸収によって決まります。
- 交差偏光照明では、サンプルを通過する偏光の回転によりサンプルのコントラストが生じます。
- 暗視野照明では、サンプルのコントラストはサンプルによって散乱された光から生じます。
その他の技術
現代の顕微鏡は、試料の透過光像を観察するだけでなく、他の種類のデータを抽出するために使用できる多くの技術があります。これらのほとんどは、基本的な複合顕微鏡に加えて追加の機器を必要とします
- 反射光または入射光(表面構造の分析用)
- 蛍光顕微鏡(両方)
- 顕微分光法(UV-可視分光光度計と光学顕微鏡を統合したもの)
- 紫外線顕微鏡
- 近赤外線顕微鏡
- コントラストの向上と収差の低減のための多重透過顕微鏡[ 27 ]
- 自動化(大きなサンプルの自動スキャンや画像キャプチャ用)
アプリケーション

光学顕微鏡は、マイクロエレクトロニクス、ナノ物理学、バイオテクノロジー、製薬研究、鉱物学、微生物学の分野で広く使用されています。[ 28 ]
光学顕微鏡は医療診断に使用され、組織を扱う場合や遊離細胞や組織片の 塗抹標本検査では組織病理学と呼ばれる分野が使用されます。
産業用途では、双眼顕微鏡が一般的です。真の奥行き知覚を必要とする用途を除けば、双眼接眼レンズの使用は、顕微鏡検査台での長時間作業に伴う眼精疲労を軽減します。特定の用途では、長作動距離顕微鏡または長焦点顕微鏡[ 29 ]が効果的です。窓越しに対象物を検査する必要がある場合や、工業用対象物が対物レンズにとって危険な場合があります。このような光学系は、近接焦点機能を備えた望遠鏡に似ています。[ 30 ] [ 31 ]
測定顕微鏡は精密測定に用いられます。基本的なタイプは2つあります。1つは焦点面における距離測定を可能にする目盛り付きのレチクルを備えています。 [ 32 ] もう1つ(より古いタイプ)は、シンプルな十字線と、対象物を顕微鏡に対して移動させるためのマイクロメーター機構を備えています。[ 33 ]
非常に小型で持ち運び可能な顕微鏡は、実験室用の顕微鏡では扱いにくい場所で使用されています。[ 34 ]
限界

透過光で非常に高い倍率では、点物体は回折リングに囲まれたぼやけた円盤として見えます。これらはエアリー ディスクと呼ばれます。顕微鏡の分解能は、2 つの近接したエアリー ディスクを区別する能力 (つまり、顕微鏡が隣接する構造の詳細を別個に区別して表示する能力) とされています。微細な詳細を分解する能力を制限するのは、これらの回折の影響です。回折パターンの範囲と大きさは、光の波長(λ)、対物レンズの製造に使用される屈折材料、および対物レンズの開口数(NA) の両方によって影響を受けます。したがって、対物フィールドで個別の点を分解することが不可能になる有限の限界があり、これを回折限界と呼びます。光学セットアップ全体の光学収差が無視できると仮定すると、解像度dは次のように表すことができます。
通常、波長は550 nmと想定され、これは緑色光に相当します。外部媒体として空気を用いた場合、実用的なNAは最大0.95、油を用いた場合は最大1.5です。実際、従来のレンズで得られるdの最小値は約200 nmです。光の多重散乱を利用する新しいタイプのレンズは、解像度を100 nm未満まで向上させました。[ 35 ]
解像度の限界を超える
上述の透過光限界を超える解像度を達成するには、複数の技術が利用可能である。1979年にCourjonとBulaboisによって報告されたホログラフィック技術も、この解像度限界を突破することが可能であるが、実験解析では解像度が制限されていた。[ 36 ]
蛍光サンプルを用いると、より多くの技術が利用可能になります。例えば、 Vertico SMI、エバネッセント波を用いた近接場走査型光学顕微鏡、誘導放出消散法などが挙げられます。2005年には、単一分子を検出できる顕微鏡が教育ツールとして発表されました。[ 37 ]
過去 10 年間で大きな進歩があったにもかかわらず、回折限界を超える技術は依然として限られており、特殊なものとなっています。
ほとんどの技術は横方向分解能の向上に重点を置いていますが、極めて薄い試料の分析を可能にすることを目的とした技術もいくつかあります。例えば、Sarfus法では、薄い試料をコントラストを高める表面に置くことで、0.3ナノメートルという薄い膜を直接観察することができます。
2014年10月8日、超解像蛍光顕微鏡の開発により、エリック・ベツィグ、ウィリアム・モーナー、シュテファン・ヘルの3人にノーベル化学賞が授与されました。[ 38 ] [ 39 ]
構造化照明SMI
SMI(空間変調照明顕微鏡法)は、いわゆる点像分布関数(PSF)工学の光光学プロセスです。これは、顕微鏡のPSFを適切に修正することで、光学解像度を向上させるか、照明光の波長に比べて小さい蛍光物体の距離測定の精度を最大化するか、ナノメートル領域の他の構造パラメータを抽出するプロセスです。[ 40 ] [ 41 ]
局在顕微鏡 SPDMphymod
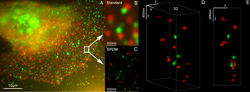
SPDM(スペクトル精密距離顕微鏡法)は、基本的な位置特定顕微鏡技術であり、蛍光顕微鏡の光学的プロセスであり、光学顕微鏡の理論的な解像度限界をはるかに下回る「光学的に分離された」粒子(例えば分子)の位置、距離、角度の測定を可能にします。「光学的に分離された」とは、ある時点において、従来の光学解像度(通常、直径約200~250 nm)によって決定されるサイズの領域内にある単一の粒子/分子のみが記録されていることを意味します。これは、そのような領域内の分子がすべて異なるスペクトルマーカー(例えば、異なる色、または異なる粒子の発光におけるその他の利用可能な違い)を持っている場合に可能になります。[ 42 ] [ 43 ] [ 44 ] [ 45 ]
GFP 、Alexa色素、Atto色素、Cy2/Cy3、フルオレセイン分子といった多くの標準的な蛍光色素は、特定の光物理的条件が満たされれば、局在顕微鏡観察に使用できます。いわゆるSPDMphymod(物理的に修飾可能な蛍光体)技術を用いることで、適切な強度の単一レーザー波長でナノイメージングが可能です。[ 46 ]
3D超解像顕微鏡
標準蛍光色素を用いた3D超解像顕微鏡は、標準蛍光色素SPDMphymodの局在顕微鏡と構造化照明SMIを組み合わせることで実現できます。[ 47 ]
STED

誘導放出抑制法は、回折限界を超える高解像度がいかに可能であるかを示す単純な例ですが、大きな限界があります。STEDは、光パルスの組み合わせを用いてサンプル中の蛍光分子の小さな集団に蛍光を誘発する蛍光顕微鏡技術です。各分子は画像内で回折限界の光点を生成し、これらの光点の中心が分子の位置に対応します。蛍光分子の数が少ないため、光点が重なり合う可能性は低く、正確に配置することができます。このプロセスは何度も繰り返され、画像が生成されます。マックス・プランク生物物理化学研究所のシュテファン・ヘルは、 STED顕微鏡と関連手法の開発により、2006年に第10回ドイツ未来賞、2014年にノーベル化学賞を受賞しました。[ 48 ]
代替案
可視光の回折限界によって設定された制限を克服するために、他の波を使用する顕微鏡が設計されました
高周波の波は物質との相互作用が限られていることに注意することが重要です。例えば、軟部組織はX線に対して比較的透明であるため、コントラストの明確な発生源となり、対象用途が異なります
光の代わりに電子やX線を使用すると、はるかに高い解像度が得られます。これは、放射線の波長が短いため、回折限界が低くなるためです。短波長プローブを非破壊的にするために、原子ビームイメージングシステム(原子ナノスコープ)が提案され、文献でも広く議論されていますが、従来のイメージングシステムとはまだ競合していません。
STMとAFMは、試料表面を走査する小さなプローブを用いる走査プローブ技術です。これらの場合の分解能はプローブのサイズによって制限されますが、マイクロマシニング技術を用いることで、先端半径が5~10nmのプローブを製造することができます。
さらに、電子顕微鏡やX線顕微鏡などの手法は真空または部分真空を使用するため、生体試料や生物学的試料への適用が制限されます(環境走査型電子顕微鏡を除く)。これらの装置はすべて試料室を必要とするため、試料のサイズも制限され、試料操作も困難です。これらの手法で得られた画像では色彩が確認できないため、一部の情報が失われます。しかしながら、アルミニウム合金の時効硬化やポリマーの微細構造など、分子や原子の影響を調べる際には不可欠です。
関連項目
参考文献
- ^ JRブルーフォード. 「レッスン2 – ページ3、顕微鏡の分類」 . msnucleus.org. 2016年5月10日時点のオリジナルよりアーカイブ。2017年1月15日閲覧
- ^ Trisha Knowledge Systems. IIT Foundation Series - Physics Class 8, 2/e . Pearson Education India. p. 213. ISBN 978-81-317-6147-2。
- ^ a bイアン・M・ワット (1997). 『電子顕微鏡の原理と実践』ケンブリッジ大学出版局. p. 6. ISBN 978-0-521-43591-8。
- ^ 「家庭用の安価な顕微鏡の購入」(PDF)。オックスフォード大学。2016年3月5日時点のオリジナルからアーカイブ(PDF)。2015年11月5日閲覧
- ^ Kumar, Naresh; Weckhuysen, Bert M.; Wain, Andrew J.; Pollard, Andrew J. (2019年4月). 「先端増強ラマン分光法を用いたナノスケール化学イメージング」 . Nature Protocols . 14 (4): 1169– 1193. doi : 10.1038/s41596-019-0132-z . ISSN 1750-2799 . PMID 30911174 .
- ^ Lee, Joonhee; Crampton, Kevin T.; Tallarida, Nicholas; Apkarian, V. Ara (2019年4月). 「原子閉じ込め光による単一分子の振動ノーマルモードの可視化」. Nature . 568 ( 7750): 78– 82. Bibcode : 2019Natur.568...78L . doi : 10.1038/s41586-019-1059-9 . ISSN 1476-4687 . PMID 30944493. S2CID 92998248 .
- ^ Aspden, Reuben S.; Gemmell, Nathan R.; Morris, Peter A.; Tasca, Daniel S.; Mertens, Lena; Tanner, Michael G.; Kirkwood, Robert A.; Ruggeri, Alessandro; Tosi, Alberto; Boyd, Robert W.; Buller, Gerald S.; Hadfield, Robert H.; Padgett, Miles J. (2015). 「光子スパース顕微鏡法:赤外線照明を用いた可視光イメージング」(PDF) . Optica . 2 (12): 1049. Bibcode : 2015Optic...2.1049A . doi : 10.1364/OPTICA.2.001049 . ISSN 2334-2536 . 2016年6月4日時点のオリジナルよりアーカイブ(PDF) .
- ^ Atti Della Fondazione Giorgio Ronchi E Contributi Dell'Istituto Nazionale Di Ottica、第 30 巻、La Fondazione-1975、554 ページ
- ^アルバート・ヴァン・ヘルデン;スヴェン・デュプレ;ロブ・ヴァン・ゲント(2010)。望遠鏡の起源。アムステルダム大学出版局。 p. 24.ISBN 978-90-6984-615-6。
- ^ a b c d J. William Rosenthal著『眼鏡とその他の視覚補助具:歴史と収集ガイド』Norman Publishing、1996年、391~392ページ
- ^ a b cレイモンド・J・シーガー『物理学者たち:ガリレオ・ガリレイの生涯と作品』エルゼビア - 2016年、24ページ
- ^アルバート・ヴァン・ヘルデン;スヴェン・デュプレ;ロブ・ヴァン・ゲント(2010)。望遠鏡の起源。アムステルダム大学出版局。32~ 36、43ページ 。ISBN 978-90-6984-615-6。
- ^ヴァン・ヘルデン、43ページ
- ^ a bシュマエフスキー、ブライアン(2006)バイオテクノロジー101。グリーンウッド。p.171。ISBN 0313335281。
- ^注:ザカリアス・ヤンセンは父ハンス・マルテンスの助けを借りたという説(あるいは父によって完全に作られたという説)など、様々な説があります。ザカリアスの生年月日は1585年と推定されるため(ファン・ヘルデン、28ページ)、彼が1590年に発明した可能性は低く、発明の主張はザカリアス・ヤンセンの息子、ヨハネス・ザカリアッセンの証言に基づいており、彼がこの物語全体を捏造した可能性があります(ファン・ヘルデン、43ページ)。
- ^ 「顕微鏡を発明したのは誰か?」 Live Science、2013年9月14日。2017年2月3日時点のオリジナルよりアーカイブ。 2017年3月31日閲覧。
- ^ロバート・D・ウエルタ『デルフトの巨人たち:ヨハネス・フェルメールと自然哲学者:大航海時代における知識の並行的探求』バックネル大学出版局 - 2003年、126ページ
- ^ A. マーク・スミス著『視覚から光へ:古代光学から現代光学への道』シカゴ大学出版局、2014年、387ページ
- ^ダニエル・J・ブールスティン『発見者たち』Knopf Doubleday Publishing Group - 2011年、327ページ
- ^グールド、スティーブン・ジェイ (2000). 「第2章:鋭い目を持つオオヤマネコ、自然に翻弄される」. 『マラケシュの嘘つき石:自然史における最後から2番目の考察』 . ニューヨーク、ハーモニー. ISBN 978-0-224-05044-9。
- ^「ガリレオの顕微鏡」 2008年4月9日アーカイブ、Instituto e Museo di Storia della Scienza(イタリア語)
- ^グールド、スティーブン・ジェイ(2000)『マラケシュの嘘つき石』ハーモニーブックス、 ISBN 0-609-60142-3。
- ^ Riddell JL (1854). 「双眼顕微鏡について」. QJ Microsc Sci . 2 : 18–24
- ^ Cassedy JH (1973). 「ジョン・L・リデルのビブリオ・ビセップス:アメリカの顕微鏡検査とコレラ病因に関する2つの文書 1849–59」J Hist Med . 28 (2): 101– 108. doi : 10.1093/jhmas/xxviii.2.101 . PMID 4572620 .
- ^ 「複合顕微鏡の使い方」 . Microscope.com . 2023年2月8日閲覧。
- ^ Kenneth, Spring; Keller, H. Ernst; Davidson, Michael W. 「顕微鏡の対物レンズ」 . Olympus Microscopy Resource Center . 2008年11月1日時点のオリジナルよりアーカイブ。 2008年10月29日閲覧。
- ^ Pégard, Nicolas C.; Fleischer, Jason W. (2011年5月1日). 「マルチパス位相共役顕微鏡によるコントラスト向上」 . CLEO:2011 - Laser Applications to Photonic Applications (2011), Paper CThW6 CThW6. Optica Publishing Group. doi : 10.1364/CLEO_SI.2011.CThW6 . ISBN 978-1-55752-910-7. S2CID 13366261 .
- ^ O1 光学顕微鏡2011年1月24日アーカイブ カタリナ・ログ著 チャルマース大学応用物理学科 2006年1月20日
- ^ 「カメラアダプター付き長焦点顕微鏡」 macrolenses.de . 2011年10月3日時点のオリジナルよりアーカイブ。
- ^ 「Questar Maksutov 顕微鏡」 . company7.com . 2011年6月15日時点のオリジナルよりアーカイブ。2011年7月11日閲覧。
- ^ 「FTA長焦点顕微鏡」 firsttenangstroms.com . 2012年2月26日時点のオリジナルよりアーカイブ。2011年7月11日閲覧。
- ^オルソン、グスタフ (2003). 「レチクル」 . ドリガース、ロナルド・G. (編).光工学百科事典 第3巻. CRC Press. p. 2409. ISBN 978-0-824-74252-2。
- ^ 「顕微鏡検査」。王立顕微鏡学会誌。学会誌、議事録、動物学と植物学(主に無脊椎動物と隠形動物)、顕微鏡検査などに関する最新の研究概要を含む。 1906年。716ページツァイス測定顕微鏡についての解説。
- ^リンダー、コートニー(2019年11月22日)「スマートフォン用顕微鏡が欲しいと思ったことがあるなら、今がチャンス」『ポピュラーメカニクス』2020年11月3日閲覧。
- ^ Van Putten, EG; Akbulut, D.; Bertolotti, J.; Vos, WL; Lagendijk, A.; Mosk, AP (2011). 「散乱レンズは可視光でサブ100 nm構造を解像する」. Physical Review Letters . 106 (19) 193905. arXiv : 1103.3643 . Bibcode : 2011PhRvL.106s3905V . doi : 10.1103/PhysRevLett.106.193905 . PMID 21668161. S2CID 15793849 .
- ^ Courjon, D.; Bulabois, J. (1979). 「特殊なホログラフィック照明システムと回転シアリング干渉計を用いたリアルタイムホログラフィック顕微鏡法」. Journal of Optics . 10 (3): 125. Bibcode : 1979JOpt...10..125C . doi : 10.1088/0150-536X/10/3/004 .
- ^ 「低コストで単一分子を測定可能なマルチモード光学顕微鏡のデモンストレーション」。2009年3月6日時点のオリジナルよりアーカイブ。 2009年2月25日閲覧。
- ^ Ritter, Karl; Rising, Malin (2014年10月8日). 「2人のアメリカ人、1人のドイツ人が化学ノーベル賞を獲得」 . APニュース. 2014年10月11日時点のオリジナルよりアーカイブ。 2014年10月8日閲覧。
- ^ Chang, Kenneth (2014年10月8日). 「2人のアメリカ人と1人のドイツ人がノーベル化学賞を受賞」 . New York Times . 2014年10月9日時点のオリジナルよりアーカイブ。 2014年10月8日閲覧。
- ^ Heintzmann, Rainer (1999). Bigio, Irving J.; Schneckenburger, Herbert; Slavik, Jan; Svanberg, Katarina; Viallet, Pierre M. (編).横方向変調励起顕微鏡法:回折格子を用いた解像度の向上. Optical Biopsies and Microscopic Techniques III. Vol. 3568. pp. 185– 196. doi : 10.1117/12.336833 . S2CID 128763403 .
- ^クレマー、クリストフ、ハウスマン、マイケル、ブラドル、ヨアキム、シュナイダー、ベルンハルト「検出点広がり関数を備えた波動場顕微鏡」、米国特許7,342,717、優先日1997年7月10日
- ^ Lemmer, P.; Gunkel, M.; Baddeley, D.; Kaufmann, R.; Urich, A.; Weiland, Y.; Reymann, J.; Müller, P.; Hausmann, M.; Cremer, C. (2008). 「SPDM:ナノスケールにおける単一分子分解能の光顕微鏡法」. Applied Physics B. 93 ( 1): 1– 12. Bibcode : 2008ApPhB..93....1L . doi : 10.1007/s00340-008-3152-x . S2CID 13805053 .
- ^ Bradl, Joachim (1996). 「従来の共焦点レーザー走査型蛍光顕微鏡と軸方向断層蛍光顕微鏡における3次元位置同定精度の比較研究」Bigio, Irving J; Grundfest, Warren S; Schneckenburger, Herbert; Svanberg, Katarina; Viallet, Pierre M (編). Optical Biopsies and Microscopic Techniques . Vol. 2926. pp. 201– 206. doi : 10.1117/12.260797 . S2CID 55468495 .
- ^ Heintzmann, R.; Münch, H.; Cremer, C. (1997). 「落射蛍光顕微鏡法における高精度測定 ― シミュレーションと実験」(PDF) . Cell Vision . 4 : 252–253 . 2016年2月16日時点のオリジナルよりアーカイブ(PDF) .
- ^クレマー、クリストフ、ハウスマン、マイケル、ブラドル、ヨアヒム、リンケ、ベルント「物体構造間の距離を測定する方法および装置」、米国特許6,424,421、優先日1996年12月23日
- ^ Manuel Gunkel ; et al. (2009). 「細胞ナノ構造のデュアルカラー局在顕微鏡法」(PDF) . Biotechnology Journal . 4 (6): 927–38 . doi : 10.1002/biot.200900005 . PMID 19548231. S2CID 18162278. 2019年5月3日時点のオリジナルよりアーカイブ(PDF) .
- ^ Kaufmann, R; Müller, P; Hildenbrand, G; Hausmann, M; Cremer, C; et al. (2011). 「局在顕微鏡法を用いた異なる種類の乳がん細胞におけるHer2/neu膜タンパク質クラスターの解析」Journal of Microscopy . 242 (1): 46– 54. CiteSeerX 10.1.1.665.3604 . doi : 10.1111/j.1365-2818.2010.03436.x . PMID 21118230 . S2CID 2119158 .
- ^ 「アッベの限界を越えたドイツ未来賞」。2009年3月7日時点のオリジナルよりアーカイブ。2009年2月24日閲覧。
引用元
- ヴァン・ヘルデン、アルバート、デュプレ、ロブ・ヴァン・ゲント(2011年)。『望遠鏡の起源』アムステルダム大学出版局。ISBN 978-90-6984-615-6。
参考文献
- Wegerhoff, Rainer; Weidlich, Olaf; Kässens, Manfred (2011). Basics of Light Microscopy & Imaging . Imaging & Microscopy (Special Issue) (第2版). Darmstadt, Germany: GIT Verlag / Wiley Analytical Science
外部リンク
- 「顕微鏡リソースセンター」。Evident(旧オリンパスサイエンティフィックソリューションズ)。
- 「MicroscopyU: 顕微鏡教育の情報源」ニコンインストゥルメンツ
- 「カールツァイス顕微鏡オンラインキャンパス:顕微鏡とデジタルイメージングの教育」。ツァイス研究顕微鏡ソリューション。
- 「分子表現:光学と顕微鏡の世界を探る」フロリダ州立大学国立高磁場研究所
- カリフォルニア大学バークレー校ゴルブ・コレクション。17世紀から19世紀にかけての歴史的な顕微鏡のコレクションで、詳細な解説も付いています。










