蛍光顕微鏡

蛍光顕微鏡は、散乱、反射、減衰または吸収の代わりに、あるいはそれらに加えて蛍光を利用して有機物質または無機物質の特性を研究する光学顕微鏡です。[ 1 ] [ 2 ]蛍光顕微鏡とは、落射蛍光顕微鏡のような単純な構成のものから、光学切片を使用して蛍光画像の解像度を向上させる共焦点顕微鏡 などのより複雑な設計のものまで、蛍光を使用して画像を生成する顕微鏡のことです。[ 3 ]
原理
標本に特定の波長(複数可)の光が照射されると、その光は蛍光体によって吸収され、より長い波長の光(吸収された光とは異なる色)を放出します。照明光は、分光発光フィルターを用いて、より弱い蛍光から分離されます。蛍光顕微鏡の代表的な構成要素は、光源(キセノンアークランプまたは水銀灯が一般的ですが、より高度な形態では高出力LEDやレーザーが使用されています)、励起フィルター、ダイクロイックミラー(またはダイクロイックビームスプリッター)、および発光フィルターです(下図参照)。フィルターとダイクロイックビームスプリッターは、標本の標識に使用されている蛍光体の励起および発光スペクトル特性に合わせて選択されます。[ 1 ]このようにして、1つの蛍光体(色)の分布が一度に画像化されます。複数種類の蛍光体のマルチカラー画像は、複数の単色画像を組み合わせて作成する必要があります。[ 1 ]
現在使用されている蛍光顕微鏡のほとんどは落射蛍光顕微鏡であり、蛍光色素の励起と蛍光の検出が同一の光路(すなわち対物レンズ)を通して行われます。これらの顕微鏡は生物学分野で広く使用されており、共焦点顕微鏡や全反射蛍光顕微鏡(TIRF)といったより高度な顕微鏡設計の基礎となっています。
落射蛍光顕微鏡
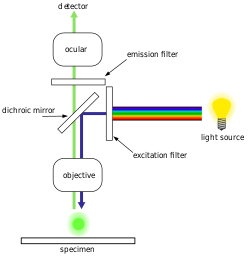
蛍光顕微鏡の大部分、特に生命科学分野で用いられるものは、図に示す落射蛍光設計となっている。励起波長の光が対物レンズを通して標本を照射する。標本から発せられた蛍光は励起に用いたのと同じ対物レンズによって検出器に集束されるが、解像度を高めるには開口数の大きい対物レンズが必要となる。励起光の大部分は標本を透過するため、反射した励起光のみが発せられた光とともに対物レンズに到達し、落射蛍光法では高い信号対雑音比が得られる。ダイクロイックビームスプリッターは波長特異的なフィルターとして機能し、蛍光を接眼レンズまたは検出器に透過させる一方、残りの励起光は光源に向かって反射する。
光源
蛍光顕微鏡では、ハロゲンランプなどの広く普及している光源では提供できない、強力でほぼ単色の照明が必要です。[ 4 ]使用される光源の主な種類は、励起フィルター付きのキセノンアークランプまたは水銀灯、レーザー、スーパーコンティニューム光源、高出力LED の4 つです。レーザーは、共焦点顕微鏡や全反射蛍光顕微鏡などのより複雑な蛍光顕微鏡技術に最も広く使用されていますが、広視野落射蛍光顕微鏡では、キセノンランプ、水銀ランプ、二色性励起フィルター付きの LED が一般的に使用されています。広視野落射蛍光顕微鏡の照明光路に 2 つのマイクロレンズアレイを配置することで、[ 5 ]変動係数が 1~2% の非常に均一な照明を実現できます。
サンプルの準備

蛍光顕微鏡に適した試料は蛍光を発する必要があります。蛍光試料の作製方法はいくつかありますが、主な手法は蛍光染色による標識化、または生物試料の場合は蛍光タンパク質の発現です。あるいは、試料が本来持つ蛍光(すなわち、自家蛍光)を利用することもできます。[ 1 ]生命科学において、蛍光顕微鏡は、試料を特異的かつ高感度に染色し、タンパク質やその他の対象分子の分布を検出する強力なツールです。そのため、生物試料の蛍光染色には多様な手法が存在します。
生物学的蛍光染色
さまざまな生体分子を対象に、多くの蛍光染色剤が設計されています。これらの一部は、本質的に蛍光を発し、対象の生体分子と結合する小分子です。主な例としては、DAPI、ヘキスト(紫外線波長の光で励起)、DRAQ5、DRAQ7(赤色光で最適に励起)などの核酸染色剤があり、これらはすべてDNAの副溝に結合して細胞核を標識します。その他には、特定の細胞構造に結合し、蛍光レポーターで誘導体化された薬物、毒素、ペプチドがあります。このクラスの蛍光染色剤の主な例は、哺乳類細胞のアクチン繊維を染色するために使用されるファロイジンです。アクチンは、特にトランスフェクションできない細胞では、GFP に結合したLifeActペプチドを使用して染色することもできます。 [ 7 ]コラーゲンハイブリダイジングペプチドと呼ばれる新しいペプチドも蛍光色素と結合して、変性コラーゲン繊維を染色するために使用できます。植物細胞壁の染色は、セルロースまたはペクチンに結合する染料を用いて行われます。高い特異性を有し、かつ植物細胞の生体イメージングも可能にする蛍光プローブの探索が進められています。[ 8 ]
フルオレセイン、Alexa Fluors、DyLight 488など、蛍光体または蛍光色素と呼ばれる蛍光分子は数多くあり、サンプル内の対象ターゲットに結合する別の分子と化学的に結合させることができます。
免疫蛍光法
免疫蛍光法は、抗体が抗原に高度に特異的に結合することを利用し、細胞内の特定のタンパク質やその他の分子を標識する技術です。サンプルは、目的の分子に特異的な一次抗体で処理されます。一次抗体には蛍光体を直接結合させることができます。あるいは、一次抗体に特異的に結合する蛍光体と結合した二次抗体を使用することもできます。例えば、マウスで作製されたチューブリンを認識する一次抗体と、蛍光体で誘導体化された抗マウス二次抗体を組み合わせることで、細胞内の 微小管を標識することができます。
蛍光タンパク質
遺伝学に関する最新の知見とDNA改変技術の進歩により、科学者はタンパク質を遺伝子改変し、蛍光タンパク質レポーターを担わせることが可能になりました。生物学的サンプルにおいて、これにより科学者は目的のタンパク質を直接蛍光化することが可能となり、生細胞内を含め、タンパク質の位置を直接追跡することが可能になります。
制限事項
蛍光色素分子は、光照射を受けると光退色と呼ばれるプロセスで蛍光を発する能力を失います。光退色は、蛍光分子が蛍光を発する際に励起された電子による化学損傷を蓄積することで発生します。光退色は、蛍光顕微鏡で試料を観察できる時間を大幅に制限する可能性があります。光退色を軽減する方法としては、より強力な蛍光色素分子の使用、照射量の最小化、光保護スカベンジャー化学物質の使用など、いくつかあります。
蛍光レポータータンパク質を用いた蛍光顕微鏡法は、生細胞の蛍光顕微鏡分析を可能にしましたが、細胞は光毒性、特に短波長光に対する感受性が強くなります。さらに、蛍光分子は光照射下で反応性化学種を生成する傾向があり、これが光毒性効果を増強します。
透過光顕微鏡や反射光顕微鏡とは異なり、蛍光顕微鏡では蛍光標識された特定の構造のみを観察できます。例えば、蛍光DNA染色で調製した組織サンプルを蛍光顕微鏡で観察すると、細胞内のDNAの構造のみが明らかになり、細胞の形態については何も分かりません。
非蛍光画像(明視野など)から蛍光信号を推定する計算技術は、こうした懸念を軽減する可能性がある。[ 9 ]一般的に、これらのアプローチでは、染色された細胞を用いて深層畳み込みニューラルネットワークを学習させ、その後、染色されていないサンプルの蛍光を推定する。このように、研究対象の細胞とネットワークの学習に使用した細胞を切り離すことで、より迅速に、かつ光毒性を低減しながらイメージングを行うことができる。
サブ回折技術
光の波動性は、回折限界によって光を集光できる点の大きさを制限します。この限界は19世紀にエルンスト・アッベによって記述され、「光学顕微鏡の解像度は、使用する光の波長の約半分に制限される」とされています。蛍光顕微鏡は、特殊な光学構成によってこの限界を超えることを目指す多くの技術の中心となっています。
20 世紀には顕微鏡技術のいくつかの改良が発明され、解像度とコントラストがある程度向上しました。しかし、回折限界は克服されませんでした。1978 年に、この障壁を打破するための最初の理論的アイデアが開発され、4Pi 顕微鏡を共焦点レーザー走査蛍光顕微鏡として使用しました。この顕微鏡では、光は理想的にはすべての側面から共通の焦点に焦点を合わせられ、その焦点を使用して「点ごと」の励起と「点ごと」の検出を組み合わせて対象物をスキャンします。[ 10 ] ただし、4Pi 顕微鏡の最初の実験的デモンストレーションは 1994 年に行われました。[ 11 ] 4Pi 顕微鏡では、2 つの対向する対物レンズ、または赤方偏移光と多光子励起を使用した2 光子励起顕微鏡を使用して、利用可能な焦点方向の量を最大化します。
統合相関顕微鏡法は、蛍光顕微鏡と電子顕微鏡を組み合わせたものです。これにより、蛍光顕微鏡のデータを標識ツールとして利用しながら、電子顕微鏡で超微細構造と文脈情報を可視化することが可能になります。 [ 12 ]
回折分解能を真に達成した最初の技術は、1994年に提案されたSTED顕微鏡法でした。この方法とRESOLFTコンセプトに基づくすべての技術は、光と蛍光分子との間の強い非線形相互作用に依存しています。分子は特定の位置において、識別可能な分子状態間を強く遷移するため、最終的には空間のごく一部からのみ光を放射することができ、解像度が向上します。
1990 年代には、広視野顕微鏡に基づく別の超解像顕微鏡法も開発されました。蛍光マーカーで染色された細胞ナノ構造のサイズ分解能は、SPDM 局在顕微鏡法と構造化レーザー照明 (空間変調照明、SMI) の開発によって大幅に向上しました。 [ 13 ] SPDM の原理と SMI を組み合わせることで、Vertico SMI顕微鏡が開発されました。[ 14 ] [ 15 ]緑色蛍光タンパク質(GFP) などの通常の点滅する蛍光色素の単一分子検出は、SPDM をさらに発展させた、いわゆる SPDMphymod 技術を使用することで実現できます。この技術により、分子レベルで 2 つの異なる蛍光分子タイプを検出してカウントすることができます (この技術は、2 色局在顕微鏡法または 2CLM と呼ばれます)。[ 16 ]
あるいは、光活性化局在顕微鏡法の登場により、単一分子の点滅やスイッチングを利用することで同様の結果を達成できる可能性があります。この場合、蛍光を発する分子の割合は毎回非常に小さくなります。照射された光に対する分子のこの確率的応答は、高度に非線形な相互作用にも対応し、回折分解能以下を実現します。
蛍光顕微鏡写真ギャラリー
- アクチンフィラメントを可視化するためにファロイジン染色した骨肉腫細胞のZ投影像。画像は共焦点顕微鏡で撮影され、その後、実験的に導出された点像分布関数を用いてデコンボリューションが行われた。
- 顕微鏡下で観察した内皮細胞。核はDAPIで青く染色され、微小管はFITCに結合した抗体で緑に、アクチンフィラメントはTRITCに結合したファロイジンで赤く染色されている。ウシ肺動脈内皮細胞(BPAE)
- 乳房細胞におけるHer2およびHer3の3Dデュアルカラー超解像顕微鏡、標準染色:Alexa 488、Alexa 568。LIMON顕微鏡
- ヒトリンパ球核をDAPIで染色し、13番染色体(緑)と21番染色体(赤)のセントロメアプローブをハイブリダイズさせた(蛍光in situハイブリダイゼーション(FISH))
- RFPおよびGFP蛍光マーカーを融合した膜タンパク質によって可視化された酵母細胞膜。両マーカーからの光が照射されると黄色に染まる。
- 超解像顕微鏡:ヒト癌細胞における単一YFP分子の検出。Vertico -SMI/SPDMphymod顕微鏡を用いて15nm領域で測定した典型的な距離測定値
- 超解像顕微鏡:GFPとRFP融合タンパク質の共局在顕微鏡(2CLM)(骨癌細胞の核)Vertico-SMI/SPDMphymod顕微鏡で測定された広視野領域(470 μm 2)内の120,000個の局在分子
- ヒト野生型およびP239S変異体パラディンにおけるDNA発現の蛍光顕微鏡観察
- 太陽フレアの病理を蛍光顕微鏡で観察すると、赤く染まった部分が血球に現れている。
参照
- 相関光電子顕微鏡法
- 細菌の細胞内タンパク質を可視化する蛍光顕微鏡技術の先駆者、エリザベス・ハリー
- 蛍光イメージング
- 生命科学における蛍光
- 緑色蛍光タンパク質(GFP)
- 水銀灯
- 顕微鏡
- 走査型電子顕微鏡 § カソードルミネッセンス
- ストークスシフト
- キセノンアークランプ
参考文献
- ^ a b c d Spring KR, Davidson MW. 「蛍光顕微鏡入門」 . Nikon MicroscopyU . 2024年10月24日閲覧。
- ^ 「蛍光顕微鏡」 .顕微鏡—科学者の隠れた世界の探査を支援する.ノーベル財団. 2008年9月28日閲覧。
- ^ Juan Carlos Stockert, Alfonso Blázquez-Castro (2017). Fluorescence Microscopy in Life Sciences . Bentham Science Publishers. ISBN 978-1-68108-519-7. 2019年5月14日時点のオリジナルよりアーカイブ。2017年12月17日閲覧。
- ^ Huang B (2010年3月). 「超解像蛍光顕微鏡法」 . Annual Review of Biochemistry . 78 : 993–1016 . doi : 10.1146/annurev.biochem.77.061906.092014 . PMC 2835776. PMID 19489737 .
- ^ FAW Coumans; E. van der Pol; LWMM Terstappen (2012). 「デュアルマイクロレンズアレイによる落射蛍光顕微鏡のフラットトップ照明プロファイル」 . Cytometry Part A. 81 ( 4): 324– 331. doi : 10.1002/cyto.a.22029 . PMID 22392641. S2CID 13812696 .
- ^ Colin, S; Coelho, LP; Sunagawa, S; Bowler, C; Karsenti, E; Bork, P; Pepperkok, R; de Vargas, C (2017). 「環境微生物真核生物の細胞生物学および生態学のための定量的3Dイメージング」 . eLife . 6 : e26066. doi : 10.7554/eLife.26066.002 . PMC 5663481. PMID 29087936 . 資料は
 このソースからコピーされたもので、Creative Commons Attribution 4.0 International Licenseに基づいて利用可能です。
このソースからコピーされたもので、Creative Commons Attribution 4.0 International Licenseに基づいて利用可能です。 - ^ Riedl, Julia; Crevenna, Alvaro H; Kessenbrock, Kai; Yu, Jerry Haochen; Neukirchen, Dorothee; Bista, Michal; Bradke, Frank; Jenne, Dieter; Holak, Tad A; Werb, Zena; Sixt, Michael; Wedlich-Soldner, Roland (2008). 「Lifeact:F-アクチンを可視化する多用途マーカー」 . Nature Methods . 5 (7): 605– 607. doi : 10.1038/nmeth.1220 . ISSN 1548-7091 . PMC 2814344 . PMID 18536722 .
- ^ Bidhendi, AJ; Chebli, Y; Geitmann, A (2020年5月). 「植物一次細胞壁におけるセルロースとペクチンの蛍光可視化」. Journal of Microscopy . 278 (3): 164– 181. doi : 10.1111/ jmi.12895 . PMID 32270489. S2CID 215619998 .
- ^ Kandel, Mikhail E.; He, Yuchen R.; Lee, Young Jae; Chen, Taylor Hsuan-Yu; Sullivan, Kathryn Michele; Aydin, Onur; Saif, M. Taher A.; Kong, Hyunjoon; Sobh, Nahil; Popescu, Gabriel (2020). 「細胞内コンパートメントにおける乾燥質量変化の測定のための計算特異性を備えた位相イメージング(PICS)」 . Nature Communications . 11 (1): 6256. arXiv : 2002.08361 . Bibcode : 2020NatCo..11.6256K . doi : 10.1038 / s41467-020-20062-x . PMC 7721808. PMID 33288761 . S2CID 212725023。
- ^ Cremer, C; Cremer, T (1978). 「高解像度と被写界深度を備えたレーザー走査型顕微鏡に関する考察」(PDF) . Microscopica Acta . 81 (1): 31– 44. PMID 713859. 2016年3月4日時点のオリジナル(PDF)からアーカイブ。 2013年8月12日閲覧。
- ^ SW Hell, EHK Stelzer, S. Lindek, C. Cremer; Stelzer; Lindek; Cremer (1994). 「検出口径を拡大した共焦点顕微鏡:タイプB 4Pi共焦点顕微鏡」. Optics Letters . 19 (3): 222– 224. Bibcode : 1994OptL...19..222H . CiteSeerX 10.1.1.501.598 . doi : 10.1364/OL.19.000222 . PMID 19829598 .
{{cite journal}}: CS1 maint: 複数の名前: 著者リスト (リンク) - ^ Baarle, Kaitlin van. 「相関顕微鏡法:蛍光で情報の世界を開く」2017年2月16日閲覧。
- ^ Hausmann, Michael; Schneider, Bernhard; Bradl, Joachim; Cremer, Christoph G. (1997)、「空間変調励起蛍光顕微鏡による3Dナノ構造の高精度距離顕微鏡法」(PDF) Bigio, Irving J; Schneckenburger, Herbert; Slavik, Jan; et al. (eds.), Optical Biopsies and Microscopic Techniques II , vol. 3197, p. 217, doi : 10.1117/12.297969 , S2CID 49339042 , 2016年3月4日時点のオリジナル(PDF)からアーカイブ、 2013年8月12日閲覧
- ^ Reymann, J; Baddeley, D; Gunkel, M; Lemmer, P; Stadter, W; Jegou, T; Rippe, K; Cremer, C; Birk, U (2008). 「空間変調照明(SMI)顕微鏡法による固定細胞および生細胞中の核下複合体の高精度構造解析」 .染色体研究. 16 (3): 367–82 . doi : 10.1007/s10577-008-1238-2 . PMID 18461478. S2CID 22811346 .
- ^ Baddeley, D; Batram, C; Weiland, Y; Cremer, C; Birk, UJ (2003). 「空間変調照明顕微鏡を用いたナノ構造解析」(PDF) . Nature Protocols . 2 (10): 2640–6 . doi : 10.1038/nprot.2007.399 . PMID 17948007. S2CID 22042676 .
- ^ Gunkel, M; Erdel, F; Rippe, K; Lemmer, P; Kaufmann, R; Hörmann, C; Amberger, R; Cremer, C (2009). 「細胞ナノ構造のデュアルカラー局在顕微鏡法」(PDF) . Biotechnology Journal . 4 (6): 927– 38. doi : 10.1002/biot.200900005 . PMID 19548231. S2CID 18162278.オリジナル(PDF)から2016年3月4日時点のアーカイブ。 2013年8月12日閲覧。
外部リンク
- Fluorophores.org、蛍光染料のデータベース
- 顕微鏡リソースセンター 2014年10月22日アーカイブWayback Machine
- 蛍光顕微鏡や共焦点顕微鏡を含む様々なタイプの顕微鏡に関するアニメーションと説明(パリ南大学)










