四面体分子構造
| 四面体分子構造 | |
|---|---|
 | |
| 例 | CH 4、MnO− 4 |
| 点群 | T d |
| コーディネート番号 | 4 |
| 結合角 | ≈ 109.5° |
| μ(極性) | 0 |
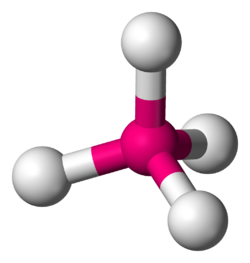
四面体分子構造では、中心原子が中心に位置し、4つの置換基が四面体の頂点に位置します。結合角はarcos(− 1/3 ) = 109.4712206...° ≈ 109.5° は、メタン( CH 4 ) [ 1 ] [ 2 ]やそのより重い類似体のように、4つの置換基がすべて同じ場合です。メタンやその他の完全に対称な四面体分子は点群T dに属しますが、ほとんどの四面体分子は対称性が低くなります。四面体分子はキラルになることがあります。
四面体結合角


CH 4のような対称四面体分子の結合角は、 2つのベクトルのドット積を用いて計算できます。左の図に示すように、分子は立方体に内接し、四価原子(例えば炭素)を立方体の中心(座標の原点O)に配置します。4つの一価原子(例えば水素)は、立方体の4つの頂点(A、B、C、D)に配置されます。これらの頂点は、立方体の1辺のみで繋がれた隣接する頂点に2つの原子が存在しないように設計されています。
立方体の辺の長さを2単位とすると、2つの結合OAとOBはベクトルa = (1, –1, 1)とb = (1, 1, –1)に対応し、結合角θはこれら2つのベクトル間の角度です。この角度は、2つのベクトルのドット積から計算できます。ドット積はa ⋅ b = ‖ a ‖ ‖ b ‖ cos θと定義されます。ここで、‖ a ‖はベクトルaの長さを表します。図に示すように、ここでのドット積は–1で、各ベクトルの長さは√3なので、cos θ = – 1/3そして四面体結合角θ = arccos (– 1/3)≃ 109.47°。
三角法を使った別の証明を右の図に示します。
例
主族化学

ほぼすべての飽和有機化合物を除けば、Si、Ge、Snの化合物のほとんどは四面体です。四面体分子は、四酸化キセノン(XeO 4)や過塩素酸イオン(ClO )のように、外側の配位子と多重結合していることが多いです。−4)、硫酸イオン(SO2−4)、リン酸イオン(PO3−4チアジルトリフルオリド(SNF3 )は四面体構造で、硫黄-窒素三重結合を特徴としています。[ 3 ]
他の分子は、中心原子の周りに電子対が四面体状に配列しています。例えば、アンモニア(NH 3)は、窒素原子が3つの水素原子と1つの孤立電子対に囲まれています。しかし、通常の分類では結合原子のみが考慮され、孤立電子対は考慮されないため、アンモニアは実際にはピラミッド型とみなされます。H–N–H角は109.5°から107°に縮んでいます。この差は、結合原子よりも大きな反発力を与える孤立電子対の影響によるものです。
遷移金属化学
金属錯体においても、その構造は広く普及しており、特に金属がd 0またはd 10配置をとる錯体では顕著である。具体例としては、テトラキス(トリフェニルホスフィン)パラジウム(0) ( Pd[P(C 6 H 5 ) 3 ] 4 )、ニッケルカルボニル( Ni(CO) 4 )、四塩化チタン( TiCl 4 ) などが挙げられる。d殻が不完全に満たされた錯体の多くは、鉄(II)、コバルト(II)、ニッケル(II)の四ハロゲン化物のように、しばしば四面体となる。
水の構造
気相では、単一の水分子は 2 つの水素と 2 つの孤立電子対に囲まれた酸素原子を持ち、H 2 O の形状は、非結合孤立電子対を考慮せずに単純に曲がっているものとして説明されます。
しかし、液体の水や氷の中では、孤立電子対は隣接する水分子と水素結合を形成します。酸素原子の周りの水素原子の最も一般的な配置は、2つの水素原子が酸素原子と共有結合し、残りの2つの水素原子が水素結合によって結合した正四面体です。水素結合の長さは変化するため、これらの水分子の多くは対称ではなく、4つの水素原子の間で一時的に不規則な正四面体を形成します。[ 4 ]
二面体構造

多くの化合物や錯体は二面体構造をとります。このモチーフでは、2つの四面体が共通の辺を共有しています。無機ポリマーである二硫化ケイ素は、辺を共有する四面体が無限に連なった構造をしています。
例外と歪み
四面体の反転は有機化学および典型族化学において広く見られる。ワルデン反転は、炭素における反転の立体化学的結果を例証する。アンモニア中の窒素反転もまた、平面状のNH 3の一時的な形成を伴う。
逆四面体幾何学
分子内の幾何学的制約は、理想的な四面体構造に大きな歪みを引き起こす可能性があります。炭素原子において「反転」四面体構造を示す化合物では、その炭素原子に結合した4つの基すべてが平面の片側に位置しています。[ 5 ]炭素原子は四角錐の頂点またはその近傍に位置し、他の4つの基は頂点に位置しています。[ 6 ] [ 7 ]
逆四面体構造を示す有機分子の最も単純な例は、 [1.1.1]プロペランなどの最小のプロペラン、またはより一般的にはパドレーン[ 8 ]やピラミダン( [ 3.3.3.3]フェネストラン)[6]である。[ 7 ]このような分子は典型的には歪みを生じ、その結果反応性が高まる。
平坦化
四面体は、2つの結合間の角度を大きくすることで歪むこともあります。極端な場合には、平坦化が起こります。炭素の場合、この現象はフェネストレーンと呼ばれる化合物群で観察されます。
中心原子を持たない四面体分子
いくつかの分子は中心原子を持たない四面体構造をとります。無機分子の例としては四リン(P 4)が挙げられます。四面体の頂点に4つのリン原子があり、それぞれが他の3つの原子と結合しています。有機分子の例としては四面体(C 4 H 4 )が挙げられます。四面体では4つの炭素原子がそれぞれ1つの水素原子と他の3つの炭素原子と結合しています。この場合、理論上のC−C−C結合角はわずか60°です(実際には、曲がった結合のために角度はより大きくなります)。これは大きな歪みを表しています。
参照
参考文献
- ^アルジャー、ニック。「四面体の2本の脚の間の角度」 。2018年10月3日時点のオリジナルよりアーカイブ。
- ^ Brittin, WE (1945). 「四面体炭素原子の原子価角」. J. Chem. Educ. 22 (3): 145. Bibcode : 1945JChEd..22..145B . doi : 10.1021/ed022p145 .
- ^ Miessler, GL; Tarr, DA (2004).無機化学(第3版). ピアソン/プレンティスホール. ISBN 0-13-035471-6。
- ^メイソン、PE; ブレイディ、JW (2007). "「「四面体性」と液体の水の集団構造と放射状分布関数の関係」。J . Phys. Chem. B. 111 ( 20): 5669– 5679. doi : 10.1021/jp068581n . PMID 17469865 .
- ^ Wiberg, Kenneth B. (1984). 「炭素における反転構造」. Acc. Chem. Res. 17 (11): 379– 386. doi : 10.1021/ar00107a001 .
- ^ a b Joseph P. Kenny; Karl M. Krueger; Jonathan C. Rienstra-Kiracofe; Henry F. Schaefer III (2001). "C 5 H 4 : Pyramidane and Its Low-Lying Isomers". J. Phys. Chem. A . 105 (32): 7745– 7750. Bibcode : 2001JPCA..105.7745K . doi : 10.1021/jp011642r .
- ^ a b Lewars, E. (1998). 「ピラミダン:C 5 H 4ポテンシャルエネルギー面の第一原理研究」. Journal of Molecular Structure: THEOCHEM . 423 (3): 173– 188. doi : 10.1016/S0166-1280(97)00118-8 .
- ^ IUPAC ,化学用語集、第5版(「ゴールドブック」)(2025年)。オンライン版:(2006年以降)「 paddlanes」。doi:10.1351/goldbook.P04395
外部リンク
- 四面体分子の例
- アニメーション化された四面体ビジュアル
- エルムハースト大学
- 点群のインタラクティブな分子例
- 3D Chem – 化学、構造、3D分子
- IUMSC – インディアナ大学分子構造センター]
- 錯イオン構造:四面体
- 分子モデリング
