トリプトファン
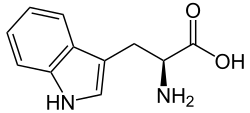 L-トリプトファンの骨格式 | |||
| |||
| 名前 | |||
|---|---|---|---|
| IUPAC名 トリプトファン | |||
| IUPAC体系名 2-アミノ-3-(1H-インドール-3-イル)プロパン酸 | |||
| その他の名前 2-アミノ-3-(1H-インドール-3-イル)プロピオン酸 | |||
| 識別子 | |||
| |||
3Dモデル(JSmol) | |||
| チェビ | |||
| チェムブル |
| ||
| ケムスパイダー |
| ||
| ドラッグバンク |
| ||
| ECHA 情報カード | 100.000.723 | ||
| ケッグ |
| ||
PubChem CID | |||
| ユニイ |
| ||
CompToxダッシュボード(EPA) | |||
| |||
| プロパティ | |||
| C 11 H 12 N 2 O 2 | |||
| モル質量 | 204.229 g·mol −1 | ||
| 溶解度: 0.23 g/L at 0 °C、 25℃で11.4 g/L、 50℃で17.1 g/L、 75℃で27.95 g/L | |||
| 溶解度 | 熱アルコール、アルカリ水酸化物に溶けるが、クロロホルムには不溶。 | ||
| 酸性度( p Ka ) | 2.38(カルボキシル)、9.39(アミノ)[ 2 ] | ||
磁化率(χ) | −132.0·10 −6 cm 3 /モル | ||
| 薬理学 | |||
| N06AX02 ( WHO ) | |||
| 補足データページ | |||
| トリプトファン(データページ) | |||
特に記載がない限り、データは標準状態(25 °C [77 °F]、100 kPa)における材料のものです。 | |||

トリプトファン(記号TrpまたはW)[ 3 ]は、タンパク質の生合成に用いられるα-アミノ酸です。トリプトファンはα-アミノ基、α-カルボン酸基、および側鎖インドールを含み、非極性芳香族β炭素置換基を有する極性分子です。トリプトファンは、神経伝達物質セロトニン、ホルモンメラトニン、ビタミンB 3(ナイアシン)の前駆体でもあります。 [ 4 ] UGGコドンによってコードされています。
他のアミノ酸と同様に、トリプトファンは生理的pHではアミノ基がプロトン化(–NH+ 3; pKa = 9.39)、カルボン酸は脱プロトン化されている( –COO − ; pKa = 2.38)。[ 5 ]
人間や多くの動物はトリプトファンを合成することができないため、食事から摂取する必要があり、必須アミノ酸となっています。
トリプトファンは、カゼインタンパク質から初めて単離された消化酵素トリプシンにちなんで名付けられました。[ 6 ]二重環が視覚的に大きな文字を連想させるため、 1文字の記号Wが割り当てられました。[ 7 ]
関数

トリプトファンを含むアミノ酸は、タンパク質生合成の構成要素として利用され、タンパク質は生命維持に不可欠です。トリプトファンはタンパク質中に見られるアミノ酸の中ではあまり一般的ではありませんが、存在する場合には重要な構造的または機能的役割を果たします。例えば、トリプトファンとチロシン残基は、細胞膜内で膜タンパク質を「固定」する上で特別な役割を果たします。トリプトファンは、他の芳香族アミノ酸とともに、糖鎖とタンパク質の相互作用においても重要です。さらに、トリプトファンは以下の化合物の生化学的前駆体として機能します。
- セロトニン(神経伝達物質)はトリプトファン水酸化酵素によって合成される。[ 8 ] [ 9 ]
- メラトニン(神経ホルモン)は、 N-アセチルトランスフェラーゼと5-ヒドロキシインドール-O-メチルトランスフェラーゼ酵素を介してセロトニンから合成されます。[ 10 ]
- トリプトファンは主に(95%以上)キヌレニンに代謝されます。免疫系と脳内のインドールアミン2,3-ジオキシゲナーゼ(IDO)と肝臓内のトリプトファン2,3-ジオキシゲナーゼ(TDO)という2つの酵素が、トリプトファンからキヌレニンを合成します。トリプトファン分解におけるキヌレニン経路は、統合失調症[ 11 ]、大うつ病[11] 、双極性障害[ 11 ]などの精神疾患を含むいくつかの疾患で変化しています。[ 11 ] [ 12 ]
- ナイアシンはビタミンB3としても知られ、キヌレニンとキノリン酸を経由してトリプトファンから合成されます。[ 13 ]
- オーキシン(植物ホルモンの一種)はトリプトファンから合成される。[ 14 ]
フルクトース吸収不良症は、腸内でトリプトファンが適切に吸収されず、血中のトリプトファン濃度が低下し、[ 15 ]うつ病を引き起こす[ 16 ]。
トリプトファンを合成する細菌では、細胞内のこのアミノ酸レベルが高いと、リプレッサータンパク質が活性化され、 trpオペロンに結合します。[ 17 ]このリプレッサーがトリプトファンオペロンに結合すると、トリプトファンの生合成に関与する酵素をコードする下流DNAの転写が阻害されます。つまり、高レベルのトリプトファンは負のフィードバックループによってトリプトファンの合成を阻害し、細胞内のトリプトファンレベルが再び低下すると、trpオペロンからの転写が再開されます。これにより、細胞内外のトリプトファンレベルの変化に対して、厳密に制御された迅速な応答が可能になります。
ヒト腸内細菌叢によるトリプトファン代謝() |
推奨される食事摂取量
2002年、米国医学研究所は19歳以上の成人に対して、トリプトファンの推奨摂取量(RDA)を体重1kgあたり5mg/日の摂取量に設定しました。 [ 22 ]
食事源
トリプトファンは、ほとんどのタンパク質食品、あるいは食物タンパク質に含まれています。特に、チョコレート、オート麦、干しナツメヤシ、牛乳、ヨーグルト、カッテージチーズ、赤身肉、卵、魚、鶏肉、ゴマ、ひよこ豆や大豆などの豆類、アーモンド、ヒマワリの種、カボチャの種、麻の実、そば、スピルリナ、ピーナッツに豊富に含まれています。調理済みの七面鳥にはトリプトファンが豊富に含まれるという一般的な考え[ 23 ] [ 24 ]とは異なり、七面鳥のトリプトファン含有量は鶏肉に典型的なものです[ 25 ] 。
| 食べ物 | トリプトファン[g/食品100g] | タンパク質[g/100gの食品] | トリプトファン/タンパク質[%] |
|---|---|---|---|
| 卵白(乾燥) | 1.00 | 81.10 | 1.23 |
| スピルリナ(乾燥) | 0.92 | 57.47 | 1.62 |
| 大西洋産タラ、干物 | 0.70 | 62.82 | 1.11 |
| 大豆、生 | 0.59 | 36.49 | 1.62 |
| チーズ、パルメザン | 0.56 | 37.90 | 1.47 |
| チアシード(乾燥) | 0.44 | 16.50 | 2.64 |
| ゴマ | 0.37 | 17.00 | 2.17 |
| 麻の実(殻付き) | 0.37 | 31.56 | 1.17 |
| チーズ、チェダー | 0.32 | 24.90 | 1.29 |
| ヒマワリの種 | 0.30 | 17.20 | 1.74 |
| 豚肉、チョップ | 0.25 | 19.27 | 1.27 |
| 七面鳥 | 0.24 | 21.89 | 1.11 |
| チキン | 0.24 | 20.85 | 1.14 |
| 牛肉 | 0.23 | 20.13 | 1.12 |
| オート麦 | 0.23 | 16.89 | 1.39 |
| 鮭 | 0.22 | 19.84 | 1.12 |
| ラムチョップ | 0.21 | 18.33 | 1.17 |
| パーチ、大西洋 | 0.21 | 18.62 | 1.12 |
| ひよこ豆(生) | 0.19 | 19時30分 | 0.96 |
| 卵 | 0.17 | 12.58 | 1.33 |
| 小麦粉、白 | 0.13 | 10.33 | 1.23 |
| ベーキングチョコレート、無糖 | 0.13 | 12.90 | 1.23 |
| 牛乳 | 0.08 | 3.22 | 2.34 |
| 米、白米、中粒、炊いたもの | 0.03 | 2.38 | 1.18 |
| キヌア(調理前) | 0.17 | 14.12 | 1.20 |
| 調理済みのキヌア | 0.05 | 4.40 | 1.10 |
| ジャガイモ、ラセット | 0.02 | 2.14 | 0.84 |
| タマリンド | 0.02 | 2.80 | 0.64 |
| バナナ | 0.01 | 1.03 | 0.87 |
医療用途
うつ
トリプトファンは5-ヒドロキシトリプトファン(5-HTP)に変換され、その後神経伝達物質セロトニンに変換されるため、トリプトファンまたは5-HTPの摂取は脳内のセロトニン濃度を上昇させ、うつ病の症状を改善する可能性があると考えられています。トリプトファンは、米国(1989年から2005年の間にさまざまな程度で禁止された後)および英国で、抗うつ薬、抗不安薬、睡眠補助薬として使用する栄養補助食品として市販されています。また、一部のヨーロッパ諸国では、重度のうつ病の治療薬として処方薬として販売されています。食生活を変えても血中トリプトファン濃度が変化する可能性は低いという証拠がありますが、[ 27 ] [ 28 ]精製されたトリプトファンを摂取すると脳内のセロトニン濃度が上昇しますが、トリプトファンを含む食品を摂取しても上昇しません。[ 29 ]
2001年、 5-HTPとトリプトファンのうつ病に対する効果に関するコクランレビューが発表されました。著者らは、厳密な研究のみをレビューに含め、5-HTPとトリプトファンの両方をレビューに含めました。これは、どちらもデータが限られていたためです。1966年から2000年の間に発表された、うつ病に対する5-HTPとトリプトファンに関する研究108件のうち、著者らが選定した研究の質基準を満たしたのは2件のみで、研究参加者は合計64名でした。含まれていた2件の研究において、これらの物質はプラセボよりも効果的でしたが、著者らは「決定的となるにはエビデンスの質が不十分である」と述べ、「有効性と安全性が証明されている代替抗うつ薬が存在するため、5-HTPとトリプトファンの臨床的有用性は現時点では限られている」と指摘しています。[ 30 ]気分障害および不安障害の標準治療に加えて、トリプトファンを補助療法として使用することは、科学的エビデンスによって裏付けられていません。 [ 30 ] [ 31 ]
不眠症
アメリカ睡眠医学会の2017年臨床診療ガイドラインでは、効果が低いため、不眠症の治療にトリプトファンを使用することは推奨されていません。[ 32 ]
副作用
トリプトファンサプリメントの潜在的な副作用には、吐き気、下痢、眠気、ふらつき、頭痛、口渇、視力低下、鎮静、多幸感、眼振(不随意眼球運動)などがあります。[ 33 ] [ 34 ]
相互作用
トリプトファンを栄養補助食品(錠剤など)として摂取すると、MAO阻害薬やSSRIなどの抗うつ薬、あるいは他の強力なセロトニン作動薬と併用すると、セロトニン症候群を引き起こす可能性があります。[ 34 ]トリプトファンの補給は臨床現場で十分に研究されていないため、他の薬剤との相互作用はよくわかっていません。[ 30 ]
分離
トリプトファンの単離は1901年にフレデリック・ホプキンスによって初めて報告されました。 [ 35 ]ホプキンスは加水分解カゼインからトリプトファンを回収し、600gの粗カゼインから4~8gのトリプトファンを回収しました。[ 36 ]
生合成と工業生産
トリプトファンはヒトや他の動物においてより単純な物質から合成されることはなく、トリプトファンを含むタンパク質を食事から摂取することで供給されます。植物や微生物は一般的にシキミ酸またはアントラニル酸からトリプトファンを合成します。[ 37 ]トリプトファンの生合成は、アントラニル酸とホスホリボシルピロリン酸(PRPP)の縮合から始まり、副産物としてピロリン酸が生成されます。リボース部分の環が開裂し、還元的脱炭酸反応を受けてインドール-3-グリセロールリン酸が生成され、これがインドールに変換されます。最後の段階では、トリプトファン合成酵素が インドールとアミノ酸のセリンからトリプトファンの形成を触媒します。
トリプトファンの工業生産も生合成であり、野生型または遺伝子組み換え細菌(B. amyloliquefaciens、B. subtilis、C. glutamicum、E. coliなど)を用いたセリンとインドールの発酵をベースとしています。これらの菌株は、芳香族アミノ酸の再取り込みを阻害する変異、または多重発現または過剰発現したtrpオペロンを有しています。この変換は、トリプトファン合成酵素によって触媒されます。[ 38 ] [ 39 ] [ 40 ]
社会と文化
昭和電工の汚染スキャンダル
1989年に米国で好酸球増多症・筋痛症候群(EMS)の大規模な流行が発生し、 CDCには1,500件以上の症例が報告され、少なくとも37人が死亡した。[ 41 ]予備調査で流行がトリプトファンの摂取に関連していることが明らかになった後、米国食品医薬品局(FDA)は1989年にトリプトファンサプリメントを回収し、1990年にはほとんどの一般販売を禁止した。[ 42 ] [ 43 ] [ 44 ]他の国々もこれに追随した。[ 45 ] [ 46 ]
その後の研究では、EMSは、単一の大手日本メーカーである昭和電工が供給したL-トリプトファンの特定のバッチに関連していることが示唆されました。[ 42 ] [ 47 ] [ 48 ] [ 49 ]最終的に、昭和電工のL-トリプトファンの最近のバッチに微量の不純物が混入していたことが明らかになり、これが1989年のEMS発生の原因であると考えられました。[ 42 ] [ 50 ] [ 51 ]しかし、他の証拠は、トリプトファン自体がEMSの潜在的に主要な要因である可能性があることを示唆しています。[ 52 ]前駆物質が毒性の二量体を形成するのに十分な濃度に達したという主張もあります。[ 53 ]
FDAは2001年2月にトリプトファンの販売とマーケティングに対する規制を緩和したが[ 42 ]、免除用途以外でのトリプトファンの輸入は2005年まで制限し続けた[ 54 ]。
昭和電工の工場が、後に好酸球増多症・筋痛症候群の発生原因となったL-トリプトファン汚染製品を生産するために遺伝子組み換え細菌を使用していたという事実は、「バイオテクノロジー由来製品の化学的純度の厳密な監視」の必要性を示す証拠として挙げられている。 [ 55 ]純度監視を求める人々は、非遺伝子組み換えによる汚染の可能性を無視し、バイオテクノロジーの発展を脅かす反遺伝子組み換え活動家として批判されている。[ 56 ]
七面鳥の肉と眠気の仮説
米国と英国で共通して主張されていることは、感謝祭やクリスマスの時期に見られるような七面鳥の肉の大量消費は、七面鳥に含まれる高レベルのトリプトファンのために眠気を引き起こすというものである。 [ 24 ]しかし、七面鳥のトリプトファンの量は他の肉類と同程度である。[ 23 ] [ 25 ]食後の眠気は、七面鳥と一緒に食べた他の食品、特に炭水化物によって引き起こされる可能性がある。[ 58 ]炭水化物が豊富な食事を摂取すると、インスリンの放出が誘発される。[ 59 ] [ 60 ] [ 61 ] [ 62 ]インスリンは次に、トリプトファンではなく大きな中性分岐鎖アミノ酸(BCAA)の筋肉への取り込みを刺激し、血流中のトリプトファンとBCAAの比率を増加させる。結果としてトリプトファン比率が増加すると、(BCAAと芳香族アミノ酸の両方を輸送する)大きな中性アミノ酸トランスポーターでの競合が減少し、血液脳関門を通過して脳脊髄液(CSF)へのトリプトファンの取り込みが増加します。[ 62 ] [ 63 ] [ 64 ]脳脊髄液に入ったトリプトファンは、通常の酵素経路によって縫線核でセロトニンに変換されます。 [ 60 ] [ 65 ]結果として生じたセロトニンは、松果体によって、概日リズムの重要なメディエーターであるホルモンであるメラトニンにさらに代謝されます[ 66 ]。[ 10 ]したがって、これらのデータは、「ごちそう誘発性眠気」、つまり食後眠気は、炭水化物を豊富に含む重い食事の結果である可能性があり、それが間接的に脳内のメラトニンの生成を増加させ、それによって睡眠を促進することを示唆しています。[ 59 ] [ 60 ] [ 61 ] [ 65 ]
研究
酵母のアミノ酸代謝
1912年、フェリックス・エールリッヒは、酵母が天然アミノ酸を主に二酸化炭素を分解し、アミノ基を水酸基に置換することで代謝することを実証した。この反応により、トリプトファンはトリプトホールを生成する。[ 67 ]
セロトニンの前駆体
トリプトファンは精製された形で経口投与されると脳内のセロトニン合成に影響を与え、研究のためにセロトニン濃度を変化させるために使用されています。[ 29 ]急性トリプトファン枯渇と呼ばれる技術でトリプトファンの少ないタンパク質を投与すると、脳内のセロトニン濃度が低下します。[ 68 ]この方法を用いた研究では、気分や社会行動に対するセロトニンの影響を評価し、セロトニンが攻撃性を軽減し、協調性を高めることがわかりました。[ 69 ]
サイケデリック効果
トリプトファンは、十分な高用量を投与されると、げっ歯類で頭部痙攣反応(HTR)を引き起こす。 [ 70 ] HTRは、リゼルグ酸ジエチルアミド(LSD)やシロシビンなどのセロトニン作動性幻覚剤によって誘発され、幻覚効果の行動的代理指標である。[ 71 ] [ 72 ]トリプトファンは微量アミンのトリプタミンに変換され、トリプタミンはインドールエチルアミンNメチルトランスフェラーゼ(INMT)によってNメチル化されて、セロトニン作動性幻覚剤として知られるN-メチルトリプタミン( NMT)とN、N-ジメチルトリプタミン(N、N -DMT)になる。 [ 70 ] [ 73 ] [ 74 ] [ 75 ] [ 76 ] [ 77 ]
蛍光
トリプトファンは重要な内因性蛍光プローブ(アミノ酸)であり、トリプトファン残基周辺の微小環境の性質を推定するために使用できます。折り畳まれたタンパク質の内因性蛍光発光のほとんどは、トリプトファン残基の励起によるものです。
参照
- 5-ヒドロキシトリプトファン(5-HTP)
- α-メチルトリプトファン
- アクリー・ローゼンハイム反応
- アダムキエヴィッチ反応
- 減衰器(遺伝学)
- N , N-ジメチルトリプタミン
- ホプキンス・コール反応
- セロトニン
- トリプタミン
参考文献
- ^ a b Görbitz CH, Törnroos KW, Day GM (2012). 「 Z ′ = 16のL-トリプトファンの単結晶研究」. Acta Crystallographica Section B . 68 (Pt 5): 549– 557. doi : 10.1107/S0108768112033484 . PMID 22992800 .
- ^ Dawson RM, et al. (1969). Data for Biochemical Research . Oxford: Clarendon Press. ISBN 0-19-855338-2。
- ^ 「アミノ酸とペプチドの命名法と記号法」 IUPAC-IUB生化学命名法合同委員会、1983年。2021年12月2日時点のオリジナルよりアーカイブ。 2022年10月22日閲覧。
- ^ Slominski A, Semak I, Pisarchik A, Sweatman T, Szczesniewski A, Wortsman J (2002). 「ヒトメラノーマ細胞におけるL-トリプトファンからセロトニンおよびメラトニンへの変換」 . FEBS Letters . 511 ( 1–3 ): 102–6 . Bibcode : 2002FEBSL.511..102S . doi : 10.1016/ s0014-5793 (01)03319-1 . PMID 11821057. S2CID 7820568 .
- ^ "L-トリプトファン | C11H12N2O2 - PubChem" . pubchem.ncbi.nlm.nih.gov . 2016年12月22日閲覧。
- ^ Curzon G (1987年12月31日)、Bender DA、Joseph MH、Kochen W、Steinhart H (編)、「Hopkinsとトリプトファンの発見」、トリプトファンとセロトニンの研究の進歩 1986、ベルリン、ボストン: De Gruyter、pp. XXIX– XL、doi : 10.1515/9783110854657-004、ISBN 978-3-11-085465-7、 2024年2月19日閲覧
{{citation}}: CS1 maint: ISBNによる作業パラメータ(リンク) - ^ 「IUPAC-IUB生化学命名法委員会 アミノ酸配列の1文字表記法」 . Journal of Biological Chemistry . 243 (13): 3557– 3559. 1968年7月10日. doi : 10.1016/S0021-9258(19)34176-6 .
- ^ Fernstrom JD (1983). 「脳におけるモノアミン生合成の制御における前駆体の利用可能性の役割」.生理学レビュー. 63 (2): 484– 546. doi : 10.1152/physrev.1983.63.2.484 . PMID 6132421 .
- ^ Schaechter JD, Wurtman RJ (1990). 「セロトニン放出は脳内トリプトファン濃度によって変化する」(PDF) . Brain Research . 532 ( 1– 2): 203– 10. doi : 10.1016/0006-8993(90)91761-5 . PMID 1704290. S2CID 8451316. 2020年8月9日時点のオリジナル(PDF)からアーカイブ。 2014年5月30日閲覧。
- ^ a b Wurtman RJ, Anton-Tay F (1969). 「哺乳類の松果体における神経内分泌トランスデューサー」(PDF) . Recent Progress in Hormone Research . 25 : 493– 522. doi : 10.1016/b978-0-12-571125-8.50014-4 . ISBN 978-0-12-571125-8. PMID 4391290 . 2014年5月31日時点のオリジナル(PDF)からアーカイブ。
- ^ a b c Marx W, McGuinness AJ, Rocks T, Ruusunen A, Cleminson J, Walker AJ, Gomes-da-Costa S, Lane M, Sanches M, Diaz AP, Tseng PT (2020年11月23日). 「大うつ病性障害、双極性障害、統合失調症におけるキヌレニン経路:101件の研究のメタアナリシス」. Molecular Psychiatry . 26 (8): 4158– 4178. doi : 10.1038/s41380-020-00951-9 . ISSN 1476-5578 . PMID 33230205. S2CID 227132820 .
- ^ Bartoli F, Misiak B, Callovini T, Cavaleri D, Cioni RM, Crocamo C, Savitz JB, Carrà G (2020年10月19日). 「双極性障害におけるキヌレニン経路:末梢血トリプトファンおよび関連代謝物の濃度に関するメタアナリシス」. Molecular Psychiatry . 26 (7): 3419– 3429. doi : 10.1038 / s41380-020-00913-1 . PMID 33077852. S2CID 224314102 .
- ^池田正之・辻 秀・中村 聡・市山 明・西塚 雄・早石 修 (1965). 「ニコチンアミドアデニンジヌクレオチドの生合成に関する研究. II. 哺乳類におけるトリプトファンからのニコチンアミドアデニンジヌクレオチド生合成におけるピコリン酸カルボキシラーゼの役割」 .生化学ジャーナル. 240 (3): 1395– 401. doi : 10.1016/S0021-9258(18)97589-7 . PMID 14284754 .
- ^ Palme K, Nagy F (2008). 「オーキシン合成のための新規遺伝子」 . Cell . 133 (1): 31–2 . doi : 10.1016/j.cell.2008.03.014 . PMID 18394986. S2CID 9949830 .
- ^ Ledochowski M, Widner B, Murr C, Sperner-Unterweger B, Fuchs D (2001). 「フルクトース吸収不良は血漿トリプトファンの減少と関連する」(PDF) . Scandinavian Journal of Gastroenterology . 36 (4): 367– 71. doi : 10.1080/003655201300051135 . PMID 11336160. 2016年4月19日時点のオリジナル(PDF)からアーカイブ。
- ^ Ledochowski M, Sperner-Unterweger B, Widner B, Fuchs D (1998年6月). 「フルクトース吸収不良は精神鬱病の初期症状と関連している」. European Journal of Medical Research . 3 (6): 295–8 . PMID 9620891 .
- ^ Gollnick P, Babitzke P, Antson A, Yanofsky C (2005). 「枯草菌におけるトリプトファン生合成制御の複雑性」. Annual Review of Genetics . 39 : 47–68 . doi : 10.1146/annurev.genet.39.073003.093745 . PMID 16285852 .
- ^ a b c d e f g h i Zhang LS, Davies SS (2016年4月). 「微生物による食事成分の生理活性代謝物への代謝:新たな治療介入の機会」 . Genome Med . 8 (1): 46. doi : 10.1186/s13073-016-0296-x . PMC 4840492. PMID 27102537.
Lactobacillus
属は、未同定の酵素を介してトリプトファンをインドール-3-アルデヒド(I3A)に変換する[125]。Clostridium
sporogenesは
、トリプトファンをIPAに変換する[6]。これはおそらくトリプトファンデアミナーゼを介している。…IPAは強力なヒドロキシルラジカル消去能も持つ。
表2:微生物代謝物:その合成、作用機序、および健康と疾患への影響図1:インドールとその代謝物の宿主生理と疾患に対する作用の分子メカニズム
- ^ Wikoff WR, Anfora AT, Liu J, Schultz PG, Lesley SA, Peters EC, Siuzdak G (2009年3月). 「メタボロミクス解析により、腸内細菌叢が哺乳類の血中代謝物に及ぼす大きな影響が明らかになった」 . Proc. Natl. Acad. Sci. USA . 106 (10): 3698– 3703. Bibcode : 2009PNAS..106.3698W . doi : 10.1073/pnas.0812874106 . PMC 2656143. PMID 19234110. IPAの産生は腸内細菌叢の存在に完全
に
依存しており、Clostridium sporogenesの定着によって確立できることが示さ
れた
。IPA代謝図
- ^ 「3-インドールプロピオン酸」 .ヒトメタボロームデータベース. アルバータ大学. 2018年6月12日閲覧。
- ^ Chyan YJ, Poeggeler B, Omar RA, Chain DG, Frangione B, Ghiso J, Pappolla MA (1999年7月). 「内因性メラトニン関連インドール構造であるインドール-3-プロピオン酸によるアルツハイマー病βアミロイドに対する強力な神経保護作用」 . J. Biol. Chem . 274 (31): 21937– 21942. doi : 10.1074/jbc.274.31.21937 . PMID 10419516. S2CID 6630247. [インドール-3-プロピオン酸(IPA)]は、
ヒトの血漿および脳脊髄液中に同定されているが、その機能は不明である。 ...フリーラジカル捕捉剤を用いた速度論的競合実験において、IPAのヒドロキシルラジカル消去能は、天然に存在するフリーラジカル消去剤の中で最も強力なインドールアミンであるメラトニンの能力を上回りました。他の抗酸化剤とは対照的に、IPAは酸化促進活性を持つ反応性中間体に変換されませんでした。
- ^ Institute of Medicine (2002). 「タンパク質とアミノ酸」 .エネルギー、炭水化物、食物繊維、脂肪、脂肪酸、コレステロール、タンパク質、アミノ酸の食事摂取基準. ワシントンD.C.: The National Academies Press. pp. 589– 768. doi : 10.17226/10490 . ISBN 978-0-309-08525-0。
- ^ a b Ballantyne C (2007年11月21日). 「七面鳥は眠気を催すのか?」 . Scientific American . 2013年6月6日閲覧。
- ^ a b McCue K. 「Chemistry.org: Thanksgiving, Turkey, and Tryptophan」 2007年4月4日時点のオリジナルよりアーカイブ。 2007年8月17日閲覧。
- ^ a b c Holden J. 「USDA National Nutrient Database for Standard Reference, Release 22」栄養データ研究所、農業研究局、米国農務省2009年11月29日閲覧。
- ^ Rambali B, Van Andel I, Schenk E, Wolterink G, van de Werken G, Stevenson H, Vleeming W (2002). 「[ココア添加物の喫煙依存への寄与]」(PDF) . RIVM (報告書 650270002/2002). 国立公衆衛生環境研究所 (オランダ). 2005年11月8日時点のオリジナル(PDF)からアーカイブ。
- ^ Soh NL, Walter GT (2011). 「トリプトファンとうつ病:食事療法だけで解決できるか?」Acta Neuropsychiatrica . 23 (1): 1601– 5215. doi : 10.1111/j.1601-5215.2010.00508.x . S2CID 145779393 .
- ^ Fernstrom JD (2012). 「ヒトにおけるトリプトファンの非栄養的使用に伴う影響と副作用」 . The Journal of Nutrition . 142 (12): 2236S– 2244S. doi : 10.3945/jn.111.157065 . PMID 23077193 .
- ^ a b Wurtman RJ, Hefti F, Melamed E (1980). 「神経伝達物質合成における前駆体制御」.薬理学レビュー. 32 (4): 315–35 . doi : 10.1016/S0031-6997(25)06841-3 . PMID 6115400 .
- ^ a b c Shaw K, Turner J, Del Mar C (2002). Shaw KA (編). 「うつ病に対するトリプトファンと5-ヒドロキシトリプトファン」(PDF) .コクラン・システマティック・レビュー・データベース. 2010 (1) CD003198. doi : 10.1002/14651858.CD003198 . PMID 11869656 .
- ^ Ravindran AV, da Silva TL (2013年9月). 「気分障害および不安障害に対する薬物療法への補完代替療法:系統的レビュー」. Journal of Affective Disorders . 150 (3): 707–19 . doi : 10.1016/j.jad.2013.05.042 . PMID 23769610 .
- ^ Sateia MJ, Buysse DJ, Krystal AD, Neubauer DN, Heald JL (2017年2月). 「成人の慢性不眠症の薬理学的治療に関する臨床実践ガイドライン:米国睡眠医学会臨床実践ガイドライン」. J Clin Sleep Med . 13 (2): 307– 349. doi : 10.5664/jcsm.6470 . PMC 5263087. PMID 27998379 .
- ^ Kimura T, Bier DM, Taylor CL (2012年12月). 「必須アミノ酸であるロイシンとトリプトファンに関する既存データに特に注目した、アミノ酸の上限値設定に関するワークショップの議論の要約」 . The Journal of Nutrition . 142 (12): 2245S– 2248S. doi : 10.3945/jn.112.160846 . PMID 23077196 .
- ^ a b Howland RH (2012年6月). 「うつ病に対する栄養補助食品による薬物療法」. Journal of Psychosocial Nursing and Mental Health Services . 50 (6): 13–6 . doi : 10.3928/02793695-20120508-06 . PMID 22589230 .
- ^ Hopkins FG, Cole SW (1901年12月). 「タンパク質化学への貢献:第1部 トリプシン消化によるこれまで未記載の生成物に関する予備的研究」 . The Journal of Physiology . 27 ( 4–5 ): 418– 428. doi : 10.1113 / jphysiol.1901.sp000880 . PMC 1540554. PMID 16992614 .
- ^コックス G、キング H (1930). 「L-トリプトファン」。組織シンセ。10 : 100.土井: 10.15227/orgsyn.010.0100。
- ^ Radwanski ER, Last RL (1995). 「トリプトファンの生合成と代謝:生化学および分子遺伝学」 . The Plant Cell . 7 (7): 921–34 . doi : 10.1105/tpc.7.7.921 . PMC 160888. PMID 7640526 .
- ^池田 正之 (2002). 「アミノ酸生産プロセス」.微生物によるL-アミノ酸の生産. 生化学工学・バイオテクノロジーの進歩. 第79巻. pp. 1– 35. doi : 10.1007/3-540-45989-8_1 . ISBN 978-3-540-43383-5. PMID 12523387 .
- ^ Becker J, Wittmann C (2012). 「バイオベースの化学物質、材料、燃料の生産 - 多用途細胞工場としてのCorynebacterium glutamicum」Current Opinion in Biotechnology . 23 (4): 631–40 . doi : 10.1016/j.copbio.2011.11.012 . PMID 22138494 .
- ^ Conrado RJ, Varner JD, DeLisa MP (2008). 「代謝酵素の空間的組織化のエンジニアリング:自然の相乗効果の模倣」Current Opinion in Biotechnology . 19 (5): 492–9 . doi : 10.1016/j.copbio.2008.07.006 . PMID 18725290 .
- ^ Allen J, Varga J (2014). 「好酸球増多症・筋痛症候群」. Wexler P (編). 『毒性学百科事典』(第3版). バーリントン: エルゼビア・サイエンス. ISBN 978-0-12-386455-0。
- ^ a b c d「L-トリプトファンと5-ヒドロキシ-L-トリプトファンに関する情報文書」。FU. S. 食品医薬品局、食品安全・応用栄養センター、栄養製品・表示・栄養補助食品局。2001年2月1日。2005年2月25日時点のオリジナルよりアーカイブ。 2012年2月8日閲覧。
- ^ 「L-トリプトファン:用途とリスク」 WebMD 、 2017年5月12日。 2017年6月5日閲覧。
- ^ Altman LK (1990年4月27日). 「研究により、障害と食品サプリメントメーカーとの関連性が明らかに」ニューヨーク・タイムズ.
- ^ Castot A, Bidault I, Bournerias I, Carlier P, Efthymiou ML (1991). 「L-トリプトファン含有製品による「好酸球増多症-筋肉痛」症候群。フランス地域医薬品安全性監視センターの共同評価。24症例の解析」。Thérapie . 46 ( 5): 355–65 . PMID 1754978 .
- ^ 「トリプトファンと好酸球増多症・筋肉痛症候群に関するCOT声明」(PDF)。英国食品・消費者製品・環境における化学物質の毒性に関する委員会。2004年6月。
- ^ Slutsker L, Hoesly FC, Miller L, Williams LP, Watson JC, Fleming DW (1990年7月). 「単一製造業者由来のトリプトファンへの曝露に関連する好酸球増多症・筋痛症候群」. JAMA . 264 (2): 213–7 . doi : 10.1001/jama.264.2.213 . PMID 2355442 .
- ^ Back EE, Henning KJ, Kallenbach LR, Brix KA, Gunn RA, Melius JM (1993年4月). 「ニューヨークのL-トリプトファン使用者における好酸球増多性筋痛症候群発症の危険因子」. The Journal of Rheumatology . 20 (4): 666–72 . PMID 8496862 .
- ^ Kilbourne EM, Philen RM, Kamb ML, Falk H (1996年10月). 「昭和電工が製造したトリプトファンと流行性好酸球増多症・筋痛症候群」. The Journal of Rheumatology Supplement . 46 : 81–8 , discussion 89–91. PMID 8895184 .
- ^ Mayeno AN, Lin F, Foote CS, Loegering DA, Ames MM, Hedberg CW, Gleich GJ (1990年12月). 「好酸球増多・筋痛症候群に関連する新規アミノ酸「ピークE」の特性評価」. Science . 250 (4988): 1707–8 . Bibcode : 1990Sci...250.1707M . doi : 10.1126/science.2270484 . PMID 2270484 .
- ^伊藤 潤一郎、保崎 勇、鳥越 勇、崎本 健一 (1992年1月). 「トリプトファン中のピークE物質の分解により生成される物質の同定」.食品化学毒性学. 30 (1): 71– 81. doi : 10.1016/0278-6915(92)90139-C . PMID 1544609 .
- ^ Smith MJ, Garrett RH (2005年11月). 「これまで明らかにされていなかった好酸球増多症・筋痛症候群の核心:ヒスタミン分解の低下」.炎症研究. 54 (11): 435–50 . doi : 10.1007/s00011-005-1380-7 . PMID 16307217. S2CID 7785345 .
- ^マイケル・プレデター・カールトン. 「分子生物学と遺伝子工学を実践者が解説」 . 2007年6月24日時点のオリジナルよりアーカイブ。
- ^ Allen JA, Peterson A, Sufit R, Hinchcliff ME, Mahoney JM, Wood TA, Miller FW, Whitfield ML, Varga J (2011年11月). 「L-トリプトファンに関連する流行後好酸球増多・筋痛症候群」 .関節炎・リウマチ. 63 (11): 3633–9 . doi : 10.1002/art.30514 . PMC 3848710. PMID 21702023 .
- ^ Mayeno AN, Gleich GJ (1994年9月). 「好酸球増多症・筋痛症候群とトリプトファン産生:警告の物語」. Trends in Biotechnology . 12 (9): 346–52 . doi : 10.1016/0167-7799(94)90035-3 . PMID 7765187 .
- ^ Raphals P (1990年11月). 「医学の謎はバイオテクノロジーを脅かすのか?」. Science . 250 (4981): 619. Bibcode : 1990Sci...250..619R . doi : 10.1126/science.2237411 . PMID 2237411 .
- ^ Harding N (2023年12月21日). 「クリスマス料理で睡眠が台無しになるのを防ぐ方法」 . The Telegraph . ISSN 0307-1235 . 2023年12月25日閲覧。
- ^ 「食事と気分(神経科学教授リチャード・ワートマン)(インタビュー)」 Nutrition Action Healthletter 1992年9月。
- ^ a b Lyons PM, Truswell AS (1988年3月). 「健康な成人における炭水化物食の種類がセロトニン前駆体に及ぼす影響」 .アメリカ臨床栄養学ジャーナル. 47 (3): 433–9 . doi : 10.1093/ajcn/47.3.433 . PMID 3279747 .
- ^ a b c Wurtman RJ, Wurtman JJ, Regan MM, McDermott JM, Tsay RH, Breu JJ (2003年1月). 「炭水化物またはタンパク質を豊富に含む通常の食事が血漿トリプトファンおよびチロシン比に及ぼす影響」 .アメリカ臨床栄養学誌. 77 (1): 128–32 . doi : 10.1093/ajcn/77.1.128 . PMID 12499331 .
- ^ a b Afaghi A, O'Connor H, Chow CM (2007年2月). 「高GI炭水化物食は睡眠開始時間を短縮する」 .アメリカ臨床栄養学誌. 85 (2): 426–30 . doi : 10.1093/ajcn/85.2.426 . PMID 17284739 .
- ^ a b Banks WA, Owen JB, Erickson MA (2012). 「脳内のインスリン:行き来」 .薬理学と治療学. 136 ( 1): 82– 93. doi : 10.1016/j.pharmthera.2012.07.006 . ISSN 0163-7258 . PMC 4134675. PMID 22820012 .
- ^ Pardridge WM, Oldendorf WH (1975年8月). 「血液脳関門におけるアミノ酸輸送の速度論的解析」. Biochimica et Biophysica Acta (BBA) - Biomembranes . 401 (1): 128– 36. doi : 10.1016/0005-2736(75)90347-8 . PMID 1148286 .
- ^ Maher TJ, Glaeser BS, Wurtman RJ (1984年5月). 「血漿中塩基性アミノ酸濃度および中性アミノ酸濃度と赤血球中アスパラギン酸およびグルタミン酸濃度の日内変動:食事性タンパク質摂取の影響」.アメリカ臨床栄養学誌. 39 (5): 722–9 . doi : 10.1093/ajcn/39.5.722 . PMID 6538743 .
- ^ a b Fernstrom JD, Wurtman RJ (1971). 「脳内セロトニン含有量:炭水化物摂取後の上昇」. Science . 174 ( 4013): 1023–5 . Bibcode : 1971Sci...174.1023F . doi : 10.1126/science.174.4013.1023 . PMID 5120086. S2CID 14345137 .
- ^アトゥル・クラー医学博士(2012年7月10日)「概日リズム睡眠覚醒サイクルにおけるメラトニンの役割」 Psychiatric Times 29 ( 7).
- ^ Jackson RW (1930). 「トリプトフォールの合成」(PDF) . Journal of Biological Chemistry . 88 (3): 659– 662. doi : 10.1016/S0021-9258(18)76755-0 .
- ^ Young SN (2013年9月). 「ヒトにおける急性トリプトファン枯渇:理論的、実践的、倫理的側面のレビュー」 . Journal of Psychiatry & Neuroscience . 38 (5): 294– 305. doi : 10.1503 / jpn.120209 . PMC 3756112. PMID 23428157 .
- ^ Young SN (2013). 「トリプトファン濃度の上昇と低下が人間の気分と社会行動に及ぼす影響」 .ロンドン王立協会哲学論文集. シリーズB, 生物科学. 368 ( 1615) 20110375. doi : 10.1098/rstb.2011.0375 . PMC 3638380. PMID 23440461 .
- ^ a b Halberstadt AL, Geyer MA (2018). 「幻覚剤の無条件行動への影響」.サイケデリックドラッグの行動神経生物学. Current Topics in Behavioral Neurosciences. Vol. 36. pp. 159– 199. doi : 10.1007/7854_2016_466 . ISBN 978-3-662-55878-2. PMC 5787039 . PMID 28224459 .
- ^ Canal CE, Morgan D (2012). 「幻覚剤2,5-ジメトキシ-4-ヨードアンフェタミン誘発性げっ歯類の頭部痙攣反応:包括的な歴史、メカニズムの再評価、そしてモデルとしての有用性」. Drug Test Anal . 4 ( 7–8 ): 556– 576. doi : 10.1002/dta.1333 . PMC 3722587. PMID 22517680 .
- ^コズレンコフ A、ゴンサレス=マエソ J (2013)。 「動物モデルと幻覚剤」。幻覚の神経科学。ニューヨーク州ニューヨーク: スプリンガー ニューヨーク。 pp. 253–277。土井: 10.1007/978-1-4614-4121-2_14。ISBN 978-1-4614-4120-5。
- ^ Carbonaro TM, Gatch MB (2016年9月). 「N,N-ジメチルトリプタミンの神経薬理学」 . Brain Res Bull . 126 (Pt 1): 74– 88. doi : 10.1016/j.brainresbull.2016.04.016 . PMC 5048497. PMID 27126737.内因性DMTは必須アミノ酸トリプトファンから合成され、トリプトファンは脱炭酸されてトリプタミンとなる。その後、トリプタミンはインドールエチルアミン-N-メチルトランスフェラーゼ(INMT)という酵素によってメチル基転移され(S-アデノシルメチオニンを基質として) 、
メチル基の付加が触媒され、N-メチルトリプタミン(NMT)とDMTが生成される。 NMT は、INMT 依存性 DMT 生合成の基質としても機能します (Barker et al.、1981)。
- ^ Barker SA (2018). 「内因性幻覚剤N, N-ジメチルトリプタミン(DMT):その役割と機能を明らかにするための過去、現在、そして未来の研究」 Front Neurosci . 12 536. doi : 10.3389/fnins.2018.00536 . PMC 6088236. PMID 30127713.ラットの脳でインドール-N-メチルトランスフェラーゼ(INMT;Axelrod, 1961)が発見された後、
研究者たちはすぐに、トリプトファン(2、図2)からトリプタミン(TA;3、図2)への変換が、いくつかの哺乳類種の脳やその他の組織でDMTに変換されるかどうかを調べ始めました。その後、数多くの研究により、哺乳類の組織標本においてin vitroおよびin vivoでDMTが生合成されることが実証されました(Saavedra and Axelrod, 1972; Saavedra et al., 1973)。1972年、Juan SaavedraとJulius Axelrodは、ラットの脳槽内に投与されたTAがN-メチルトリプタミン(NMT; 4、図2)とDMTに変換されることを報告しました。これは、生体内での脳組織によるDMTの生成を初めて実証した事例です。
- ^ Cameron LP, Olson DE (2018年10月). 「化学神経科学におけるダーククラシック:N, N-ジメチルトリプタミン(DMT)」(PDF) . ACS Chem Neurosci . 9 (10): 2344– 2357. doi : 10.1021/acschemneuro.8b00101 . PMID 30036036.セロトニンやメラトニンと同様に、DMTはトリプトファン代謝産物である。25
トリプトファン脱炭酸反応後、トリプタミンはN-メチルトランスフェラーゼ(INMT)によってメチル化され、S-アデノシルメチオニンがメチル基供与体となる。 2回目の酵素メチル化によりDMTが生成される(図3A)。26 [...] インドールエチルアミンN-メチルトランスフェラーゼ(INMT)酵素は、さまざまな生体アミンのメチル化を触媒し、哺乳類においてトリプタミンをDMTに変換する役割を担っている。140
- ^ Colosimo FA, Borsellino P, Krider RI, Marquez RE, Vida TA (2024年2月26日). 「ジメチルトリプタミンの臨床的可能性:精神疾患、神経変性、そして意識の向こう側への突破口」 . Psychoactives . 3 (1). MDPI AG: 93– 122. doi : 10.3390/psychoactives3010007 . ISSN 2813-1851 .
体内でのDMTの代謝は、その合成から始まります。内因性DMTは、トリプトファンが脱炭酸反応によってトリプタミンに変換された後に生成されます[22,25]。その後、トリプタミンは、S-アデノシルメチオニン(SAM)を基質としてインドールエチルアミン-N-メチルトランスフェラーゼ(INMT)によるメチル基転移反応を受けてN-メチルトリプタミン(NMT)に変換され、最終的にN,N-DMTが生成されます[26]。興味深いことに、INMTは体中に広く分布しており、主に肺、甲状腺、副腎に存在し、脊髄前角に密に存在します。大脳領域内では、鉤状核、延髄、扁桃体、前頭皮質、前頭頭頂葉、側頭葉などの領域でINMT活性が示され、主に細胞体に局在しています[26]。INMTの転写産物は、ラットとヒトの両方で、大脳皮質、松果体、脈絡叢を含む特定の脳領域に見られます。ラットの脳は、セロトニンのような既存のモノアミン神経伝達物質と同程度の濃度でDMTを合成・放出する能力があるものの[27]、DMTが真の神経伝達物質である可能性は依然として推測の域を出ません。この問題は数十年にわたって議論の的となっており[28]、ヒトの脳においてシナプス間隙における活動依存的(すなわちCa2+刺激による)DMT放出が完全に証明される必要があります。
- ^アラウージョ AM、カルヴァーリョ F、バストス Mde L、ゲデス デ ピニョ P、カルヴァーリョ M (2015 年 8 月)。 「トリプタミンの幻覚性の世界: 最新のレビュー」。アーチトキシコール。89 (8): 1151–1173。ビブコード: 2015ArTox..89.1151A。土井:10.1007/s00204-015-1513-x。PMID 25877327。
さらに読む
- Wood RM, Rilling JK, Sanfey AG, Bhagwagar Z, Rogers RD (2006年5月). 「健康な成人における反復囚人のジレンマゲームのパフォーマンスに対するトリプトファン枯渇の影響」 . Neuropsychopharmacology . 31 (5): 1075–84 . doi : 10.1038/sj.npp.1300932 . PMID 16407905 .
- Huang Y, Zhao M, Chen X, Zhang R, Le A, Hong M, Zhang Y, Jia L, Zang W, Jiang C, Wang J, Fan X, Wang J (2023年6月). 「中枢神経系疾患におけるトリプトファン代謝:病態生理と潜在的治療戦略」 . Aging Dis . 14 (3): 858– 878. doi : 10.14336/AD.2022.0916 . PMC 10187711. PMID 37191427 .
外部リンク
- 「KEGG PATHWAY:トリプトファン代謝 - ホモ・サピエンス」 KEGG:京都遺伝子ゲノム百科事典。2006年8月23日。 2008年4月20日閲覧。
- GP Moss. 「トリプトファン分解(初期段階)」 . 国際生化学・分子生物学連合命名委員会(NC-IUBMB). 2003年9月13日時点のオリジナルよりアーカイブ。 2008年4月20日閲覧。
- GP Moss. 「トリプトファン分解(後期)」 . 国際生化学・分子生物学連合命名委員会(NC-IUBMB). 2003年9月13日時点のオリジナルよりアーカイブ。 2008年4月20日閲覧。
- B. ミケルソン、DP ミケルソン (2007年11月22日). 「七面鳥は眠気を引き起こす」 .都市伝説参考ページ. Snopes.com . 2008年4月20日閲覧.




