塩化アルミニウム
 塩化アルミニウム六水和物、純粋(上)、および塩化鉄(III)が混入したもの(下) | |||
| |||
| 名前 | |||
|---|---|---|---|
| IUPAC名 塩化アルミニウム | |||
| その他の名前 塩化アルミニウム(III) 三塩化アルミニウムトリクロロアルミニウム | |||
| 識別子 | |||
| |||
3Dモデル(JSmol) | |||
| チェビ |
| ||
| ケムスパイダー |
| ||
| ECHA 情報カード | 100.028.371 | ||
| EC番号 |
| ||
| 1876 | |||
PubChem CID | |||
| RTECS番号 |
| ||
| ユニイ |
| ||
CompToxダッシュボード(EPA) | |||
| |||
| プロパティ | |||
| 塩化アルミニウム | |||
| モル質量 |
| ||
| 外観 | 無色の結晶、吸湿性 | ||
| 密度 |
| ||
| 融点 | |||
| |||
| 溶解度 |
| ||
| 蒸気圧 |
| ||
| 粘度 |
| ||
| 構造 | |||
| 単斜晶系、mS16 | |||
| C12/m1、No.12 [ 3 ] | |||
a = 0.591 nm、b = 0.591 nm、c = 1.752 nm [ 3 ] | |||
格子体積(V) | 0.52996 nm 3 | ||
数式単位(Z) | 6 | ||
| 八面体(固体)四面体(液体) | |||
| 三方平面(単量体蒸気) | |||
| 熱化学 | |||
熱容量(℃) | 91.1 J/(モル·K) [ 4 ] | ||
| 109.3 J/(モル·K) [ 4 ] | |||
標準生成エンタルピー(Δ f H ⦵ 298) | −704.2 kJ/モル[ 4 ] | ||
ギブスの自由エネルギー(Δ f G ⦵) | −628.8 kJ/モル[ 4 ] | ||
| 薬理学 | |||
| D10AX01 ( WHO ) | |||
| 危険 | |||
| GHSラベル: [ 6 ] | |||
 | |||
| 危険 | |||
| H314 | |||
| P260、P280、P301+P330+P331、P303+P361+P353、P305+P351+P338+P310、P310 | |||
| NFPA 704(ファイアダイヤモンド) | |||
| 致死量または濃度(LD、LC): | |||
LD 50(中間投与量) | 380 mg/kg、ラット(経口、無水)3311 mg/kg、ラット(経口、六水和物) | ||
| NIOSH(米国健康曝露限界): | |||
PEL(許可) | なし[ 5 ] | ||
REL(推奨) | 2 mg/m 3 [ 5 ] | ||
IDLH(差し迫った危険) | ND [ 5 ] | ||
| 関連化合物 | |||
その他の陰イオン | |||
その他の陽イオン | |||
関連するルイス酸 | |||
関連化合物 | |||
| 補足データページ | |||
| 塩化アルミニウム(データページ) | |||
特に記載がない限り、データは標準状態(25 °C [77 °F]、100 kPa)における材料のものです。 | |||
塩化アルミニウム(三塩化アルミニウムとも呼ばれる)は、化学式Al Cl 3で表される無機化合物です。 [Al(H 2 O) 6 ]Cl 3で表される六水和物を形成し、6つの水和分子を含みます。無水物と六水和物はどちらも無色の結晶ですが、試料にはしばしば塩化鉄(III)が混入し、黄色を呈します。
無水形態は商業的に重要である。融点と沸点が低い。主にアルミニウムの製造に生産・消費されるが、化学産業の他の分野でも大量に使用されている。[ 7 ]この化合物はしばしばルイス酸として引用される。これは、温和な温度でポリマーからモノマーへと可逆的に変化する無機化合物である。
構造

無水
AlCl 3 は、温度と状態(固体、液体、気体)に応じて 3 つの構造をとります。固体AlCl 3は、立方最密充填の塩化物イオンを持つシート状の層状構造です。このフレームワークでは、Al 中心が八面体配位構造を示します。[ 8 ]塩化イットリウム(III) は、他のさまざまな化合物と同様に、同じ構造をとります。三塩化アルミニウムが溶融状態にある場合、四配位アルミニウムを持つ二量体( Al 2 Cl 6点群D 2h )として存在します。この構造の変化は、液相 (1.78 g/cm 3 ) の密度が固体三塩化アルミニウム (2.48 g/cm 3 )よりも低いことに関係しています。Al 2 Cl 6二量体は気相でも見られます。高温では、Al 2 Cl 6二量体は三方平面晶系のAlCl 3単量体(点群D 3h )に解離し、これはBF 3と構造的に類似している。この溶融物は、塩化ナトリウムなどのよりイオン性の高いハロゲン化物とは異なり、電気伝導性が低い[ 9 ]。
六水和物
六水和物は、八面体状の[Al(H 2 O) 6 ] 3+陽イオン中心と、対イオンとして塩化物陰イオン(Cl −)から構成される。陽イオンと陰イオンは水素結合によって結合している。 [ 10 ] 塩化アルミニウムの水和物は八面体分子構造を有し、中心のアルミニウムイオンは6つの水配位子分子に囲まれている。配位飽和であるため、この水和物はフリーデル・クラフツアルキル化反応や関連反応 における触媒としてはあまり有用ではない。
用途
アレーンのアルキル化とアシル化
AlCl 3は、アシル化とアルキル化の両方のフリーデルクラフツ反応のための一般的なルイス酸触媒です。 [ 11 ]これらのタイプの反応は塩化アルミニウムの主な用途であり、例えば、ベンゼンとホスゲンからアントラキノン(染料産業で使用される)を製造する際に使用されます。[ 9 ]一般的なフリーデルクラフツ反応では、アシル塩化物またはアルキルハライドが芳香族系と次のように反応します。[ 11 ]
アルキル化反応はアシル化反応よりも広く用いられていますが、その実施にはより高度な技術が要求されます。どちらの反応においても、塩化アルミニウム、その他の材料、装置は乾燥している必要がありますが、反応を進行させるには微量の水分が必要です。[ 12 ]芳香族のアルキル化[ 13 ]およびアシル化[ 14 ] [ 15 ]については、詳細な手順が利用可能です。
フリーデル・クラフツ反応の一般的な問題点は、塩化アルミニウム触媒が生成物と強く錯体を形成するため、化学量論量全体が必要となる場合があることです。この複雑な状況により、大量の腐食性廃棄物が発生することがあります。こうした理由から、塩化アルミニウムの使用はゼオライトに置き換えられることが多くなっています。[ 7 ]
塩化アルミニウムは芳香族環にアルデヒド基を導入するためにも使用することができ、例えば一酸化炭素、塩化水素、塩化銅(I)を共触媒とするガッターマン・コッホ反応が挙げられる。[ 16 ]
有機および有機金属合成におけるその他の応用
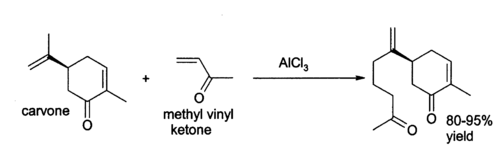
塩化アルミニウムは有機化学において様々な用途に用いられている。[ 17 ]例えば、3-ブテン-2-オン(メチルビニルケトン)のカルボンへの付加反応など、エン反応を触媒することができる。[ 18 ]
これは、様々な炭化水素のカップリングや転位を誘発するために使用されます。[ 19 ] [ 20 ]
塩化アルミニウムとアルミニウムをアレーン存在下で反応させることで、フィッシャー・ハフナー合成により、特定の金属ハロゲン化物からビス(アレーン)金属錯体(例えばビス(ベンゼン)クロム)を合成することができる。ジクロロフェニルホスフィンは、塩化アルミニウム触媒下でベンゼンと三塩化リンを反応させることで合成される。[ 21 ]
医学
| 臨床データ | |
|---|---|
| AHFS / Drugs.com | モノグラフ |
| ライセンスデータ | |
| 投与経路 | トピック |
| ATCコード |
|
| 識別子 | |
| CompToxダッシュボード(EPA) | |
| ECHA 情報カード | 100.028.371 |
| データページ | |
| 塩化アルミニウム(データページ) | |
局所用塩化アルミニウム六水和物は、多汗症(過剰な発汗)の治療に使用されます。[ 22 ] [ 23 ] [ 24 ]
反応
無水塩化アルミニウムは強力なルイス酸であり、ベンゾフェノンやメシチレンなどの弱いルイス塩基ともルイス酸塩基付加物を形成することができる。[ 11 ]塩化物イオンの存在下ではテトラクロロアルミネート([AlCl 4 ] − )を形成する。
塩化アルミニウムはテトラヒドロフラン中の水素化カルシウムおよび水素化マグネシウムと反応してテトラヒドロアルミネートを形成します。
水との反応
無水塩化アルミニウムは吸湿性があり、水との親和性が非常に強い。湿った空気中では煙を出し、液体の水と混合するとシューという音を立てる。これは、Cl -配位子がH 2 O分子に置換されて六水和物[Al(H 2 O) 6 ]Cl 3を形成するためである。この六水和物を加熱しても無水相は回復しない。代わりにHClが失われ、水酸化アルミニウムまたはアルミナ(酸化アルミニウム)が残る。
- [Al(H 2 O) 6 ]Cl 3 → Al(OH) 3 + 3 HCl + 3 H 2 O
金属アクア錯体と同様に、水性AlCl 3はアクア配位子のイオン化により酸性である。
- [Al(H 2 O) 6 ] 3+ ⇌ [Al(OH)(H 2 O) 5 ] 2+ + H +
水溶液は、水和Al 3+イオンを含む他のアルミニウム塩と同様に振舞い、希水酸化ナトリウムと反応して水酸化アルミニウムのゼラチン状の沈殿物を生成します。
- AlCl 3 + 3 NaOH → Al(OH) 3 + 3 NaCl
合成
塩化アルミニウムは、アルミニウム金属と塩素または塩化水素を650~750℃(1,202~1,382°F)の温度で発熱反応させることによって大規模に製造されています。 [ 9 ]
- 2 Al + 3 Cl 2 → 2 AlCl 3
- 2 Al + 6 HCl → 2 AlCl 3 + 3 H 2
塩化アルミニウムは、塩化銅(II)とアルミニウム の間の単一置換反応によって形成される可能性があります。
- 2 Al + 3 CuCl 2 → 2 AlCl 3 + 3 Cu
1993年に米国では、アルミニウムの生産に消費された量を除いて、約21,000トンが生産されました。[ 7 ]
水和三塩化アルミニウムは、酸化アルミニウムを塩酸に溶解することによって製造されます。金属アルミニウムも塩酸に容易に溶解し、水素ガスを放出し、かなりの熱を発生します。この固体を加熱しても無水三塩化アルミニウムは生成されず、六水和物は加熱すると水酸化アルミニウムに分解します。
- [Al(H 2 O) 6 ]Cl 3 → Al(OH) 3 + 3 HCl + 3 H 2 O
アルミニウムは低級塩化物である塩化アルミニウム(I) (AlCl)も形成しますが、これは非常に不安定で、気相でのみ存在することが知られています。[ 9 ]
自然発生
無水塩化アルミニウムは鉱物として存在しません。しかし、六水和物は希少鉱物である塩化アルミニウム鉱石として知られています。[ 25 ]より複雑で塩基性であり、水和した塩化アルミニウム鉱物はカドワラデライトです。[ 26 ] [ 25 ]
歴史
塩化アルミニウムは18世紀には、塩化アルミナ、海産ミョウバン、粘土質海塩、[ 27 ]塩化粘土として知られていました。[ 28 ]化学的に研究されたのは1830年代でした。[ 29 ]
安全性
無水AlCl3は強い腐食性があり、水と接触すると塩酸を放出します。[ 7 ]
参照
参考文献
- ^ a b c d Haynes WM編 (2011). CRC Handbook of Chemistry and Physics (92nd ed.). Boca Raton, Florida: CRC Press . p. 4.45. ISBN 1-4398-5511-0。
- ^ a b「物質の特性:塩化アルミニウム」 Chemister.ru 2007年3月19日。2014年5月5日時点のオリジナルよりアーカイブ。 2017年3月17日閲覧。
- ^ a bケテラール JA (1935)。 「ハロゲン化アルミニウムIIの結晶構造」。結晶写真の時代 – 結晶材料。90 ( 1–6 ): 237–255 .土井: 10.1524/zkri.1935.90.1.237。S2CID 100796636。
- ^ a b c d Haynes WM編 (2011). CRC Handbook of Chemistry and Physics (92nd ed.). Boca Raton, Florida: CRC Press . p. 5.5. ISBN 1-4398-5511-0。
- ^ a b c NIOSH化学物質ハザードポケットガイド。「#0024」。米国国立労働安全衛生研究所(NIOSH)。
- ^シグマアルドリッチ社、塩化アルミニウム。
- ^ a b c d Helmboldt O, Keith Hudson L, Misra C, Wefers K, Heck W, Stark H, et al. (2007). 「無機アルミニウム化合物」. Ullmann's Encyclopedia of Industrial Chemistry . Weinheim: Wiley-VCH. doi : 10.1002/14356007.a01_527.pub2 . ISBN 978-3527306732。
- ^ Wells AF (1984).構造無機化学.オックスフォード, イギリス.: オックスフォード出版. ISBN 0198553706
対照的に、
AlBr
3
はより分子的な構造を持ち、
Al
3+
中心がBr
−
イオン
の最密充填構造の隣接する四面体空孔を占めています
。 - ^ a b c d Greenwood NN , Earnshaw A (1984). 『元素の化学』オックスフォード:ペルガモン・プレス. ISBN 978-0-08-022057-4。
- ^アンドレス KR、カーペンター C (1934)。 「クリスタルハイドレート II. Die Struktur von クロムクロリドとアルミニウムクロリドヘキサハイドレート」。結晶写真の時代 – 結晶材料。87.土井:10.1524/zkri.1934.87.1.446。S2CID 263857074。
- ^ a b c Olah GA編 (1963).フリーデル・クラフツ反応と関連反応. 第1巻. ニューヨーク市: インターサイエンス.
- ^ネニチェスク CD、Cantuniari IP (1933)。 「塩化アルミニウムの触媒反応、VI. Mitteil.: メチル-シクロペンタンにおけるシクロヘキサンの評価」。Berichte der Deutschen Chemischen Gesellschaft (A および B シリーズ)。66 (8): 1097–1100 .土井: 10.1002/cber.19330660817。ISSN 1099-0682。
- ^ Reeves JT, Tan Z, Fandrick DR, Song JJ, Yee NK, Senanayake CH (2012). 「カルボン酸からのトリフルオロメチルケトンの合成:4-(3,4-ジブロモフェニル)-1,1,1-トリフルオロ-4-メチルペンタン-2-オン」 . Organic Syntheses . 89 : 210. doi : 10.15227/orgsyn.089.0210 .
- ^ Paruch K, Vyklicky L, Katz TJ (2003). 「9,10-ジメトキシフェナントレンおよび3,6-ジアセチル-9,10-ジメトキシフェナントレンの製造」.有機合成. 80 : 227. doi : 10.15227/orgsyn.080.0227 .
- ^ Seed AJ, Sonpatki V, Herbert MR (2002). 「3-(4-ブロモベンゾイル)プロパン酸」.有機合成. 79 : 204. doi : 10.15227/orgsyn.079.0204 .
- ^ Wade LG (2003).有機化学(第5版).アッパーサドルリバー、ニュージャージー州: Prentice Hall . ISBN 013033832X。
- ^ Galatsis P (1999). 「塩化アルミニウム」. Reich HJ, Rigby JH (編).酸性および塩基性試薬. 有機合成試薬ハンドブック.ニューヨーク市: Wiley . pp. 12– 15. ISBN 978-0-471-97925-8。
- ^ Snider BB (1980). 「ルイス酸触媒によるエン反応」. Acc. Chem. Res. 13 (11): 426. doi : 10.1021/ar50155a007 .
- ^ Rieke RD, Bales SE, Hudnall PM, Burns TP, Poindexter GS (1979). 「グリニャール試薬の調製のための高反応性マグネシウム:1-ノルボルナンカルボン酸」.有機合成. 59:85 . doi : 10.15227/orgsyn.059.0085 .
- ^ Shama SA, Wamser CC (1983). 「ヘキサメチルデュワーベンゼン」.有機合成. 61:62 . doi : 10.15227/orgsyn.061.0062 .
- ^ Buchner B, Lockhart Jr LB (1951). 「フェニルジクロロホスフィン」.有機合成. 31 : 88. doi : 10.15227/orgsyn.031.0088 .
- ^ McConaghy JR, Fosselman D (2018年6月). 「多汗症:治療の選択肢」. American Family Physician . 97 (11): 729– 734. PMID 30215934 .
- ^ Nawrocki S, Cha J (2019年9月). 「多汗症の病因、診断、および管理:包括的レビュー:治療の選択肢」. Journal of the American Academy of Dermatology . 81 (3): 669– 680. doi : 10.1016/j.jaad.2018.11.066 . PMID 30710603 .
- ^ 「塩化アルミニウム(局所用)(モノグラフ)」 .米国医療システム薬剤師会(ASHP) . drugs.com.
- ^ a b「鉱物一覧」 . www.ima-mineralogy.org .国際鉱物学協会. 2011年3月21日.
- ^ 「カドワラデライト」 . www.mindat.org。
- ^ de Fourcroy AF (1790). 『自然史と化学の要素:これらの科学に関する初等講義の第2版。著者によって拡充・改良。英語に翻訳され、注釈と翻訳者W. Nicholsonによる歴史的序文が付されている。
- ^ Berthollet CL (1791). 『染色芸術の要素』…ウィリアム・ハミルトン訳、スティーブン・カウチマン著。J.ジョンソン社販売。
- ^ Mather WW (1835). 「塩化アルミニウムとその分析」 . Silliman B (編).アメリカ科学誌. 第27巻. イェール大学クライン地質学研究所. pp. 241–253 (249).