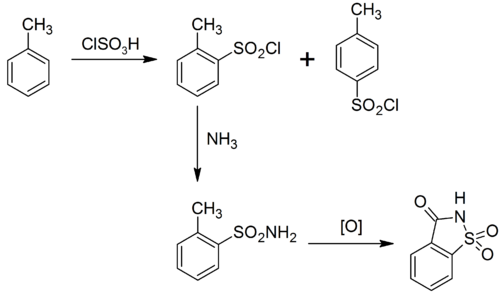サッカリン
 | |
 | |
| 名前 | |
|---|---|
| 推奨IUPAC名 1 H -1λ 6 ,2-ベンゾチアゾール-1,1,3(2 H )-トリオン | |
その他の名前
| |
| 識別子 | |
| |
3Dモデル(JSmol) | |
| チェビ | |
| チェムブル |
|
| ケムスパイダー |
|
| ECHA 情報カード | 100.001.202 |
| E番号 | E954 (艶出し剤、…) |
| ケッグ |
|
PubChem CID | |
| ユニイ |
|
CompToxダッシュボード(EPA) | |
| |
| |
| プロパティ | |
| C 7 H 5 N O 3 S | |
| モル質量 | 183.18 g·mol −1 |
| 外観 | 白色結晶固体 |
| 密度 | 0.828 g/cm 3 |
| 融点 | 228.8~229.7℃(443.8~445.5°F、501.9~502.8K) |
| 290mLあたり1g | |
| 酸性度( p Ka ) | 1.6 [ 4 ] |
特に記載がない限り、データは標準状態(25 °C [77 °F]、100 kPa)における材料のものです。 | |
サッカリンは、サッカリン、ベンゾスルフィミド、E954とも呼ばれ、サッカリンナトリウムやサッカリンカルシウムの形で使用され、非栄養性の人工甘味料です。[ 1 ] [ 5 ]サッカリンは、スクロースの約500倍の甘さを持つスルタムですが、特に高濃度では苦味や金属のような後味があります。 [ 1 ]飲料、キャンディー、焼き菓子、タバコ製品、賦形剤などの製品を甘味料として、また一部の医薬品の苦味を隠すために使用されます。[ 1 ] [ 5 ]白色の結晶で無臭です。[ 1 ]
語源
サッカリンの名称は「砂糖のような」という意味の「サッカリン」に由来します。サッカリンという言葉は比喩的に、しばしば軽蔑的な意味で用いられ、「不快なほど丁寧すぎる」または「甘すぎる」ものを表します。[ 6 ]どちらの言葉もギリシャ語で「砂利」を意味するσάκχαρον ( sakkharon )に由来します。[ 7 ]同様に、サッカロースはスクロース(砂糖) の古語です。
プロパティ

サッカリンは熱安定性がある。[ 8 ]他の食品成分と化学反応を起こさないため、保存性に優れている。サッカリンと他の甘味料の混合は、それぞれの甘味料の弱点や欠点を補うためによく使われる。サイクラメートとサッカリンを10:1の割合で混合したものは、サイクラメートとサッカリンの両方が合法である国では一般的であり、この混合ではそれぞれの甘味料が互いの異臭を隠している。サッカリンはダイエット炭酸飲料にアスパルテームと混合して使用されることが多いため、アスパルテームの比較的短い保存期間を超えて保存した場合でも、サッカリンシロップの甘味はいくらか残る。
酸性のサッカリンは水に溶けません。人工甘味料として使用されるのは、通常、ナトリウム塩です。[9] カルシウム塩も、特に食事中のナトリウム摂取量を制限している人によって使用されることがあります。どちらの塩も水溶性が高く、室温では0.67 g/mlです。[ 10 ] [ 11 ]
安全性と健康への影響
1970年代に行われた実験用ラットの研究では、高用量のサッカリンの摂取と膀胱がんの発症との関連が明らかになった。[ 12 ]しかし、その後の研究で、この影響はヒトには関係のないメカニズム(結晶の沈着;§ 歴史の項を参照)によるものであることが判明した。[ 12 ]疫学的研究では、サッカリンがヒトの膀胱がんと関連しているという証拠は示されていない。[ 12 ] [ 13 ]国際がん研究機関(IARC)は当初、ラットの研究に基づいてサッカリンをグループ2B (「ヒトに対して発がん性の可能性がある」)に分類したが、その後の研究を検討した結果、グループ3 (「ヒトに対する発がん性については分類できない」)に格下げした。[ 14 ]
サッカリンには食物エネルギーがなく、栄養価もありません。[ 15 ]糖尿病または糖尿病予備群 の人でも安全に摂取できます。[ 16 ] [ 17 ]
スルホンアミドアレルギーを持つ人はサッカリンに対してアレルギー反応を起こす可能性があるが、これは抗菌性スルホンアミドと非抗菌性スルホンアミド(サッカリンなど)との間の特異的な交差反応ではなく、アレルギー反応に対する一般的な素因によるものである可能性が示唆されている。[ 18 ] [ 19 ]
歴史

_(page_10_crop).jpg/440px-thumbnail.jpg)
サッカリンは1879年に、ジョンズ・ホプキンス大学のアイラ・レムゼンの研究室でコールタール誘導体の研究をしていた化学者コンスタンティン・ファールバーグによって初めて作られました。[ 20 ]ファールバーグはある晩に手に甘い味がすることに気づき、その日研究していた化合物である安息香酸スルフィミドと結び付けました。 [ 21 ] [ 22 ]ファールバーグとレムゼンは1879年と1880年に安息香酸スルフィミドに関する論文を発表しました。[ 10 ] [ 23 ] 1884年、当時ニューヨークで独力で研究していたファールバーグは、サッカリンと名付けたこの物質の製造方法を記載した特許を数カ国で申請しました。[ 24 ] 2年後、彼はドイツのマクデブルク郊外の工場でこの物質の生産を開始しました。ファルベルグはすぐに富を得たが、レムゼンは自分の研究室で作られた物質の功績は自分のものだと考え、ただ苛立ちを募らせた。この件についてレムゼンは「ファルベルグは悪党だ。彼と並んで自分の名前が挙がるのを聞くと吐き気がする」と述べている[ 25 ]。
サッカリンは発見後まもなく商業化されましたが、第一次世界大戦中の砂糖不足までは広く使用されることはありませんでした。サッカリンはカロリーゼロの甘味料であるため、1960年代から1970年代にかけてダイエット中の人々の間で人気が高まりました。アメリカ合衆国では、レストランでピンク色の袋に入ったサッカリンをよく見かけます。最も人気のあるブランドは「Sweet'n Low」です。
第一次世界大戦中、西インド諸島からの砂糖輸入が困難だったため、 1917年にブリティッシュ・サッカリン・カンパニーが設立され、ランカシャー州アクリントン近郊のパラゴン工場でサッカリンを生産しました。生産はロンドン商務省によって認可・管理されていました。この工場では1926年まで生産が続けられました。
政府の規制
 | このセクションの例と視点は主にアメリカ合衆国に関するものであり、この主題に関する世界的な見解を代表するものではありません。必要に応じて、( 2015年10月) |
1907年、米国食品医薬品局(FDA)は、純粋食品医薬品法に基づきサッカリンの調査を開始しました。当時FDA化学局長だったハーベイ・ワイリーは、サッカリンは価値の高い原料である砂糖を、価値の低い原料で違法に代替したものであると見なしました。ワイリーは、大統領のキャリアにも影響を及ぼす衝突の中で、セオドア・ルーズベルト大統領にこう語りました。「あのスイートコーンを食べた人は皆騙されたのです。彼は砂糖を食べていると思っていましたが、実際には全く栄養価がなく、健康に極めて有害なコールタール製品を食べていたのです。」しかし、ルーズベルト自身もサッカリンの消費者であり、激しい口論の末、ワイリーは「サッカリンが健康に有害だと言う者は馬鹿だ」と激怒して反論しました。この出来事は、ワイリーのキャリアを破滅に導いたのです。[ 26 ]
1911年、食品検査決定135号はサッカリンを含む食品は不純物が混入していると規定した。[ 27 ]しかし、1912年の食品検査決定142号はサッカリンは有害ではないと規定した。[ 28 ]
1969年、FDAによる1948年と1949年の調査ファイルが発見され、さらなる論争が巻き起こった。当初サッカリンの使用に反対する主張を展開していたこれらの調査は、サッカリンが人体に有害であるという証拠をほとんど示していないことが明らかになった。1977年、FDAは、ラットに膀胱がんを引き起こすという研究結果を受け、サッカリンの完全禁止を試みた[ 11 ] [ 29 ]。しかし、業界の広告によって煽られた国民の反対により、この禁止措置は失敗に終わり[ 29 ]、代わりに「本製品の使用は健康に有害である可能性があります。本製品には、実験動物においてがんを引き起こすことが確認されているサッカリンが含まれています」というラベル表示が義務付けられた。この義務付けは、ラットとは異なる反応を示すヒトと、通常の摂取量ではがんのリスクがないという新たな研究結果を受けて、2000年に撤廃された。[ 29 ] (下記§警告ラベルの追加と削除も参照)この甘味料はアメリカ合衆国で広く使用され続けており、現在ではスクラロースとアスパルテームに次いで3番目に人気のある人工甘味料となっている。
欧州連合では、サッカリンはE番号(添加物コード)E954でも知られています。 [ 30 ]
サッカリンの現状は、ほとんどの国で許可されており、カナダなどの国では食品添加物としての禁止が解除されました。[ 31 ]サッカリンが膀胱がんと関連しているという主張は、霊長類の実験で根拠がないことが示されました。[ 32 ](ただし、サッカリンの錠剤や袋をフランスに郵送することは禁止されています。)[ 33 ]
サッカリンは、以前はカリフォルニア州の提案65号に基づいて、がんを引き起こすことが知られている化学物質のリストに載っていましたが、2001年にリストから削除されました。[ 34 ]
警告ラベルの追加と削除
1958年、米国議会は1938年食品医薬品化粧品法をデラニー条項で改正し、食品医薬品局(FDA)に対し、「ヒトにがんを誘発する、または試験の結果、動物にがんを誘発することが判明した」物質を承認しないことを義務付けました。1970年代初頭に行われたラットを用いた実験では、サッカリンがげっ歯類の膀胱がんの発生と関連していることが示されました。その結果、サッカリンを含むすべての食品には、1977年サッカリン研究表示法の要件を満たす警告ラベルが貼付されました。[ 35 ]
しかし、2000年に警告ラベルは削除されました。科学者たちは、げっ歯類はヒトとは異なり、尿中のpH、リン酸カルシウム、タンパク質濃度が高いという独特な組み合わせを持っていることを発見したからです。 [ 36 ] [ 37 ]雄のラットに多く含まれるタンパク質の1つ以上がリン酸カルシウムおよびサッカリンと結合して微小結晶を形成し、膀胱の内壁に損傷を与えます。時間が経つにつれて、ラットの膀胱はこの損傷に反応し、損傷を修復するために細胞を過剰に生成し、腫瘍形成につながります。これはヒトでは起こらないため、膀胱がんのリスク上昇はありません。[ 38 ]
サッカリンのリストからの除外により、サッカリンを含む製品に対する警告ラベルの義務付けを撤廃する法律が制定された。[ 39 ] 2001年、米国食品医薬品局とカリフォルニア州はサッカリンに関する立場を覆し、摂取しても安全であると宣言した。[ 29 ] FDAの決定は、2000年に米国保健福祉省の国家毒性プログラムがサッカリンを発がん性物質リストから削除することを決定したことを受けて行われた。
環境保護庁(EPA)は、サッカリンとその塩を有害成分および市販化学製品のリストから正式に削除しました。2010年12月の発表で、EPAはサッカリンがもはや人体への潜在的な危険性を持つとは考えられていないと述べました。[ 40 ]
化学
準備
サッカリンは様々な方法で製造できる。[ 41 ] レムセンとファールバーグによる最初の経路はトルエンから始まり、別の経路はo-クロロトルエンから始まる。[ 42 ]トルエンをクロロスルホン酸でスルホン化すると、オルトおよびパラ置換スルホニルクロリドが得られる。オルト異性体は分離され、アンモニアでスルホンアミドに変換される。メチル置換基の酸化によりカルボン酸が得られ、これが環化してサッカリン遊離酸が得られる。[ 43 ]
1950年、オハイオ州トレドのマウミー・ケミカル社で改良された合成法が開発されました。この合成法では、メチルアントラニル酸を亜硝酸(亜硝酸ナトリウムと塩酸から)、二酸化硫黄、塩素、そしてアンモニアと順次反応させてサッカリンを生成します。[ 43 ]
特性と反応
サッカリンの遊離酸のp Kaは1.6と低い(酸性水素は窒素原子に結合している)。[ 4 ]サッカリンは、求核置換反応[ 44 ]とそれに続くガブリエル合成により、アルキルハライドから二置換アミン のみを合成するために使用することができる。[ 45 ] [ 46 ]
参照
参考文献
- ^ a b c d e「サッカリン」。PubChem、米国国立医学図書館。2023年6月13日。 2023年6月15日閲覧。
- ^ 「サッカリン(CAS:81-07-2)」メルクミリポア、2023年。 2022年8月22日閲覧。
- ^ NCERT化学パートII教科書(クラスXII用)デリー:NCERT。2021年。p.449。ISBN 978-81-7450-716-7。
- ^ a b Bell RP, Higginson WC (1949). 「アセトアルデヒド水和物の触媒脱水反応と構造がプロトン分解反応速度に及ぼす影響」 Proceedings of the Royal Society A . 197 (1049): 141– 159. Bibcode : 1949RSPSA.197..141B . doi : 10.1098/rspa.1949.0055 .
- ^ a b「サッカリン」 . Drugs.com . 2022年8月16日. 2023年6月15日閲覧。
- ^ 「サッカリン」 . Reference.com . 2007年3月3日時点のオリジナルよりアーカイブ。
- ^ 「サッカリン」 . etymonline.com . 2006年3月23日時点のオリジナルよりアーカイブ。
- ^ 「甘味料の比較」食品成分シリーズ、NCSU、2006年。 2019年1月20日時点のオリジナルよりアーカイブ。
- ^ Chattopadhyay S, Raychaudhuri U, Chakraborty R (2014年4月). 「人工甘味料 - レビュー」 . Journal of Food Science and Technology . 51 (4): 611–21 . doi : 10.1007/ s13197-011-0571-1 . PMC 3982014. PMID 24741154 .
- ^ a b Fahlberg C、レムセン I (1879)。「Über die Oxydation des Orthotoluolsulfamids」 [オルトトルエンスルファミドの酸化について]。ベルリンの Berichte der Deutschen Chemischen Gesellschaft。12 : 469–473 .土井: 10.1002/cber.187901201135。2013 年 5 月 13 日のオリジナルからアーカイブされました。
- ^ a b Priebe PM, Kauffman GB (1980). 「科学的不確実性の下での政策立案:議会と研究室におけるサッカリンをめぐる1世紀にわたる論争」Minerva . 18 (4): 556–74 . doi : 10.1007/BF01096124 . PMID 11611011 . S2CID 40526005 .
- ^ a b c「人工甘味料とがん」国立がん研究所2005年8月18日. 2015年12月8日時点のオリジナルよりアーカイブ。
- ^ Weihrauch MR, Diehl V (2004年10月). 「人工甘味料は発がんリスクを伴うのか?」 Annals of Oncology . 15 (10): 1460–5 . doi : 10.1093/annonc/mdh256 . PMID 15367404 .
- ^ 「サッカリン:FDA機関」ミネソタ大学、環境健康科学。2016年2月27日時点のオリジナルよりアーカイブ。
- ^ 「Common Terms: S–Z」 .米国糖尿病協会. 2015年11月28日時点のオリジナルよりアーカイブ。
- ^ 「低カロリー甘味料:最新情報」アメリカ糖尿病協会。2016年3月4日時点のオリジナルよりアーカイブ。
- ^ 「人工甘味料は糖尿病患者にとって安全か?」クリーブランド・クリニックの健康必需品。クリーブランド・クリニック。2015年6月29日。2016年10月2日時点のオリジナルよりアーカイブ。
- ^ Strom, Brian L.; Schinnar, Rita; Apter, Andrea J.; Margolis, David J.; Lautenbach, Ebbing; Hennessy, Sean; Bilker, Warren B.; Pettitt, Dan (2003). 「スルホンアミド系抗生物質とスルホンアミド系非抗生物質間の交差反応性の欠如」 . New England Journal of Medicine . 349 (17): 1628– 1635. doi : 10.1056/nejmoa022963 . PMID 14573734 .
- ^ Giles, Amber; Foushee, Jaime; Lantz, Evan; Gumina, Giuseppe (2019). 「スルホンアミドアレルギー」 . Pharmacy . 7 (3): 132. doi : 10.3390/pharmacy7030132 . PMC 6789825. PMID 31514363 .
- ^ (以下で論じるように、この発見に対するファルベルグとレムゼンの相対的な貢献は後に争われ、最終的な解決は見通せないままであった。1879年にこの発見を発表した論文には両者の名前が著者として挙げられており、ファルベルグの名前が先頭となっている。)
- ^ファルバーグがサッカリンの甘味を発見した経緯については、 Anon(1886年7月17日)「サッカリンの発明者」に掲載されています。Scientific American . new series. 60 (3): 36. 2017年3月14日時点のオリジナルよりアーカイブ。
- ^マイヤーズRL、マイヤーズRL(2007年)『最も重要な化学物質100選:リファレンスガイド』ウェストポート、コネチカット州:グリーンウッド・プレス、p.241。ISBN 978-0-313-33758-1。
- ^ Remsen I, Fahlberg C (1880年2月). 「芳香族炭化水素の置換生成物の酸化について. IV. オルトトルエンスルファミドの酸化について」 . American Chemical Journal . 1 (6): 426– 439. 2021年2月24日時点のオリジナルよりアーカイブ。 2022年2月24日閲覧。430~431ページより:
- 「それは『非常に際立った甘味があり、サトウキビ糖よりもはるかに甘い』。その味は完全に純粋である。舌先にほとんど目に見えないほどの少量の粉末を載せるだけで、口腔全体に心地よい甘味が広がる。前述の通り、この物質は冷水にはほとんど溶けないが、この冷水溶液を数滴、普通のゴブレットの水に垂らすと、水は極めて甘いシロップのような味になる。したがって、最も薄い溶液であっても、味覚によって容易にその存在を検知できる。」
- ^ US 319082、Fahlberg, C. & List, A.、「サッカリン化合物の製造」
- ^ Getman FH (1940). The Life of Ira Remsen . Easton, Pennsylvania: Journal of Chemical Education. p. 66. OCLC 2640159 . OL 6411359M .
- ^ 「砂糖:警告の物語」 FDA.gov 2010年4月28日時点のオリジナルよりアーカイブ。 2010年6月20日閲覧。
- ^ Dunn CW (1913).連邦、州、および準州の純食品および医薬品法参考マニュアル: Dunn's Pure Food and Drug Legal Manual . p. 1327. 2017年3月13日時点のオリジナルよりアーカイブ。
- ^ 「Monthly Bulletin」カリフォルニア州保健局、1921年、p. 21。2017年3月14日時点のオリジナルよりアーカイブ。
- ^ a b c d Conis E (2010年12月27日). 「サッカリンの支持者の多くは甘い」 .ロサンゼルス・タイムズ. 2011年2月17日時点のオリジナルよりアーカイブ。2011年1月14日閲覧。
- ^ 「承認添加物とE番号|食品基準庁」www.food.gov.uk . 2024年5月2日閲覧。
- ^ 「カナダでサッカリンが食品への使用を許可」 AgCanada.comカナダ保健省2021年5月15日時点のオリジナルよりアーカイブ。2022年2月24日閲覧。
- ^ Takayama S, Sieber SM, Adamson RH, Thorgeirsson UP, Dalgard DW, Arnold LL, et al. (1998年1月). 「非ヒト霊長類へのサッカリンナトリウムの長期投与:尿路がんへの影響」 . Journal of the National Cancer Institute . 90 (1): 19– 25. doi : 10.1093/jnci/90.1.19 . PMID 9428778 .
- ^ 「USPS郵送条件」。2013年4月4日時点のオリジナルよりアーカイブ。2013年4月7日閲覧。
- ^ Sun M (2015年12月28日). 「サッカリンは2001年4月6日付けで、州が発がん性物質として認める物質リストから削除されました」CA.gov . 2011年3月10日時点のオリジナルよりアーカイブ。
- ^ 「サッカリンの警告」 Associated Press via Telegraph-Herald. 1973年5月22日. 2021年12月23日時点のオリジナルよりアーカイブ。 2011年6月9日閲覧。
- ^ Whysner J, Williams GM (1996). 「サッカリンの作用機序データとリスク評価:尿成分、細胞増殖促進、および腫瘍プロモーション」. Pharmacology & Therapeutics . 71 ( 1– 2): 225– 52. doi : 10.1016/0163-7258(96)00069-1 . PMID 8910956 .
- ^ Dybing E (2002年12月). 「化学発がん物質の作用機序を評価するためのIPCS概念枠組みの開発と実装」. Toxicology . 181–182 : 121–5 . Bibcode : 2002Toxgy.181..121D . doi : 10.1016/S0300-483X(02)00266-4 . PMID 12505296 .
- ^ 「発がん性物質に関する報告書 第13版 付録B」(PDF)。米国国立毒性学プログラム(NTP)。2 ~ 4ページ。2016年5月20日時点のオリジナルからアーカイブ(PDF) 。「サッカリン索引ページ」からリンクされています。米国国立毒性学プログラム(NTP)。2014年11月18日。2016年3月7日時点のオリジナルよりアーカイブ。 2016年2月29日閲覧。
- ^ 「人工甘味料とがん」国立がん研究所、2009年8月5日。2015年12月8日時点のオリジナルよりアーカイブ。 2016年2月29日閲覧。
- ^ 「EPA、サッカリンを有害物質リストから削除」 2010年12月14日. 2010年12月24日時点のオリジナルよりアーカイブ。 2011年1月14日閲覧。
- ^ Ager DJ, Pantaleone DP, Henderson SA, Katritzky AR , Prakash I, Walters DE (1998). 「市販の合成非栄養甘味料」. Angewandte Chemie International Edition . 37 ( 13– 24): 1802– 1823. doi : 10.1002/(SICI)1521-3773(19980803)37:13/14<1802::AID-ANIE1802>3.0.CO;2-9 .
- ^ブンガード G (1967). 「Die Süßstoffe」[甘味料]。Der Deutscher Apotheker。19:150
- ^ a b Lipinski GW. 「甘味料」. Ullmann's Encyclopedia of Industrial Chemistry . Weinheim: Wiley-VCH. doi : 10.1002/14356007.a26_023 . ISBN 978-3-527-30673-2。
- ^ Jaroentomeechai T, Yingsukkamol PK, Phurat C, Somsook E, Osotchan T, Ervithayasuporn V (2012年11月). 「窒素求核剤誘起ケージ転位シルセスキオキサンの合成と反応性」.無機化学. 51 (22): 12266–72 . doi : 10.1021/ic3015145 . PMID 23134535 .
- ^ Ragnarsson U, Grehn L (2002年5月). 「新規ガブリエル試薬」. Accounts of Chemical Research . 24 (10): 285– 289. doi : 10.1021/ar00010a001 .
- ^菅沢誠・阿部憲一 (1952). 「第二級アミンの新製法. I. 脂肪族第二級アミンの合成」 .薬学雑誌. 72 (2): 270– 273. doi : 10.1248/yakushi1947.72.2_270 . 2017年10月3日時点のオリジナルよりアーカイブ。
外部リンク
 ウィキメディア・コモンズのサッカリン関連メディア
ウィキメディア・コモンズのサッカリン関連メディア