ゲムシタビン
 | |
 | |
| 臨床データ | |
|---|---|
| 発音 | / dʒ ɛ m ˈ s aɪ t ə b iː n / |
| 商号 | ジェムザール、その他[ 1 ] |
| その他の名前 | 2', 2'-ジフルオロ2'デオキシシチジン、dFdC |
| AHFS / Drugs.com | モノグラフ |
| 妊娠カテゴリー |
|
| 投与経路 | 静脈内 |
| ATCコード | |
| 法的地位 | |
| 法的地位 | |
| 薬物動態データ | |
| タンパク質結合 | 10%未満 |
| 消失半減期 | 短時間注入:32~94分長時間注入:245~638分 |
| 識別子 | |
| |
| CAS番号 |
|
| PubChem CID | |
| IUPHAR/BPS | |
| ドラッグバンク |
|
| ケムスパイダー |
|
| ユニイ | |
| ケッグ |
|
| チェビ |
|
| チェムブル |
|
| CompToxダッシュボード(EPA) | |
| ECHA 情報カード | 100.124.343 |
| 化学および物理データ | |
| 式 | C 9 H 11 F 2 N 3 O 4 |
| モル質量 | 263.201 g·mol −1 |
| 3Dモデル(JSmol) | |
| |
| |
| (確認する) | |
ゲムシタビンは、ジェムザールなどのブランド名で販売されており、[ 1 ]癌の治療に使用される化学療法薬です。[ 3 ]精巣癌、[ 4 ]乳癌、卵巣癌、非小細胞肺癌、膵臓癌、膀胱癌の治療に使用されます。[ 3 ] [ 5 ]静脈内注入で投与されます。[ 3 ]腫瘍の成長を抑制し、インターフェロンシグナル伝達のアップレギュレーションを介して、E型肝炎の原因物質であるオルソヘペウイルスAの複製を阻害します。[ 6 ]
一般的な副作用には、骨髄抑制、肝臓や腎臓の問題、吐き気、発熱、発疹、息切れ、口内炎、下痢、神経障害、脱毛などがあります。[ 3 ]妊娠中に使用すると胎児に悪影響を与える可能性があります。[ 3 ]ゲムシタビンはヌクレオシドアナログ系の薬剤です。[ 3 ]新しいDNAの生成を阻害することで細胞死を引き起こします。[ 3 ]
ゲムシタビンは1983年に特許を取得し、1995年に医療用として承認されました。[ 7 ]ジェネリック版は2009年に欧州で、2010年に米国で導入されました。 [ 8 ] [ 9 ] WHOの必須医薬品モデルリストに掲載されています。[ 10 ]
医療用途
ゲムシタビンは様々な癌腫の治療に用いられます。膵臓癌では単独で第一選択治療として、進行性または転移性膀胱癌および進行性または転移性非小細胞肺癌ではシスプラチンとの併用療法として用いられます。卵巣癌ではカルボプラチンとの併用療法として、転移性または外科的切除不能な乳癌ではパクリタキセルとの併用療法として第二選択治療として用いられます。 [ 11 ] [ 12 ] [ 13 ]
胆管癌[ 14 ]やその他の胆道癌の治療に適応外使用されている。[ 15 ]
禁忌および相互作用
ゲムシタビンの服用は、男女ともに妊孕性、性生活、月経に影響を及ぼす可能性があります。ゲムシタビンを服用している女性は妊娠してはいけません。また、妊娠中および授乳中の女性は服用しないでください。[ 16 ]
2014年時点では薬物相互作用は研究されていなかった。[ 12 ] [ 11 ]
副作用
ゲムシタビンは、分裂中の細胞を殺すことで作用する化学療法薬です。 [ 11 ]がん細胞は急速に分裂するため、ゲムシタビンはより高い割合でがん細胞を標的としますが、皮膚、頭皮、胃の内壁、骨髄などの多くの重要な細胞も急速に分裂するため、副作用が生じます。[ 17 ] : 265
ゲムシタビンの添付文書には、骨髄機能を抑制し、白血球、血小板、赤血球の減少を引き起こす可能性があること、また肝臓、腎臓、または心血管疾患のある人は慎重に使用する必要があることなどの警告が記載されています。ゲムシタビンを服用している人は生ワクチンを接種してはいけません。また、警告ラベルには、可逆性後頭葉脳症症候群、毛細血管漏出症候群、肺水腫、肺炎、成人呼吸窮迫症候群などの重篤な肺疾患を引き起こす可能性があること、そして精子に悪影響を与える可能性があることも記載されています。[ 11 ] [ 18 ]
使用者の10%以上に、呼吸困難、白血球と赤血球の減少、血小板数の減少、嘔吐と吐き気、トランスアミナーゼの上昇、発疹や皮膚のかゆみ、脱毛、尿中の血液とタンパク質、インフルエンザ様症状、浮腫などの副作用が現れる。[ 11 ] [ 16 ]
一般的な副作用(使用者の1~10%に発生)には、発熱、食欲不振、頭痛、睡眠障害、疲労感、咳、鼻水、下痢、口内炎や唇の痛み、発汗、背中の痛み、筋肉痛などがあります。[ 11 ]
血栓性血小板減少性紫斑病(TTP)は、ゲムシタビンを含む特定の化学療法薬に関連する、まれではあるものの深刻な副作用です。TTPは血液疾患であり、微小血管性溶血性貧血(MAHA)、神経学的異常、発熱、腎疾患を引き起こす可能性があります。[ 19 ]
薬理学
ゲムシタビンは親水性であるため、ヌクレオシド分子トランスポーター(ゲムシタビンの最も一般的なトランスポーターはSLC29A1、SLC28A1、およびSLC28A3)を介して細胞内に輸送される必要がある。 [ 20 ] [ 21 ]細胞内に入った後、ゲムシタビンはまずリン酸基が付加されて修飾され、ゲムシタビン一リン酸(dFdCMP)となる。[ 20 ] [ 21 ]これは、デオキシシチジンキナーゼ(DCK)という酵素によって触媒される律速段階である。 [ 20 ] [ 21 ]さらに2つのリン酸基が別の酵素によって付加される。3つのリン酸基が付加された後、ゲムシタビンは最終的にゲムシタビン三リン酸(dFdCTP)として薬理学的に活性となる。[ 20 ] [ 22 ]
ゲムシタビンは3回リン酸化されるとデオキシシチジン三リン酸として偽装し、細胞複製時に合成される新しいDNA鎖に組み込まれる。[ 3 ] [ 20 ] [ 21 ]
ゲムシタビンがDNAに取り込まれると、その隣には天然の、つまり正常なヌクレオシド塩基が付加されます。これは「マスクされた連鎖終結」を引き起こします。これは、ゲムシタビン自体が「欠陥のある」塩基であるにもかかわらず、隣接する天然のヌクレオシドの存在により、細胞の通常の修復システム(塩基除去修復)を回避してしまうためです。このように、ゲムシタビンが細胞のDNAに取り込まれると、修復不可能なエラーが発生し、DNA合成が阻害され、結果として細胞死に至ります。[ 3 ] [ 20 ] [ 21 ]
2つのリン酸基が結合したゲムシタビン(dFdCDP)にも活性があり、 DNAのヌクレオチド合成に必要なリボヌクレオチド還元酵素(RNR)を阻害します。ヌクレオチドの不足により、細胞はヌクレオチド合成に必要な成分を細胞外からより多く取り込もうとするため、ゲムシタビンの取り込みも増加します。[ 3 ] [ 20 ] [ 21 ] [ 23 ]
化学
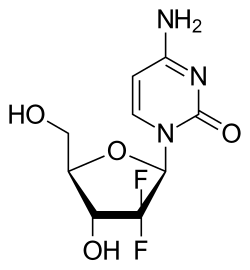
ゲムシタビンは合成ピリミジンヌクレオシドプロドラッグであり、デオキシシチジンの2'炭素上の水素原子がフッ素原子に置換されたヌクレオシド類似体である。[ 3 ] [ 24 ] [ 25 ]
以下に説明および写真で示す合成法は、イーライリリー社の研究所で行われたオリジナルの合成法です。合成は、D-マンニトールから2~7段階で合成できる、光学的に純粋なD-グリセルアルデヒド(R)-2を出発物質として開始します。次に、ブロモジフルオロ酢酸エチルを用いた「ビルディングブロック」アプローチによりフッ素を導入します。その後、標準条件下でリフォルマツキー反応を行うと、3:1のアンチ/シンジアステレオマー混合物が得られ、主生成物は1つです。ジアステレオマーの分離はHPLCで行われ、65%の収率でアンチ-3ゲムシタビンが得られます。[ 24 ] [ 25 ]少なくとも2つの他の完全合成法も、異なるグループによって開発されています。[ 25 ]

歴史
ゲムシタビンは、1980年代初頭にイーライリリー社のラリー・ハーテル研究室で初めて合成されました。抗ウイルス薬として開発されましたが、前臨床試験では試験管内で白血病細胞を死滅させることが示されました。[ 26 ]
1990年代初頭、ゲムシタビンは臨床試験で研究されました。膵臓がんの臨床試験では、ゲムシタビンが1年生存率を有意に向上させることが明らかになり、1995年に英国で承認されました[ 11 ]。また、1996年にはFDA(米国食品医薬品局)によって膵臓がんの治療薬として承認されました[ 5 ]。1998年には、ゲムシタビンは非小細胞肺がんの治療薬としてFDAの承認を受け、2004年には転移性乳がんの治療薬として承認されました[ 5 ] 。
欧州のラベルは2008年にEMAによって統一されました。[ 27 ]
2008年までに、リリーのゲムシタビンの全世界での売上高は約17億ドルでした。その時点で、米国特許は2013年に、欧州特許は2009年に失効する予定でした。[ 28 ]欧州で最初のジェネリックが2009年に発売され、[ 8 ]米国で特許に関する異議申し立てが行われ、その結果、リリーの重要な医薬品の製造方法に関する特許が無効になりました。[ 29 ] [ 30 ]ジェネリック企業は、化学物質自体の特許が失効した2010年に米国でこの薬の販売を開始しました。[ 30 ] [ 9 ]中国での特許訴訟は同国で注目を集め、2010年に解決しました。[ 31 ]
社会と文化
2017 年の時点で、ゲムシタビンは世界中で多くのブランド名で販売されています。アビン、アコジェム、アシタビン、アントリル、アクシゲム、ベンダシタビン、バイオジェム、ボリゲム、セルザール、シテジン、サイトジェム、サイトジェム、ダプラックス、DBL、デモザール、デルシン、エムシタブ、エネカムブ、エリオゲム、フォティネックス、ゲビナ、ゲマラータ、ゲンビン、ゲンビネ、ゲンビオ、ゲムセル、ゲムセチン、ゲムシビン、ゲムシカル、ゲムシペン、ゲムシレッド、ゲムシレナ、ゲムシット、ゲムシタビン、ゲムシタビナ、ゲムシタビン、ゲムシタビナム、ゲムシタン、ゲメダック、ゲムフロール、ジェムフル、ゲミタ、ジェムコ、ジェムリキッド、ジェムミス、ジェムニル、ジェムパワー、ゲムソル、ゲムスタッド、ゲムスタダ、ゲムタビン、ゲムタヴィス、ゲムタズ、ゲムテロ、ゲムトラ、ゲムトロ、ゲヴィク、ゲムシット、ジェムザール、ゲンタビム、ゲヌテン、ゲンビル、ゲロアム、ゲストレドス、ゲタノサン、ゲトミシ、ゲズト、ギトラビン、グラマゲン、ハクサニット、ジェムタ、カルベザール、メディゲム、メディタビン、ナビゲム、ナリアン、オンコジェム、オンコリル、パミジェノ、リボザール、サンタビン、シタゲム、シンタビン、ユー・ジエ、ゼ・フェイ、ゼフェイ。[ 1 ]
研究
臨床的に価値があり、静脈内または膀胱内に投与した場合にのみ有効であるため、経口投与できるように処方する方法が研究の対象となっている。[ 32 ] [ 33 ] [ 34 ]
薬理ゲノム学と薬理遺伝学の研究が進行中です。2014年の時点では、遺伝子検査が投与量の決定に役立つかどうかや、ゲムシタビンに最もよく反応する人は誰かについては明らかではありませんでした。[ 20 ]しかし、ゲムシタビンを細胞内に輸送するために使用されるタンパク質(SLC29A1、SLC29A2、SLC28A1、およびSLC28A3)の発現の多様性が、ゲムシタビンの効力の多様性につながるようです。同様に、ゲムシタビンの不活性化につながるタンパク質(デオキシシチジンデアミナーゼ、シチジンデアミナーゼ、およびNT5C)を発現する遺伝子と、その他の細胞内標的(RRM1 、RRM2、およびRRM2B)を発現する遺伝子が、薬剤への反応の多様性につながります。[ 20 ]膵臓がんの変異自体がゲムシタビンへの反応をどのように決定するかを理解するための研究も進行中です。[ 35 ]
これは、先進国では珍しいが発展途上国では珍しくない、エイズ患者によく見られる癌であるカポジ肉腫の治療薬として研究されてきた。 [ 36 ]
参考文献
- ^ a b c「Gemcitabine International Brands」 . Drugs.com. 2014年5月25日時点のオリジナルよりアーカイブ。2017年5月6日閲覧。
- ^ 「ジェムザール製品情報」カナダ保健省、2015年3月11日。 2025年2月17日閲覧。
- ^ a b c d e f g h i j k「塩酸ゲムシタビン」。米国医療システム薬剤師会。2017年2月2日時点のオリジナルよりアーカイブ。 2016年12月8日閲覧。
- ^ 「医薬品集/医薬品/ゲムシタビン - プロバイダーモノグラフ」 Cancer Care Ontario . 2020年12月6日閲覧。
- ^ a b c「FDAによる塩酸ゲムシタビンの承認」国立がん研究所2006年10月5日. 2017年4月5日時点のオリジナルよりアーカイブ。 2017年4月22日閲覧。
- ^ Li Y, Li P, Li Y, Zhang R, Yu P, Ma Z, 他 (2020年12月). 「薬物スクリーニングにより、STAT1リン酸化の活性化を介してインターフェロン様反応を誘導し、E型肝炎ウイルスを抑制するゲムシタビンが同定された」 . Antiviral Research . 184 104967. doi : 10.1016/j.antiviral.2020.104967 . hdl : 1765/133780 . PMID 33137361 .
{{cite journal}}: CS1 メンテナンス: 上書き設定 (リンク) - ^ Fischer J, Ganellin CR (2006).アナログベースの創薬. John Wiley & Sons. p. 511. ISBN 9783527607495。
- ^ a b Myers C (2009年3月13日). 「アクタビス社のゲムシタビン、特許満了に伴いEU市場で発売」FierceBiotech . 2017年9月11日時点のオリジナルよりアーカイブ。
- ^ a b「プレスリリース:ホスピラ社、注射用塩酸ゲムシタビン2グラムバイアルを発売」 Hospira via News-Medical.Net. 2010年11月16日。2015年10月2日時点のオリジナルよりアーカイブ。
- ^世界保健機関(2023).必須医薬品の選択と使用 2023: ウェブ付録A: 世界保健機関必須医薬品モデルリスト: 第23次リスト (2023) . ジュネーブ: 世界保健機関. hdl : 10665/371090 . WHO/MHP/HPS/EML/2023.02.
- ^ a b c d e f g「UK label」 . UK Electronic Medicines Compendium. 2014年6月5日. 2017年7月10日時点のオリジナルよりアーカイブ。 2017年5月6日閲覧。
- ^ a b「US formLabel」(PDF) FDA、2014年6月。2017年2月16日時点のオリジナルよりアーカイブ(PDF) 。 2017年5月6日閲覧。ラベルの更新については、FDAのNDA 020509のインデックスページを参照してください。2017年4月29日にWayback Machineにアーカイブされています。
- ^ Zhang XW, Ma YX, Sun Y, Cao YB, Li Q, Xu CA (2017年6月). 「局所進行または転移性膵臓癌の第一選択治療におけるゲムシタビンと二次細胞傷害性薬剤の併用:系統的レビューとメタアナリシス」. Targeted Oncology . 12 (3): 309– 321. doi : 10.1007/s11523-017-0486-5 . PMID 28353074. S2CID 3833614 .
- ^ Plentz RR, Malek NP (2016年12月). 「胆管癌の全身療法」 .内臓医学. 32 (6): 427– 430. doi : 10.1159/000453084 . PMC 5290432. PMID 28229078 .
- ^ Jain A, Kwong LN, Javle M (2016年11月). 「胆道がんのゲノムプロファイリングと臨床実践への示唆」. Current Treatment Options in Oncology . 17 (11) 58. doi : 10.1007/ s11864-016-0432-2 . PMID 27658789. S2CID 25477593 .
- ^ a b「ゲムシタビン」。マクミランがんサポート。2017年3月25日時点のオリジナルよりアーカイブ。 2017年5月6日閲覧。
- ^レイチェル・エアリー (2009).癌化学療法. ワイリー・ブラックウェル. ISBN 978-0-470-09254-5。
- ^ Siddall E, Khatri M, Radhakrishnan J (2017年7月). 「毛細血管漏出症候群:病因、病態生理、および管理」 . Kidney International . 92 (1): 37– 46. doi : 10.1016/j.kint.2016.11.029 . PMID 28318633 .
- ^ Kasi PM (2011年1月). 「血栓性血小板減少性紫斑病とゲムシタビン」 . Case Reports in Oncology . 4 (1): 143– 148. doi : 10.1159/000326801 . PMC 3114619. PMID 21691573 .
- ^ a b c d e f g h i Alvarellos ML、Lamba J、Sangkuhl K、Thorn CF、Wang L、Klein DJ、他。 (2014年11月)。「PharmGKB の概要: ゲムシタビン経路」。薬理遺伝学とゲノミクス。24 (11): 564–574 .土井: 10.1097/fpc.0000000000000086。PMC 4189987。PMID 25162786。
{{cite journal}}: CS1 メンテナンス: 上書き設定 (リンク) - ^ a b c d e f Mini E, Nobili S, Caciagli B, Landini I, Mazzei T (2006年5月). 「ゲムシタビンの細胞薬理学」 Annals of Oncology . 17 (Suppl 5): v7-12. doi : 10.1093/annonc/mdj941 . PMID 16807468 .
- ^ Fatima, M., Iqbal Ahmed, MM, Batool, F., Riaz, A., Ali, M., Munch-Petersen, B., & Mutahir, Z. (2019). ショウジョウバエ由来の組換えデオキシリボヌクレオシドキナーゼは、がん細胞を標的としたゲムシタビンをベースとした遺伝子・化学療法の併用療法を改善する可能性がある。ボスニア基礎医学ジャーナル、19(4), 342-349. https://doi.org/10.17305/bjbms.2019.4136
- ^ Cerqueira NM, Fernandes PA, Ramos MJ (2007). 「ゲムシタビンによるリボヌクレオチド還元酵素の不活性化の理解」. Chemistry: A European Journal . 13 (30): 8507– 8515. Bibcode : 2007ChEuJ..13.8507C . doi : 10.1002/chem.200700260 . PMID 17636467 .
- ^ a b Brown K, Weymouth-Wilson A, Linclau B (2015年4月). 「ゲムシタビンの線形合成」 .炭水化物研究. 406 : 71–75 . doi : 10.1016/j.carres.2015.01.001 . PMID 25681996 .
- ^ a b c Brown K, Dixey M, Weymouth-Wilson A, Linclau B (2014年3月). 「ゲムシタビンの合成」 .炭水化物研究. 387 : 59–73 . doi : 10.1016/j.carres.2014.01.024 . PMID 24636495 .
- ^スニーダー、ウォルター(2005年)『創薬の歴史』ニューヨーク:ワイリー、259頁。ISBN 978-0-471-89979-2。
- ^ 「Gemzar」 . 欧州医薬品庁. 2008年9月24日. 2017年9月11日時点のオリジナルよりアーカイブ。
- ^ Myers C (2009年8月18日). 「リリーの抗がん剤ジェムザールの特許が無効に」 FiercePharma . 2017年9月11日時点のオリジナルよりアーカイブ。
- ^ Holman CM (2011年夏). 「特許法における予測不可能性とその医薬品イノベーションへの影響」(PDF) .ミズーリ・ロー・レビュー. 76 (3): 645– 693. 2017年9月11日時点のオリジナル(PDF)からアーカイブ。 2017年5月6日閲覧。
- ^ a b Ravicher DB (2010年7月28日). 「ジェネリック医薬品ジェムザールの特許をめぐる争いについて」 . Seeking Alpha . 2012年12月9日時点のオリジナルよりアーカイブ。
- ^ Wang MH, Alexandre D (2015). 「中国における医薬品特許侵害事件の分析」飯村 剛, Wang MH, Voit TJ, Rader RR (編).知的財産権に関する法、政治、そして収益の抽出ケンブリッジ・スカラーズ・パブリッシング. p. 119. ISBN 9781443879262. 2017年9月11日時点のオリジナルよりアーカイブ。
- ^ Dyawanapelly S, Kumar A, Chourasia MK (2017). 「ゲムシタビンから学んだ教訓:治療用薬物キャリアシステムとゲムシタビンの薬物結合体のがん治療への影響」.治療用薬物キャリアシステムの批評的レビュー. 34 (1): 63– 96. doi : 10.1615/CritRevTherDrugCarrierSyst.2017017912 . PMID 28322141 .
- ^ Birhanu G, Javar HA, Seyedjafari E, Zandi-Karimi A (2017年4月). 「膵臓がん治療におけるゲムシタビン送達のためのナノテクノロジー」. Biomedicine & Pharmacotherapy . 88 : 635–643 . doi : 10.1016/j.biopha.2017.01.071 . PMID 28142120 .
- ^ Dubey RD, Saneja A, Gupta PK, Gupta PN (2016年10月). 「ゲムシタビンの治療効果向上に向けた薬物送達戦略の最近の進歩」. European Journal of Pharmaceutical Sciences . 93 : 147–162 . doi : 10.1016/j.ejps.2016.08.021 . PMID 27531553 .
- ^ Pishvaian MJ, Brody JR (2017年3月). 「膵臓がんにおける分子サブタイピングの治療的意義」 . Oncology . 31 (3): 159– 66, 168. PMID 28299752. 2017年7月3日時点のオリジナルよりアーカイブ。
- ^ Krown SE (2011年9月). 「サハラ以南のアフリカにおけるカポジ肉腫の治療戦略:課題と機会」 . Current Opinion in Oncology . 23 (5): 463– 468. doi : 10.1097/cco.0b013e328349428d . PMC 3465839. PMID 21681092 .
