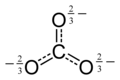
オキソカーボン陰イオン

化学において、オキソカーボン陰イオンは炭素原子と酸素原子のみからなる陰イオンであり、したがって一般式Cで表される。×おn − yいくつかの整数x、y、nに対して。
最も一般的なオキソカーボン陰イオンは炭酸塩、CO2−3、およびシュウ酸、C 2 O2−4しかし、このクラスには安定な陰イオンが多数存在し、その中には研究や産業用途で使用されているものもいくつか含まれています。また、COのような不安定な陰イオンも数多く存在します。−2およびCO 4− は、いくつかの化学反応中に瞬間的に存在する。また、CO4−4これらは理論的研究の対象となってきたが、まだ観察されていない。
安定なオキソカーボン陰イオンは、様々な陽イオンと塩を形成します。不安定な陰イオンは、星間雲のような非常に希薄な気体状態で存在することがあります。ほとんどのオキソカーボン陰イオンは有機化学において対応する基を持ち、その化合物は通常エステルです。例えば、シュウ酸ジメチルエステルH 3 C−O−(C=O) 2 −O−CH 3には、シュウ酸基[−O−( C=O) 2 −O−]が存在します。
炭酸イオンの電子構造

炭酸イオンは三方平面構造を持ち、点群はD 3hです。3つのCO結合の長さはそれぞれ136 pmで、3つのOCO結合角は120°です。炭素原子は4対の価電子を持ち、分子はオクテット則に従っています。これは、石灰岩などの岩石中に見られるこのイオンの高い安定性の一因となっています。電子構造は、3つのCO結合しかない分子において4つの電子対がどのように分布しているかを示す2つの主要な理論によって説明されます。
原子価結合理論によれば、炭酸イオンの電子構造は3 つの標準形の 共鳴混成体です。
それぞれの標準形には、2つの単結合と1つの二重結合があります。3つの標準形は共鳴混成体に均等に寄与するため、3つのCO結合の長さは同じになります。

分子軌道理論では、三回軸は分子のZ軸と定義されます。炭素原子上のs、p x、p y軌道と各酸素原子上のp軌道が重なり合うことで、3つのσ結合が形成されます。さらに、炭素原子上のp z軌道と各酸素原子上のp z軌道が分子平面に垂直に重なり合うことで、非局在化したπ結合が形成されます。
同じ結合スキームが、炭酸イオンと 等電子である硝酸イオンNO 3 −にも適用できることに注意してください。
同様に、カルボキシル基COの2回対称構造は、– 2は、原子価結合理論における 2 つの標準形の共鳴混成として記述されるか、分子軌道理論における 2 つの σ 結合と非局在化 π 結合との共鳴混成として記述されることがあります。
関連化合物
オキソカーボン酸
オキソカーボンアニオンC×おn − y対応する酸C x H n O yからすべての陽子を取り除いた結果と見ることができます。炭酸塩CO2−3例えば、炭酸H 2 CO 3の陰イオンとして見ることができる。「酸」は実際にはアルコールや他の化学種である場合もある。例えば、アセチレンジオールCがそうだ。2お2−2するとアセチレンジオールC 2 H 2 O 2が得られる。しかし、陰イオンは酸よりも安定であることが多い(炭酸塩の場合など)[ 1 ] 。また、酸が未知であったり、極めて不安定であると予想される場合もある(メタンテトラカルボキシレートC(COO − ) 4の場合など)。
中和された種
すべてのオキソカーボンアニオンC×おn − y原理的には、電気的に中性(または酸化された)異形であるC x O y、つまり負電荷を除いて同じ組成と構造を持つオキソカーボン(炭素酸化物)に相当します。しかし、一般的にこれらの中性オキソカーボンは対応するアニオンよりも安定性が低くなります。例えば、安定した炭酸イオンは、極めて不安定な中性三酸化炭素CO 3に対応します。[ 2 ]シュウ酸C2お2−4より不安定な1,2-ジオキセタンジオンC 2 O 4に相当する。[ 3 ]そして安定なクロコン酸アニオンC5お2−5中性のシクロペンタンペントンC 5 O 5に相当するが、微量しか検出されていない。[ 4 ]
変異体の減少
逆に、一部のオキソカーボン陰イオンは還元されて、同じ構造式を持ちながらより大きな負電荷を持つ他の陰イオンを生成する。例えば、ロジゾン酸C6お2−6テトラヒドロキシベンゾキノン(THBQ)アニオンCに還元される。 6お4−6そしてベンゼンヘキソレートC6お6−6. [ 5 ]
酸無水物
オキソカーボンアニオンC×おn − y対応する酸の無水物とも関連している。後者は、化学式C x O y − n ⁄ 2で表される別のオキソカーボン、すなわち酸からn ⁄ 2個の水分子を除いたH 2 Oである。標準的な例としては、炭酸塩CO2−3二酸化炭素 CO 2 。この形式的な脱水には、2つ以上のアニオンを結合させてオリゴマーやポリマーを作るなど、複数の方法があるため、対応関係は必ずしも明確に定義されていません。中和とは異なり、この形式的な脱水では、メリテートCからメリト酸無水物C 12 O 9のような、かなり安定したオキソカーボンが得られることがあります。12お6〜12歳メリト酸C 12 H 6 O 12経由[ 6 ] [ 7 ] [ 8 ]
水素化アニオン
各オキソカーボンアニオンC×おn − y原理的には、式Hで表されるn −1個の部分水素化陰イオンが存在する。けC×お( n − k )− yここで、kは1からn −1の範囲です。これらの陰イオンは、一般的に「水素」、「二水素」、「三水素」などの接頭辞で示されます。ただし、一部の陰イオンには特別な名前が付けられています。炭酸水素塩HCO− 3一般的には重炭酸塩、シュウ酸水素塩HCと呼ばれる。2お− 4二シュウ酸として知られています。
完全にプロトン化された酸が安定していなくても、水素化されたアニオンは安定している場合があります (重炭酸塩の場合など)。
オキソカーボン陰イオンの一覧
以下は既知または推定されるオキソカーボンアニオンの不完全なリストである。
| 図 | 式 | 名前 | 酸 | 無水物 | 中和 |
|---|---|---|---|---|---|
 | : CO2−2 | カーボナイト | C(OH) 2(炭酸) | 二酸化炭素 | CO2 |
 | 二酸化炭素2−3 | 炭酸塩 | CH 2 O 3 | CO2 | CO3 |
 | 二酸化炭素2−4 | ペルオキソ炭酸塩 | CO3 | CO4 | |
 | 二酸化炭素4−4 | オルト炭酸塩 | C(OH) 4メタンテトロール | CO2 | CO4 |
 | C2お2−2 | アセチレンジオレート | C 2 H 2 O 2アセチレンジオール | C 2 O 2 | |
 | C2お2−4 | シュウ酸 | C 2 H 2 O 4 | C 2 O 3、C 4 O 6 | C 2 O 4 |
 | C2お2−5 | 二炭酸塩 | C 2 H 2 O 5 | C 2 O 4 | |
 | C2お2−6 | ペルオキソ二炭酸塩 | |||
 | C3お2−3 | デルタ | C 3 O(OH) 2 | C 3 O 3 | |
 | C3お2−5 | メソシュウ酸 | C 3 H 2 O 5 | ||
 | C4お2−4 | アセチレンジカルボキシレート | C 4 H 2 O 4 | ||
 | C4お2−4 | 四角形 | C 4 O 2 (OH) 2 | C 4 O 4 | |
 | C4お2−6 | ジオキソコハク酸 | C 4 H 2 O 6 | ||
 | C5お2−5 | クロコン酸塩 | C 5 O 3 (OH) 2 | C 5 O 5 | |
 | C5お4−8 | メタンテトラカルボキシレート | C 5 H 4 O 8 | ||
 | C6お2−6 | ロジゾン酸塩 | C 4 O 4 (COH) 2 | C 6 O 6 | |
 | C6お4−6 | ベンゾキノンテトラオレート; THBQアニオン | (CO)2(COH)4THBQ | C 6 O 6 | |
 | C6お6−6 | ベンゼンヘキソレート | C 6 (OH) 6ベンゼンヘキソール | C 6 O 6 | |
 | C6お4−8 | エチレンテトラカルボキシレート | C 6 H 4 O 8 | C 6 O 6 | |
 | C8お4−9 | フランテトラカルボキシレート | C 8 H 4 O 9 | C 8 O 7 | |
 | C10お4〜10 | ベンゾキノンテトラカルボキシレート | C10H4お10 | C10お8 | |
 | C12お6〜12歳 | 美化する | C 6 (COOH) 6 | C 12 O 9 |
Cなどの他のいくつかのオキソカーボン陰イオンも微量に検出されている。6お− 6ロジゾン酸の単一イオン化バージョンである。[ 9 ]
参照
参考文献
- ^「陽子照射を受けたH 2 O + CO 2氷の赤外線および質量スペクトル研究:炭酸の証拠」、Moore, MH; Khanna, RK
- ^ DeMore WB; Jacobsen CW (1969). 「液体二酸化炭素中のオゾンの光分解における三酸化炭素の生成」. Journal of Physical Chemistry . 73 (9): 2935– 2938. doi : 10.1021/j100843a026 .
- ^ Herman F. Cordes; Herbert P. Richter; Carl A. Heller (1969). 「1,2-ジオキセタンジオン(二酸化炭素二量体)の存在を示す質量分析的証拠。化学発光中間体」J. Am. Chem. Soc . 91 (25): 7209. doi : 10.1021/ja01053a065 .
- ^ Schröder, Detlef; Schwarz, Helmut; Dua, Suresh; Blanksby, Stephen J.; Bowie, John H. (1999年5月). 「オキソカーボンC n O n ( n = 3–6)の質量分析研究」. International Journal of Mass Spectrometry . 188 ( 1– 2): 17– 25. Bibcode : 1999IJMSp.188...17S . doi : 10.1016/S1387-3806(98)14208-2 .
- ^ Haiyan Chen, Michel Armand, Matthieu Courty, Meng Jiang, Clare P. Grey, Franck Dolhem, Jean-Marie Tarascon, Philippe Poizot (2009), 「テトラヒドロキシベンゾキノンのリチウム塩:持続可能なリチウムイオン電池の開発に向けて」 J. Am. Chem. Soc. , 131 (25), pp. 8984–8988 doi : 10.1021/ja9024897
- ^ J. Liebig、F. Wöhler (1830)、「Ueber die Zusammensetzung der Honigsteinsäure」 Poggendorfs Annalen der Physik und Chemie、vol. 94、第 2 号、161 ~ 164 ページ。オンライン版は2009 年 7 月 8 日にアクセスされました。
- ^マイヤー H、シュタイナー K (1913). 「Über ein neues Kohlenoxyd C 12 O 9 (新しい炭素酸化物 C 12 O 9 )」。Berichte der Deutschen Chemischen Gesellschaft。46 : 813–815 .土井: 10.1002/cber.191304601105。
- ^ハンス・マイヤー;カール・シュタイナー (1913)。「Über ein neues Kohlenoxyd C 12 O 9」。Berichte der Deutschen Chemischen Gesellschaft。46 : 813–815 .土井: 10.1002/cber.191304601105。
- ^ リチャード・B・ウィルワスとキャロライン・チック・ジャロルド(2006年)「 Cの生産6お− 6モリブデンアニオン上でのCOのオリゴマー化による」。J . Am. Chem. Soc.第128巻 第42号 13688~13689ページ。doi : 10.1021 /ja0643927